川芎嗪对庆大霉素耳中毒豚鼠耳蜗组织caspase-3的表达及ABR阈值的影响
2016-10-22杨政道张继方侯豪华王张敏倪月秋
杨政道,张继方,侯豪华,王张敏,倪月秋
(1.沈阳医学院基础医学院临床医学专业2011级2班,辽宁沈阳110034;2.临床医学专业2012级1班;3.医学检验专业2013级1班;4.生理学教研室)
川芎嗪对庆大霉素耳中毒豚鼠耳蜗组织caspase-3的表达及ABR阈值的影响
杨政道1,张继方1,侯豪华2,王张敏3,倪月秋4*
(1.沈阳医学院基础医学院临床医学专业2011级2班,辽宁沈阳110034;2.临床医学专业2012级1班;3.医学检验专业2013级1班;4.生理学教研室)
目的:研究川芎嗪(TMP)对庆大霉素(GM)耳中毒豚鼠耳蜗组织caspase-3的表达以及ABR阈值的影响。方法:将健康白色红目豚鼠80只随机分为对照组、GM组、GM+TMP组和TMP组,各组均连续用药10 d,每日测量体重调整药量。在给药前和给药10 d后分别检测ABR阈值,停药处死后应用SABC免疫组化技术检测各组豚鼠耳蜗螺旋神经节、毛细胞以及血管纹caspase-3的表达。结果:(1)GM组耳蜗螺旋神经节细胞、血管纹处和毛细胞平均灰度值与对照组比较,差异有统计学意义(P<0.05);GM+TMP组耳蜗螺旋神经节细胞和毛细胞的平均灰度值与对照组比较差异无统计学意义(P>0.05),而血管纹细胞的平均灰度值与对照组比较差异有统计学意义(P<0.05);同时GM+TMP组耳蜗螺旋神经节、毛细胞、血管纹的平均灰度值与GM组比较差异均有统计学意义(P<0.05)。(2)各组用药前ABR阈值差异无统计学意义(P>0.05)。给药10 d后,GM组的ABR阈值明显高于对照组(P<0.05);TMP+GM组ABR阈值较GM组明显降低(P<0.05)。结论:TMP可能通过阻断庆大霉素耳中毒豚鼠耳蜗组织中caspase-3的表达从而参与阻止GM对耳蜗损伤的过程,实现对GM性耳聋的保护作用。
川芎嗪;庆大霉素;耳毒性;耳蜗;caspase-3;免疫组化;ABR阈值
[Abstract]Objective:To investigate the effects of Ligustrazine(TMP)on the expression of caspase-3 and ABR threshold in guinea pig cochlea after gentamicin(GM)ototoxicity.Methods:A total of 80 guinea pigs were randomly divided into saline group,GM group,GM+TMP group and TMP group.The duration of treatment was lasted 10 d continuously in all groups.The dose was decided by their weight.The ABR threshold were measured before and after administration of 10 d.SABC immunohistochemical method was used to detect the expression of caspase-3 in the spiral ganglion,cochlea hair cells,and stria vascularis of guinea pigs. Results:(1)The average gray value in the spiral ganglion cells,stria vascularis and hair cells in GM group had significant difference with those in the same position of control group(P<0.05).The average gray value in the spiral ganglion cells and hair cells in GM+TMP group had no difference with those in the same position of control group(P>0.05),but in stria vascularis(P<0.05).Meanwhile the average gray value in spiral ganglion,hair cells,stria vascularis in TMP+GM group had significant difference with those in GM group(P<0.05).(2)The ABR threshold had no significant differences before treatment(P>0.05). After administration of 10 d,the ABR threshold of GM group was significantly changed(P<0.05).The ABR thresholds in GM group was significantly higher than that in control group(P<0.05).The ABR threshold in TMP+GM group was lower than that in GM group(P<0.05).Conclusion:TMP participates in preventing the process of cochlea injury caused by GM,through blocking the expression of caspase-3 in cochlea tissue of GM ototoxicosis probably,which achieve the protection of GM deafness eventually.
[Key words]Ligustrazine;gentamicin;ototoxicity;cochlea;caspase-3;immunohistochemistry;ABR threshold
庆大霉素(GM)是一种广谱、高效且廉价的抗生素,在临床中尤其是作为治疗由革兰阴性菌导致的严重感染的首选药仍然占据着不可替代的位置[1],但其所具有的耳毒性早已被人认知[2],其损伤耳蜗的病理改变主要表现为毛细胞的损伤与缺失[3]。有研究表明:GM引起毛细胞线粒体的破坏,进而激活经典的caspase凋亡通路[4]。且caspase-3蛋白表达的增高与GM耳中毒后听力阈值的下降有相关性[5]。川芎嗪(Ligustrazine,tetramethylpyrazine,TMP),化学结构为四甲基吡嗪,是从具有“血中气药”之称的中药川芎中提取出的有效单体,属酰胺类生物碱,有抗血小板聚集、扩张小动脉、改善微循环和脑血流的作用,用于闭塞性血管疾病、脑血栓形成、脉管炎、心绞痛等的治疗[6]。现已知道它可以降低GM的耳毒性[7],但TMP是否是通过影响GM中毒豚鼠耳蜗caspase-3的表达,从而拮抗GM的耳蜗毒性,尚未见报道。本实验应用SABC免疫组化技术及图像分析技术并结合ABR测试,观察TMP对GM中毒豚鼠耳蜗caspase-3表达和ABR阈值的影响,探讨TMP对GM耳毒性损伤的保护作用机制。
1 材料与方法
1.1实验动物分组及耳毒模型的复制耳廓反射灵敏的健康白色红目豚鼠80只(辽宁省长生生物技术有限公司提供,实验动物许可证号:SCXK(辽)2015-0001),体重200~250 g,雌雄不拘,随机分成对照组、GM组、GM+TMP混合组和TMP组,每组20只。对照组:每日腹腔注射生理盐水2.5 ml/kg(辰欣药业股份有限公司,国药准字:H37022337);GM组:每日腹腔注射硫酸GM注射液100 mg/kg(新乡东升制药有限公司,国药准字:H41020249);GM+TMP混合组:每日右侧腹腔注射硫酸GM注射液100 mg/kg,同时左侧腹腔注射TMP注射液100 mg/kg;TMP组:每日腹腔注射TMP注射液100 mg/kg(上海现代哈森(商丘)药业有限公司,国药准字:H20054485)。各组均连续用药10 d。各组动物混合饲养,每日测量体重调整药量。
1.2ABR阈值检测在用药前和用药10 d后,用1%戊巴比妥钠(40 mg/kg)腹腔注射麻醉,利用Intelligent Hearing Systems发出主频率为2 kHz的滤波click声刺激信号,滤波带宽50~3 000 Hz,间隔时间90 ms,扫描时间20 ms,耳机插入豚鼠外耳道,记录电极置颅顶正中,参考电极及接地电极分别置于给声耳及对侧耳后乳突部皮下,以Intelligent Hearing Systems(Miami,FL33143)进行叠加1 024次,输出信号,观察时程为20 ms,测试强度由80 dB nHL开始,按10 dB递减,接近阈值后按5 dB逐档递减,听阈判定以刚出现ABR的P3波为准。
1.3耳蜗冰冻切片的制备各组豚鼠在行第2次ABR检测后,快速断头,迅速取出听泡。打开听泡后,充分暴露耳蜗,在解剖显微镜下刺破圆窗膜,将镫骨底脱位暴露卵圆窗,在蜗顶钻一小孔,用微量注射器缓慢注入含40 g/L多聚甲醛的磷酸缓冲液,再将标本置于上述固定液中4℃下1 d。磷酸盐缓冲液(PBS)冲洗后,放入100 g/L EDTA脱钙液中脱钙20 d,再移入250 g/L蔗糖磷酸缓冲液中,4℃过夜。次日用OCT包埋,行10 μm恒冷冰冻切片。方法同文献[8]。
1.4免疫组织化学方法检测caspase-3的表达免疫组织化学方法检测试剂盒由武汉博士德生物工程有限公司提供。切片干燥后,为了减少操作时组织脱片,用冷丙酮浸泡20 min,用0.01 mol/L的PBS(pH=7.2~7.6)洗3次,每次3 min(下同)。将切片放入用甲醇稀释的5 g/L H2O2中室温下浸泡30 min,以灭活内源性过氧化物酶,0.01 mol/L的PBS洗3次。将切片浸泡于0.01 mol/L枸橼酸钠缓冲液中(pH=6.0)于高压锅内抗原修复。自然冷却至室温,PBS洗涤3次。滴加5%BSA封闭液,室温下孵育20 min,甩去多余的液体,然后滴加稀释度为1∶200的一抗,4℃过夜。次日,用0.01 mol/L的PBS洗3次,滴加二抗,37℃孵育20 min,0.01 mol/L的PBS洗3次,DAB染色,在显微镜下观察并控制染色时间,并在同一时间用PBS冲洗,终止各组染色。用梯度酒精脱水,透明,封片,显微镜下观察。阴性对照组,用0.01 mol/L的PBS代替一抗,其他步骤不变。采用JeDa形态学图像分析系统,每组随机抽取20张切片,在同等条件下测量各组每张切片螺旋神经节细胞、毛细胞以及血管纹caspase-3阳性反应产物灰度值,分别计算各组阳性反应产物平均灰度值。
1.5统计学分析采用SPSS 17.0软件进行统计学分析,数据以(±s)表示,显著性检验采用t检验及相关分析,P<0.05为差异有统计学意义。
2 结果
2.1TMP干预GM耳中毒后耳蜗ABR阈值变化的测定结果各组给药前ABR阈值差异无统计学意义(P>0.05)。给药10 d后,GM组ABR阈值较给药前发生显著变化(P<0.05);且给药后的GM组ABR阈值明显高于对照组(P<0.05)。GM+TMP组ABR阈值虽然在给药后也有所增高,但相对于对照组和TMP组差异均无统计学意义(P>0.05),而较GM组明显降低(P<0.05);TMP组和对照组ABR阈值在给药后差异无统计学意义(P>0.05),见表1。
表1 各组豚鼠用药前后的ABR阈值比较(±s)
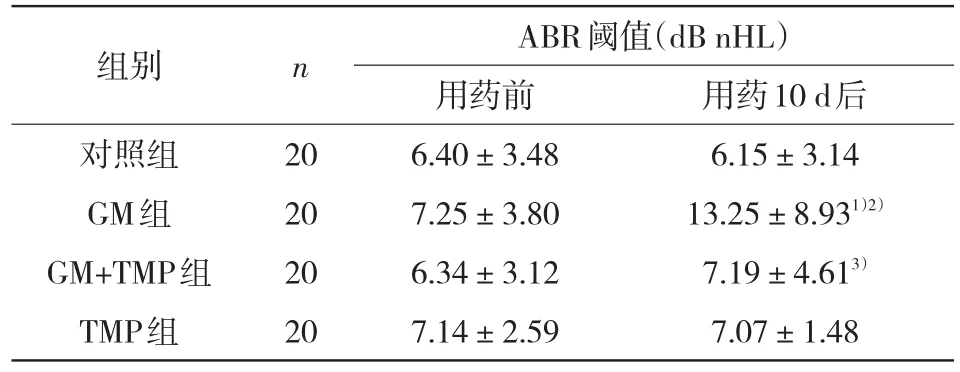
表1 各组豚鼠用药前后的ABR阈值比较(±s)
注:与用药前比较,1)P<0.05;与对照组比较,2)P<0.05;与GM组比较,3)P<0.05
用药10 d后6.15±3.14 13.25±8.931)2)7.19±4.613)7.07±1.48组别对照组GM组GM+TMP组TMP组n 20 20 20 20 ABR阈值(dB nHL)用药前6.40±3.48 7.25±3.80 6.34±3.12 7.14±2.59
2.2Caspase-3免疫组化检测
2.2.1光镜下观察结果耳蜗各部分caspase-3阳性免疫反应产物呈深黄色颗粒,弥漫分布于螺旋神经节、毛细胞和血管纹中。GM组的caspase-3阳性免疫反应产物明显强于GM+TMP组和对照组,即染色明显加深,呈强阳性,尤其是耳蜗螺旋神经节的阳性反应颗粒更加明显,见图1~图3。
2.2.2显微图像分析GM组在螺旋神经节细胞、血管纹、毛细胞处有阳性反应产物表达,平均灰度值与对照组相同部位比较,差异均有统计学意义(P<0.05);GM+TMP组螺旋神经节细胞和毛细胞的平均灰度值与对照组相同部位比较差异均无统计学意义(P>0.05),而血管纹细胞则与对照组比较差异有统计学意义(P<0.05);同时GM+TMP组的螺旋神经节、毛细胞、血管纹与GM组比较差异均有统计学意义(P<0.05)。TMP组与对照组各部位平均灰度值比较差异均无统计学意义(P> 0.05)。见表2。
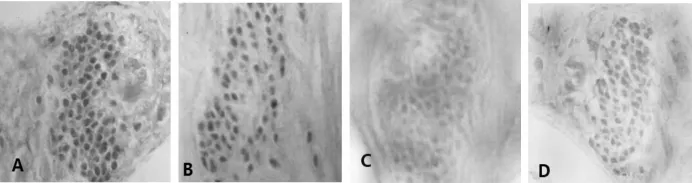
图1 免疫组化法检测耳蜗螺旋神经节caspase-3的表达(×100)

图2 免疫组化法检测耳蜗毛细胞caspase-3的表达(×100)
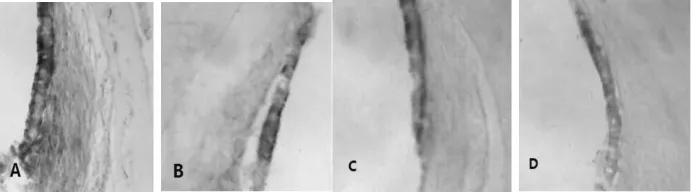
图3 免疫组化法检测耳蜗血管纹caspase-3的表达(×100)
表2 豚鼠耳蜗caspase-3的平均灰度值比较(±s)
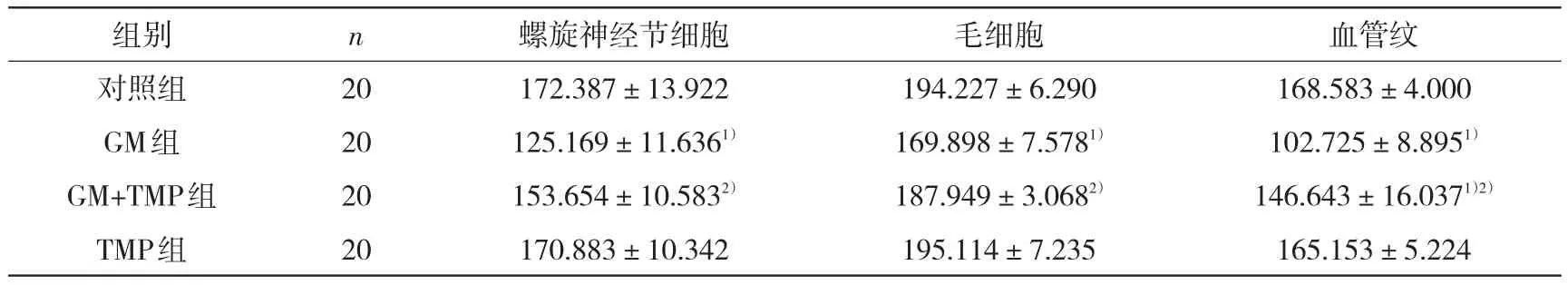
表2 豚鼠耳蜗caspase-3的平均灰度值比较(±s)
注:与对照组比较,1)P<0.05;与GM组比较,2)P<0.05
组别对照组GM组GM+TMP组TMP组n 20 20 20 20螺旋神经节细胞172.387±13.922 125.169±11.6361)153.654±10.5832)170.883±10.342毛细胞194.227±6.290 169.898±7.5781)187.949±3.0682)195.114±7.235血管纹168.583±4.000 102.725±8.8951)146.643±16.0371)2)165.153±5.224
3 讨论
GM耳毒性表现为感音神经性耳聋[9]。有研究表明,GM通过引起耳蜗细胞的凋亡而导致耳蜗损伤[7],其中包括耳蜗毛细胞[10]、螺旋神经节细胞[11]以及血管纹组织细胞的凋亡损伤。
凋亡是损伤的一种共同的结局,而细胞凋亡的发生与caspase家族成员的活化有直接关系。凋亡的发生是一系列caspase家族成员共同参与完成的[12]。其中caspase-3被认为是各种凋亡刺激因子激活的caspase家族中的关键酶,处于核心地位[13],并为凋亡蛋白酶级联反应的必经之路[5]。活化的caspase-3在凋亡细胞中存在[14],其阳性表达为细胞凋亡的主要标志。已有研究表明,GM耳中毒的耳蜗中有caspase-3的表达,且caspase-3蛋白表达增高与GM耳中毒后听力阈值的下降呈正相关[5]。
TMP现临床广泛用于治疗兼有血瘀症候的疾病,具有扩张血管、抑制血小板激活聚集,并改善血管血流变学等[6]。现已知道它可以降低GM的耳毒性[7],但目前,其具体机制尚不清楚。
本研究通过设立GM组、TMP组、GM+TMP组及对照组,分别测试给药前后各组的ABR阈值,并进行caspase-3的免疫组化染色,来观察各组耳蜗相应部位caspase-3的表达情况。结果发现各组用药前ABR阈值差异无统计学意义;给药10 d后,GM组的ABR阈值明显高于对照组(P<0.05);TMP+GM组的ABR阈值较GM组降低(P<0.05)。说明TMP可显著降低GM耳毒性。在caspase-3免疫组化染色结果中,GM组各部位的平均灰度值与对照组的相同部位比较差异均有统计学意义(P<0.05);GM+TMP组螺旋神经节细胞和毛细胞的平均灰度值与对照组的相同部位比较差异无统计学意义(P>0.05),而血管纹细胞则与对照组比较差异有统计学意义(P<0.05);同时GM+TMP组的螺旋神经节、毛细胞、血管纹平均灰度值与GM组比较差异均有统计学意义(P<0.05)。因此TMP能明显抑制GM引起的耳蜗内组织caspase-3的表达,尤其是螺旋神经节细胞,次为血管纹和毛细胞。
有研究表明GM对螺旋神经节细胞(SGCs)具有直接作用,其通过破坏SGCs氧化与抗氧化体系的平衡,导致线粒体损伤,并通过凋亡效应蛋白caspase-3的活化,从而触发凋亡级联反应[11]。同时,对于毛细胞来说,在caspase-3水平上阻断细胞凋亡通路可以有效保护毛细胞[15]。在本实验GM+TMP组中,所出现的caspase-3减少的情况表明TMP抑制了caspase-3的表达,同时该组ABR阈值结果提示TMP显著降低GM耳毒性。因此我们推测:TMP可能通过阻断庆大霉素耳中毒豚鼠耳蜗组织中caspase-3的表达从而参与阻止GM对耳蜗损伤的过程,实现对GM性耳聋的保护作用。
[1]简心韵,邓子新,孙宇辉.氨基糖苷抗生素庆大霉素:基础研究的新进展及应用研究的新潜力[J].生物工程学报,2015,31(6):829-844.
[2]Schatz A,Buqie E,Waksman SA.Streptomycin,a subsatance exhibiting antibiotic activity against gram-positive and gramnegative bacteria.1944[J].Clin Orthop Relat Res,2005,(437):3-6.
[3]Zhang D,Fan Z,Han Y,et al.Apoptosis-inducing factor is involved in gentamicin-induced vestibular hair cell death[J]. ORL J Otorhinlaryngol Relat Spec,2012,74(1):1-5.
[4]蔡琴芳,蒋立新.豚鼠耳蜗基底膜硝酸银染色铺片法的改良与观察[J].听力学及言语疾病杂志,2010,18(3):282-283.
[5]陈浩,谢民强,吴剑,等.盐酸椒苯酮胺通过降低caspase-3表达减轻庆大霉素豚鼠耳蜗损伤[J].南方医科大学学报,2014,34(3):329-334.
[6]宋飞.近十年来国内对川芎嗪临床应用的研究进展[J].海峡药学,2014,26(10):1-3.
[7]李慧.川穹嗪对庆大霉素耳肾毒性保护作用的研究[D].长春:吉林大学,2011.
[8]温利民.川芎嗪对药物耳毒性聋耳蜗毛细胞损伤修复的作用机制研究[D].长春:吉林大学,2008.
[9]Gooi A,Hochman J,Wellman M,et al.Ototxic effects of singledose verse 19-day daily-dose gentamicin[J].J Otolaryngologyhead Neck surg,2008,37(5):664-667.
[10]陈浩.盐酸椒苯酮胺对庆大霉素豚鼠耳蜗损伤保护作用及机制[D].广州:南方医科大学,2013.
[11]顾晰,林昶,张榕.庆大霉素对小鼠耳蜗螺旋神经节细胞损伤机制初步研究[J].中华耳科学杂志,2009,7(3):256-260.
[12]郭莹.HSP70、P38MAPK、Caspase3与胎盘细胞凋亡在妊娠期高血压疾病中的作用[D].郑州:郑州大学,2011.
[13]Broughtton BR,Reutens DC,Sobey CG.Apoptotic mechanisms after cerebral ischemia[J].Stroke,2009,40(5):e331-e339.
[14]Parvathy S,Rajadas J,Ryan H,et al.Abeta peptide conformation determines uptake and interleukin-1 alpha expression by primary microglial cells[J].Neurobiol Aging,2009,30(11):1792-1804.
[15]闫辉.miRNA-182对成年大鼠药物性聋损伤的保护及机制[D].西安:第四军医大学,2014.
Effect of Ligustrazine on the Expression of Caspase-3 and ABR Threshold in Guinea Pig Cochlea after Gentamicin Ototoxicity
YANG Zhengdao1,ZHANG Jifang1,HOU Haohua2,WANG Zhangmin3,NI Yueqiu4*
(1.Grade 2011 Class 2,Shenyang Medical College,Shenyang 110034,China;2.Grade 2011 Class 1;3.Grade 2013 Class 1;4.Department of Physiology)
R735.37
A
1008-2344(2016)05-0403-04
10.16753/j.cnki.1008-2344.2016.05.026
2016-04-21
(文敏 编辑)
国家自然基金项目(No.81273809);沈阳医学院大学生科研项目(No.20141021)
倪月秋(1963—),女(汉),教授,博士.研究方向:药物中毒性耳聋作用机制的研究.E-mail:niyueqiu@163.com
