CYP2E1在HBV转基因小鼠急性肝损伤时的表达及意义
2016-10-22李志强王雪梅段明军
张 春, 寿 玺, 李志强, 王雪梅, 姜 涛, 段明军, 魏 琴, 郑 茜
(新疆医科大学1第一附属医院, 新疆医学动物模型研究重点实验室, 乌鲁木齐 830054;2新疆医科大学第二附属医院中医科, 乌鲁木齐 830063)
CYP2E1在HBV转基因小鼠急性肝损伤时的表达及意义
张春1, 寿玺1, 李志强1, 王雪梅1, 姜涛1, 段明军1, 魏琴1, 郑茜2
(新疆医科大学1第一附属医院, 新疆医学动物模型研究重点实验室, 乌鲁木齐830054;2新疆医科大学第二附属医院中医科, 乌鲁木齐830063)
目的研究HBV转基因小鼠肝脏在四氯化碳(CCl4)急性损伤情况下,肝癌相关基因细胞色素P2E1(CYP2E1)表达水平的变化。方法选择8~10周龄HBV(-)[HBV(-)组]及HBV(+)[HBV(+)组]转基因小鼠各24只,按照1.0 μL/g体质量腹腔注射CCl4(1∶4溶于橄榄油)建立急性肝损伤模型,另外选用正常健康小鼠8只作为对照组,仅给予生理盐水腹腔注射。各组分别于注射后3、6、12、24、48 h和72 h处死小鼠。采集各组大鼠肝组织样本,光镜下观察不同时间点肝脏组织学改变,并采用荧光定量PCR法测定各组大鼠肝组织中CYP2E1基因相对的mRNA水平,采用免疫组织化学和蛋白印迹技术观察各组大鼠肝脏组织中CYP2E1的表达水平。结果与对照组比较,HBV(-)组和HBV(+)组,CCl4致急性肝损伤时,CYP2E1的mRNA及其蛋白表达水平明显升高,在注射CCl472 h达到峰值。与HBV(-)组比较,HBV(+)组小鼠肝脏损伤程度较重,CYP2E1基因和蛋白的表达水平均明显增高。结论CCl4所致急性肝损伤HBV转基因小鼠CYP2E1基因的表达明显增加。该研究结果为HBV所致的肝损伤及肝癌的发病机制提供了依据。
基因表达; 肝癌; 转基因小鼠; CYP2E1; 急性肝损伤
乙型肝炎病毒(Hepatitis B virus, HBV)是一种嗜肝DNA病毒,可以引起急、慢性肝炎,甚至肝细胞癌[1-4]。因为HBV只感染人类及少数灵长类动物,因此很大程度限制了HBV相关性肝炎及肝癌在整体动物水平的研究。自基因工程技术成熟以来,研究人员可以通过研制转/敲除基因的动物模型,来研究任何感兴趣的基因,而建立HBV转基因小鼠已成为研究HBV相关肝脏疾病的一种有效方法[5-8]。
肝癌是我国常见的恶性肿瘤之一,居全国恶性肿瘤死亡的第二位[9]。有研究证实肝癌的发生和HBV病毒的感染有关[1-4]。但HBV感染所致肝癌的具体机制不清。目前研究认为,遗传因素和HBV感染之间可能存在交互作用,共同导致肝癌的发生[10-15]。最近研究表明,细胞色素P4502E1(CYP2E1)基因的变异和表达和肝癌的易感性存在关联[16-19]。HBV感染可能诱导CYP2E1基因的高表达,从而参与肝脏损伤及肝癌的发病机制。本研究选用HBV转基因小鼠为工具,模拟HBV感染急性肝损伤的病理过程,观察CYP2E1基因的表达水平变化,以期为阐明HBV相关性肝病的发病机制提供依据。
1 材料与方法
1.1实验试剂与仪器橄榄油(欧丽薇兰公司),四氯化碳(CCl4,湖北大学化工厂),组织总RNA提取试剂盒、核蛋白提取试剂盒(北京百泰克有限公司),实时荧光定量PCR试剂盒、Western Blotting试剂盒(美国Invitrogen公司),免疫组化试剂盒(北京中杉金桥生物技术有限公司,货号:PV-9000),DAB显色试剂盒(武汉博士德生物工程有限公司,货号:AR1022),兔抗人CYP2E1抗体(Bioworld公司,货号:BS6577)。
1.2实验动物及分组SPF级HBV(-)[HBV(-)组]及HBV(+)[HBV(+)组]转基因小鼠各24只(上海模式生物研究中心),8~10周龄,体质量18~22 g。 SPF级C57BL/6小鼠8只(新疆医科大学实验动物中心,许可证号:XJZZQ(XK)200301)为对照组,8~10周龄,体质量18~22 g。HBV(-)及HBV(+)组按照1.0 μL/g体重质量腹腔注射CCl4(1∶4溶于橄榄油)建立急性肝损伤模型[20],对照组仅给予生理盐水腹腔注射。各组分别于注射后3、6、12、24、48和72 h处死小鼠,采集各组小鼠肝组织样本备用。
1.3HE染色各组小鼠肝组织样本经4%多聚甲醛浸泡固定,梯度乙醇脱水,二甲苯透明,石蜡包埋,切片;经HE染色,光学显微镜观察肝组织形态学改变。
1.4免疫组化采用常规LSAB法进行免疫组织化学检测,一抗孵育:每张切片滴加约50~100 μL一抗工作液,(稀释浓度为1∶100),用商业化的抗体稀释液稀释一抗,配成工作液后4℃冰箱保存待用,湿盒内4℃孵育过夜。生物素处理后再与前述抗原成分结合,将抗原放大,并借助于显色剂DAB将抗原抗体反应部位显示出来在光镜下观察到表达阳性部位棕黄着色。
1.5实时荧光定量PCR (RT-PCR)RT-PCR检测各组大鼠肝脏组织细胞中CYP2E1基因mRNA的表达,组织总RNA按照试剂盒说明书进行。紫外分光光度计波长260 nm和280 nm检测吸光度(A),A260 nm/A280 nm值为1.8~2.0。将其逆转录为cDNA,进行PCR扩增。CYP2E1和β-actin基因的引物序列见表1。
1.6Western Blot检测采用Western Blotting 技术检测肝脏组织中CYP2E1基因蛋白的表达。BCA法测定待测样品的蛋白浓度,取50 μg总蛋白加入上样缓冲液煮沸3 min变性,经SDS-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离蛋白,电转移至PVDF膜,封闭后与1∶600稀释的CYP2E1一抗振摇2 h,4℃孵育过夜;与1∶1 000稀释的二抗37℃孵育1 h,再与化学发光试剂(ECL)温浴1 min后曝光、显影和定影。用Quantity One分析软件进行分析,通过目的蛋白除以内参β-actin蛋白的积分光密度值,得到各组蛋白条带相对值。
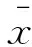
2 结果
2.1光学显微镜观察肝脏组织结构变化经HE染色观察,肝脏组织细胞核呈蓝色,细胞浆、肌纤维、胶原纤维和红细胞呈不同程度的红色。对照组小鼠肝脏组织有完整的肝小叶结构,细胞大小均匀,排列整齐,分界清楚,未见炎性细胞浸润和汇管区异常,未见干细胞变性、坏死,纤维组织增生。HBV(+)组镜下可见肝小叶结构破坏,出现以中央静脉为中心的局灶性肝细胞变性,最为明显的是细胞气球样变和脂肪变性,肝小叶内点状坏死和炎细胞浸润,肝细胞核大小不一,呈不同程度的固缩。上述变化在CCl4注射后72 h最为明显。HBV(-)组变化和HBV(+)组相同,但程度较轻,见图1。
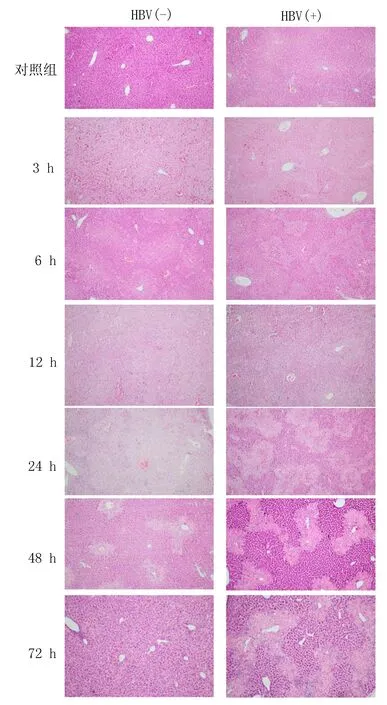
图1 肝脏组织学改变的HE染色(×100)
2.2CYP2E1基因mRNA表达水平变化与对照组比较,HBV(-)组及HBV(+)组CYP2E1基因mRNA表达水平在CCl4注射3 h开始表达上调,在注射后72 h达到高峰。HBV(-)组在6、12、24、48及72 hCYP2E1基因mRNA表达水平较对照组明显升高,差异有统计学意义(P<0.05);HBV(+)组在注射CCl4后3 h CYP2E1基因mRNA表达水平明显高于对照组(P<0.05),在6、12、24、48及72 h时与对照组比较差异均具有统计学意义(P<0.05);HBV(+)组在3、6、12、24、48及72h时mRNA表达水平较对照组均明显升高,差异有统计学意义(P<0.05),见图2。

注:与对照组比较,*P<0.05; 与HVB(-)组比较,#P<0.05。
图2CYP2E1基因mRNA表达水平变化
2.3在组织水平CYP2E1蛋白的水平与对照组比较, HBV(-)组和HBV(+)组CYP2E1蛋白表达水平均明显升高;与HBV(-)组比较,HBV(+)组CYP2E1蛋白表达在6、12、24、48及72 h均明显升高,见图3。
2.4CYP2E1蛋白水平变化与对照组比较,CYP2E1蛋白的表达在HBV(-)组和HBV(+)组CCl4注射后3 h明显升高(P<0.05)。HBV(-)组和HBV(+)组间比较,CYP2E1蛋白的表达在6、12和24 h未见明显差异,在48和72 h,HBV(+)组CYP2E1蛋白的表达明显高于HBV(-)组,差异有统计学意义(P<0.05),见图4。
3 讨论
近年来,为了使实验性肝损伤及肝癌模型更加接近实际,并深入研究HBV引起肝癌的发病机制,人们建立了乙型肝炎病毒转基因小鼠模型,并能使之自发产生肝癌[21-22]。本研究采用CCl4诱导HBV转基因小鼠,使之产生急性肝损伤的病理过程,观察在HBV作用下,CCl4对肝组织产生损伤时CYP2E1基因的表达。CYP2E1参与肝病的发生机制主要和以下环节有关:CYP2E1在其底物的代谢过程中可产生大量氧自由基,使DNA、蛋白质和脂质氧化,造成肝细胞多种成分的广泛氧化损伤,导致肝细胞的坏死和生物膜损伤,诱导肝细胞癌变的形成[23-25]。CYP2E1途径的氧化代谢不但不能产生ATP,还可增加对氧的消耗,造成能量的耗竭加大肝细胞区域带的氧耗梯度,影响肝细胞正常功能代谢。肝细胞内CYP2E1的表达增加导致大量活性氧(ROS)的产生,同时通过增强脂质过氧化程度,损伤生物膜功能,协同细胞因子和肝细胞凋亡来加重肝细胞的炎症、坏死、纤维化甚至癌变[23-25]。
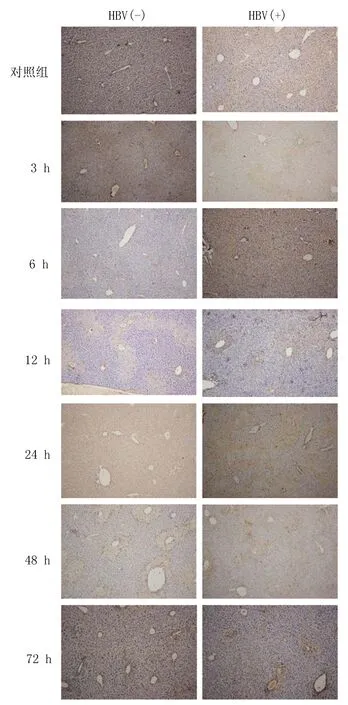
图3 免疫组织化学结果
研究发现,肝癌转移水平的增强与环氧化酶(COX-2)的表达及乙型肝炎X蛋白(HBx)上调密切相关[26-28]。由于CYP2E1可促进细胞内花生四烯酸(AA)的产生,推测 CYP2E1和HBV存在一定相关性,可能通过相互作用促进肝癌的发生。本研究通过免疫组化、实时荧光定量PCR及Western blotting等多种技术的同时应用,观察到HBV(+)组小鼠在受到CCl4损伤后,CYP2E1基因及其蛋白的表达显著高于HBV(-)组小鼠,表明HBV在肝组织损伤时可以促进CYP2E1基因的表达。CCl4所致急性肝损伤HBV转基因小鼠CYP2E1基因的表达明显增加。

注:与HBV(-)组比较, *P<0.05。
综上,本研究发现HBV转基因小鼠在CCl4所致急性肝损伤病理过程中较野生型小鼠具有明显的组织学改变,CYP2E1基因及蛋白的表达明显升高。该项研究为探讨HBV所致的肝损伤者肝癌的发病机制提供了新的依据。
[1]Wong GL, Wong VW. Risk prediction of hepatitis B virus-related hepatocellular carcinoma in the era of antiviral therapy[J]. World J Gastroenterol, 2013, 19(39):6515-6522.
[2]Liu Y, Jiang L, Mu Y. Somatostatin receptor subtypes 2 and 5 are associated with better survival in operable hepatitis B-related hepatocellular carcinoma following octreotide long-acting release treatment[J]. Oncol Lett, 2013, 6(3):821-828.
[3]Al-Qahtani AA, Al-Anazi MR, Abdo AA, et al. Genetic variation in interleukin 28B and correlation with chronic hepatitis B virus infection in Saudi Arabian patients[J]. Liver Int, 2014, 34(7):e208-216.
[4]Han Y, Pu R, Han X, et al. Association of a potential functional pre-miR-218 polymorphism and its interaction with hepatitis B virus mutations with hepatocellular carcinoma risk[J]. Liver Int, 2014, 34(5):728-736.
[5]Zhang H, Li H, Yang Y, et al. Differential regulation of host genes including hepatic fatty acid synthase in HBV-transgenic mice[J]. J Proteome Res, 2013, 12(6):2967-2979.
[6]Buchmann P, Dembek C, Kuklick L, et al. A novel therapeutic hepatitis B vaccine induces cellular and humoral immune responses and breaks tolerance in hepatitis B virus(HBV) transgenic mice[J]. Vaccine, 2013, 31(8):1197-1203.
[7]Farag MM, Tedjokusumo R, Flechtenmacher C, et al. Immune tolerance against HBV can be overcome in HBV transgenic mice by immunization with dendritic cells pulsed by HBVsvp[J]. Vaccine, 2012, 30(42):6034-6039.
[8]Jiang W. Blockade of B7-H1 enhances dendritic cell-mediated T cell response and antiviral immunity in HBV transgenic mice[J]. Vaccine, 2012, 30(4):758-766.
[9]Ren W, Qi X, Yang Z, et al. Prevalence and risk factors of hepatocellular carcinoma in Budd-Chiari syndrome: a systematic review[J]. Eur J Gastroenterol Hepatol, 2013, 25(7):830-841.
[10]Li G, Zheng Z. Toll-like receptor 3 genetic variants and susceptibility to hepatocellular carcinoma and HBV-related hepatocellular carcinoma[J]. Tumour Biol, 2013, 34(3):1589-1594.
[11]Wu X, Xin Z, Zhang W, et al. Polymorphisms in the VEGFA promoter are associated with susceptibility to hepatocellular carcinoma by altering promoter activity[J]. Int J Cancer, 2013, 133(5):1085-1093.
[12]Deng B, Liu F, Wei Y, et al. Association of a p73 exon 2 G4C14-to-A4T14 polymorphism with risk of hepatocellular carcinoma in a Chinese population[J]. Tumour Biol, 2013, 34(1):293-299.
[13]Wang L, Huang J, Jiang M, et al. Activated PTHLH coupling feedback phosphoinositide to G-protein receptor signal-induced cell adhesion network in human hepatocellular carcinoma by systems-theoretic analysis[J]. Scientific World J, 2012, 2012:428979.
[14]Arzumanyan A, Sambandam V, Clayton MM, et al. Hedgehog signaling blockade delays hepatocarcinogenesis induced by hepatitis B virus X protein[J]. Cancer Res, 2012, 72(22):5912-5920.
[15]Liu H, Xu L, He H, et al. Hepatitis B virus X protein promotes hepatoma cell invasion and metastasis by stabilizing Snail protein[J]. Cancer Sci, 2012, 103(12):2072-2081.
[16]Bose S, Tripathi DM, Sukriti, et al. Genetic polymorphisms of CYP2E1 and DNA repair genes HOGG1 and XRCC1: association with hepatitis B related advanced liver disease and cancer[J]. Gene, 2013, 519(2):231-237.
[17]Tian Z, Li YL, Zhao L, et al. CYP2E1 RsaI/PstI polymorphism and liver cancer risk among east Asians: a HuGE review and meta-analysis[J]. Asian Pac J Cancer Prev, 2012, 13(10):4915-4921.
[18]Catanzaro I, Naselli F, Saverini M, et al. Cytochrome P450 2E1 variable number tandem repeat polymorphisms and health risks: a genotype-phenotype study in cancers associated with drinking and/or smoking[J]. Mol Med Rep, 2012, 6(2):416-420.
[19]Liu C, Wang H, Pan C, et al. CYP2E1 PstI/RsaI polymorphism and interaction with alcohol consumption in hepatocellular carcinoma susceptibility: evidence from 1 661 cases and 2 317 controls[J]. Tumour Biol, 2012, 33(4):979-984.
[20]Jin Z, Sun R, Wei H, et al. Accelerated liver fibrosis in HBV transgenic mice: involvement of NKT cells[J]. Hepatology, 2011,53: 219-229.
[21]Barone M, Spano D, D′Apolito M, et al. Gene expression analysis in HBV transgenic mouse liver: a model to study early events related to hepatocarcinogenesis[J]. Mol Med, 2006, 12(4-6):115-123.
[22]Ghebranious N, Sell S. Hepatitis B injury, male gender, aflatoxin, and p53 expression each contribute to hepatocarcinogenesis in transgenic mice[J]. Hepatology, 1998, 27(2):383-391.
[23]Yang H, Nie Y, Li Y, et al. Histone modification-mediated CYP2E1 gene expression and apoptosis of HepG2 cells[J]. Exp Biol Med(Maywood), 2010, 235(1):32-39.
[24]Wang Y, Millonig G, Nair J, et al. Ethanol-induced cytochrome P4502E1 causes carcinogenic etheno-DNA lesions in alcoholic liver disease[J]. Hepatology, 2009, 50(2):453-461.
[25]Man XB, Tang L, Qiu XH, et al. Expression of cytochrome P4502E1 gene in hepatocellular carcinoma[J]. World J Gastroenterol, 2004, 10(11):1565-1568.
[26]You X, Liu F, Zhang T, et al. Hepatitis B virus X protein upregulates oncogene Rab18 to result in the dysregulation of lipogenesis and proliferation of hepatoma cells[J]. Carcinogenesis, 2013, 34(7):1644-1652.
[27]Lim W, Kwon SH, Cho H, et al. HBx targeting to mitochondria and ROS generation are necessary but insufficient for HBV-induced cyclooxygenase-2 expression[J]. J Mol Med(Berl), 2010, 88(4):359-369.
[28]Cheng AS, Yu J, Lai PB, et al. COX-2 mediates hepatitis B virus X protein abrogation of p53-induced apoptosis[J]. Biochem Biophys Res Commun, 2008, 374(2):175-180.
(本文编辑杨晨晨)
CYP2E1 expression in HBV-Transgenic mice with acute liver injury
ZHANG Chun1, SHOU Xi1, LI Zhiqiang1, WANG Xuemei1, JIANG Tao1, DUAN Mingjun1,WEI Qin1, ZHENG Qian2
(1XinjiangKeyLaboratoryforMedicalAnimalModelResearch,theFirstAffiliatedHospitalofXinjiangMedicalUniversity,Urumqi830054,China;2DepartmentofChineseMedicine,theSecondAffiliatedHospitalofXinjiangMedicalUniversity,Urumqi830063,China)
ObjectiveTo study the CYP2E1 gene expression in carbon tetrachloride (CCl4)-induced acute liver injury in HBV transgenic mice. MethodsTwenty four HBV (-) and twenty four HBV(+) transgenic mice aged 8 to 10 weeks were selected for the present study. CCl4intraperitoneal injection were performed to induce acute liver injury model. 8 normal clean-grad C57BL/6 mice were taken as the control group. The control group received saline intraperitoneally. 3 h, 6 h, 12 h, 24 h, 48 h and 72 h after injection, respectively, the mice in each group were killed. The liver tissue samples of mice were collected. The liver histological changes at different time points in each group were observed under light microscope. The quantitative PCR methods were utilized to measure the relative mRNA levels of CYP2E1 gene in liver tissue. Immunohistochemistry and Western blot techniques were used to observe tissue expression levels of CYP2E1 in each group. ResultsCompared with the control group, both in HBV(-) group and in HBV (+) group had severe liver damage, CYP2E1 gene and protein expression levels significantly increased. ConclusionIn CCl4induced acute liver injury of HBV transgenic mice, the CYP2E1 gene expression significantly increased. The results provided evidence for the HBV-induced liver damage and liver cancer pathogenesis.
gene expression; liver; mice; CYP2E1; acute liver injury; carbon tetrachloride
新疆医学动物模型研究重点实验室开发课题(XJDX1103-2013-07)
张春(1981-),男, 硕士,助理研究员,研究方向:人类疾病动物模型研究。
郑茜,女,硕士,副主任医师,研究方向:中医内科学,E-mail:17260135@qq.com。
R575.5
A
1009-5551(2016)10-1272-05
10.3969/j.issn.1009-5551.2016.10.015
2016-04-11]
