水产品中沙门菌检测实验室间比对样品制备的研究
2016-10-20陈冠武陈冬娥曾梅锦苏建晖张峥嵘
陈冠武 陈冬娥 蔡 颖 曾梅锦 苏建晖 张峥嵘
(汕头出入境检验检疫局广东汕头515000)
水产品中沙门菌检测实验室间比对样品制备的研究
陈冠武陈冬娥蔡颖曾梅锦苏建晖张峥嵘
(汕头出入境检验检疫局广东汕头515000)
为了探索优化水产品中沙门菌检测实验室间比对样品制备方法,为科学实施实验室比对提供依据。以冻虾仁为样品基质,人工添加沙门菌和(或)某些生物性状相近的干扰菌后作为实验室间比对样品,研究样品基质处理、染菌样品中阳性菌株与干扰菌株的互相影响、阴阳性样品染菌方案的比较、验证3个关键步骤的技术要点。结果证明制作的冻虾仁沙门菌比对样品均匀性和稳定性检验结果符合要求,应用于实验室间比对中能够较好地反映参试实验室的检测水平。
沙门菌;实验室间比对;样品制备;水产品;干扰菌
1 前言
沙门菌广泛分布于自然界,是人类和动物的重要致病菌[1],在世界各地的食物中毒中,沙门菌食物中毒位居1、2位[2],国内外各类食品水产品卫生标准中均要求沙门菌不得检出[3]。因此,沙门菌的检测在食品安全检测中具有重要的意义。实验室间比对是指在预定条件下,对两个或两个以上实验室就同一或相似的检测对象进行检测或测量的组织、实施和评价[4]。实验室间比对可用于多种目的,其中,最常见的目的为确定实验室进行某些特定检测或者测量的能力,以及监控实验室的持续能力[5]。实验室间比对的结果既可用于实验室内部质量控制评价,也可供监管机构了解和监督实验室的检测水平和质量控制情况[6]。
进行水产品中沙门菌检测实验室间比对样品制备时,应尽量模拟实际样品检测中可能遇到的各种干扰因素,将检测过程的重点、难点考虑进去,同时应保证样品性状、干扰因素的均匀性和稳定性。
2 材料与方法
2.1材料
2.1.1实验菌株
2.1.1.1标准菌株
甲型副伤寒沙门菌(salmonella paratyphi-A,简称甲沙,菌株编号CMCC50093)、鼠伤寒沙门菌(salmonella typhimurium,简称鼠沙,菌株编号CMCC50115):购自中国微生物菌种保藏管理中心。
2.1.1.2干扰菌菌株
奇异变形杆菌(简称奇杆)、杨氏柠檬酸杆菌(简称杨杆)、迟钝爱德华杆菌(简称爱杆)、粘质沙雷菌(简称粘雷)、温和气单胞菌(简称温单)、大肠杆菌(简称大杆)、产碱普罗威斯菌(简称普罗):均来自本实验室日常水产品检验分离并经鉴定保留的菌种。
2.1.2主要仪器设备
SPX-250B-Z型等生化培养箱:上海博迅实业有限公司;HR40-II-B2生物安全柜:青岛海尔特种电器有限公司;CLASS II A/B3和NU-400-400E型生物安全柜:北京奥创兴业科技发展有限公司;MDF-382E超低温冰箱:日本三洋株式会社;HV-85型自动高压灭菌器:日本HIRAYAMA公司;菌液浊度计:生物梅里埃中国有限公司。
2.1.3主要培养基及试剂
缓冲蛋白胨水(BPW)、四硫磺酸钠煌绿增菌液(TTB)、亚硒酸盐胱氨酸增菌液(SC)、亚硫酸铋(BS)、HE琼脂(HE)、XLD琼脂(XLD)、三糖铁琼脂(TSI)、营养琼脂(NA)、胆硫乳糖脂(DHL)、沙门菌生化检测试剂盒:广东环凯生物科技有限公司;沙门菌显色培养基(CAS):法国科马嘉;API20E生化试剂鉴定盒:法国梅里埃公司;沙门菌属A-F多价O诊断血清(O血清):宁波天润生物药业有限公司。
2.2方法
2.2.1比对样品制备方法
样品制备方法流程见图1。
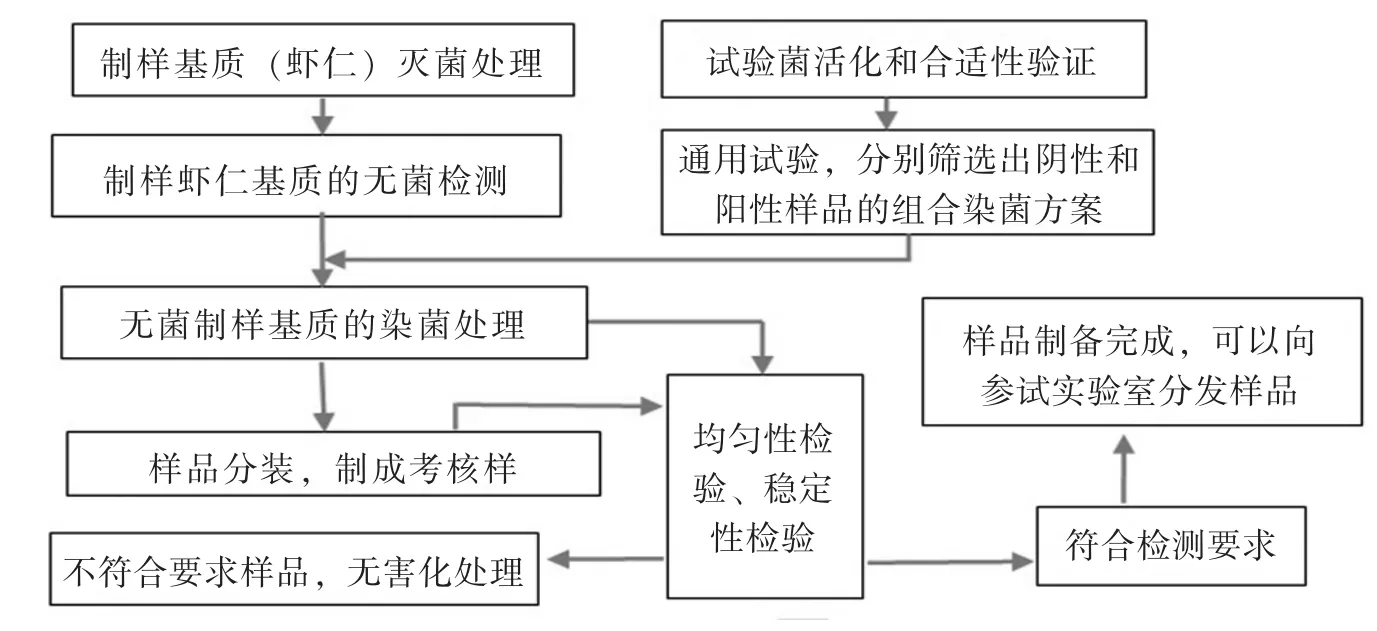
图1 水产品中沙门菌检测实验室间比对样品制备方法流程
2.2.2样品基质的选择及处理
2.2.2.1样品基质的选择
由于预报名的参试实验室达30多家,按每个实验室发送样品2×30 g计,加上预试验和均匀性、稳定性实验的消耗和其他损耗,初步估计至少约需5 kg样品。同时,要求样品基质要在灭菌处理后能“吸入和包裹”所要加入的菌液,制备的样品才可能均匀。根据以上两点,结合本地和本实验室实际情况,并经过比较和选择,最终选定单冻虾仁作为本研究的制样基质。
2.2.2.2样品基质的处理
首先进行无菌处理,将每份2000 g冻虾仁样品盛放于网格底容器室温下解冻,经121℃、30min高压灭菌后,在无菌条件下60℃、30min烘干,结果制出干虾仁约700 g。取经无菌处理的干虾仁按1:10加入BPW,经37℃培养8 h,吸1.0mL涂布NA平板2块,观察菌落生长情况以评价灭菌效果。
2.2.2.3样品吸水量测试
为了保证染菌过程菌液的完全吸收,需通过试验确定干虾仁的吸水能力。取70 g干虾仁,加入适量无菌水,观察其在室温下30min内能完全吸收的液体量。
2.2.3染菌样品中阳性菌株与干扰菌株的互相影响
2.2.3.1标准菌株和干扰菌株筛选试验
将9种实验菌株经复壮后,分别接到沙门菌检验标准中使用到的HE、XLD、DHL、BSA、CAS平板上,经过适当时间培养后,观察菌落形态;同时将这些细菌进行O血清凝集试验,观察凝集反应。标准菌株应符合相关检验标准《GB 4789.4-2010食品安全国家标准食品微生物学检验沙门菌检验》《SN 0170-92出口食品沙门菌属(包括亚利桑那菌)检验方法》中的描述,干扰菌应为水产品或环境中的常见杂菌,且有某些性状与沙门菌近似,在某些分离平板上能生长出易与沙门菌混淆的菌落或影响目标菌菌落特征的表现,但可以根据生化特征和血清学鉴定明确区分其与沙门菌特征不符。
2.2.3.2染菌样品中阳性菌株与干扰菌株的互相影响
为了使试验结果更为清晰,方便分析,本研究将2种沙门菌标准菌株的菌液分别与7种干扰菌株的菌液以5∶1比例做一对一混合后,以约10-30CFU/g的浓度,按2.2.2.3样品吸水量测试实验结果将不高于样品基质最高吸水量的菌液加入干虾仁样品中,放置30min使菌液完全吸干。在4℃±2℃放置2 d、6 d、10 d、14 d、18 d后,分别进行样品的感观检查,观察样品的性状、气味等是否发生明显变化;同时分别取样,按照现行沙门菌检验标准进行检验。要求染菌后至18 d,样品性状不能发生明显变化;阳性样品染菌用的干扰菌与沙门菌共存时,在增菌培养过程应能保证两者共存,不能出现任一种菌被完全抑制的情况,也不能影响沙门菌的菌落特征、生化特性和血清学性状;阴性样品染菌用的干扰菌既表现出与沙门菌相近的一些特性,但通过现有检验方法标准的操作,能够比较清楚、明确地互相区分出来。
2.2.4阴阳性样品染菌方案的比较、验证
根据2.2.3的试验结果,经分析后初步确定阴阳性样品中不同菌株染菌样品的组合和配比,并进行实验验证。为了保证染菌样品的稳定性和均匀性,将按2.2.3实验结果选出的阳性菌株和干扰菌株的菌液分别添加到不同的制样基质中,放置30min使菌液完全吸干。然后按事先确定的比例将不同菌株的染菌样品充分混合一起,分别制成不同配方的阴阳性样品。在4℃±2℃放置2 d、6 d、10 d、14 d、18 d后,分别进行样品的感观检查,观察样品的性状、气味等是否发生明显变化;同时分别取样,按照现行沙门菌检验标准进行检验。
3 结果
3.1样品基质的选择及处理
经121℃、30min高压灭菌后,制样基质无菌落生长。经吸水量测试,70 g无菌干虾仁样品能吸干无菌水9-10mL。
3.2样品染菌方法及对样品性状的影响
3.2.1标准菌株和干扰菌株筛选试验结果
各菌株培养基生长试验及血清凝集试验结果见表1。结果表明,标准菌株符合现行检验标准的描述,干扰菌也都具有与沙门菌近似的某些性状,但同时具有可以与沙门菌区分的明显特征。9种菌株均可作为下一步混合和配比的候选菌。
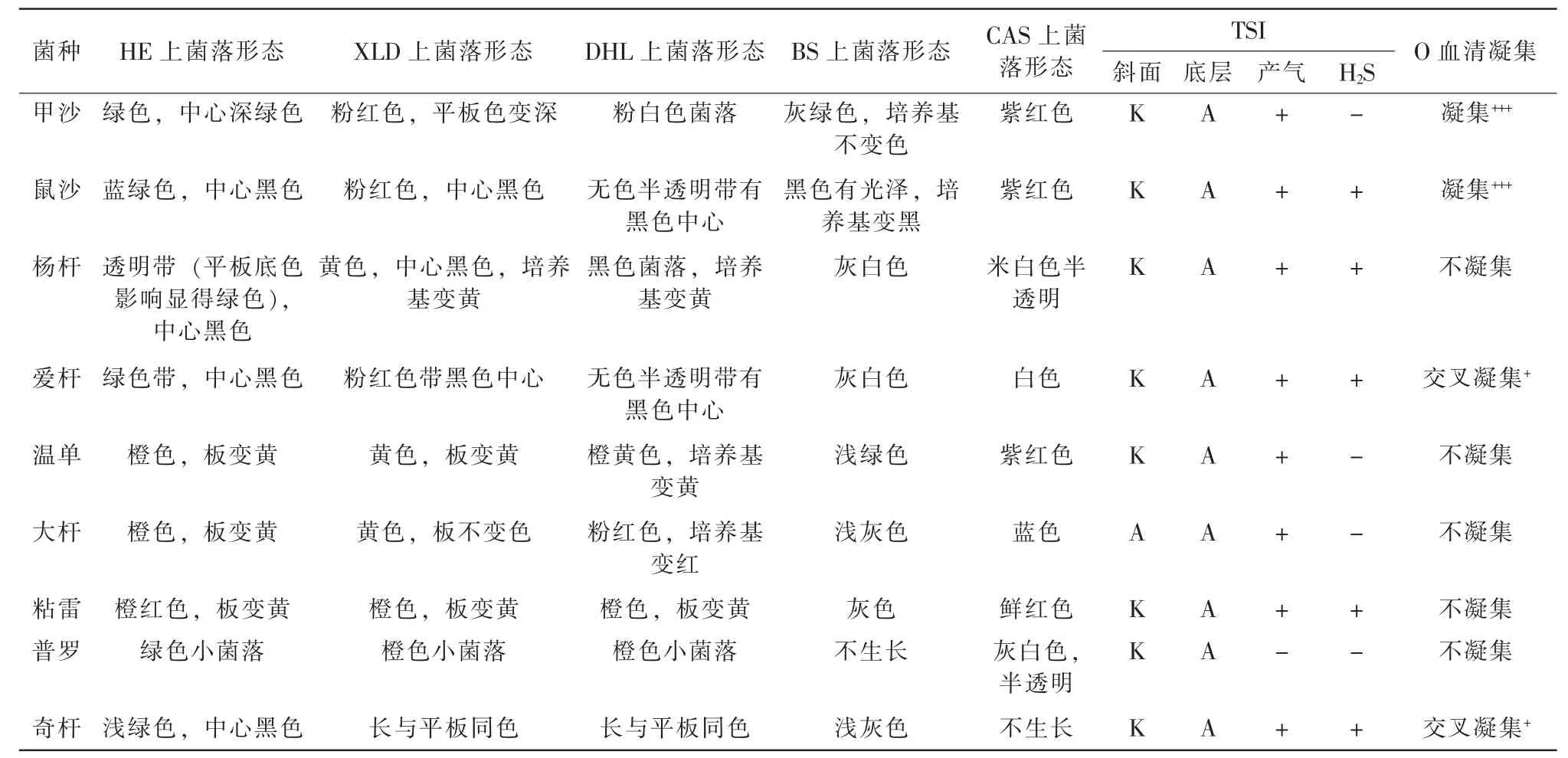
表1 各菌株培养基生长试验及血清凝集试验结果
3.2.2阴/阳性样品不同菌株染菌样品组合和配比的比较、验证结果
实验结果显示,所有干扰菌中大肠杆菌与沙门菌的相似度虽不大,但共存时相互抑制作用不明显,适合作为阳性样品的干扰菌,为防止考核过程“串通”行为,作为阴性样品中也需加入大肠杆菌作为干扰菌;爱杆、杨杆和温单菌既表现出与沙门菌相近的一些特性而且在增菌过程不会相互抑制,组合后能使各种分离平板上都长有具近似沙门菌的菌落形态,需通过现有检验方法标准的生化及血清学鉴定,才能够比较清楚、明确地互相区分出来,适合作为阴性样品干扰菌。粘雷和奇杆菌在几天内使虾仁变质(变红色和发臭);鼠沙在有粘雷菌的平板上产H2S出现变缓的无黑色中心的变化;普罗在TTB、SC增菌液中生长明显劣于鼠沙,普罗在SC增菌液中生长明显优于甲沙并在HE、XLD平板上接近甲沙,甲沙在有普罗菌的平板上出现24 h产H2S黑色中心变化,这给挑可疑沙门菌增加很大难度,所以粘雷、奇杆和普罗菌均排除出组合。为此,初步确定阴、阳性样品各2种染菌样品组合方式(表2),组合样品实验验证结果见表3。

表2 初步确定的4种染菌样品组合和配比

表3 组合样品实验验证结果
4 讨论
(1)采用水产品实物制备,要求制备比对样品的水产品基质要在灭菌处理后能“吸入和包裹”所要加入的菌液,让菌液渗入样品内部,而不是只附着于样品表面,制备的样品才可能均匀。本研究根据日常检验的经验和本实验室的实际情况,选择了单冻虾仁作为制样基质。基质处理方案是先经121℃、30min高压灭菌,然后经60℃、30min烘干,使样品达到半脱水状态,才有利于在后面染菌步骤充分地吸收菌液。经过组织实验室间比对验证,证明本研究选择的样品基质和处理方式合适。
(2)标准菌株和干扰菌株筛选试验结果表明,本研究选取的2株标准菌株(鼠沙、甲沙)符合相关检验标准中的描述,7株干扰菌(奇杆、粘雷、爱杆、杨杆、温单、普罗、大杆)均有某些性状与沙门菌近似,易造成混淆,但又具有可以与沙门菌区分的明显特征。由于沙门菌属包含的菌型数量多,因此现有检测标准中规定需要使用多种增菌液及多种分离平板,才能保证不会漏检,而且保证能够与非沙门菌区分开来。组织水产品中沙门菌检测实验室间比对的目的,就是要考察参试实验室是否能够掌握并熟练运用检测方法标准。因此,样品制备时,必须围绕这个主要目的,首先至少要准备两种不同的沙门菌菌株,其次是使用的干扰菌有相当的迷惑性,但不能超出检验校准的检测能力。本研究通过染菌样品中阳性菌株与干扰菌株的互相影响的研究,制定了初步的染菌方案,并进行了阴阳性样品染菌方案的比较、验证。结果表明,最后确定的阴性和阳性样品各两种染菌方案(杨氏柠檬酸杆菌+温和气单胞菌+大肠杆菌、迟钝爱德华杆菌+温和气单胞菌+大肠杆菌的组合作为阴性样品;1份鼠伤寒沙门菌染菌样品+3份大肠杆菌染菌样品、1份甲型副伤寒沙门菌染菌样品+3份大肠杆菌染菌样品组合作为阳性样品),能够较好地达到实验室比对目的。考虑到某些企业实验室首次参加实验室间比对检测,所以考核难度不宜太高,每份样品中要有一个阳性样品,方便检测过程中可做为阳性对照菌株。最终发给参试实验室的测试样品为:阳性样品中随机取1个,阴性样品中取1个,共有4种可能的组合,每个样品都是随机编号。
(3)实验室比对样品检测期限内,本实验室按一定间隔进行了一系列稳定性试验,结果表明,样品稳定性符合实验室间比对试验要求。本次参试实验室的样品运输时间都在48 h内,实验室间比对自检是从发样后第2 d、4 d、6 d、8 d、10 d、12 d,由不同检验员进行6次检测,考核冻虾仁共24份样品。每次从留样中按类随机抽样检验,检验结果:6次均从A类样品中检出杨杆、温单、大杆;从B类样品中检出爱杆、温单、大杆;从C类样品中检出鼠沙和大杆;从D类样品检出甲沙和大杆。与预期结果完全一致,说明制备的样品符合实验室间比对样品要求。
(4)本次比对30家参试实验室中有23家检验结果满意,7家不满意,满意率为77%。经核查7家不满意实验室的检测原始记录,发现其检测质量或技术存在较严重问题,归纳主要原因有:①生化结果正确,但未做血清学鉴定,凭菌落特征和生化结果做出错误判断;②单个生化项目错误导致结果判断错误,存在综合分析能力不足和生化结果阴阳性判断不熟悉;③没有研读标准,未按标准应用多种增菌液和分离平板或仅挑一个可疑菌落进行鉴定;④某些基础操作技能不规范,如菌株没有分纯就进行生化鉴定等。经过向实验室发出实验室间比对结果分析报告,并进行个别辅导,纠正了这些实验室的错误做法,有效提高了其水产品中沙门菌检测水平。结果说明,本次实验室间比对由于样品制备科学、稳定,使比对试验既有一定难度,又不至于造成无法检测或结果不稳定,可以考查出实验室的真实水平。
5 结论
通过研究样品基质处理、染菌样品中阳性菌株与干扰菌株的互相影响、阴阳性样品染菌方案的比较、验证3个关键步骤的技术要点,结果显示,先于121℃、30min高压灭菌,然后经60℃、30min烘干的方法处理样品基质,并采用阴性和阳性样品各两种染菌方案(杨氏柠檬酸杆菌+温和气单胞菌+大肠杆菌、迟钝爱德华杆菌+温和气单胞菌+大肠杆菌的组合作为阴性样品;1份鼠伤寒沙门菌染菌样品+3份大肠杆菌染菌样品、1份甲型副伤寒沙门菌染菌样品+3份大肠杆菌染菌样品组合作为阳性样品),分别随机组合成含阴阳性样品的考核样品组,能够较好地达到实验室比对的目的。
[1]徐建国,阚飙,张建中,等.现场细菌学[M].北京:科学出版社,2011:115-130.
[2]苏世彦.食品微生物检验手册[M].北京:中国轻工业出版社,1998:107.
[3]吕志平.国内外技术法规和标准中食品微生物限量[M].北京:中国标准出版社,2002:1-371.
[4]GB/T 28043-2011利用实验室间比对进行能力验证的统计方法[S].
[5]GB/T 15483.1-1999利用实验室间比对的能力验证第1部分:能力验证计划的建立和运作[S].
[6]陈文胜,谭慧嘉,罗建波,等.公共卫生实验室内部质量控制技术探讨与实例分析[J].中国职业医学,2011,38(增刊):40-42.
[7]GB4789.4-2010食品安全国家标准食品微生物学检验沙门菌检验[S].
Study on the Detection of Preparation for Salmonella Samples in Aquatic Products between Laboratories
CHEN Guanwu,CHEN Donge,CAI Ying,ZENG MeiJin,SU Jianhui,ZHANG Zhengrong
(Shantou Entry-Exit Inspection and Quarantine Bureau,Shantou,Guangdong,515000)
This study aims to explore optim ization methods of Salmonella samples in aquatic products between Laboratories and provides scientific basis for the implementation of laboratory comparison. Frozen shrimp as the basic sample,adding the artificial Salmonella and(or)some sim ilar interference bacteria as the final inter laboratory comparison specimen,studying and testing the sample processing procedures,the interaction between positive strains and interfering strains in the bacterial samples,the comparison of bacterial contam ination in the positive strains and interfering strains in the bacterial samples,verifying three key steps of the technical essentials.Results proved the homogeneity and stability of frozen shrimp Salmonella samples’test results meets the requirements.The application between different laboratories can better reflect the test level of the laboratory.
Salmonella;Inter Laboratory Comparison;Sample Preparation;Aquatic Products;Interfering Bacteria
TS207.4
E-mail:13682884777@139.com
2016-03-07
