Fe/羟基磷灰石多相类Fenton体系有效降解结晶紫染料废水
2016-10-14郭效军严虎东
郭效军,韩 晓,严虎东
(西北师范大学化学化工学院,兰州 730070)
Fe/羟基磷灰石多相类Fenton体系有效降解结晶紫染料废水
郭效军,韩晓,严虎东
(西北师范大学化学化工学院,兰州730070)
以结晶紫溶液为模拟染料废水,Fe/HAP为催化剂,对该多相类Fenton体系的催化活性进行了研究,探讨了H2O2投加量、催化剂投加量、pH值、反应温度、溶液初始浓度对结晶紫去除效果的影响。结果表明在H2O2用量为1 mL,催化剂投加量为1 g/L,pH值为9,降解温度为30 ℃,浓度为40 mg/L的结晶紫溶液脱色率在96%以上。
类Fenton; 非均相催化; Fe/HAP; 结晶紫
1 引 言
随着现代工业的发展,大量的有机工业品、杀虫剂、染料等排入环境,直接或间接的对水体造成了污染[1]。处理污水的方法有很多,活性污泥法、混凝中和法、沉淀(或气浮)法等属于常规的水处理技术,简便易行,但效果不佳。焚烧、膜分离等方法处理效果良好,但存在技术要求高、投资大、成本高等不足。Fenton法是一种高效、无选择性的化学处理方法。但传统Fenton法在强酸性下反应,过氧化氢利用率低,活性组分流失严重,催化剂难以重复利用,处理成本较高[2-4]。有报道称将铁负载在树脂、层状粘土和活性炭上,可有效减少Fe组分的流失[5-7]。作为一种功能材料,羟基磷灰石[Ca10(PO4)6(OH)2, hydroxyapatite, HAP]可用于污水中重金属的脱除,也可作为催化剂的载体[8,9]。结晶紫是一种应用广泛的染料,性质稳定,毒副作用明显,难以生物降解,因此有效处理结晶紫染料废水具有重要的现实意义。Chen[10]对CuFe2O4在微波辐射下降解结晶紫的行为进行了研究。Ameen[11]研究了氧化锌光催化降解结晶紫的行为。郭效军[12]以Mg-Al CLDHs和H2O2组成的类芬顿体系催化降解结晶紫染料废水。
本文在HAP上负载一定量金属Fe制成Fe/HAP催化剂,在H2O2存在下,对该多相类Fenton体系降解结晶紫(C25H30N3Cl·9H2O,Crystal Violet,简称CV)溶液的行为进行研究,考察Fe/HAP用量、H2O2用量、pH值、反应温度、溶液初始浓度等因素的影响。
2 实 验
2.1实验试剂和仪器
试剂:结晶紫(化学纯);氢氧化钠(分析纯);30%过氧化氢;盐酸(分析纯);催化剂Fe/HAP由本实验室自制;结晶紫储备液质量浓度为1000 mg/L,实验时稀释至所需浓度。
仪器:PHS-3C精密pH计;80-2型低速离心机;BS124S电子天平;SHA-B型恒温振荡器;79HW-1恒温磁力搅拌器;UV-8453A型紫外分光光度计。
2.2实验方法
催化剂的制备:准确称取10 g自制的羟基磷灰石(HAP),浸渍于1000 mg/L的Fe(III)溶液中。在体系pH值为2~3时,于恒温振荡器振荡12 h(振荡速度为200 r/min)。过滤,去离子水洗涤至中性,并于105 ℃干燥后,研磨备用。
降解实验:将50 mL一定浓度的结晶紫溶液移入100 mL具塞锥形瓶中,分别加入一定量的催化剂和氧化剂,在一定温度下于恒温振荡器中振荡。反应一段时间后取样,采用紫外分光光度计分析离心分离所得上层清液。以如下公式计算结晶紫溶液的脱色率:
(1)
其中:T-结晶紫溶液的脱色率;A0-降解前结晶紫溶液的吸光度值;A-降解一段时间后所得清液的吸光度值。
3 结果与讨论
3.1催化剂的表征
图1为HAP和Fe/HAP的X射线衍射图谱。根据图1,将羟基磷灰石放入1000 mg/L的Fe(III)溶液浸渍后,羟基磷灰石的主要特征衍射峰仍然清晰可见,但是(300)、(321)、(410)、(402)等晶面的衍射峰已基本上消失,特征衍射峰宽化明显表明一些衍射峰发生了合并。以上说明羟基磷灰石经Fe3+溶液浸泡后,Fe3+已负载其上,可能其结构中部分Ca2+被Fe3+取代。
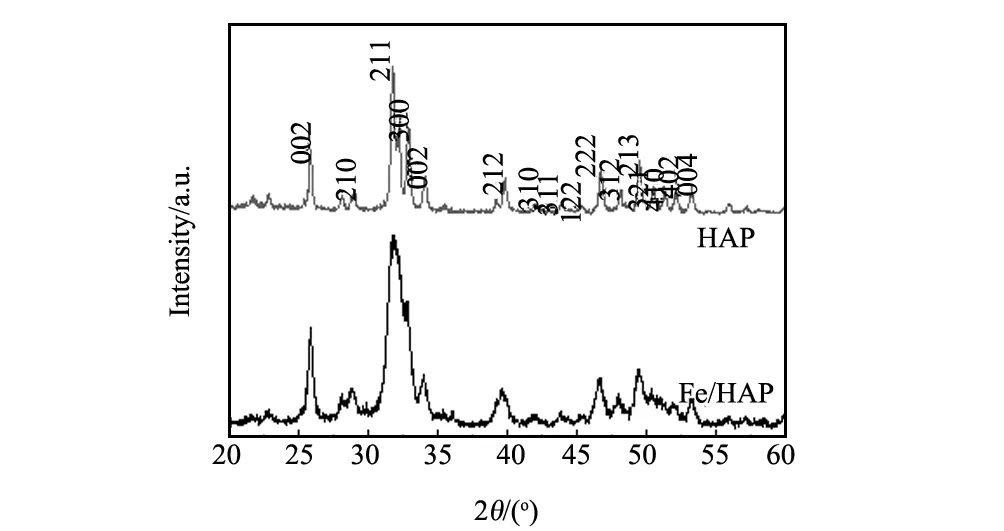
图1 HAP和Fe/HAP的X射线粉末衍射图Fig.1 XRD spectra of HAP and Fe/HAP
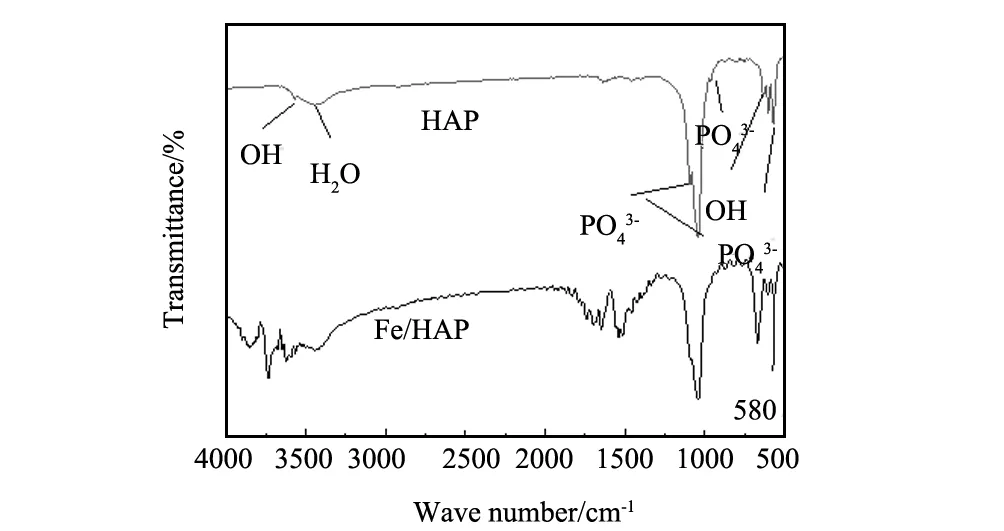
图2 样品的傅里叶红外光谱图Fig.2 FT-IR spectra of Fe/HAP and HAP
图2为HAP以及Fe/HAP的傅里叶变换红外光谱图。由图2可见,Fe/HAP在580 cm-1处的吸收峰归属为Fe-O的伸缩振动和弯曲振动,说明铁负载的羟基磷灰石已经形成[13,14]。这与前面所述XRD分析结果相一致。
3.2pH值的影响
催化剂加入量为0.05 g,H2O2加入量为1 mL,温度为30 ℃,反应时间40 min时,不同pH值下多相类芬顿体系对40 mg/L结晶紫溶液的降解情况如图3所示。pH值较小时,结晶紫溶液的脱色率随着pH值增加而增大;pH值为9时脱色率达到最大;pH值大于9以后,pH值增加,脱色率表现出缓慢减少的趋势。这是由于碱性条件有利于体系中存在较高浓度的·OH自由基[15],使其脱色率较高;但碱性太强时,H2O2将快速分解为H2O和O2,降低了体系中·OH自由基的浓度,使脱色效果变差。故在随后的实验中pH均选为9。
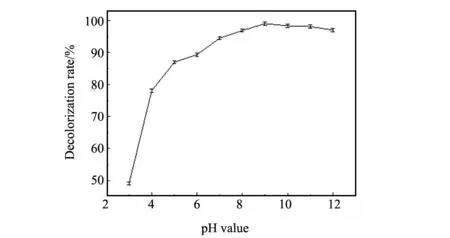
图3 pH值对结晶紫溶液脱色率的影响Fig.3 Effect of pH value on the decolorization rate of CV solution
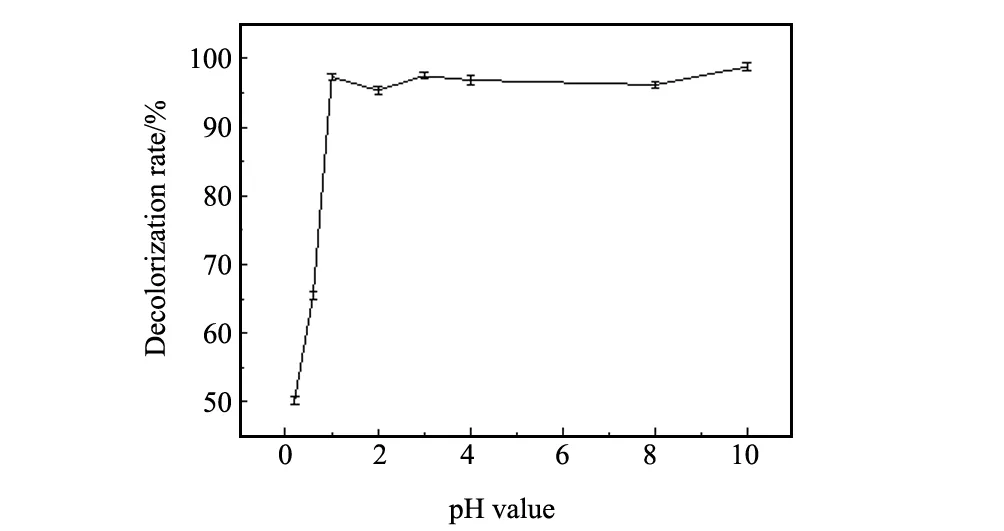
图4 催化剂用量对结晶紫溶液脱色率的影响Fig.4 Effect of catalyst dose on the decolorization rate of CV solution
3.3催化剂用量的影响
pH值为9,H2O2加入量为1 mL,温度为30 ℃,反应时间40 min时,不同催化剂加入量下多相类芬顿体系对40 mg/L结晶紫溶液的降解行为如图4。由图4可知,增大催化剂的投加量,会使更多的H2O2转化为·OH,如果催化剂用量足够,将显著增加结晶紫溶液的脱色率;当催化剂用量增加到一定值后,由于降解过程持续地进行,溶液中染料分子的浓度逐渐降低,使染料分子与·OH接触几率减少,再多的催化剂用量也不能使脱色率明显提高。因此催化剂用量选为1 g/L。
3.4H2O2用量的影响
催化剂加入量为0.05 g,pH值为9,温度为30 ℃,反应时间40 min时,不同H2O2加入量下多相类芬顿体系对40 mg/L结晶紫溶液的降解情况如图5所示。当H2O2投加量增加时,由于体系中存在较多的·OH,结晶紫溶液脱色率的增加非常明显;当H2O2投入量达到一定值后,再增加H2O2用量,脱色率变化不大,表明过多的氧化剂对脱色率的提高已没有大的作用。过量的H2O2或者无效分解,或者与溶液中的活性物种·OH发生竞争[16]。因此随后实验中H2O2加入量为1 mL。
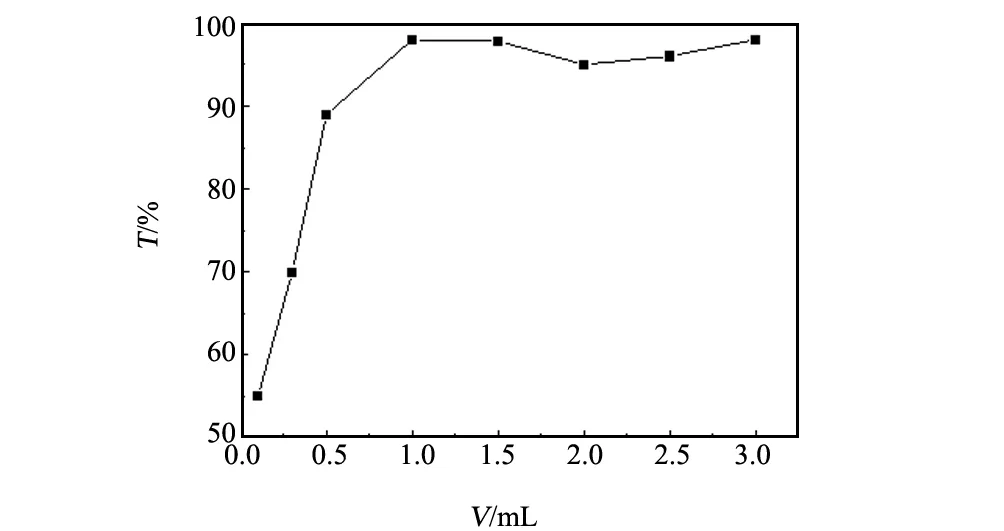
图5 氧化剂用量对结晶紫溶液脱色率的影响Fig.5 Effect of oxidant dose on the decolorization rate of CV solution
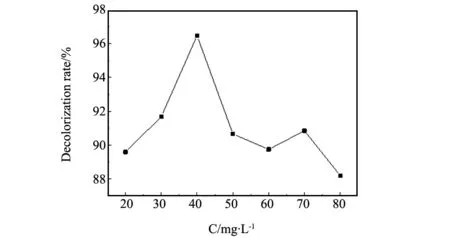
图6 初始浓度对结晶紫溶液脱色率的影响Fig.6 Effect of initial concentration on the decolorization rate of CV solution
3.5溶液初始浓度的影响
催化剂加入量为0.05 g,pH值为9,H2O2加入量为1 mL,温度为30 ℃,反应时间40 min时,多相类芬顿体系对不同浓度结晶紫溶液的降解情况如图6所示。由图6可知,初始浓度增加,脱色率升高,当结晶紫初始浓度为40 mg/L时,废水脱色率达到最大;溶液浓度继续增大,废水脱色率逐渐下降。较高的初始浓度将增大反应物与·OH自由基接触的几率,有利于降解反应的进行;当溶液浓度增大到一定值后,由于反应体系中·OH自由基相对不足,减少了反应物与·OH自由基接触的几率,导致脱色率下降。
3.6反应温度的影响
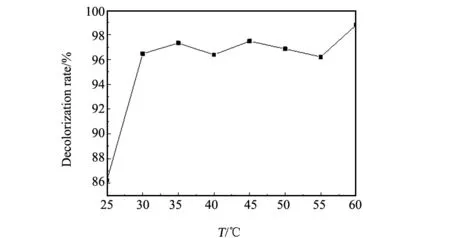
图7 温度对结晶紫溶液脱色率的影响Fig.7 Effect of temperature on the decolorization rate of CV solution
催化剂加入量为0.05 g,pH值为9,H2O2加入量为1 mL,反应时间40 min时,不同温度下多相类芬顿体系对40 mg/L结晶紫溶液的降解情况如图7所示。由图7可知,选定温度下结晶紫溶液的脱色率均大于96%且变化不大。故在操作中将反应温度选为30 ℃。
3.7多相类Fenton催化反应机理
关于多相类Fenton催化反应机理,目前主要有两种机理。一种认为过氧化氢在固相催化剂表面以Haber-Weiss机制产生羟基自由基并在催化剂表面对有机化合物进行氧化降解[17]。另一种是Lin等[18]提出的铁氧化合物络合-催化机理。研究表明多相类Fenton体系在酸性条件下,自由基机理占主导作用;中性条件下,两种作用机理同时共存;碱性条件下,非自由基机理占主导[19,20]。因此在本实验的反应条件下(pH=9),Fe负载HAP催化H2O2降解结晶紫的反应按非自由基机理进行,催化作用主要由铁氧化物的表面催化反应所致。其具体的机理有待进一步深入研究。
4 结 论
以Fe/HAP为催化剂,研究了该多相类Fenton体系降解结晶紫模拟染料废水的行为。考察了pH值、反应时间、反应温度、催化剂用量、氧化剂用量、溶液起始浓度等因素的影响。结果显示Fe/HAP投加量为1 g/L、pH为9、H2O2用量为1 mL、反应温度为30 ℃、染料浓度为40 mg/L时,结晶紫溶液脱色率在96%以上。
[1] 何立平,杨迎春,徐成华,等.Fe/活性炭多相类Fenton法湿式氧化罗丹明B废水的研究[J].环境工程学报,2009,3(8):1433-1437.
[2] 阳立平,肖贤明.Fenton法在焦化废水处理中的应用及研究进展[J].中国给水排水,2008,24(18):9-13.
[3] Badawy M I,Ghaly M Y,Gad-Allah T A.Advanced oxidation processes for the removal of organophosphonm pesticides from wastewater[J].Desalination,2006,194:166-175.
[4] Ince N H,Gokce T G.Impacts of pH and molecular structure on ultrasonic degradation of Azo dyes[J].Ultrasonics,2004,42:591-596.
[5] Liou R M,Chen S H,Hung M Y,et al.Fe(III) supported on resin as effective catalyst for the heterogeneous oxidation of phenol in aqueous solution[J].Chemosphere,2005,59(1):117-125.
[6] Guelou E,Barrault J,Fournier J,et al.Active iron species in the catalytic wet peroxide oxidation of phenol over pillared clays containing iron[J].AppliedCatalysisB,2003,44:1-8.
[7] Ramirez J H,Maldonado-Hodar F J,Perez-Cadenas A F,et al.Azo dye orange II degradation by heterogeneous Fenton-like reaction using carbon-Fe catalysts[J].AppliedCatalysisB,2007,75(3): 312-323.
[8] Corami A,Mignardi S,Ferrini V.Cadmium removal from single- and multi-metal (Cd+Pb+Zn+Cu) solutions by sorption on hydroxyapatite[J].JournalofColloidandInterfaceScience,2008,317(2): 402-408.
[9] Sandrine B,Ange N,Didier B,et al.Removal of aqueous lead ions by hydroxyapatite: Equilibria and kinetic process[J].JournalofHazardousMaterials,2007,139:443-446.
[10] Chen H,Yang S,Chang J,et al.Efficient degradation of crystal violet in magnetic CuFe2O4aqueous solution coupled with microwave radiation[J].Chemosphere,2012,89(2):185-189.
[11] Ameen S,Akhtar M S,Nazim M,et al.Rapid photocatalytic degradation of crystal violet dye over ZnO flower nanomaterials[J].MaterialsLetters,2013,96:228-232.
[12] 郭效军,李海如,李雨甜.Mg-Al CLDHs/H2O2体系降解结晶紫染料废水的研究[J].硅酸盐通报,2015,34(5):1223-1228.
[13] Kaushik A,Khan R,Solanki P R, et al.Iron oxide nanoparticles-chitosan composite based glucose biosensor[J].BiosensorsandBioelectronics,2008,24:676-683.
[14] Kaushik A,Pratima R S,Anees A A,et al.Iron oxide-chitosan nanobiocomposite for urea sensor[J].SensorsandActuatorsB,2009,138:572-580.
[15] Du Y K,Rabani J.Flocculation-induced homolysis of hydrogen peroxide in aqueous colloid solution of titanium dioxide nanoparticles[J].JournalofPhysicalChemistryB,2006,110:6123-6128.
[16] Pham A L T,Lee C,Doyle F M,et al.A silica-supported iron activating hydrogen peroxide at neutral pH values[J].EnvironmentalScienceandTechnology,2009,43, 8930-8935.
[17] Xue X F,Hanna K,Abdelmoula M,et al.Adsorption and oxidation of PCP on the surface of magnetite: kinetic experiments and spectroscopic investigations[J].AppliedCatalysisB:Environmental,2009,89(3/4): 432-440.
[18] Lin S S,Gurol M D.Catalytic decomposition of hydrogen Peroxide on iron oxide: kineties, mechanism, and implications[J].EnvironmentalScienceandTechnology,1998,32:1417-1423.
[19] Kwan W P,Voelker B M.Rates of hydroxyl radical generation and organic compound oxidation in mineral-catalyzed Fenton-like systems[J].EnvironmentalScienceandTechnology,2003,37:1150-1158.
[20] Kwan W P,Voelker B M.Decomposition of hydrogen peroxide and organic compounds in the presence of dissolved iron and ferrihydrite[J].EnvironmentalScienceandTechnology,2002,36:1467-1476.
Efficient Degradation of Crystal Violet in Simulated Dye Wastewater Using Fe/HAP/H2O2Reagents
GUOXiao-jun,HANXiao,YANHu-dong
(College of Chemistry & Chemical Engineering,Northwest Normal University,Lanzhou 730070,China)
The catalytic efficiency of Fe/HAP which is used to promote heterogeneous Fenton-like reaction was examined by employing crystal violet as a model compound. The influencing factors such as the dosage of hydrogen peroxide and Fe/HAP, reaction temperature, pH value and initial dye concentration were also discussed. When the dosage of H2O2and Fe/HAP were 1 mL and 1 g/L, respectively, and pH value was 9, the removal rate of Crystal Violet whose initial concentration was 40 mg/L was over 96% at 30 ℃.
Fenton-like;heterogeneous catalysis;Fe/HAP;crystal violet
甘肃省高等学校基本科研业务费
郭效军(1969-),男,博士,副教授.主要从事能源与功能材料化学方面的相关研究
TQ175
A
1001-1625(2016)04-1249-5
