黑曲霉产胺氧化酶培养及诱导条件的优化
2016-10-14周小虎朱霞王磊焦梦然黄瑶付彩霞曹约泽高冰汪超李冬生徐宁
周小虎,朱霞,王磊,焦梦然,黄瑶,付彩霞,曹约泽,高冰,汪超,李冬生,徐宁*
(1.湖北工业大学工业发酵湖北省协同创新中心湖北省食品发酵工程技术研究中心,湖北武汉430068;2.湖北土老憨调味食品股份有限公司湖北省发酵调味品工程技术研究中心,湖北宜昌443000;3.湖北顺溪生物食品股份有限公司,湖北十堰442300)
黑曲霉产胺氧化酶培养及诱导条件的优化
周小虎1,朱霞1,王磊1,焦梦然1,黄瑶1,付彩霞2,曹约泽3,高冰1,汪超1,李冬生1,徐宁1*
(1.湖北工业大学工业发酵湖北省协同创新中心湖北省食品发酵工程技术研究中心,湖北武汉430068;2.湖北土老憨调味食品股份有限公司湖北省发酵调味品工程技术研究中心,湖北宜昌443000;3.湖北顺溪生物食品股份有限公司,湖北十堰442300)
黑曲霉可经诱导产生胺氧化酶,该酶具有催化生物胺氧化脱氨生成相应醛、氨气和过氧化氢的特性。黑曲霉胺氧化酶产生分菌体生长和诱导产酶两个阶段。通过单因素试验优化得出黑曲霉产胺氧化酶的菌体生长最佳培养条件:氮源为NaNO3,碳源为麦芽糖,接种量1%,培养时间24 h;诱导产酶的最佳培养条件:诱导氮源为质量浓度60 g/L的正己胺,诱导碳源为葡萄糖,培养时间36 h,培养温度30℃,摇床转速160 r/min,初始pH 7.0,胺氧化酶酶活力从诱导前的1 006.5 U/g提升至1 422.4U/g,提高幅度为41.3%。
黑曲霉;胺氧化酶;生物胺;条件优化
生物胺是一类具有生物活性含氮的低分子质量有机化合物的总称,是生成激素、核酸、生物碱、蛋白质等物质的前体,具有维持免疫系统代谢活性和正常的内脏功能的作用[1]。人体内适量的生物胺能调节各种正常的生理作用,但当存在过量生物胺时,就会改变正常生理机能,从而产生毒性作用[2]。发酵食品中生物胺的主要来源是某些细菌产生的氨基酸脱羧酶催化氨基酸发生了脱羧反应而形成[3-4]。胺氧化酶广泛存在于动物、植物和微生物中,催化各种小分子胺类物质氧化脱氨基形成相应的醛、过氧化氢和氨[5-7]。微生物中黑曲霉产胺氧化酶研究最早,当其在以正丁胺作为唯一氮源的培养基中诱导可获得三种胺氧化酶,分别为MAO-N、AO-Ⅰ、AO-Ⅱ,前者为含黄素单胺氧化酶(EC 1.4.3.4),可催化一级胺、一些二级和三级胺氧化;后两种为含铜胺氧化酶(EC 1.4.3.6),具有氧化一级单胺活性和二元胺的特性[8-10]。
因此胺氧化酶可以催化分解生物胺,在发酵食品中使用可降低生物胺的含量,保证食品安全[11-12]。黑曲霉工业应用广泛,也是安全的食品发酵菌种[13],本研究以一株从黑曲霉3.350分离出的FF05菌株为出发菌,研究了其产生胺氧化酶的培养及诱导条件,为该酶的应用提供了理论支持。
1 材料与方法
1.1材料与试剂
黑曲霉(Aspergillus niger)FF05:湖北省食品发酵工程技术研究中心保藏;辣根过氧化物酶(300 U/mg)、愈创木酚:上海阿拉丁生化科技股份有限公司;其他试剂均为国产分析纯。
种子培养基:豆汁1 000 mL,可溶性淀粉20 g,MgSO40.5 g,KH2PO41.0 g,(NH4)2SO40.5 g,pH7.0,121℃灭菌20 min。
发酵培养基:蔗糖30 g,(NH4)2SO42.0 g,K2HPO41.0 g,MgSO40.5g,FeSO40.01g,酵母抽提物1g,蒸馏水1000mL,pH 7.0,121℃灭菌20 min。
诱导培养基:蔗糖50g,正丁胺5g,K2HPO41.0g,MgSO40.5 g,FeSO40.01 g,蒸馏水1 000 mL,pH 7.0,121℃灭菌20 min。
1.2仪器与设备
LDZX-50FBS立式压力蒸汽灭菌锅:上海申安医疗器械厂;ZAD-1270生化培养箱:上海智城分析仪器制造公司;WFJ2000紫外可见分光光度计:上海尤尼柯仪器有限公司。
1.3方法
1.3.1黑曲霉培养
从黑曲霉斜面接种1~2环孢子到种子培养基(装液量50 mL/250 mL),30℃、180 r/min培养36 h。菌体生长培养条件:取体积分数1%种子液接种至发酵培养基,180 r/min培养36 h。诱导产酶培养条件:取体积分数1%发酵液接种至诱导培养基,30℃、180 r/min培养24 h。
1.3.2产胺氧化酶条件的优化
(1)菌体生长条件的优化
以发酵培养基为基础,分别采用2.0g的尿素、(NH4)2SO4、NH4NO3和NaNO3代替发酵培养基中的氮源,其他成分不变,考察氮源对产胺氧化酶酶活力的影响;
以发酵培养基为基础,分别采用30 g的葡萄糖、果糖、蔗糖、麦芽糖、淀粉和甘露醇代替发酵培养基中的碳源,其他成分不变,考察碳源对产胺氧化酶酶活力的影响;
以菌体生长培养条件为基础,改变培养时间分别为12 h、24 h、36 h、48 h、60 h和72 h,其他条件不变,考察培养时间对产胺氧化酶酶活力的影响;
以菌体生长培养条件为基础,在发酵培养基中分别接种0.1%、0.2%、0.5%、1.0%、1.5%和2.0%的种子液,其他条件不变,考察接种量对产胺氧化酶酶活力的影响。
(2)诱导产酶条件的优化
以诱导培养基为基础,分别采用5 g/L的丙胺、正丁胺、正戊胺、正己胺和苄胺替代诱导培养基中的氮源,其他成分不变,考察诱导氮源对产胺氧化酶酶活力的影响。
以诱导培养基为基础,分别调整正己胺质量浓度为0.5 g/L、1 g/L、2 g/L、4 g/L、6 g/L、8 g/L和10 g/L,其他成分不变,考察正己胺质量浓度对产胺氧化酶酶活力的影响。
以诱导培养基为基础,分别采用50g/L的葡萄糖、果糖、蔗糖、麦芽糖、淀粉和甘露醇替代诱导培养基中的碳源,其他成分不变,考察诱导碳源对产胺氧化酶酶活力的影响。
以诱导培养基为基础,分别调整诱导培养时间为12 h、 24 h、36 h、48 h、60 h;诱导培养温度为20℃、23℃、25℃、28℃、30℃、33℃、35℃;摇床转速为100 r/min、120 r/min、140 r/min、160 r/min、180 r/min、200 r/min;初始pH值为5.5、6.0、6.5、7.0、7.5、8.0、8.5;考察不同诱导条件对产胺氧化酶酶活力的影响。
1.3.3胺氧化酶粗酶提取
将1 g菌丝放入10 mL离心管中,加入5 mL的硫酸钾缓冲液,放在装满冰块的烧杯中,进行冷冻超声破碎。设定超声功率为60%,超声间隔为2 s,选择超声时间为5 min。将超声破碎获得的粗酶液,10 000 r/min离心10 min,去沉淀,取上清液,测量酶活。加入pH 7.0的磷酸钾缓冲液,定容,保存于4℃环境中待用。
1.3.4胺氧化酶酶活力测定
胺氧化酶先作用于胺类生成相应的醛类、H2O2和氨,然后使用辣根过氧化物酶催化释放的H2O2产生氧气,使无色的愈创木酚氧化成红棕色的四邻甲氧基连酚。该产物在波长470 nm处有最大的光吸收,可通过测定ΔA470nm间接表示胺氧化酶的活力[14-15]。3 mL反应体系包括0.1 mol/L pH 7.0的磷酸盐缓冲液,0.2 mmol/L正丁胺,0.2 mg/mL辣根过氧化物酶,0.05 mol/L愈创木酚,100 μL稀释酶液。25℃条件下检测波长470 nm处的吸光度值变化(ΔA470nm/min)。以每分钟内A470nm变化0.01为1个酶活性单位(U)。相对酶活力以每组实验中所产酶活力最高为100%。
2 结果与分析
2.1黑曲霉产酶培养条件优化
2.1.1氮源对胺氧化酶酶活力的影响
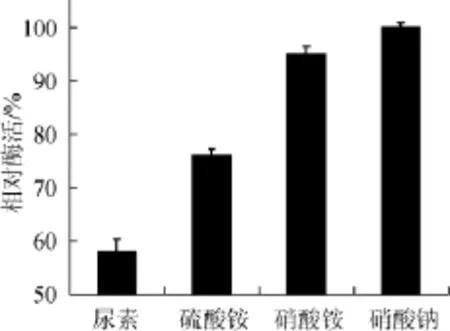
图1 氮源对胺氧化酶酶活力的影响Fig.1 Effect of nitrogen sources on amine oxidase production
由图1可知,NaNO3作为发酵培养基氮源时酶活最高,尿素作为发酵培养基氮源时酶活最低,可能是由于有机氮源尿素相对于无机氮源利用率较低。因此选择NaNO3为发酵培养基最适氮源。
2.1.2碳源对产胺氧化酶酶活力的影响
由图2可知,不同碳源对胺氧化酶酶活的影响依次为麦芽糖>果糖>葡萄糖>淀粉>蔗糖>甘露醇。因此选择麦芽糖为发酵培养基最适碳源。

图2 碳源对胺氧化酶酶活力的影响Fig.2 Effect of different carbon sources on amine oxidase production
2.1.3培养时间对胺氧化酶酶活力的影响

图3 培养时间对胺氧化酶酶活力的影响Fig.3 Effect of culture time on amine oxidase production
由图3可知,随着发酵时间的增长,诱导后胺氧化酶的酶活呈现先增高再降低的趋势,培养24h时,酶活达到最高。因此选择24 h为最适菌体培养时间。
2.1.4接种量对胺氧化酶酶活力的影响
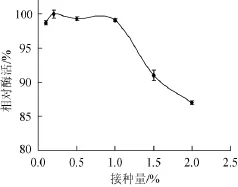
图4 接种量对胺氧化酶酶活力的影响Fig.4 Effect of inoculum on amine oxidase production
由图4可知,接种量为0.1%~1.0%时,胺氧化酶酶活较高,接种量>1.0%后,酶活明显下降。可能是因为接种量过多,空间、营养不够,导致菌丝球直径小,菌种不够成熟,影响了后面的诱导实验。因此选择1.0%为最适接种量。在此优化的培养条件下,胺氧化酶酶活为1 006.5 U/g。
2.2诱导培养条件的优化
2.2.1诱导氮源对胺氧化酶酶活力的影响
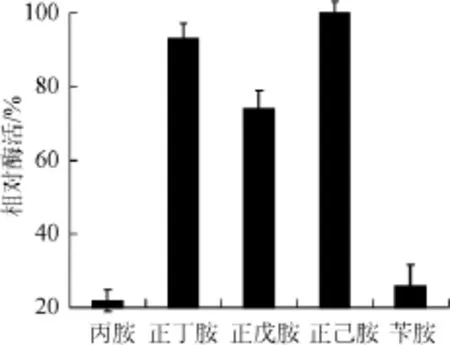
图5 诱导氮源对胺氧化酶酶活力的影响Fig.5 Effect of induction nitrogen sources on amine oxidase production
由图5可知,不同诱导氮源对胺氧化酶的诱导结果差异性很大,丙胺、苄胺诱导能力很低,相对酶活力<30%。正己胺的诱导能力最好,正丁胺和正戊胺次之。因此选取正己胺为诱导培养基的氮源。
2.2.2正己胺质量浓度对胺氧化酶酶活力的影响
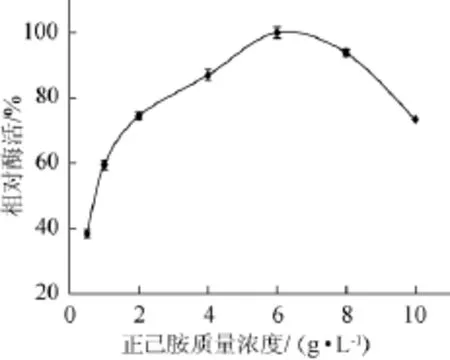
图6 正己胺质量浓度对胺氧化酶酶活力的影响Fig.6 Effect of different n-hexylamine concentrations on amine oxidase production
由图6可知,随着正己胺含量的逐渐升高,酶产量也逐渐升高,当正己胺质量浓度达到6 g/L时,酶活力达到最高。当正己胺质量浓度>6 g/L后,酶活力逐渐开始缓慢降低,说明高浓度的诱导剂不利于酶的诱导。因此,后续试验中选用正己胺质量浓度为6 g/L。
2.2.3诱导碳源对胺氧化酶酶活力的影响

图7 诱导碳源对胺氧化酶酶活力的影响Fig.7 Effect of different induction carbon sources on amine oxidase production
由图7可知,6种碳源都有较好的诱导产酶效果,也说明菌丝以完成生长阶段,碳源对产酶影响不显著,其中葡萄糖对黑曲霉产胺氧化酶的效果最好,因此选择葡萄糖为最佳诱导碳源。
2.2.4诱导培养时间对胺氧化酶酶活力的影响

图8 诱导培养时间对胺氧化酶酶产量的影响Fig.8 Effect of induction culture time on amine oxidase production
由图8可知,诱导培养时间为12~36 h时,随着时间的延长酶活增加;36h时酶活达到最高;36~60 h时,随着时间的延长,酶活逐渐降低。可能是由于一元胺诱导培养基并不适宜黑曲霉的生长,在诱导前期,黑曲霉菌种还能继续生长,并为了适应一元胺类培养基,逐渐的分泌胺氧化酶来维持其生长,因此酶产量一直在增高。到了36 h后,黑曲霉由于无法完全利用一元胺生长,导致黑曲霉生长能力大幅度下降,甚至开始出现自溶现象,胺氧化酶也渐渐失活,酶活降低。因此选择诱导培养时间36 h为宜。
2.2.5诱导培养温度对胺氧化酶酶活力的影响
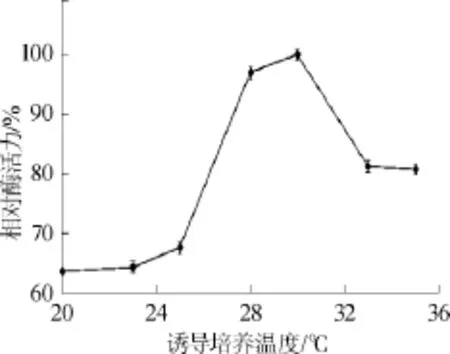
图9 诱导培养温度对胺氧化酶酶活力的影响Fig.9 Effect of induction culture temperature on amine oxidase production
由图9可知,随着诱导培养温度的升高,酶活呈现先增加后降低的趋势,培养温度为30℃时,酶产量最高。可能是因为胺氧化酶的诱导分泌跟黑曲霉的生长情况有密切的关系,在30℃时,黑曲霉的生长代谢最旺盛,分泌的胺氧化酶酶活力也最高。因此选择诱导培养温度30℃为宜。
2.2.6摇床转速对胺氧化酶酶活力的影响
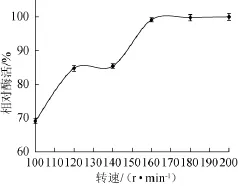
图10 摇床转速对胺氧化酶酶活力的影响Fig.10 Effect of shaking speed on amine oxidase production
由图10可知,随着摇床转速的增加,酶活逐渐升高,摇床转速>160 r/min后,酶活趋于稳定。说明培养达到一定转速后,满足了黑曲霉生长所需的氧气量。因此选择摇床转速160 r/min为宜。
2.2.7诱导初始pH对胺氧化酶酶活力的影响
由图11可知,初始pH对产酶量的影响较显著,pH≥7.5或pH≤6.0的时候都不利于胺氧化酶的产生,在初始pH值为7.0的时候是最利于胺氧化酶的产生的,因此选择初始pH值为7.0的培养基。通过诱导产酶条件的优化,胺氧化酶酶活达到1 422.4 U/g。

图11 诱导pH对胺氧化酶酶活力的影响Fig.11 Effect of induction pH on amine oxidase production
3 结论
通过单因素实验优化得出黑曲霉产胺氧化酶的最佳菌体生长培养条件:氮源为NaNO3,碳源为麦芽糖,接种量1.0%,培养时间24 h;诱导产酶培养的最佳条件:诱导氮源为6g/L正己胺,诱导碳源为50 g/L葡萄糖,诱导时间36 h,温度30℃,摇床转速160 r/min,pH 7.0。胺氧化酶酶活力从诱导前的1 006.5 U/g提升至1 422.4 U/g,提高幅度为41.3%。
[1]俞剑燊,张凤杰,王德良,等.酿酒工艺对黄酒中生物胺的影响[J].中国酿造,2015,34(4):123-127.
[2]彭金龙,胡健,张凤杰.黄酒中生物胺的检测方法改进[J].中国酿造,2015,34(3):141-144.
[3]涂婷,龙文胜,蒋立文,等.腐乳中生物胺的存在、污染途径及控制研究进展[J].中国酿造,2013,32(12):1-4.
[4]CHONG C Y,BAKAR F A,RUSSLY A R,et al.The effects of food processing on biogenic amines formation[J].Int Food Res J,2011,18(3):867-876.
[5]ZHANG Y M,LIVINGSTONE J R,HIRASAWA E.Purification and characterisationofmonoamineoxidasefromAvenasativa[J].Acta Physiol Plant,2012,34(4):1411-1419.
[6]HERRAIZ T,CHAPARRO C.Human monoamine oxidase is inhibited by tobacco smoke:β-carboline alkaloids act as potent and reversible inhibitors[J].Biochem Bioph Res Co,2005,326(2):378-386.
[7]SUGAWARA A,MATSUI D,YAMADA M,et al.Characterization of two amine oxidases fromAspergillus carbonariusAIU 205[J].J Biosci Bioeng,2015,116(6):629-635.
[8]YAMADA H,ADACHI O,OGATA K.Amine oxidase of microorganismsⅡPurification and crystallization of amine oxidase ofAspergillus niger[J].Agr Biol Chem,1965,29:649-654.
[9]SCHILLING B,LERCH K.Amine oxidases fromAspergillus niger:I-dentificationofanovelflavin-dependent enzyme[J].BBA-Gen Subjects, 1995,1243(3):529-537.
[10]FREBORT I,TAMAKI H,ISHIDA H.Two distinct quinoprotein amine oxidases are induced by n-butylamine in the mycelia ofAspergillus nigerAKU 3302 purification,characterization,cDNA cloning and sequencing[J].EurJ Biochem,1996,237(1):255-265.
[11]NAILA A,FLINT S,FLETCHER G,et al.Control of biogenic amines in food-existing and emerging approaches[J]. J Food Sci,2010,15(7):139-150.
[12]TAPINGKAE W,TANASUPAWAT S,PARKIN K L,et al.Degradation of histamine by extremely halophilic archaea isolated from high salt-fermented fishery products[J].Enzyme Microb Tech,2010,46(2):92-99.
[13]李保英,姜佳丽,蒋予箭.酱油生产中应用米曲霉和黑曲霉混合制曲的探索[J].中国酿造,2011,30(12):70-74.
[14]MATSUMURA K,HISADA H,OBATA H,et al.A novel amine oxidase-encoding gene fromAspergillus oryzae[J].J Biosci Bioeng,2004,98(5):359-365.
[15]徐芝勇,严群,强毅,等.大豆过氧化物酶纯化及酶学特性研究[J].中国粮油学报,2006,21(2):82-85.
ZHOU Xiaohu1,ZHU Xia1,WANG Lei1,JIAO Mengran1,HUANG Yao1,FU Caixia2,CAO Yueze3,GAO Bing1,WANG Chao1,LI Dongsheng1,XU Ning1*
(1.Hubei Cooperative Innovation Center for Industrial Fermentation,Research Center of Food Fermentation Engineering and Technology of Hubei,Hubei University of Technology,Wuhan 430068,China;2.Research Center of Fermentation flavouring Engineering and Technology of Hubei,Hubei Tulaohan Flavouring and Food Co.,Ltd.,Yichang 443000,China;3.Hubei Shunxi Biological Food Co.,Ltd.,Shiyan 442300,China)
Amine oxidase can be produce by inducedAspergillus niger,and has the characteristic of catalyzing biogenic amines to their corresponding aldehydes,H2O2and NH3.There are two stages duringA.nigeramine oxidase production,including cell growth and enzyme induction.Single factor experiments were adopted to optimize the liquid fermentation medium and induction conditions for amine oxidase production byA.niger.The optimum fermentation conditions were nitrogen source NaNO3,carbon source maltose,inoculum 1%,culture time 24 h.The optimum induction conditions were induction nitrogen source 60 g/L normal hexyl amine,carbon source glucose,culture time 36 h,temperature 30℃,rotate speed 160 r/min,and initial pH 7.0.The amine oxidase activity increased from 1 006.5 U/g to 1 422.4 U/g after induction,which increased 41.3%.
Aspergillus niger;amine oxidase;biogenic amine;optimizing condition
TS264.2
0254-5071(2016)06-0096-05
10.11882/j.issn.0254-5071.2016.06.020

2016-03-21
国家级大学生创新创业训练计划项目(20130500009);湖北省教育厅项目(Q20141409)
周小虎(1993-),男,本科生,研究方向为食品科学与工程。
徐宁(1979-),男,讲师,博士,研究方向为生物工程。
