发酵法生产柠檬酸的研究进展
2016-10-13王宝石陈坚孙福新庞海强李由然张梁丁重阳顾正华石贵阳
王宝石,陈坚,2,孙福新,庞海强,李由然,张梁,丁重阳,顾正华,石贵阳*
1(江南大学,粮食发酵工艺与技术国家工程实验室,江苏 无锡, 214122)2(江南大学,工业生物技术教育部重点实验室,江苏 无锡, 214122)3(江苏国信协联能源有限公司,江苏 宜兴,214200) 4(山东省费县检验检测中心,山东 费县,273400)
发酵法生产柠檬酸的研究进展
王宝石1,陈坚1,2,孙福新3,庞海强4,李由然1,张梁1,丁重阳1,顾正华1,石贵阳1*
1(江南大学,粮食发酵工艺与技术国家工程实验室,江苏 无锡, 214122)2(江南大学,工业生物技术教育部重点实验室,江苏 无锡, 214122)3(江苏国信协联能源有限公司,江苏 宜兴,214200) 4(山东省费县检验检测中心,山东 费县,273400)
柠檬酸是一种具有多功能的重要有机酸,是当前世界上产量和消费量最大的食用有机酸,伴随着在新兴产业领域的广泛应用,其需求量以每年5%的速度增长。发酵法生产柠檬酸起步较早,但工艺鲜有创新;文中首先介绍了柠檬酸生产工艺国内外研究现状,并以产业化的视角,纵观柠檬酸生产全过程分析限制柠檬酸快速增长的瓶颈,着重提出了实现柠檬酸高效生产与清洁生产相统一的主要策略,为实现柠檬酸高效绿色制造奠定基础。
柠檬酸;同步糖化发酵;多糖分子量分布;连续发酵;废水资源化利用
柠檬酸(citric acid)又名枸橼酸,是一种三羧酸类化合物,易溶于水,无毒,无臭,具有很强的酸味,是一种重要的、多功能的有机酸[1-3],广泛应用于食品、医药,化工等领域。柠檬酸全球产量超过170万t,随着生物聚合、药物运输、细胞培养等新兴产业领域的广泛应用,每年以5%的速度增长,是世界第二大发酵产品,产量仅次于酒精产量[4],柠檬酸发酵生产一直是学者关注的热点。随着需求量的逐年增加,提高柠檬酸发酵效率成为新的研究课题。本篇以工业化生产的视角,从发酵菌株,原料处理,发酵方式及废水处理等方面分析限制柠檬酸增长的因素,并重点阐述实现柠檬酸高效生产的主要策略。
1 生产菌种
多种类型的微生物可以用于生产柠檬酸,如曲霉类——Aspergillusniger,A.awamori,Penicilliumjanthinelum; 酵母类-Yarrowialipolytica,Candidatropicalis,Candidaoleophila;及细菌类——Bacilluslicheniformis,Arthrobacterparaffinens,Corynebacteriumsp.[5-6]。CARLOS[7]报道细菌类如Arthro-bacterparaffinens,Bacilluslicheniformis和Corynebac-teriumssp.能够生产柠檬酸。酵母类可以利用不同类型碳源生产柠檬酸,其中解脂亚罗酵母已经被广泛用于生产柠檬酸,RYMOWICZ利用解脂假丝酵母发酵烷烃类底物,获得大量柠檬酸[8]。然而,柠檬酸是能量代谢产物,仅在代谢不平衡条件下才能大量积累,虽然文献报道多种类型微生物可以生产柠檬酸,可用于工业化生产仅曲霉类与酵母类。酵母类发酵会产生大量的副产物异柠檬酸,降低柠檬酸产量。因此,筛选低顺乌头酸酶活性的突变株或许有助于提高柠檬酸产量。
黑曲霉易操作,底物广泛,产量高,副产物少,是柠檬酸工业化生产的最佳选择[9]。CURRIE[10]最初研究发现黑曲霉在初始pH为2.5~3.5,含有高浓度糖与矿物盐的培养基上能够大量繁殖并积累柠檬酸,此发现为黑曲霉工业化生产柠檬酸奠定了基础。研究专家对黑曲霉发酵底物优化拓展以及传统诱变技术应用于菌株筛选,进一步提升了柠檬酸产量。KUTYA-OLESIUK[11]采用黑曲霉发酵蔗糖生产柠檬酸;孟佼[12]采用黑曲霉以玉米秸秆为原料发酵生产柠檬酸,发酵216 h,柠檬酸产量为98.27 g/L;ADEOYE[13]采用黑曲霉发酵木薯皮生产柠檬酸。WEI HU[14]组合碳离子束(12C6+)与X射线对黑曲霉诱变处理,显著提高了柠檬酸产量,产量达到187.5 g/L,产率为3.13 g/(L·h);王德培[15]采用氮离子注射与微波辐射复合诱变,柠檬酸产量提高60%;IKRAM -UL-HAQ[16]通过UV与NTG诱变处理,发酵赤糖糊168 h,柠檬酸产量达到86.1 g/L。现代诱变技术的应用,也取得了良好的效果。JONGH[17]将来源于根霉的延胡索酸酶基因(FumRs)与酵母菌的富马酸还原酶(Frds1)在黑曲霉中过量表达,可以有效改善黑曲霉在锰离子培养基中耐受力,提高柠檬酸产量,产率为0.025 g/g菌体;HJORT[18]构建了不产草酸的黑曲霉菌株,减少发酵过程中副产物产生,提高柠檬酸产量。传统诱变与现代诱变技术的应用一定程度上提高了柠檬酸产量,降低了副产物形成;未来黑曲霉高产菌种的筛选可以组合传统诱变技术与代谢工程技术进一步提高柠檬酸生产效率。
与单细胞发酵(细菌类与酵母类)相比,黑曲霉因其独特的形态学特征,在搅拌条件下更易受到复杂环境影响产生非均相体系,影响发酵过程传质、溶氧。其中最有趣的是其复杂的菌丝体形态,从致密的菌丝球到各种形态的菌丝,黑曲霉菌丝体形态会直接影响其发酵产酸[19]。PAPAGIANNI[20-21]采用数字图像技术分析黑曲霉菌丝体形态学特征,通过人工神经网络模型将菌丝体形态分为球形、椭圆形、团块状和游离菌丝;研究发现改变孢子接种量可以有效调节菌丝聚集形态。随后,PAPAGIANNI[19,22]在发酵初期剧烈搅拌会导致菌丝高度分支化,产生大量菌丝碎片,菌丝平均长度降低,菌丝球直径减小;而发酵后期菌丝逐渐衰老,菌丝高度空泡化,菌丝增生较少。究竟菌丝球还是游离菌丝更适宜生产柠檬酸,PAUL等[23]研究发现分散菌丝比生长速率、比产酸速率与比耗糖速率等指标明显高于大菌丝球,同时UJCOVA[24], SEICHERT[25]研究表明菌丝体形态为游离丝状产酸更高;而GOMEZ与KISSER等[26-27]研究表明,菌丝体形态为菌丝球的产酸更高。虽然何种菌丝体形态更适合柠檬酸发酵一直存在争议,但存在一定共识—产酸较高的黑曲霉菌丝一般具有短、膨大,分支菌丝尖端多的特征。因此,控制发酵过程菌丝体特定形态有助于提高柠檬酸产量。
现代工业化生产的黑曲霉种子仍然沿用传统二级培养方式,即首先一级培养得到黑曲霉孢子,经二级培养获得成熟的菌丝球,然后用于接种发酵。工业化生产中,一批成熟的孢子需要经过平板筛选,斜面培养,茄子瓶培养,最后麸曲桶培养等逐级扩大培养,流程长,制备繁琐,制备周期需要30 d以上,如图1所示;二级种子培养周期较长,仅孢子萌发需要12 h以上。因此,菌丝替代孢子接种方式,缩短孢子萌发时间,是改善传统种子培养方式的重要方向。
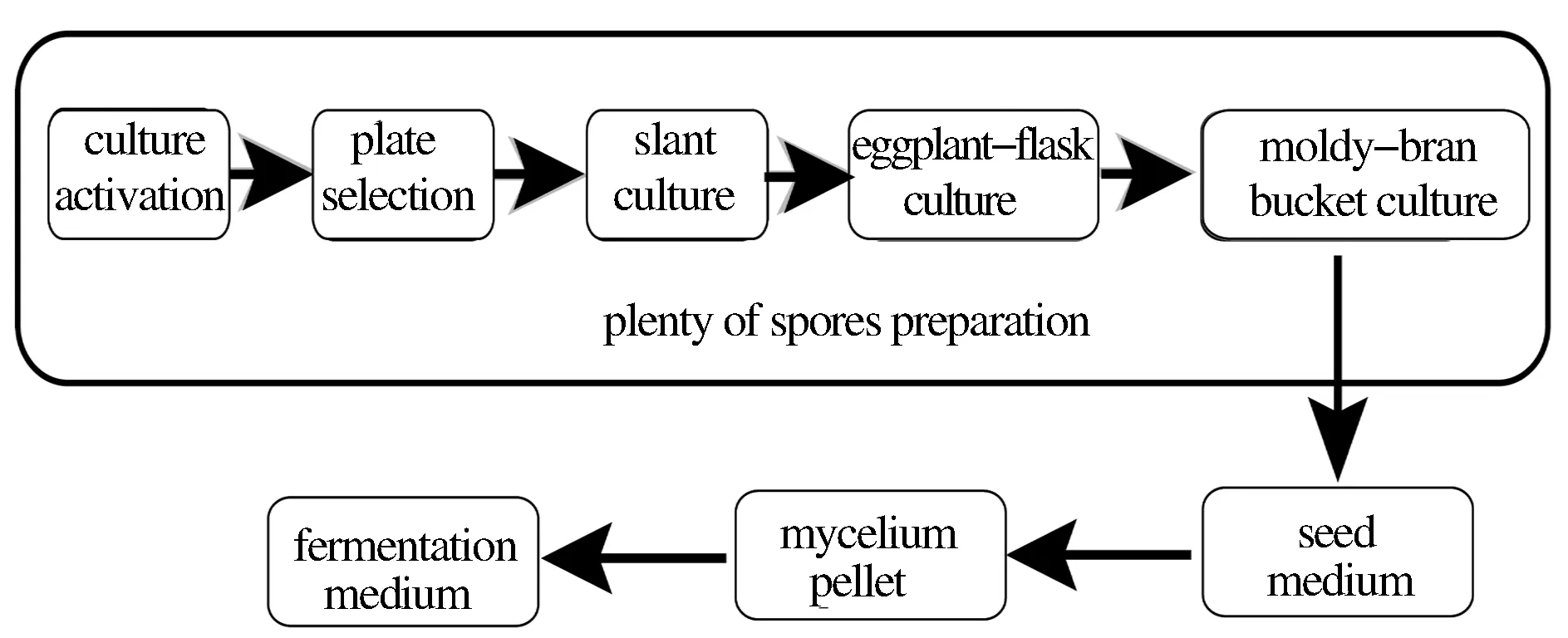
图1 传统培养模式规模孢子制备工艺Fig.1 Large-scale spores preparation in conventional process
高质量的生物产品及发酵稳定性与其细胞活力密切相关,目前黑曲霉细胞缺乏有效的活力评价方法。SIGLER[28],GABRIEL[29]建立了基于酸化力法快速评价酵母活力,PRASHANT[30]基于亚甲基蓝褪色速度反应酵母细胞活力,对于评价黑曲霉细胞活力具有良好的借鉴意义。种子培养过程中种子活力波动会造成发酵过程不稳定,因而建立一种快速有效的黑曲霉细胞活力评价方法对于指导种子培养与移种均具有重要意义。
2 原料处理
黑曲霉是发酵生产柠檬酸的主要菌种,是因为它能够利用廉价原料,产量仍能达到理论值70%以上[31]。产柠檬酸培养基主要成分为淀粉质或含葡萄糖、蔗糖的原料,随着全球柠檬酸需求量增加,低成本原料逐渐成为柠檬酸生产竞逐的对象,一些工农业加工废料及副产物应用于柠檬酸生产,同时缓解了环境压力。YASSER[32]利用过期的糖浆生产柠檬酸,经1.5%磷酸钙除去金属离子,产量比未处理对照组提高38.87%。 DHILLON[33]以苹果渣超滤后的污泥为底物发酵144 h,柠檬酸产量达到44.9 g/L。BARRINGTON[34]发酵泥煤苔生产柠檬酸,发酵120 h,产量为354.8 g/( kg底物)。KHOSRAVI-DARANI[35]采用尿素处理甘蔗渣生产柠檬酸,柠檬酸产量、产率分别为82.38 g/kg(干基),26.45 g/(kg·d)。各种低廉、废弃原料的应用拓宽了柠檬酸原料范围,同时对缓解环境压力,降低原料成本等方面做出了巨大贡献。但由于各种废弃原料的成分复杂,增加了生产后期柠檬酸提取难度,纵观柠檬酸整个生产过程,生产成本不减反增,生产效率降低。因此,淀粉质原料仍然是柠檬酸工业化生产的主要原料。
黑曲霉对碳源的代谢是影响柠檬酸发酵水平最重要的因素,MADDOX, VANDENBERGHE, HOSSAIN[36]研究表明,淀粉质原料需首先被水解为单糖才能用于柠檬酸的高效合成。柠檬酸工业化生产中采用淀粉质粗原料,经液化后利用黑曲霉自身的糖化能力进行同步糖化发酵。基于同步发酵的工艺特点,在发酵过程中任何时间葡萄糖生成速度与消耗速度的不匹配均会降低发酵效率。葡萄糖的消耗速度可通过控制溶氧和发酵温度等参数精确调控;而葡萄糖的生成速度则以液化效果为主因,常常成为发酵产酸的瓶颈所在。以上都体现出液化糖化阶段对整个柠檬酸发酵过程的重要性。黑曲霉自身液化型淀粉酶系作用效率有限,降解淀粉的速率无法满足柠檬酸合成过程中的代谢需求。因此,淀粉质原料在发酵前需经α-淀粉酶水解液化,将大分子切割成短链,形成糊精和少量寡糖,降低淀粉黏度,为糖化酶的作用创造条件。同时黑曲霉自身分泌的糖化酶是一种外切型淀粉酶,它针对不同结构的底物作用效率不同,黑曲霉糖化酶作用于长链的活性更大;HIROMI[37]研究发现黑曲霉糖化酶对低聚糖的Km值(米氏常数)随着聚合度( degree of polymerization,DP≤7)的增加而降低,对麦芽糖Km值为0.18~1.4 mmol/L,而对麦芽低聚糖的Km值为 0.02~0.14 mmol/L;DOUGLAS[38]研究发现,不同聚合度的底物与黑曲霉糖化酶活性中心竞争性结合能力不同; MEAGHER[39]也发现黑曲霉糖化酶的水解速率k2以及与底物的亲和力不同。传统淀粉质粗料发酵模式的液化工艺缺乏精细化调控,液化组分中多糖分子量分布不均,导致后期发酵过程不稳定,是长期制约柠檬酸发酵行业提升的关键技术难题。因此,精细化调控淀粉液化过程,改善液化组分中多糖分子量分布规律,有利于提高黑曲霉糖化速率,进而改善发酵效率。
3 发酵方式
柠檬酸发酵方式包括浅盘发酵法(surface fermentation)、固态发酵法(solid fermentation)、液态深层发酵法(submerged fermentation)3种形式。浅盘发酵又称表面发酵,是柠檬酸发酵最初的发酵形式;固态发酵方式能够利用工农业加工废料,降低生产成本,同时减少环境污染[2, 35, 40-41],是一种非常具有潜力的发酵模式,但因废料成分复杂,对发酵后期产物提取影响较大,有待于进一步研究;液态深层发酵方式具有产率高,自动化程度高,不易污染,发酵周期短等优势,是柠檬酸工业化生产的主要方式,约有80%的柠檬酸产量是通过液态深层分批发酵方式得到的[7, 42]。
传统分批发酵模式严重制约了柠檬酸的快速增长,对于工业化生产,连续发酵方式更具有优势,消耗少的劳动力获得较高的发酵效率,学者始终未停止对柠檬酸连续发酵工艺的探索。然而柠檬酸合成是部分生长偶联型[43],且黑曲霉菌丝体结构复杂,实现黑曲霉连续发酵生产柠檬酸比较困难[44]。
酵母菌作为单细胞生物,操作简便,易于实现连续发酵,解脂假丝酵母连续发酵生产柠檬酸取得了一定进展。MOELLER等人[45]使用解脂假丝酵母反复分批发酵,连续发酵3 d,柠檬酸产量为100 g/L,柠檬酸产量提高了32%;随后MOELLER等人[46]采用解脂假丝酵母H222重复补料发酵10批次,发酵时间553h,产率由1.4 g/(L·h)降至1.1g/(L·h)。RYWISKA等人[8]采用解脂假丝酵母反复分批发酵甘油16批次,仍保持较高活性,柠檬酸产量为0.78 g/g,产率1.05 g/(L·h)。ARZUMANOV等人[44]采用解脂假丝酵母反复分批发酵乙醇生产柠檬酸,发酵700 h,柠檬酸产量为105 g/L。解脂假丝酵母虽然在连续生产柠檬酸取得一定进展,但酵母类发酵方式存在缺陷,使其工业化生产受阻。其最大的缺点是副产物异柠檬酸产量较高(5%~10%),提取过程困难;酶系单一,原料转化率低;同时解脂假丝酵母作为产油脂酵母菌的菌种来源,细胞中还易累积较多油脂,这些副产物的产生降低了柠檬酸产量[47]。
黑曲霉由于酶系丰富,发酵效率高、副产物少等优势,仍然是实现柠檬酸连续发酵的主要选择。通过引入菌丝球分割技术,组合发酵过程控制策略改善黑曲霉菌丝体形态,实现黑曲霉连续培养,提高柠檬酸生产效率。
4 柠檬酸废水处理
柠檬酸生产主要采用液体深层发酵,发酵液经固液分离钙盐法或色谱提取、蒸发、结晶等工艺获得柠檬酸成品。提取过程中会产生大量废水,其中含有一些有机酸、糖、蛋白质胶体、矿物质等物质[48],COD高达350 kg/t柠檬酸,浓度高达10 00015 000 mg/L。柠檬酸废水处理主要采用生物处理法、Fenton试剂法、光合细菌法、乳化液膜法等[49],其中生物处理法的应用最为广泛,单独采用厌氧生物法或者好氧生物法处理高浓度柠檬酸废水,往往不能达到国家排放标准,需结合其他处理技术进行深度处理。
方亚叶[50]将酒精发酵过程中废水经陶瓷膜过滤回流至生产系统中,发酵13次未产生明显抑制作用, 对柠檬酸废水回流具有良好的借鉴意义。国内外学者对柠檬酸废水进行深度处理进而资源化利用,取得了较好的效果。WIECZOREK等[51]将发酵液经过液液萃取系统,连续运行55 d,发酵结果正常,但部分萃取剂会溶解到水相中,需要活性炭进一步吸附处理。HUSEYIN[52]利用 Fenton 氧化法处理废水,作为 SBR 生物处理的预处理,组合工艺的COD去除率达98%。此处理方法过程比较复杂,成本高,单一处理方法不能达到污水排放标准,不符合资源化利用技术的要求。XU[53-55]构建了柠檬酸-沼气双发酵藕联生态体系,产生的柠檬酸废水经厌氧发酵产生沼气,厌氧出水经过进一步预处理用于柠檬酸发酵体系,柠檬酸废水循环利用10批次,柠檬酸发酵过程比较稳定。
现有的柠檬酸废水回用方法一般需要前期预处理,流程较长,可操作性与稳定性较差,有些可能造成二次污染。基于菌种适应性进化技术,提高菌种废水耐受性,减少废水复杂前处理过程,降低生产成本,是实现柠檬酸废水资源化利用的重要手段。
5 展望
高产量、高产率、高生产强度统一为目标的发酵过程技术,一直是发酵工程领域关注的焦点问题。针对柠檬酸传统生产工艺存在问题,建立上游发酵技术、下游提取技术和后期污水处理各环节有效的沟通机制,提高生产效率,实现清洁生产,可从以下几个方面开展。集成传统诱变技术与现代代谢工程技术筛选黑曲霉高产菌株,基于细胞活力快速评价方法,指导建立黑曲霉种子连续培养方式;精细化调控淀粉质原料液化过程,改善液化组分多糖分子量分布,同步糖化发酵,提高发酵效率;通过引入菌丝球分割技术,组合发酵过程控制策略改善黑曲霉连续发酵过程中的菌丝体形态,实现黑曲霉连续发酵;基于菌种适应性进化技术,提高菌种废水耐受性,实现柠檬酸废水资源化利用。
[1]BETIKU E,ADESINA O A. Statistical approach to the optimization of citric acid production using filamentous fungusAspergillusnigergrown on sweet potato starch hydrolyzate[J]. Biomass and Bioenergy,2013,55:350-354.
[2]DHILLON G S, BRAR S K, VERMA M, et al. Utilization of different agro-industrial wastes for sustainable bioproduction of citric acid byAspergillusniger[J].Biochemical Engineering Journal, 2011,54(2):83-92.
[3]DHILLON G S, BRAR S K, KAUR S, et al. Bioproduction and extraction optimization of citric acid fromAspergillusnigerby rotating drum type solid-state bioreactor[J]. Industrial Crops and Products,2013,41:78-84.
[4]VENDRUSCOLO F, ALBUQUERQUE P M, STREIT F, et al. Apple Pomace: A versatile substrate for biotechnological application[J]. Critical Reviews in Biotechnology,2008,28(1):1-12.
[5]GREWAL H S, KALRA K L. Fungal production of ciric aicd [J].Biotechnology Advances,1995,13(2):209-234.
[6]FRISVAD ESND-CJC,DIJCK PWMV. On the safety ofAspergillusniger-a review[J]. Applied Microbiology and Biotechnology,2002,59(5):426-435.
[7]CARLOS R. SOCCOL L P S V, CRISTINE RODRIGUES,PANDEY A A. New perspectives for citric acid production and application[J]. Food Technology Biotechnology, 2006,44(2):141-149.
[9]SINGH DHILLON G, KAUR BRAR S, VERMA M, et al. Recent advances in citric acid bio-production and recovery[J]. Food and Bioprocess Technology, 2010,4(4):505-529.
[10]JAMES N. CURRIE. The citric acid fermentation ofAspergillusniger[J].Journal of Biolichal Chemistry, 1917, 5:1-37.
[12]孟佼.玉米秸秆原料的黑曲霉发酵生产柠檬酸[D].上海:华东理工大学,2014:14-59.
[13]ADEOYE A O A L, Gueguim-Kana E B. Optimization of citric acid production using a mutant strain ofAspergillusnigeron cassava peel substrate[J]. Biocatalysis and Agricultural Biotechnology, 2015,1:1-7.
[14]HU W, LIU J, CHEN J H,et al. A mutation ofAspergillusnigerfor hyper-production of citric acid from corn meal hydrolysate in a bioreactor[J]. Journal of Zhejiang University Science B, 2014,15(11):1 006-1 010.
[15]王德培, 周婷, 张灵燕,等. 氮离子注入和微波复合诱变选育高产柠檬酸的黑曲霉研究[J].中国酿造,2012,31(5):123-127.
[16]KHURSHID S, ALI S, ASHRAF H,et al. Mutation ofAspergillusnigerfor hyperproduction of citric acid from black strap molasses[J]. World Journal of Microbiology and Biotechnology,2001,17(1):35-37.
[17]W. A.DE JONGH JN. Enhanced citrate production through gene insertion inAspergillusniger[J]. Metabolic Engineering,2008,10(2):87-96.
[18]PEDERSEN H, CHRISTENSEN B, HJORT C, et al. Construction and characterization of an oxalic acid nonproducing strain ofAspergillusniger[J]. Metabolic Engineering,2000,2(1):34-41.
[19]PAPAGIANNI M, MATTEY M, KRISTIANSEN B. Hyphal vacuolation and fragmentation in batch and fed-batch culture ofAspergillusnigerand its relation to citric acid production[J]. Process Biochemistry,1999,35(3):359-366.
[20]PAPAGIANNI M, MATTEY M. Morphological development ofAspergillusnigerin submerged citric acid fermentation as a function of the spore inoculum level. Application of neural network and cluster analysis for characterization of mycelial morphology[J].Microbial Cell Factories, 2006,5(3): 1-12.
[21]PAPAGIANNI M. Quantification of the fractal nature of mycelial aggregation inAspergillusnigersubmerged cultures[J]. Microbial Cell Factories,2006,5(1):1-13.
[22]PAPAGIANNI M, MATTEY M, KRISTIANSEN B. The influence of glucose concentration on citric acid production and morphology ofAspergillusnigerin batch and culture[J]. Enzyme and Microbial Technology, 1999,25(8):710-717.
[23]PAUL G C, PRIEDE M A, THOMAS C R. Relationship between morphology and citric acid production in submergedAspergillusnigerfermentations[J]. Biochemical Engineering Journal,1999,3(2):121-129.
[25]SEICHERT L, UJCOVA E, MUSLKOVAM. Effect of aerationand agitation on the biosynthetic activity of diffusely growingAspergillusniger[J]. Folia Microbiology, 1982,27(5):333-334.
[27]MONIKA K, KUBICEK C P, ROHR M. Influence of manganese on morphology and cell wall composition ofAspergillusnigerduring citric acid fermentation[J]. Archives of microbiology,1980,128(1):26-33.
[28]SIGLER K, MIKYSKA A, KOSAR K,et al. Factors affecting the outcome of the acidification power test of yeast qualitycritical reappraisal[J].Folia Microbiologica,2006,51(6):525-534.
[29]GABRIEL P,DIENSTBIER M, SLANKY P,et al. A new method of optical detection of yeast acidification power[J]. Folia Microbiol,2008,53(6): 527-533.
[30]PRASHANT B, SUBIR K N, PRAMOD W, et al.Quantification of metabolically active biomass using Methylene Blue dye Reduction Test (MBRT) measurement of CFU in about 200 s[J].Journal of Microbiological Methods, 2006, 65(1): 107-116.
[31]PAPAGIANNI M. Advances in citric acid fermentation byAspergillusniger: Biochemical aspects, membrane transport and modeling[J]. Biotechnology Advances, 2007,25(3):244-263.
[32]MOSTAFA Y S, ALAMRI S A. Optimization of date syrup for enhancement of the production of citric acid using immobilized cells ofAspergillusniger[J].Saudi Journal of Biological Sciences, 2012,19(2):241-246.
[33]DHILLON G S, BRAR S K, VERMA M, et al. Apple pomace ultrafiltration sludge - A novel substrate for fungal bioproduction of citric acid: Optimisation studies[J].Food Chemistry, 2011,128(4):864-871.
[34]BARRINGTON S, KIM J-W. Response surface optimization of medium components for citric acid production byAspergillusnigerNRRL 567 grown in peat moss[J]. Bioresource Technology, 2008,99(2):368-377.
[35]KHOSRAVI-DARANI K, ZOGHI A. Comparison of pretreatment strategies of sugarcane baggase: Experimental design for citric acid production[J].Bioresource Technology, 2008,99(15):6 986-6 993.
[36]HOSSAIN M.BROOKS J D,MADDOX I S.The effect of the sugar source on citric acid production[J].Applied Microbiology Biotechnology,1984, 19(6):393-397.
[37]KEITARO H,MASATAKE O,AKIYOSHI T. Subsite structure and ligand binding mechanism of glucoamylase[J].Mol Cell Biochem,1983,51(1):71-95.
[38]DOUGLAS D L,GENE K L,PETER J R,et al. Effect of pore diffusion limitation of dextrin hydrolysis by immobilized glucoamylase[J]. Biotechnology Bioengineering, 1980,22:1-17.
[39]MICHAEL M M,ZIVKO L N,PETER J R. Subsite mapping ofAspergillusnigerglucoamylases I and II with malto- and isomaltooligosaccharides[J]. Biotechnology Bioengineering,1989,34(5):681-688.
[40]BARI M N, ALAM M Z, MUYIBI S A,et al. Improvement of production of citric acid from oil palm empty fruit bunches:Optimization of media by statistical experimental designs[J]. Bioresource Technology,2009,100(12):3 113-3 120.
[41]BIELECKI S, TRAMPER J,POLAK J. Induction of citric acid overproduction inAspergillusnigeron beet molasses[J]. Food Biotechnology, 2000, 1:247-250.
[42]THOMPSON J C, HE B B. Characterization of crude glycerol from biodiesel production from multiple feedstocks[J].Applied Engineeringin in Agriculture,2006,22(2):261-265.
[43]ELMER L G J. Fermentation process kinetics[J]. Journal of Biochemical and Microbiological Technology and Engineering,1959, 1:413-429.
[44]ARZUMANOV T, SHISHKANOVA N, FINOGENOVA T. Biosynthesis of citric acid byYarrowialipolyticarepeat-batch culture on ethanol[J]. Applied Microbiology and Biotechnology,2000,53(5):525-529.
[45]MOELLER L, GRÜNBERG M, ZEHNSDORF A, et al. Biosensor online control of citric acid production from glucose byYarrowialipolyticausing semicontinuous fermentation[J]. Engineering in Life Sciences,2010,10(4):311-320.
[46]MOELLER L, GRÜNBERG M, ZEHNSDORF A,et al. Repeated fed-batch fermentation using biosensor online control for citric acid production byYarrowialipolytica[J]. Journal of Biotechnology,2011,153(34):133-137.
[47]ZHAO C H, CUI W, LIU X Y, et al. Expression of inulinase gene in the oleaginous yeastYarrowialipolyticaand single cell oil production from inulin-containing materials[J].Metabolic Engineering,2010,12(6):510-517.
[48]ZHI Xiaohua, YANG Haijun, SASCHA B,et al.Potential improvement to a citric wastewater treatment plant using biohydrogen and a hybrid energy system[J].Journal of Power Sources, 2010, 195(15):6 945-6 953.
[49]I P. Case study-wastewater reuse in Limassol as an alternative water source[J]. Desalination, 2001,136:55-59.
[50]方亚叶,石贵阳,章克昌. 浓醪酒糟膜分离滤液全回流工艺的研究[J].酿酒, 2004, 31(2):44-45.
[51]WIECZOREK S, BRAUER H. Continuous production of citric acid with recirculation of the fermentation broth after product recovery[J]. Bioprocess Engineering, 1997,18(1):1-5.
[52]HUSEYIN T, OKAN B, SELALE S, et al.Use of Fenton oxidation to improve the biodegrability of a pharmaceutical wastewater[J]. Jounrnal of Hazardous Materials,2006,136(2):258-265.
[53]XU Jian,SU Xian-feng,BAO Jia-wei, et al. Cleaner production of citric acid by recycling its extraction wastewater treated with anaerobic digestion and electrodialysis in an integrated citric acid-methane production process[J]. Bioresource Technology,2015,189:186-194.
[54]XU Jian,CHEN Yang-qiu,ZHANG HONG-jan, et al. Establishment and assessment of an integrated citric acid-methane production process[J]. Bioresource Technology, 2015,176:121-128.
[55]ZHANG HONG-jian,ZHANG Jian-hua,XU Jian, et al. A novel recycling process using the treated citric acid wastewater as ingredients water for citric acid production[J]. Biochemical Engineering Journal,2014,90:206-213.
Advances in production of citric acid through microbial fermentation
WANG Bao-shi1, CHEN Jian1,2, SUN Fu-xin3, PANG Hai-qiang4, LI You-ran1,ZHANG Liang1, DING Zhong-yang1, GU Zheng-hua1, SHI Gui-yang1*
1(National Engineering Laboratory for Cereal Fermentation Technology, Jiangnan University, Wuxi 214122, China)2(Key Laboratory of Industrial Biotechnology, Ministry of Education,Jiangnan University,Wuxi 214122,China)3(Jiangsu Guoxin Union Energy Co., Ltd., Yixing 214203, China)4(Shandong Feixian Inspection and Detection Center, Feixian 273400, China)
Citric acid is one of the most important multifunctional organic acids produced by fermentation. At present, it is the world’s second largest fermentation products ranking behind ethanol. The volume of citric acid production is increasing at a high annual rate of 5% with numerous new applications coming to light. Though production of citric acid through microbial fermentation has a long history, there is little innovation in the production process. We firstly reviewed the advances in citric acid production and then analyzed the factors limiting the fast increase of citric acid in perspective of the entire production-process. Main strategies for efficient production of citric acid coupled with cleaner production were elaborated, which laid foundation for the realization of efficient green manufacturing of citric acid.
citric acid; simultaneous scarification and fermentation; polysaccharide molecular weight distribution; continuous fermentation; utilization of wastewater resource
10.13995/j.cnki.11-1802/ts.201609042
博士研究生(石贵阳教授为通讯作者,E-mail:gyshi@jiangnan.edu.cn)。
国家高技术研究发展计划(863计划,No: 2015AA020302);江苏省产学研前瞻性联合研究项目 (No. BY2015019-13)
2016-02-28,改回日期:2016-04-11
