植物乳杆菌的DPO引物实时荧光PCR检测方法
2016-10-13孙凯魏霜刘玉莉许如苏刘中勇鄞杰平袁俊杰吴希阳
孙凯,魏霜,刘玉莉,许如苏,刘中勇,鄞杰平,袁俊杰,吴希阳*
1(暨南大学 理工学院, 食品科学与工程系,广东 广州,510632)2(汕头出入境检验检疫局,广东 汕头,515041)3(湛江出入境检验检疫局,广东 湛江,524000)
植物乳杆菌的DPO引物实时荧光PCR检测方法
孙凯1,魏霜2,刘玉莉2,许如苏2,刘中勇2,鄞杰平2,袁俊杰3,吴希阳1*
1(暨南大学 理工学院, 食品科学与工程系,广东 广州,510632)2(汕头出入境检验检疫局,广东 汕头,515041)3(湛江出入境检验检疫局,广东 湛江,524000)
根据已报道的植物乳杆菌(Lactobacillusplantarum)的23S rRNA基因保守序列,设计用于检测植物乳杆菌的特异性DPO(dual priming oligonucleotide)引物,结合SYBR GreenⅠ实时荧光PCR技术,建立植物乳杆菌的DPO引物实时荧光PCR检测方法,对其特异性和灵敏度进行了评价,并将建立的检测方法用于实际样品的检测中。结果显示,该方法对2株植物乳杆菌能得到阳性扩增,其余11株乳酸菌及阴性对照没有扩增曲线,灵敏度高达0.001 ng/μL,而且在退火温度为50~60 ℃范围内不影响其特异性,表明该方法对退火温度不敏感;用微生物菌制剂和酸奶共13种益生菌产品进行了验证,检出情况与产品标识一致。因此,该研究建立的SYBR GreenⅠ实时荧光PCR能够快速、准确、高效地检测微生物菌制剂及其他益生菌产品中的植物乳杆菌。
植物乳杆菌;实时荧光PCR;DPO引物;检测
植物乳杆菌(Lactobacillusplantarum)是一种广泛使用的益生菌,具有维持肠道微生态平衡,提高机体免疫力等功效,目前已经被应用于食品、医用益生菌制剂、微生物肥料等领域[1]。对这些产品中微生物的准确鉴定是产品质量控制的重要依据,因此建立一种快速、准确的鉴定方法具有重要意义。
目前乳杆菌属的检测主要依靠传统生理生化和分子生物学方法进行。前者耗时耗力,而且由于乳杆菌属许多种非常相似,生理生化特征也存在许多相似之处,实际检测过程中难以判断,不能满足实际检测的需要[2]。基于特异性引物的PCR的方法具备快速、准确、低成本的优点,目前被广泛用于转基因、食源性微生物、医学病原菌等方面的检测[3-5]。目前PCR法已经被应用于植物乳杆菌的检测,KWON等[6]建立用于检测植物乳杆菌的普通PCR特异性引物;杨小红等[7]建立了普通PCR法检测植物乳杆菌,并用40株标准菌株验证了方法的特异性,并将该特异性引物成功转化成为农业部标准NY/T 2066—2011[8]。以往报道的特异性引物检测植物乳杆菌全部使用的是普通引物,需要严格控制反应条件尤其是退火温度,退火温度的变化可能会影响到引物的特异性,例如农业部标准NY/T 2066—2011中所使用的植物乳杆菌特异性引物以较高的退火温度(67℃)来保证引物的特异性。而不同实验室之间由于仪器、人员等差异,可能会无法精确重复出试验的各项条件,导致检测特异性受到影响,可能造成误判,而且普通PCR法需要进一步凝胶电泳判断结果,增加了检测时间。
DPO(dual priming oligonucleotide)引物是由CHUN等[9]于2007年第1次提出,其特点在于它包含2个各自独立的特异性引物区域,5′端序列由18~25个碱基组成并与靶基因序列配对,3′端序列由6~12个碱基组成用来引导PCR反应的特异性延伸,这两段独立的特异性区域利用寡聚次黄嘌呤(Inosine,I)进行连接,由于次黄嘌呤比一般碱基的退火温度低,在退火时寡聚次黄嘌呤形成类似泡状的结构,从而使5′和3′区域形两个独立功能的双特异性引物结构,而且由于其特殊的结构,引物自身以及引物之间很难形成二级结构且对退火温度不敏感,在一定范围内改变退火温度对检测特异性不产生影响,如图1所示。而且理论上5′和3′任何一个区域超过3个碱基不匹配就不能扩增,运用DPO引物这一特点,已建立了基于DPO引物的SNP的检测方法[9]。目前,DPO引物已经被广泛应用于医学病原菌、食源性微生物等[10-11]。本研究拟运用DPO引物高特异性、不受退火温度影响等特征,结合SYBR Green Ⅰ实时荧光PCR技术,建立一种特异性强、灵敏度高的植物乳杆菌检测方法。
1 材料与方法
1.1材料
供试材料:植物乳杆菌(ATCC 14917,ATCC 8014)、鼠李糖乳杆菌(ATCC 53103,ATCC 9595)、格氏乳杆菌(ATCC 33323)、约氏乳杆菌(ATCC 33200)、嗜酸乳杆菌(ATCC 314)、德氏乳杆菌(ATCC 4797)、发酵乳杆菌(ATCC 9338)、沙克乳杆菌(ATCC 15521)、詹氏乳杆菌(ATCC 25258)、副干酪乳杆菌(ATCC 25598)、干酪乳杆菌(ATCC 393)共13株乳杆菌,由暨南大学理工学院食品科学与工程系提供[12-13]。
试剂:细菌基因组DNA提取试剂盒购自天根生化科技(北京)有限公司;SYBR Premix Ex TaqTM购自宝生物工程(大连)有限公司;MRS琼脂培养基、MRS液体培养基购自广东环凯微生物科技有限公司。
仪器:LightCycle Roche 480荧光定量PCR仪,瑞士罗氏公司;VERITI 2.0 PCR扩增仪,美国AB公司; HE99电泳仪,美国GE公司;G:BOX EF凝胶成像系统,美国基因公司;ND-1000生物分光光度计,美国Therme公司。
1.2基因组DNA的提取
菌株在MRS液体培养基增菌培养24 h后,取1 mL菌液用于DNA的提取,采用细菌基因组DNA提取试剂盒提取DNA,参照说明书的要求操作,并用生物分光光度计测定DNA的浓度和纯度,-20 ℃保存备用。
1.3引物的设计
参考DPO引物设计的要求[9],用植物乳杆菌的23S rRNA基因序列(GenBank ID: AB092638.1)在NCBI上进行BLAST,根据比对结果在其保守区域设计DPO引物,上游引物LP-DPO-F:5′- GGGGCAACCCAGCAGTTTTAIIIIICTGTTACCAC -3′,下游引物LP-DPO-R:5′- TAATGAGATGTTTCAGTTCACAGCGIIIIICTCCAACTAG -3′,产物大小为91 bp。引物由生工生物工程(上海)股份有限公司合成。
1.4实时荧光PCR反应体系及程序
实时荧光PCR反应体系为20 μL:10 μL SYBR Premix ExTaq、引物终浓度为0.2 μmol/L、DNA模板50 ng、ddH2O补足至20 μL。反应程序:95 ℃ 预变性30 s;95 ℃变性5 s、60 ℃退火30 s、72 ℃延伸30 s,35个循环,在每个循环的72 ℃阶段结束后收集荧光信号,在反应结束后进行熔融曲线的分析。
1.5实时荧光PCR特异性试验
按1.4实时荧光PCR反应体系及程序,对包括1.1所示的13株乳杆菌标准菌株进行SYBR GreenⅠ实时荧光PCR检测。同时采用农业部标准NY/T 2066-2011[8]中植物乳杆菌的特异性引物PlantF/PlantR及反应条件对以上标准菌株进行特异性验证。用无菌纯水代替等量模板作为阴性对照。农业部标准引物序列为PlantF:5′- GTTGACTCGGTGGCGGCCTT -3′;PlantR:5′- GGAGCGCTTGTGACATCAGCCG -3′,产物大小为100 bp。
1.6实时荧光PCR灵敏度试验
利用植物乳杆菌ATCC 14917的DNA为模板,进行10倍梯度稀释,得到浓度分别为10、1、0.1、0.01、0.001和0.0001 ng/μL共稀释6个梯度,每个梯度取1 μL做模板,进行实时荧光PCR灵敏度试验。
1.7不同退火温度下特异性试验
以1.1中13株乳杆菌标准菌株的基因组DNA为模板,运用本研究建立的方法,分别在50、55和60 ℃进行实时荧光PCR扩增,探讨在不同退火温度下DPO引物的特异性。
1.8实际样品的检测
从市场采购13种益生菌制品,其中3种微生物菌制剂、10种酸奶,其产品标识菌种组成见表2。运用本研究建立的方法进行实际样品的检测,同时采用农业部标准方法进行对比。
2 结果与分析
2.1基于DPO引物的实时荧光PCR的建立
用13株乳杆菌DNA作为模板用于建立基于DPO引物的植物乳杆菌的SYBR GreenⅠ实时荧光PCR检测方法,结果如图2所示。仅2株植物乳杆菌扩增生成“S”形的扩增曲线,结果为阳性,且熔解曲线测试为单一波峰,产物Tm值均一,为75 ℃,无非特异性产物出现;另外11株乳杆菌扩增无扩增曲线,结果为阴性。证明本研究设计的DPO引物特异性较好,建立的基于DPO引物的实时荧光PCR方法能够准确对植物乳杆菌进行检测。
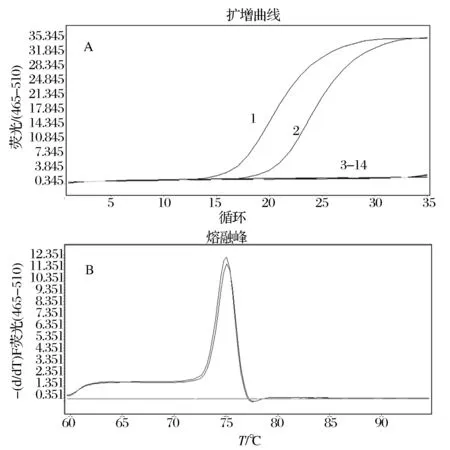
A:基于DPO引物的实时荧光PCR特异性实验结果;B: 基于DPO引物的实时荧光PCR熔解曲线1-13:植物乳杆菌(ATCC 14917)、植物乳杆菌(ATCC 8014)、鼠李糖乳杆菌(ATCC 53103)、鼠李糖乳杆菌(ATCC 9595)、格式乳杆菌(ATCC 33323)、约氏乳杆菌(ATCC 33200)、嗜酸乳杆菌(ATCC 314)、德氏乳杆菌(ATCC 4797)、发酵乳杆菌(ATCC 9338)、沙克乳杆菌(ATCC 15521)、詹氏乳杆菌(ATCC 25258)、副干酪乳杆菌(ATCC 25598)、干酪乳杆菌(ATCC 393);14:阴性对照图2 基于DPO引物的实时荧光PCR方法的建立Fig.2 Establishment of Real-time PCR on DPO primers method
2.2灵敏度评价
利用建立的基于DPO引物的SYBR GreenⅠ实时荧光定量PCR方法对含量分别为10、1、0.1、0.01、0.001和0.000 1 ng/μL的植物乳杆菌的DNA进行实时荧光PCR灵敏度检测,结果如图3,模板DNA起始浓度越高,Ct值越小,当DNA浓度稀释到0.001 ng/μL时,取1 μL DNA做模板仍可以检测到荧光信号的增加,Ct值为31,表现为阳性扩增;当DNA浓度稀释到0.000 1 ng/μL时无扩增,检测不到荧光信号的增加,故该方法对植物乳杆菌的DNA检测灵敏度为0.001 ng/μL。10~0.001 ng/μL系列DNA模板的扩增产物的熔解曲线均呈现单一且相同的峰值,产物Tm值均一,为75 ℃,无非特异性产物出现。

A:基于DPO引物的实时荧光PCR灵敏度实验结果;B: 基于DPO引物的实时荧光PCR熔解曲线1-6: DNA模板浓度依次为10、1、0.1、0.01、0.001、0.000 1 ng/μL图3 基于DPO引物的实时荧光PCR的灵敏度检测Fig.3 Sensitivity test of real-time PCR on DPO primers
2.3不同退火温度下特异性对比
本研究还探讨了退火温度在50、55和60 ℃该检测体系的特异性,结果如表1所示。
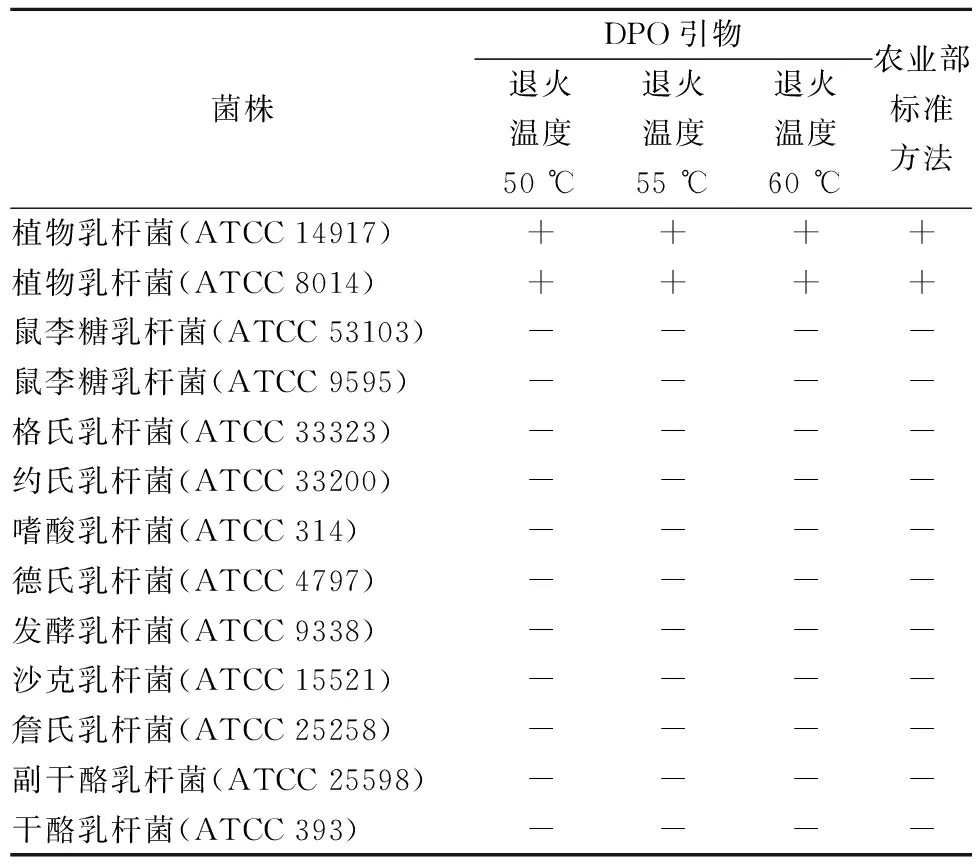
表1 DPO引物特异性
注:“+”表示阳性扩增;“-”表示阴性扩增。
在较低退火温度(50 ℃)和较高的退火温度下(60 ℃)下,利用本研究建立的方法仅植物乳杆菌(ATCC 14917、ATCC 8014)结果为阳性;其他11株乳杆菌均为阴性,检测结果与农业部标准方法一致。说明本研究基于DPO引物建立的实时荧光PCR检测方法对退火温度不敏感,有利于在不同实验室之间得到准确的检测结果,适合该方法的推广。
2.4实际样品的检测
在3种微生物菌制剂产品中,1种微生物菌制剂产品检测结果为阳性,另外2种检测结果为阴性;在10中酸奶产品中,1种检测结果为阳性,其余9种检测结果为阴性。13株样品的检测结果与产品标识一致,结果如表2所示,且本研究的检测方法无需凝胶电泳,与常规PCR相比大大节省了时间,农业部标准方法与本研究建立的方法检测结果一致,证明本方法特异性强,检测结果准确,实用性强,可运用于实际样品的检测。

表2 实际样品的检测
注:“+”表示阳性扩增;“-”表示阴性扩增。
3 讨论与结论
植物乳杆菌作为益生菌被广泛应用于食品、医药、农业等领域,因此建立这些产品中植物乳杆菌的检测方法具有重要意义。在细菌进化过程中,核糖体RNA(rRNA)基因的进化相对保守,因此被认为是对细菌进行亲缘关系分析的最理想的基因,该基因序列几乎可以对所有细菌进行属水平的鉴定[14]。然而,由于16S rRNA基因的高度保守性,对相似性极高的近源种无法做出进一步区分,很难设计出种特异性引物[15]。23S rRNA基因与16S rRNA基因相比,23S rRNA的序列可变性更为明显,可变区内多态性位点较多,不同细菌间差异相对较大,目前已经被广泛应用于微生物鉴定中[16-17]。本研究针对植物乳杆菌的23S rRNA基因设计特异性DPO引物,建立了实时荧光PCR法,成功实现了种水平的鉴定。
特异性引物设计中,即要保证引物的特异性,又要保证引物的各个参数符合PCR反应的要求,因此在设计过程中存在一定的难度[18]。DPO引物作为一种新型的引物类型,其引物包含两个各自独立的特异性引物区域,5′端序列由18-25个碱基(Tm>65℃)组成并与靶基因序列配对,3′端序列包含6~12个碱基(GC含量40~80%)用来引导PCR反应的特异性延伸,这两段独立的特异性区域利用寡聚次黄嘌呤(Inosine, I)进行连接,在退火过程中寡聚次黄嘌呤会形成“泡状”结构。MA等[10]的研究发现DPO引物中间的次黄嘌呤为3~8个时的效果较好,5个时效果最好。根据以上信息确定DPO引物的设计过程为:在基因序列保守区域确定3′端位置,向5′端延伸6-12个碱基保证3′端序列的GC含量在40~80%,紧接着再向5′端延伸5个次黄嘌呤形成寡聚次黄嘌呤结构,最后再向5′端延伸18-25个碱基保证5′端序列Tm大于65℃即可。这大大减少了特异性引物设计的难度,即能保证引物的特异性,又能保证引物能正常工作。
在实时荧光PCR中使用TaqMan探针能检测PCR中的特异性扩增产物,而不受非特异性扩增产物的影响,因此被广泛应用于微生物的定性及定量检测[19]。但一条有效的探针需要具备很高的保守性、合适的GC含量和长度以及合适的Tm值等,而且不同乳杆菌之间的差异较小,这使特异性探针设计的难度大大增加。另外,探针合成的价格比较昂贵,因而在一定程度上限制了探针的使用。因此,本研究将SYBR GreenⅠ实时荧光PCR和DPO引物检测技术相结合,吸收了DPO引物高特异性且引物之间难以形成二聚体等优点,成功建立了植物乳杆菌的实时荧光PCR检测方法。
DPO的另外一个优势在于它对退火温度不敏感。本研究探讨了在较低退火温度(50 ℃)和较高的退火温度下(60 ℃)下DPO引物的特异性,结果显示与农业部标准方法一致,这大大增强了本方法在不同实验室之间的通用性,徐义刚等[20-21]的研究也表明DPO引物不受退火温度的影响,在较宽的退火温度范围内依然保持较高的特异性。另外,将DPO引物和SYBR Green I的实时荧光PCR结合起来,检测结果易于判断,无需凝胶电泳,这也增强了本方法的实用性。
本研究建立的检测方法灵敏度高达0.001 ng/μL,这与武鑫[22]、谢志勤[23]、苗立中[24]等建立的SYBR GreenⅠ实时荧光PCR方法的灵敏度一致,这体现了该方法的高灵敏度。将该方法运用于13份实际样品的检测中,在2份标识中含有植物乳杆菌的样品中准确检出植物乳杆菌,其它样品结果均为阴性,检测结果与农业部标准方法一致,这体现了该方法的准确性。
本研究采用DPO引物和SYBR GreenⅠ实时荧光PCR技术相结合的方法,建立用于检测植物乳杆菌的DPO引物实时荧光PCR方法。该方法特异性强,只有2株植物乳杆菌扩增结果为阳性,熔解曲线波峰单一,其余11株非植物乳杆菌扩增结果均为阴性;能检测出0.001 ng/μL的DNA模板,灵敏度高;无需凝胶电泳,相比传统PCR方法提高了检测速度;对退火温度不敏感,提高了不同实验室之间的适用性;对13份样品的检测结果与农业部标准方法检测结果一致,并与产品标识相符合。这表明本研究建立的DPO引物结合SYBR GreenⅠ实时荧光PCR技术的植物乳杆菌检测方法具有速度快、灵敏度高、特异性强等优点,适用于酸奶、微生物菌制剂等产品的检测中。
[1]肖仔君, 钟瑞敏, 陈惠音, 等. 植物乳杆菌的生理功能与应用[J]. 中国食品添加剂, 2005(2): 87-89.
[2]东秀珠, 蔡妙英, 等. 常见细菌系统鉴定手册[M]. 北京: 科学出版社, 2001: 289-294.
[3]WEI S, ZHAO H, XIAN Y, et al. Multiplex PCR assays for the detection ofVibrioalginolyticus,Vibrioparahaemolyticus,Vibriovulnificus, andVibriocholeraewith an internal amplification control[J]. Diagnostic Microbiology and Infectious Disease, 2014, 79(2): 115-118.
[4]魏霜, 陈贞, 芦春斌, 等. 多重PCR检测转基因水稻的转基因成分[J]. 食品科学, 2012, 33(12): 159-162.
[5]CORMAN V M, EICKMANN M, LANTD O, et al. Specific detection by real-time reverse-transcription PCR assays of a novel avian influenza A (H7N9) strain associated with human spillover infections in China[J]. Euro Surveill, 2013, 18(16): 20 461.
[6]KWON H S, YANG E H, YEON S W, et al. Rapid identification of probioticLactobacillusspecies by multiplex PCR using species-specific primers based on the region extending from 16S rRNA through 23S rRNA[J]. FEMS Microbiology Letters, 2004, 239(2): 267-275.
[7]杨小红, 曹凤明, 关大伟, 等. 应用特异PCR快速鉴定微生物肥料中4种乳酸菌[J]. 微生物学通报, 2014, 41(4): 674-680.
[8]NY/T 2066-2011,微生物肥料生产菌株的鉴别 聚合酶链式反应(PCR)法[S].
[9]CHUN J Y, KIM K J, HWANG I T, et al. Dual priming oligonucleotide system for the multiplex detection of respiratory viruses and SNP genotyping of CYP2C19 gene[J]. Nucleic Acids Research, 2007, 35(6): e40.
[10]MA X, XU H, SHI L, et al. A multiplex PCR assay for the detection of five influenza viruses using a dual priming oligonucleotide system[J]. BMC Infectious Diseases, 2015, 15(1): 93.
[11]THIERRY S, DERZELLE S. Multiplexed genotyping of Bacillus anthracis by Luminex xMAP suspension array[M].Veterinary Infection Biology: Molecular Diagnostics and High-Throughput Strategies. Springer New York, 2015: 401-412.
[12]张思璐, 刘云霄, 张浩琪, 等. 属特异性T-RFLP技术用于乳酸杆菌的群落分析[J]. 微生物学通报, 2012(8): 1 179-1 189.
[13]倪奕弘. 耐受重金属铜的乳酸菌的筛选及其铜结合性能的研究[D]. 广州:暨南大学, 2014.
[14]杨霞, 陈陆, 王川庆. 16S rRNA基因序列分析技术在细菌分类中应用的研究进展[J]. 西北农林科技大学学报(自然科学版), 2008(2): 55-60.
[15]WANG L T, Lee F L, TAI C J, et al. Comparison of gyrB gene sequences, 16S rRNA gene sequences and DNA-DNA hybridization in theBacillussubtilisgroup[J]. International Journal of Systematic and Evolutionary Microbiology, 2007, 57(8): 1 846-1 850.
[16]STRAUB J A, HERTEL C, HAMMES W P. A 23S rDNA-targeted polymerase chain reaction-based system for detection ofStaphylococcusaureusin meat starter cultures and dairy products[J]. Journal of Food Protection, 1999, 62(10): 1 150-1 156.
[17]林东昉, 徐晓刚, 朱德妹, 等. 23S rRNA 基因在常见病原菌鉴定中的应用[J]. 中华检验医学杂志, 2005, 28(1): 79-81.
[18]申志勇. PCR引物特异性评估体系及多重PCR引物设计系统的构建与应用[D].中国人民解放军军事医学科学院,2009.
[19]陈旭, 齐凤坤, 康立功, 等. 实时荧光定量PCR技术研究进展及其应用[J]. 东北农业大学学报, 2010 (8): 148-155.
[20]徐义刚, 李丹丹, 刘忠梅, 等. 基于DPO引物的空肠弯曲菌PCR检测方法的建立与初步应用[J]. 中国预防兽医学报, 2014(4): 293-296.
[21]徐义刚, 李丹丹, 刘忠梅, 等. 基于DPO引物特异性检测小肠结肠炎耶尔森氏菌的PCR方法[J]. 中国人兽共患病学报, 2014(5): 507-510.
[22]武鑫, 张宇霞, 史晗, 等. 致病性沙门氏菌SYBR Green I 实时荧光定量PCR检测方法的建立[J]. 中国兽医科学, 2015, 45(3): 270-274.
[23]谢志勤, 谢芝勋, 刘加波, 等. 牛分歧杆菌SYBR Green I 实时荧光定量PCR检测方法的建立[J]. 南方农业学报, 2012, 43(10): 1 584-1 589.
[24]苗立中, 王艳, 付强, 等. 副鸡禽杆菌SYBR Green I 实时荧光定量PCR检测方法的建立[J]. 中国兽医学报, 2015, 35(1): 57-62.
Real-time PCR for the detection ofLactobacillusplantarumbased on dual priming oligonucleotide system
SUN Kai1, WEI Shuang2, LIU Yu-li2, XU Ru-su2, LIU Zhong-yong2,YIN Jie-ping2,YUAN Jun-jie3, WU Xi-yang1*
1 (Department of Food Science and Engineering, Jinan University, Guangzhou 510632, China)2 (Shantou Entry-Exit Inspection and Quarantine Bureau, Shantou 515041, China)3 (Zhanjiang Entry-Exit Inspection and Quarantine Bureau, Zhanjiang 524000, China)
The species-specific DPO (dual priming oligonucleotide) primers were designed basing on the 23S rRNA gene sequences ofLactobacillusplantarum. A SYBR GreenⅠreal-time PCR assay based on DPO primers was developed for the detection ofL.plantarum. The specificity and sensitivity of the assay have been estimated. The results showed that this method was of high specificity at annealing temperature range from 50 to 60 ℃, and only twoL.plantarumstrains could be amplified. The other 10Lactobacillus. spp. strains gave negative results, and the sensitivity of this method reached 0.001 ng/μL. The specificity and sensitivity of the assay was evaluated using 13 probiotics products including microbiological preparation and yogurt, and the results were in consistent with the product identification. Therefore,L.plantarumcan be detected rapidly, accurately and efficiently by this method.
Lactobacillusplantarum; real-time PCR; DPO (dual priming oligonucleotide); detection
10.13995/j.cnki.11-1802/ts.201609031
硕士研究生(吴希阳教授为通讯作者,E-mail:tkentwu@jnu.edu.cn)。
国家质量监督检验检疫总局科技计划项目(2015IK078)
2016-03-14,改回日期:2016-05-16
