秀珍菇子实体多糖PFP-m的膜法分离及其性质研究
2016-10-13孙玉军周礼元
孙玉军,周礼元
1(安徽科技学院生命科学学院,安徽 凤阳,233100) 2(安徽大学生命科学学院, 安徽 合肥,230601)
秀珍菇子实体多糖PFP-m的膜法分离及其性质研究
孙玉军1*,周礼元2
1(安徽科技学院生命科学学院,安徽 凤阳,233100) 2(安徽大学生命科学学院, 安徽 合肥,230601)
以秀珍菇子实体为原料,经闪式提取、Sevag法脱蛋白、不同孔径的滤膜分离,得到秀珍菇子实体多糖(PFP-m)。采用光谱分析和比色等方法对其部分结构和性质进行测定。结果表明:PFP-m为均一组分,分子质量为3.27×104Da;具有多糖的特征吸收峰;PMP衍生化结合HPLC法得出其单糖组成及摩尔比为甘露糖∶鼠李糖∶葡萄糖∶木糖∶阿拉伯糖=3.10∶1.00∶22.99∶6.85∶4.59。PFP-m具有多糖的一般理化性质,总糖含量为93.16 %。与柱层析法相比,膜超滤法操作简单,效率高,适合秀珍菇子实体多糖PFP-m的分离纯化。
秀珍菇;子实体;多糖;膜分离
多糖是生物体内具有重要功能的生物大分子之一,在自然界分布广泛,主要存在于动物、植物、微生物等机体内,具有抗氧化、抗衰老、增强机体免疫[1]、抗肿瘤等功效[2]。
多糖的提取方法有热水浸提、超声提取、微波提取、超高压提取、超临界提取、酶法提取等,不同的提取方法各有其优缺点[3]。闪式提取是近年来发展起来的一种高效的提取方法,其原理是利用高速机械剪切力和超速动态分子的渗滤作用,在一定的温度(如室温)和溶剂条件下,将植物、食用菌子实体等材料破碎成细微颗粒,使待提成分迅速达到微粒组织的内外平衡,能最大限度的保留材料的有效成分,具有速度快、效率高、能耗低等优点,适合多糖等活性物质的有效提取[4]。
获得多糖纯品,除了去除蛋白、脱色素等除杂外,还需进一步分离纯化。近年来,膜过滤法开始用于多糖等生物活性物质的分离与纯化[5-8]。本文以秀珍菇子实体为材料,采用闪式提取、闪式蒸馏、乙醇沉淀、Sevag法脱蛋白得秀珍菇粗多糖(PFP),PFP经膜超滤技术获得均一多糖PFP-m,并通过红外光谱、紫外光谱、液相色谱等方法对其理化性质和部分结构进行测定。
1 材料与方法
1.1材料与试剂
秀珍菇(Pleurotusgeesteranus)子实体,由安徽科技学院食用菌研究所陆晓民教授提供。
标准葡聚糖T3,T10,T40,T70,T100, T200,T500,T2000,瑞典Pharmacia公司;DEAE-Sepharose F.F,瑞典Pharmacia公司;其他试剂皆为国产分析纯。
1.2主要仪器与设备
JHBE-50T闪式提取器,河南智晶生物科技股份有限公司;JMF-320G多级闪蒸器,河南智晶生物科技股份有限公司; AKTA Purifier10 FPLC,GE公司; Masterflex蠕动泵,Cole-Parmer公司;Vivaflow50 超滤膜, Sartorius Stedim Biotech公司;Eppendorf 5810R冷冻离心机,Eppendorf公司;Nicolet 380红外光谱仪,Thermo公司;Agilent 1200高效液相色谱仪、Agilent1260蒸发光散射检测器,Agilent 公司;UltrahydrogelTM1000色谱柱(7.8 mm×300 mm),Waters公司。
1.3实验方法
1.3.1秀珍菇粗多糖的闪式提取
秀珍菇子实体粉末200 g,加入7 000 mL蒸馏水,电子转速8 000 r/min,闪式提取器闪式提取2 min,提取液经多级闪蒸器浓缩至适当体积,加3倍体积的体积分数为95%乙醇沉淀12 h,4 500 r/min离心10 min,沉淀经蒸馏水复溶,离心,上清液冷冻干燥得秀珍菇子实体粗多糖。
1.3.2秀珍菇粗多糖的脱蛋白[9]及HPLC 法[10]检测
取一定质量的秀珍菇粗多糖,用蒸馏水溶解,加入多糖溶液1/4体积的Sevag试剂[V(三氯甲烷)∶V(正丁醇)=4∶1]脱蛋白数次,直至中间层无蛋白出现,再经冷冻干燥得多糖干粉(PFP)。取少许PFP溶于适量的二蒸水中,12 000 r/min离心10 min,上清液再经0.22 μm微孔滤膜过滤,进样量为10 μL,色谱条件:色谱柱为UltrahydrogelTM1000(7.8 mm×300 mm);流动相为二蒸水,流速为1 mL/min;柱温35 ℃,蒸发光散射检测器(ELSD)检测,根据HPLC图谱分析,判断PFP含有多糖的种类及相应的分子质量。
1.3.3PFP的超滤膜分离
取PFP溶于适当体积的二蒸水,12 000 r/min离心10 min,过0.22 μm 微孔滤膜,根据PFP的HPLC图谱(图1)可知,第三个峰面积最大,且其保留时间与Dextran T40(分子质量40 kDa)相近,因此首先选择截留分子质量50 kDa的超滤膜超滤,跨膜压力为103.42 kPa,收集滤液;滤液再选择截留分子质量5 kDa的超滤膜超滤,跨膜压力为103.42 kPa,收集截留液,截留液经冷冻干燥,命名为秀珍菇子实体多糖PFP-m。
1.3.4PFP-m的纯度鉴定及分子质量测定
1.3.4.1纯度鉴定
采用HPLC法[10]。
1.3.4.2分子质量测定
采用HPLC法[10]。系列标准葡聚糖和样品PFP-m用二蒸水溶解,12 000 r/min离心10 min,0.22 μm微孔滤膜过滤,进样量为20 μL。色谱条件:色谱柱UltrahydrogelTM1000;流动相为二蒸水,流速为1 mL/min;柱温35 ℃,蒸发光散射检测器(ELSD)检测。以保留时间为横坐标,相对应的各标准葡聚糖(Dextran)分子质量的对数值(lgMw)为纵坐标绘制标准曲线,得出分子质量标准曲线方程。
1.3.5PFP-m紫外光谱扫描
取适量的PFP-m用适量的二蒸水溶解,于190~400 nm波长范围内扫描。
1.3.6PFP-m红外光谱扫描
样品采用KBr压片,于400~4 000 cm-1扫描。
1.3.7PFP-m的单糖组分测定
采用PMP柱前衍生化法[11]。样品经三氟乙酸(TFA)水解,水解后的样品和鼠李糖(Rha)、葡萄糖(Glc)、甘露糖(Man)、半乳糖(Gal)、木糖(Xyl)、阿拉伯糖(Ara)等标准单糖与PMP发生衍生化反应,所得产物采用HPLC法检测分析。流动相为PBS(50 mmol/L)-乙腈混合物,柱温25 ℃,色谱柱为ZORBAX Eclipse XDB-C18柱(4.6 mm×250 mm),检测波长245 nm,进样量20 μL。
1.3.8PFP-m的一般理化性质及总糖含量测定
理化性质测定参考文献[12]进行;总糖含量测定以葡聚糖T40为标准品,采用苯酚-硫酸法[13]。
2 结果与分析
2.1秀珍菇粗多糖的提取结果
秀珍菇子实体经闪式提取、闪蒸、离心、醇沉、冷冻干燥获得17.16 g粗多糖,得率为8.58%,比杨润亚等[14]采用的超声提取秀珍菇子实体多糖的得率6.19 mg/g(即6.19%)高,且提取时间短,这主要是由于闪式提取伴有高速搅拌、超强振动、负压渗透等作用实现秀珍菇子实体组织的快速破碎,浸提时间短、提取效率高的缘故。
2.2PFP、PFP-m的HPLC的检测及膜超滤结果
PFP、PFP-m的HPLC检测图谱如图1、图2所示。由图1可知,PFP含有4种多糖,按照分子质量从大到小依次命名为PFP-1、PFP-2、PFP-3、PFP-4,保留时间分别为6.349、7.607、8.794、10.972 min。根据葡聚糖分子质量标准曲线方程 lgMw=8.900 6-0.498 7t(R2=0.998 8)计算出它们的分子质量分别为5.42×105、1.28×105、3.27×104、2.7×103Da,因此选择截留分子质量50、5 kDa的超滤膜分离多糖。

图1 PFP 的高效液相色谱图Fig.1 HPLC of PFP
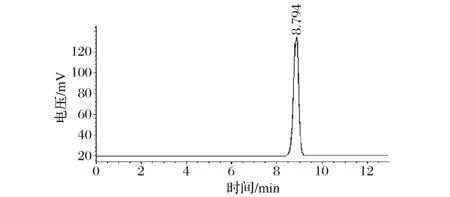
图2 PFP-m的高效液相色谱图Fig.2 HPLC of PFP-m
PFP经截留分子质量50 kDa的超滤膜超滤,滤液再经5 kDa的超滤膜超滤,截留液冷冻干燥得白色絮状物质,即为秀珍菇子实体膜分离多糖PFP-m,得率为73.21%,分子质量在5~50 kDa。
由图2可以看出,PFP-m的液相色谱图均呈单一狭长对称峰,表明其纯度高,为均一组分。其保留时间和图1中的第三个峰(PFP-3)的保留时间一致,可判断PFP-m 和PFP-3为同一种多糖。
2.3PFP-m的红外光谱分析
PFP-m在190~400 nm扫描发现,在260、280 nm处均没有吸收峰,表明PFP-m既不含有蛋白,也不含有核酸。
2.4PFP-m的红外光谱分析
PFP-m的红外光谱图谱见图3。PFP-m典型吸收峰均在3 425.13、2 931.41、1 637.35、1 403.10、1 145.57、1 035.01 cm-1波数位置。3 425.13 cm-1吸收峰是由O—H的伸缩振动引起的,2 931.41 cm-1吸收峰是由糖类C—H伸缩振动引起的,它是糖类的特征吸收峰;1 637.35 cm-1吸收峰是由糖类O—H的弯曲振动引起的;1 403.10 cm-1吸收峰是由糖类C—H变角振动引起的;1 035.01 cm-1吸收峰是由吡喃糖环引起的。红外光谱表明PFP-m是一种含有吡喃糖苷键的多糖。

图3 PFP-m的红外扫描图谱Fig.3 IR spectrum of PFP-m
2.5PFP-m的单糖组成分析
PFP-m的水解物PMP衍生化高效液相色谱图见图4。根据液相色谱的保留时间可判断PFP-m含有Man、Rha、Glc、Xyl、Ara 5种组分,它们的摩尔比为Man∶Rha∶Glc∶Xyl∶Ara=3.10∶1.00∶22.99∶6.85∶4.59,PFP-m的单糖组分中,葡萄糖含量最高,鼠李糖含量最低。

1-甘露糖;2-鼠李糖;3-葡萄糖;4-半乳糖;5-木糖;6-阿拉伯糖图4 标准单糖(a)与PFP-m(b)水解物的PMP衍生化液相色谱图Fig.4 PMP-labeled HPLC spectrum of standard monosaccharides(a) and PFP-m(b)
2.6PFP-m的一般理化性质及总糖含量
PFP-m的一般理化性质及总糖含量的测定结果见表1。由表1可知PFP-m不是淀粉类物质,也不是单糖和多酚类物质,而是典型的多糖类物质。

表1 PFP-m的一般理化性质及总糖含量
3 结论与讨论
目前实验室中均一多糖的分离纯化多采用离子交换柱层析和凝胶过滤柱层析法,柱层析法操作繁琐,上样量少,分离制备的效率低,不能进行大规模的制备。而膜超滤法操作简单,分离制备的量大,效率高,适合工厂化生产。但不是所有的多糖都可以采用膜分离法来制备,首先要看目的多糖与其他物质的分子质量大小差距有没有合适的膜可供选择,其次要看被分离的多糖粘性是否大,如果黏性过大,易产生膜污染和膜孔堵塞,引起膜渗透通量下降。因此在膜分离过程中,多糖的浓度不能太大,否则会引起黏性的增加,造成超滤困难。
本文采用闪式提取、闪式蒸馏的方法制备的秀珍菇子实体粗多糖,提取率高,能耗低,制备时间短,效率高,该方法适合秀珍菇子实体多糖的提取。
秀珍菇子实体粗多糖经Sevag法脱蛋白后、采用截留分子量50 kDa和5 kDa的超滤膜分离得到1种秀珍菇子实体多糖PFP-m。经测定,PFP-m为一种均一多糖,且含量高,达到73.21 %,该方法适合秀珍菇子实体多糖PFP-m的分离纯化。
[1]LUO Q, SUN Q, WU L S, et al. Structural characterization of an immunoregulatory polysaccharide from the fruiting bodies ofLepistasordida[J]. Carbohydrate Polymers, 2012, 88(3): 820-824.
[2]LIU L, JIA J, ZENG G, et al. Studies on immunoregulatory and anti-tumor activities of a polysaccharide fromSalviamiltiorrhizaBunge[J]. Carbohydrate Polymers, 2013,92(1):479-483.
[3]熊建文,蔡锦源,许金蓉.多糖的提取纯化技术及其活性功能的研究进展[J].食品工业,2014,35(3): 234-236.
[4]赵宏,张宇,柴桂芳,等.沙棘多糖的闪式提取工艺条件的优化[J].辽宁中医杂志,2015,42(2):364-366.
[5]FAN Y J, YU F F, ZHANG P, et al. Separation technology of polysaccharides fromFructuslyciiby ultrafiltration method[J]. Medicinal Plant,2011,2(8):61-65.
[6]SUN H J, QI D, XU J Y, et al. Fractionation of polysaccharides from rapeseed by ultrafiltration: Effect of molecular pore size and operation conditions on the membrane performance[J].Separation and Purification Technology, 2011,80(3):670-676.
[7]XIE J H, SHEN M Y, NIE S P, et al.Separation of water-soluble polysaccharides fromCyclocaryapaliurusby ultrafiltration process[J]. Carbohydrate Polymers, 2014,101(1):479-483.
[8]MOHAMMAD A W, NG C Y, LIM Y, et al.Ultrafiltration in food processing industry: Review on application, membrane fouling, and fouling control[J].Food and Bioprocess Technology,2012,5(4): 1 143-1 156.
[9]孙玉军,江昌俊,祝嫦巍,等.秀珍菇多糖 PMP-2a 的理化性质及其体外抗氧化活性研究[J].现代食品科技, 2014, 30(12) :79-84.
[10]SADHAN K ROY, DEBABRATA MAITI, SUBHAS MONDAL, et al.Structural analysis of a polysaccharide isolated from the aqueous extract of an edible mushroom,Pleurotussajor-caju, cultivar Black Japan [J]. Carbohydrate Research,2008, 343(6): 1 108-1 113.
[11]YANG J F, LI Y H,ZHAO J, et al. Isolation, structural characterization, and lymphopoiesis stimulant activity of a polysaccharide from the abalone gonad [J]. Food Science and Biotechnology, 2015, 24(1):23-30.
[12]孙玉军,査正其,郑文超,等. 草菇多糖VVP-1b 的分离纯化及其光谱分析[J].食品与发酵工业,2014,40(9):172-175.
[13]张惟杰.糖复合物生化研究技术[M].杭州:浙江大学出版社,1999.
[14]杨润亚,李维焕,吕芳芳.秀珍菇子实体多糖的提取工艺优化及体外抗氧化性[J].食品与生物技术学报, 2012, 31(10): 1 093-1 099.
Separation of polysaccharide PFP-m fromPleurotusgeesteranusfruit body by ultrafiltration membrane and its property
SUN Yu-jun1*, ZHOU Li-yuan2
1(School of Life Science, Anhui Science and Technology University,Fengyang 233100, China)2(School of Life Science, AnhuiUniversity, Hefei 230601, China)
A polysaccharide(PFP-m)was obtained from the fruit body ofPleurotusgeesteranusby a sequential processing of flash extraction, deproteinization and separation through different pore ultrafiltration membrane. Its partial properties and structure were studied by spectrographic method and colorimetry. The results showed that PFP-m was a homogeneous polysaccharide. ItsMw was 3.27×104Da. Typical polysaccharide absorption of PFP-m was in its IR spectrum. PFP-m consists of Man, Rha, Glc, Xyl, Ara, in molar ratios of 3.10∶1.00∶22.99∶6.85∶4.59 by PMP-HPLC. PFP-m has general physical and chemical properties of polysaccharide and its total sugar content were 93.16 %. Compared with column chromatography, ultrafiltration membrane method was easier to operate and more efficient. It was suitable for separation and purification of polysaccharide PFP-m frompleurotusgeesteranusfruit body.
Pleurotusgeesteranus; fruit body; polysaccharide; membrane separation
10.13995/j.cnki.11-1802/ts.201609029
在读博士,教授(本文通讯作者,E-mail:sunyujun208@163.com)。
安徽省高等学校省级自然科学研究重点项目(KJ2014A052);安徽大学现代生物制造协同创新中心2015年度开放课题(BM2015004);安徽省高校2016年优秀青年人才支持计划重点项目(gxyqZD2016211);安徽科技学院重点学科项目(AKZDXK2015B02)
2015-11-10,改回日期:2016-02-23
