羊肚菌菌丝体富硒条件优化及其硒多糖抗氧化活性研究
2016-10-13冮洁麦海美解彬韩琳冀春阳曹蕾
冮洁,麦海美,解彬,韩琳,冀春阳,曹蕾
(大连民族大学 生命科学学院, 辽宁 大连,116600)
羊肚菌菌丝体富硒条件优化及其硒多糖抗氧化活性研究
冮洁*,麦海美,解彬,韩琳,冀春阳,曹蕾
(大连民族大学 生命科学学院, 辽宁 大连,116600)
对羊肚菌菌丝体液体深层发酵富硒条件进行优化,考察培养基中硒浓度、温度、装液量和pH值对富硒率的影响。采用Fenton 法、邻苯三酚自氧化法和DPPH(1,1-二苯基-2-苦基肼)还原法对羊肚菌菌丝体多糖的体外抗氧化活性进行了研究。羊肚菌菌丝体富硒的适宜培养条件为:亚硒酸钠质量浓度为10 mg/L,温度25 ℃,装液量100 mL/250 mL,初始pH值7。在此条件下,富硒率最大达9.10%。羊肚菌菌丝体多糖和羊肚菌菌丝体硒多糖清除羟自由基(·OH)IC50分别为:0.62 mg/mL和0.42 mg/mL;清除超氧阴离子(O2-·)IC50分别为:0.85 mg/mL和0.59 mg/mL;清除DPPH自由基IC50分别为:0.66 mg/mL和0.49 mg/mL。羊肚菌菌丝体多糖具有较强的体外抗氧化活性,且随着多糖浓度的增大其抗氧化活性逐渐增强,羊肚菌菌丝体硒多糖抗氧化作用更强。
羊肚菌;菌丝体多糖;富硒率;抗氧化作用
羊肚菌(Morchellaesculenta),隶属子囊菌门(Ascomycota)、盘菌纲(Pezizomycetes)、盘菌目(Pezizales)、羊肚菌科(Morchellaceae),是一种名贵野生食药用真菌[1-2]。羊肚菌中重要的功效成分是其多糖。羊肚菌多糖对小鼠的肝脏损伤有明显保护作用[3];能够显著提高人皮肤成纤维细胞的增殖活力,促进胶原蛋白的合成,延缓细胞衰老[4];具有提高小鼠脑SOD的活性、减少脂褐质的沉积等功效[5];对胃溃疡[6]、胃黏膜[7]、辐射危害[8]具有保护作用;能显著抑制S-180肿瘤的生长[9];具有抗氧化、抗炎症和抗肿瘤的作用[10-11]。但羊肚菌大规模人工栽培目前仍较难实现[12]。羊肚菌菌丝体液体培养时,生长速度快,高效经济,适合工业化生产,且液体发酵培养的食用菌菌丝体与其子实体在化学组成上、生理功能上都很相似[13]。因此,采用菌丝体的液体发酵培养方法是目前主要培养羊肚菌的方法[14]。硒是人体必需的微量元素,与人类健康有密切关系,研究发现贫血、大骨节病、糖尿病、癌症等疾病都与人体内缺乏硒元素相关[15]。从地理条件分析,我国是一个缺硒大国,粮食等天然食物中硒含量较低,尤其是华北、东北、西北地区属于严重硒匮乏地区,开发高效的富硒食品具有重要的意义[16]。多糖和硒结合成为硒多糖,是一种多糖有机硒化合物,其生物药理活性普遍高于多糖和硒,更容易被机体吸收和利用[17]。食用菌因具有较强的富硒能力,通过菌丝细胞内物质代谢,使无机硒安全有效地转化为有机硒多糖,同时营养成分因富硒得到改善[18-19]。羊肚菌对硒具有较强的的富集和转化作用[20-21]。羊肚菌菌丝体富硒培养后获得的硒多糖的抗氧化性强于普通多糖[22]。香菇富硒培养的菌丝体提取物抗氧化、清除自由基的活性显著增加[23]。硒与食用菌蛋白之间在清除自由基方面存在协同作用[24]。以金针菇为载体进行硒的生物有机化不仅成本低,含硒量高,而且硒的主要存在形态安全无毒、人体利用率高[25]。本文对羊肚菌菌丝体液体深层培养富硒条件进行了优化,并研究其硒多糖的抗氧化活性。
1 材料与方法
1.1实验材料
羊肚菌(Morchellaesculenta),辽宁朝阳食用菌研究所提供;3,3’-二氨基联苯胺,阿拉丁试剂(上海)有限公司;二苯代苦味酰基自由基(DPPH),美国Sigma公司;马铃薯,市购;亚硒酸钠、苯酚、H2SO4、HNO3、NaOH、HCl、甲苯、乙二胺四乙酸(EDTA)、乙醇、Tris-HCl、硫酸亚铁铵、邻二氮菲、VC、邻苯三酚、MgSO4·7H2O、葡萄糖、琼脂粉、KH2PO4等均为分析纯试剂。
1.2实验仪器
PL203电子精密天平,梅特勒-托利多仪器(上海)有限公司;HYG-3多功能摇床,杰瑞尔电器有限公司;RE-52AA旋转蒸发仪,亚荣生化仪器厂;UV2800型紫外可见分光光度计,尤尼柯(上海)仪器有限公司;GRP-9080恒温培养箱,森信实验仪器有限公司;TGL-16C高速台式离心机,江苏省兴化市分析仪器厂;KDB-III COD微波消解仪,青岛科迪博电子科技有限公司;MLS-3750高压灭菌锅,日本三洋;SW-CJ-1C无菌操作台,苏州净化设备有限公司。
1.3实验方法
1.3.1硒含量的测定
采用3,3’- 二氨基联苯胺比色法[26]。

(1)
式中:Wi为富硒菌丝体硒含量,μg/g,W0为空白(不添加硒)菌丝体硒含量,μg/g,Mi为富硒菌丝体干重,g/100 mL,Wj为培养基内添加的初始硒含量,μg/100 mL。
1.3.2多糖的提取及测定
热水浸提法提取多糖:称取干燥粉碎后的羊肚菌菌丝体样品5.0 g,加入120 mL的去离子水,置于250 mL锥形瓶中,在90 ℃的水浴锅中保温120 min,残渣重复提1次。合并上清液,用旋转蒸发仪浓缩至适当体积,加3倍体积的无水乙醇进行醇沉,4 ℃静置过夜,3 500 r/min离心20 min,弃去上清液,沉淀用无水乙醇洗2次后,置于60 ℃烘干,即为粗多糖。

(2)
将粗多糖用蒸馏水配制成1 mg/mL的样品溶液,采用苯酚-硫酸法测定多糖含量[27]。
1.3.3羊肚菌菌种制备
培养基:斜面培养基(综合PDA培养基):马铃薯200 g、葡萄糖20 g、KH2PO41.5,MgSO41.0,琼脂粉20 g、水1 000 mL,pH 自然。液体种子和发酵培养基:不加琼脂的综合PDA培养基。
菌种活化:将保存菌种用接种针接入斜面培养基中,25 ℃恒温培养7 d。
液体菌种培养:将活化的斜面菌种4块(黄豆粒大小)接种到装有100 mL液体PDA综合培养基的250 mL三角瓶中,置25 ℃,150 r/min恒温振荡培养5 d。
1.3.4羊肚菌菌丝体液体培养
将液体菌种接入装100 mL发酵培养基的250 mL三角瓶中,接种量为10%, 25 ℃,150 r/min振荡培养7 d。培养结束后将菌丝体过滤,蒸馏水洗涤2遍,60 ℃烘干,称重后测定菌丝体中硒含量。
1.3.5单因素法优化羊肚菌菌丝体的富硒培养条件
硒浓度的选择:向PDA液体培养基中加入亚硒酸钠制备含不同硒浓度的培养基,硒浓度(mg/L)分别为:5,10,20,30,40,50,60,70,80,以不加亚硒酸钠为空白对照。
培养温度的选择:分别取22,25,28 ℃。
装液量的选择:分别取50,100,150 mL于250 mL三角瓶中。
pH的选择:分别取5,6,7,8,9。
1.3.6正交试验优化羊肚菌的富硒培养条件
采用4因素3水平正交试验优化羊肚菌的富硒培养条件。分别考察培养基中硒浓度、pH值、装液量和温度4方面对羊肚菌富硒率的影响。

表1 羊肚菌富硒培养条件正交试验因素水平表
1.3.7羊肚菌菌丝体多糖抗氧化性的研究
1.3.7.1清除羟自由基(·OH)试验
取8支10 mL刻度管,依次加入1 .0 mL的Tris-HCl溶液(pH 8.2),0.3 mL硫酸亚铁铵(5.0 mmol/L)和0.3 mL的邻二氮菲溶液(7.5 mmol/L),1号为空白,3~7号管分别加入0.2,0.4,0.6,0.8 mL和 1.0 mL 的样品溶液(1 mg/mL),8号管加入1.0 mL的 VC溶液(0.2 mg/mL),最后向 2~8号管分别加入1.0 mL H2O2溶液(7.5 mmol/L),定容至刻度。在37℃水浴锅中反应 1.0 h 。以Tris-HCl 溶液调零,在510 nm 处测吸光度A,计算对·OH 的清除率。
(3)
式中:A1和A2分别是体系不加 H2O2及加入 H2O2的吸光值;A3是加入样品溶液以后的吸光值。
1.3.7.2抑制超氧阴离子(O2-·)试验
取5支10 mL刻度管,均加入4.5 mL的Tris-HCl缓冲液(0.05 mol/L),置于25 ℃水浴中预热25 min,分别加入0.1 mL不同浓度的样品溶液和0.4 mL邻苯三酚溶液(0.5 mmol/L),于25 ℃水浴中反应4.0 min,加入8.0 mol/L HCl 2滴终止反应。以Tris-HCl溶液调零,在320 nm 处测定吸光度(Ai),空白对照组以相同体积的蒸馏水代替。
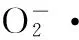
(4)
式中:A0为空白的吸光度;Ai为多糖的吸光度。
1.3.7.3清除DPPH·试验
吸取样品2.0 mL,加入2.0 mL DPPH溶液(0.2 mmol/L),摇匀,避光静置30 min。以无水乙醇调零,测定 517 nm 波长处的吸光度(A样品)。测定样品2.0 mL与无水乙醇2.0 mL混合液在517 nm 处的吸光度(A对照),再测定2.0 mL DPPH溶液与2.0 mL无水乙醇在517 nm波长处的吸光度(A空白)。计算DPPH·的清除率。
(5)
IC50值是清除率为50%时对应的样品浓度。
1.4数据分析
每个试验处理3次重复,用Microsoft Excel软件计算平均值和标准偏差。
2 结果与分析
2.1羊肚菌菌丝体富硒培养条件优化的单因素实验
2.1.1羊肚菌菌丝体富硒培养适宜硒浓度的选择
结果如表2所示,硒的浓度(5~10 mg/L)范围内促进菌丝体生长,在高浓度(大于10 mg/L)范围内则抑制菌丝体生长,硒对羊肚菌菌丝体具有促进生长与抑制生长的双重性。硒浓度为5 mg/L时,菌丝体生物量为7.48 g/L,硒含量为0.07 mg/g,富硒率为7.48%;硒浓度为10 mg/L时,菌丝体生物量为6.72 g/L,硒含量为0.11mg/g,富硒率为6.05%。虽然硒浓度为5 mg/L时的富硒率高于硒浓度为10 mg/L时,但考虑到菌丝体中的硒含量,选择的硒浓度为10 mg/L。
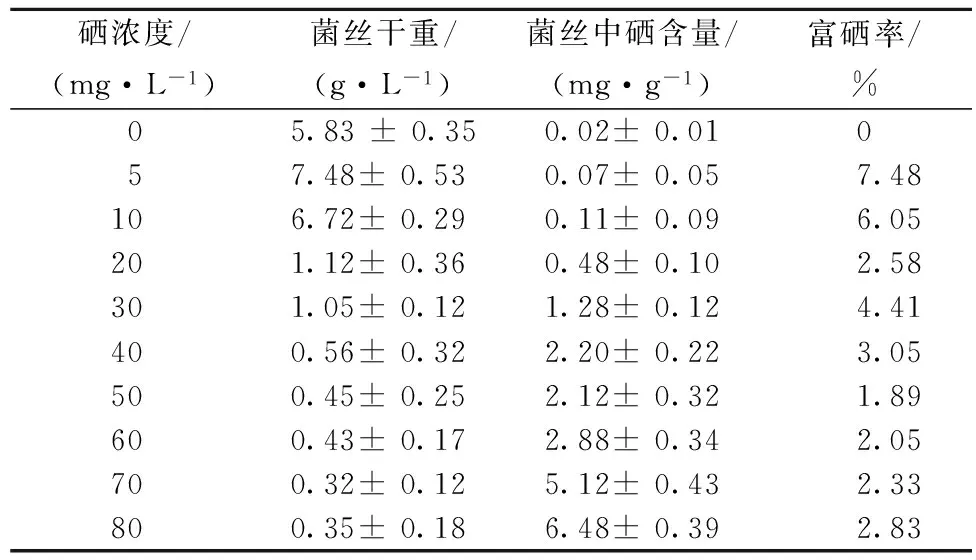
表2 羊肚菌菌丝体富硒培养适宜硒浓度的选择
2.1.2羊肚菌菌丝体富硒培养适宜温度的选择
培养基中硒浓度为10 mg/L,将已接种好的三角瓶置于18、22、25、28 ℃培养,测定菌丝体生物量和硒含量,计算富硒率,结果如表3所示。培养温度对菌丝体硒含量的影响效果不显著,但对菌丝体生物量的影响比较大,羊肚菌菌丝体干重随温度的升高呈现先增大后减小的趋势,且温度为25 ℃时菌丝体生物量和富硒率最大。因此,选择25 ℃为最佳培养温度。
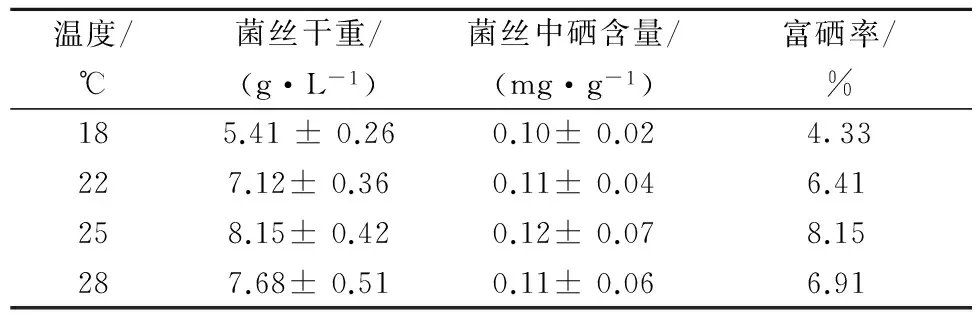
表3 羊肚菌菌丝体富硒培养适宜温度的选择
2.1.3羊肚菌菌丝体富硒培养适宜装液量的选择
装液量影响菌丝体液体培养过程中发酵液的溶氧状态,因此可以考察该菌生长和富硒对氧的需求程度。装液量对羊肚菌菌丝体富硒培养的影响(表4),装液量对菌丝体硒含量的影响效果不显著, 但对菌丝体生长的影响效果显著。羊肚菌菌丝体在250 mL三角瓶中装液量为100 mL时,菌丝干重达到最大值7.85 g/L,此时菌丝体的富硒率为7.85%。从装液量来看,并不是溶氧越大越有利于羊肚菌菌丝生长和富硒。

表4 羊肚菌菌丝体富硒培养适宜装液量的选择
2.1.4羊肚菌菌丝体富硒培养适宜pH的选择
培养基配制后灭菌前,自然pH值为6.85,pH对羊肚菌菌丝体富硒培养的影响结果如表5所示。羊肚菌富硒培养时,初始pH值小于6或大于7菌丝体生长都受到抑制,当pH为 7.0以上时, 菌体干重开始急剧下降,pH在6~7范围内比较适合菌丝体生长。当pH为7时菌丝体生物量最高,pH为7时富硒率最高。因此,初步选择初始pH值为7。

表5 pH值对羊肚菌菌丝体富硒培养的影响
2.2正交试验优化羊肚菌菌丝体富硒的培养条件
优化得到的羊肚菌菌丝体富硒培养条件方案为:A2B3C2D2,即培养基中硒浓度10 mg/L、pH值7.0、装液量100 mL/250 mL、温度25 ℃。实验因素对羊肚菌菌丝体富硒影响的大小顺序为:硒浓度﹥温度﹥装液量﹥pH值。经方差分析,正交试验的4个因素在所选实验浓度范围内,对富硒率无显著影响。通过验证试验,在上述优化的适宜条件下得到菌丝体生物量为8.27 g/L、硒含量0.13 mg/g,富硒率为9.10%,比优化前的富硒率6.05%提高50.41%。
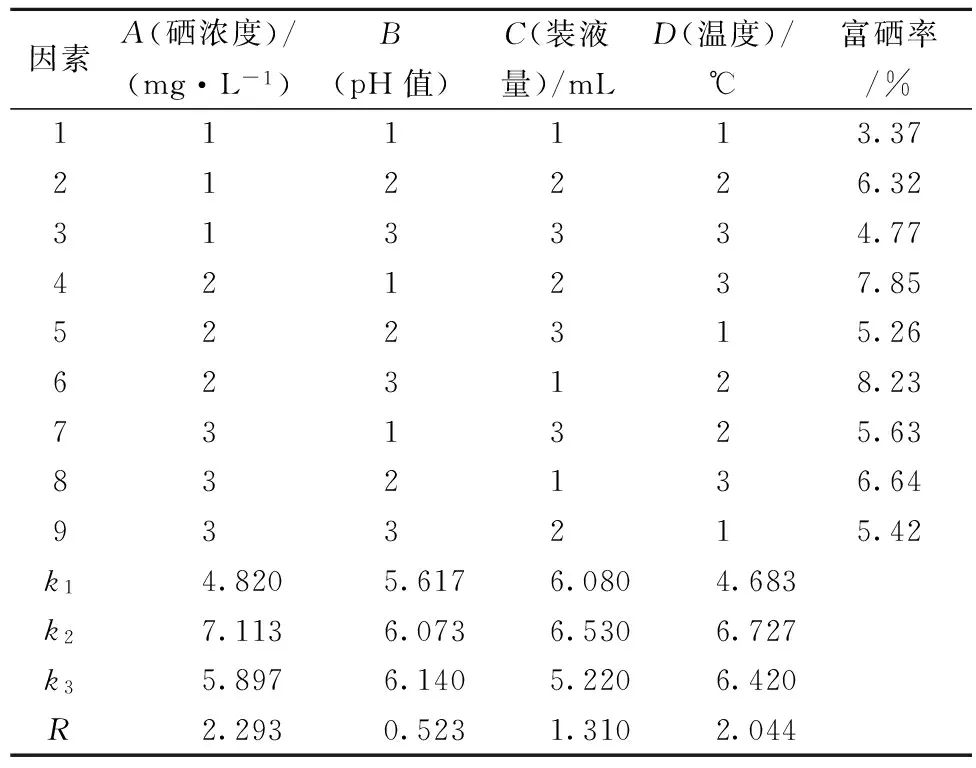
表6 羊肚菌菌丝体富硒培养条件正交试验结果
2.3富硒羊肚菌菌丝体多糖抗氧化性的研究
2.3.1羊肚菌菌丝体多糖提取及富硒率的测定
采用液体深层发酵技术进行羊肚菌菌丝体富硒培养,其菌丝体多糖提取和富硒率计算结果如表7所示。羊肚菌菌丝体多糖的纯度和提取率分别为88.07 %和10.94 %,硒多糖的纯度和提取率分别为 90.18 %和11.64 %,在相同的培养条件下得到硒多糖的量比羊肚菌菌丝体多糖的量高6.40 %,表明羊肚菌菌丝体富硒培养,在一定程度上可以促进菌丝体产糖,且提高多糖的提取率。

表7 羊肚菌菌丝体多糖提取
2.3.2羊肚菌菌丝体多糖清除羟自由基(·OH)
通过H2O2/Fe2+体系测定羊肚菌富硒菌丝体多糖和没加硒的菌丝体多糖清除羟自由基(·OH)实验,结果如图2所示。Vc的线性回归方程为:y=52.5x+31.2(R2=0.990 9),IC50为0.36 mg/mL,硒多糖的线性回归方程为:y=43.35x+31.735(R2=0.986 3),IC50为0.42 mg/mL,羊肚菌多糖的线性回归方程为:y=51.3x+18.33(R2=0.936 4),IC50为0.62 mg/mL。对羟自由基的清除作用大小为:Vc>羊肚菌富硒菌丝体多糖>羊肚菌菌丝体多糖。在一定的多糖浓度范围内,3者的羟自由基清除能力与样品多糖浓度成正相关。实验表明羊肚菌富硒后,其多糖的羟自由基清除能力增强,羊肚菌富硒菌丝体多糖清除·OH的活性比羊肚菌菌丝体多糖提高52.38 %。
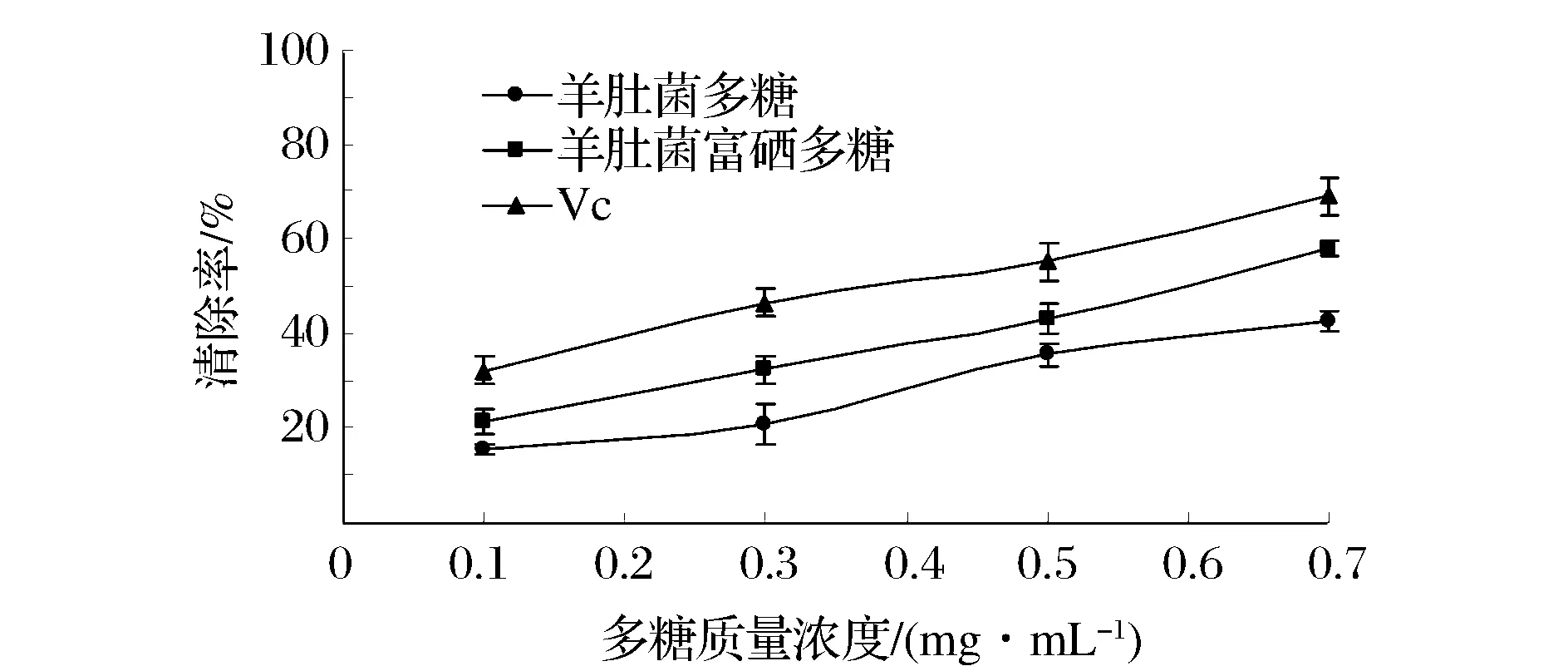
图2 羊肚菌菌丝体多糖对·OH清除率Fig.2 Scavenging rates of Morchella esculenta mycelium polysaccharides on hydroxyl free radicals
2.3.3羊肚菌菌丝体多糖清除超氧阴离子(O2-·)
通过测定Vc、羊肚菌富硒菌丝体多糖和没添加硒源的菌丝体多糖对邻苯三酚的自氧化抑制作用来表明它们清除O2-·活性,结果如图3所示。

图3 羊肚菌菌丝体多糖对O2-·的清除率Fig.3 Scavenging rates of Morchella esculenta mycelium polysaccharides on superoxide anion free radicals
由图3可见,清除O2-·活性,Vc的线性回归方程为:y=59.55x+26.855(R2= 0.991 8),IC50为0.39 mg/mL,硒多糖的线性回归方程为:y=59.9x+14.69(R2=0.993 6),IC50为0.59 mg/mL,羊肚菌多糖的线性回归方程为:y=47.65x+9.515(R2=0.967 6),IC50为0.85 mg/mL,对O2-·清除作用大小为:Vc >羊肚菌富硒菌丝体多糖 > 羊肚菌菌丝体多糖。羊肚菌富硒菌丝体多糖清除O2-·活性比羊肚菌菌丝体多糖提高44.07 %。
2.3.4羊肚菌菌丝体多糖清除DPPH·
DPPH在有机溶剂中呈现深紫色,通过测定颜色的褪色程度来评价多糖对DPPH·的清除效果,其测定结果如图4所示。

图4 羊肚菌菌丝体多糖对DPPH·的清除率Fig.4 Scavenging rates of Morchella esculenta mycelium polysaccharides on DPPH free radicals
由图4清除DPPH·实验结果表明,Vc对DPPH·的清除率的线性回归方程为:y=72.15x+27.715(R2= 0.956 1),IC50为0.31 mg/mL,硒多糖的线性回归方程为:y=39.4x+30.74(R2=0.998 6),IC50为0.49 mg/mL,羊肚菌多糖的线性回归方程为:y=37.1x+25.36(R2=0.972 8),IC50为0.66 mg/mL。对DPPH·清除作用大小为:Vc >羊肚菌富硒菌丝体多糖 > 羊肚菌菌丝体多糖。羊肚菌富硒菌丝体多糖清除DPPH·活性比羊肚菌菌丝体多糖提高34.69 %。
3 结论
羊肚菌菌丝体具有较强的富硒能力,通过优化获得的适宜富硒条件为:硒浓度10 mg/L、pH值7.0、装液量100 mL/250 mL、温度25 ℃。菌丝体中硒含量可达0.13 mg/g,富硒率为9.10%,提高了50.41%。通过清除·OH、O2-·和DPPH·证明了羊肚菌菌丝体多糖具有较强的体外抗氧化性,由于多糖和硒的双重作用,通过富硒培养获得的羊肚菌富硒菌丝体多糖比羊肚菌菌丝体多糖具有更强的体外抗氧化活性,其中清除·OH的活性提高了52.38 %,清除O2-·活性提高了44.07 %,清除DPPH·活性提高了34.69%。富硒羊肚菌多糖可作为天然抗氧化剂和补硒制剂开发利用。
[1]HIBBETT D,BINDER M,BISCHOFF JF,et al. A higher-level phylogenetic classification of the fungi[J]. Mycological Research,2007,111(5): 509-547.
[2]杜习慧,赵琪,杨祝. 羊肚菌的多样性、演化历史及栽培研究进展[J]. 菌物学报,2014,33(2):183-197.
[3]孙玉军,陈彦,周正义,等. 羊肚菌胞内多糖对小鼠急性肝损伤的影响[J]. 中国食用菌,2008,27(2):41-45.
[4]马利,李霞,张松. 尖顶羊肚菌胞外多糖提取物对皮肤成纤维细胞增殖和衰老的影响[J]. 菌物学报,2014,33(2):385-393.
[5]潘志福,兰瑛,张松. 尖顶羊肚菌胞外多糖提取物抗氧化作用的研究[J]. 华南师范大学学报(自然科学版),2011(2):124-128.
[6]高明燕,郑林用,余梦瑶. 尖顶羊肚菌菌丝体水提液对实验型胃溃疡的作用[J]. 菌物学报,2011,30(2):325-330.
[7]魏巍,余梦瑶,许晓燕. 不同羊肚菌菌株的遗传差异性与胃黏膜保护作用的比较研究[J]. 食品科学,2014,35(7):160-163.
[8]吕晓莲,郭宏,贾建会. 羊肚菌发酵产物功能性研究[J]. 食品科学,2013,34(1):311-314.
[9]陈彦,潘见,周丽伟,等. 羊肚菌胞外多糖抗肿瘤作用的研究[J]. 食品科学,2008,27(9):555-558.
[10]NITHA B,MEERA C K,JANARDHANAN K K. Anti-inflammatory and antitumor activities of cultured mycelium of morel mushroomMorchellaesculenta[J]. Curr Sci,2007,92(2):235-239.
[11]MAU Jeng-leun,CHANG Chieh-no,HUANG Shih-jeng,et al. Antioxidant properties of methanolic extracts fromGrifolafrondosa,MorchellaesculentaandTermitomycesalbuminosusmycelia[J]. Food Chemistry,2004,87(1):111-118.
[12]熊川,李小林,李强,等. 羊肚菌生活史周期、人工栽培及功效研究进展[J]. 中国食用菌,2015,34 (1):7-12.
[13]杨建,张光宇,杜秀娟. 羊肚菌液体发酵培养基成分及培养条件的优化[J]. 中国酿造,2013,32(10) :113-116.
[14]康小虎,蔡亚东,孙宜法,等. 甘南州尖顶羊肚菌菌丝体液体发酵培养研究[J]. 中国食用菌,2012,31(6):40-43.
[15]颜炳祥,潘道东,曾小群. 乳酸菌胞外多糖硒化修饰及其抗氧化活性研究[J]. 中国食品学报,2012,12(2):15-23.
[16]李丽辉,林亲录,陈海军. 硒的生理学功能及富硒强化食品的研究进展[J]. 现代食品科技,2005,21(3):198-200.
[17]SHANG De-jing,LI Yang,WANG Che,et al. A novel polysaccharide from Se-enrichedGanodermaluciduminduces apoptosis of human breast cancer cells[J]. Oncology Reports,2011,25(1):267-272.
[18]余杰,崔鹏举,崔仕超,等. 鸡腿菇菌丝深层培养富硒的研究[J]. 食品与发酵工业,2008,34(7): 93-97.
[19]高慧娟,袁承玲,赵丽,等. 响应面法优化富硒荷叶离褶伞菌丝体胞内粗多糖发酵条件[J]. 菌物学报,2016,35(1): 86-93.
[20]丁健峰,孙永海,付天宇,等. 响应曲面法优化羊肚菌富硒深层发酵条件[J]. 吉林大学学报(工学版),2013,43(增刊):557-563.
[21]黄春燕,张柏松,万鲁长,等. 食用菌富硒培养研究进展[J]. 山东农业科学,2012,44(7):81-87.
[22]黄玲玲,苏彩霞,张宗申,等. 硒、锌元素对羊肚菌多糖抗氧化性的影响[J]. 食品与发酵工业,2015,41(7):122-125.
[23]JADWIGA T,BOZENNA G,FRANCISZEK H.Effect of selenium enrichment on antioxidant activities and chemical composition ofLentinulaedodes(Berk.) Pegl. mycelial extracts[J]. Food and Chemical Toxicology,2010,48:1 085-1 091.
[24]杨奇,郭阳,徐锐,等. 富硒食用菌硒蛋白清除氧自由基作用研究[J]. 食品研究与开发,2014,35(13):1-5.
[25]李华为,铁梅,张崴,等. 金针菇子实体富硒栽培特性及 HPLC-ICP-MS 法对硒的分布研究[J]. 菌物学报,2012,31(1):86-91.
[26]贾姗姗,朱连勤,朱风华,等. 3,3'-二氨基联苯胺分光光度法检测硒[J]. 畜牧与兽医,2012,44 (6):74-75.
[27]王文平,郭祀远,李琳,等. 苯酚-硫酸法测定野木瓜中多糖含量的研究[J]. 食品科学,2007,28(4):276-278.
Optimization of Se-rich culture conditions and antioxidant activities of polysaccharides fromMorchellaesculentamycelium
GANG Jie*,MA Hai-mei,XIE Bin,HAN Lin,JI Chun-yang,CAO Lei
(College of Life Sciences,Dalian Nationalities University,Dalian 116600,China)
The cultivation conditions for a selenium-accumulating ofMorchellaesculentamycelium was optimized using submerged liquid culture. The influences of selenium concentration,temperature,liquid volume,pH value of cultivation medium on selenium accumulation rate were studied. The results showed that the optimum conditions were as follows: the selenium concentration in cultivation medium was 10 mg/L,temperature was 25 ℃,liquid volume was 100 mL/250 mL and initial pH was 7.0. Under such conditions,the selenium-rich rate can reach 9.10%. The crude polysaccharides were isolated fromMorchellaesculentamycelium,and their antioxidant abilities in scavenging hydroxyl radical, inhibiting superoxide anion, scavenging DPPH radical were studied. The IC50values of ·OH clearance forMorchellaesculentamycelium polysaccharide and mycelium selenium-accumulating polysaccharide were 0.62 mg/mL and 0.42 mg/mL respectively. The IC50values of O2-·clearance were 0.85 mg/mL and 0.59 mg/mL respectively. The IC50values of DPPH· clearance were 0.66 mg/mL and 0.49 mg/mL, respectively.Morchellaesculentamycelium polysaccharides exerted antioxidant activities in a concentration-dependent manner, and the antioxidant activities of mycelium selenium-rich polysaccharides were higher than those of mycelium polysaccharides without selenium-rich culture.
Morchellaesculenta; mycelium polysaccharide; selenium accumulation rate; antioxidant activity
10.13995/j.cnki.11-1802/ts.201609021
博士,教授(本文通讯作者, E-mial:gangjie@dlnu.edu.cn)。
辽宁省自然科学基金资助项目(2015020676);财政专项-中央高校基本科研业务费资助项目(DC201501020301)
2016-02-26,改回日期:2016-05-23
