柚皮微晶纤维素的制备及其结构特性研究
2016-10-13曾小峰彭雪娇谈安群王华
曾小峰,彭雪娇,谈安群,王华
(中国农业科学院 柑桔研究所,重庆,400712)
柚皮微晶纤维素的制备及其结构特性研究
曾小峰,彭雪娇,谈安群,王华*
(中国农业科学院 柑桔研究所,重庆,400712)
采用盐酸水解法制备柚皮微晶纤维素,通过单因素试验,分别考察HCl浓度、酸解时间、酸解温度对柚皮微晶纤维素制备工艺的影响。在此基础上,通过正交试验优化制备工艺条件,并确定了柚皮微晶纤维素制备工艺的最佳条件:HCl体积分数为8%、酸解温度为60 ℃、酸解时间为80 min。利用红外光谱、X衍射、扫描电镜对柚皮微晶纤维素晶型结构、微观形态进行表征。柚皮微晶纤维素为纤维素I型结构,相对结晶度为71.26%,表面形态粗糙,呈长杆状。
柚皮;微晶纤维素;聚合度;结构特性
纤维素经稀酸水解、酶水解或者物理法处理即可得到极限聚合度在15~375之间的微晶纤维素(microcrystalline cellulose,MCC),它是一种白色、无味的结晶粉末状物质,具有生物可降解性,常作为悬浮稳定剂及保水剂,广泛应用于化妆品、食品及制药工业等领域[1-2]。目前,国内外制备微晶纤维素的方法主要有酸水解法[3-4]、物理法[5]、酶水解法[6-7]等, 其中酸法水解因制备工艺成熟,成本低而被广泛采用。国内用于微晶纤维素工业规模化生产的原料主要为木材和短绒棉,随着对原材料需求的不断增加,且农作物及其副产品具有天然、可再生等优点,稻壳、苹果渣、大豆皮、花生壳、玉米积杆等被开发应用。
柚皮富含丰富的果胶、纤维素、黄酮类等物质[8],研究者目前对柚皮的研究主要集中在对其功能性成分,如黄酮类、果胶、香精油、膳食纤维等的分离提取[9]。本文在提取柚皮纤维素基础上,通过酸法水解及正交试验优化了工艺条件,并分析了柚皮微晶纤维素的结构特性。
1 材料与方法
1.1材料与试剂
HCl、铜乙二胺溶液、甘油等,均为分析纯。
1.2仪器与设备
恒温水浴锅,上海双舜实业发展有限公司;BT224S电子天平,赛多利斯科学仪器(北京)有限公司;GZX-9240MBE型电热恒温鼓风干燥器,上海博讯实业有限公司医疗设备厂 ;乌氏黏度计,上海笛柏实验设备有限公司 ;傅里叶变换红外光谱,天津瑞岸科技有限公司;JSM-6510LV扫描电子显微镜,日本电子珠式会社;XRD-7000粉末衍射仪,日本岛津。
1.3实验方法
1.3.1柚皮预处理
柚子清洗干净,用手工除去表皮油胞,切成2 cm×2 cm小块,电热恒温鼓风干燥器65 ℃烘干,粉碎过筛(60目),得到柚皮粉,4 ℃贮藏备用。
1.3.2柚皮纤维素的提取
将柚皮粉原料以1∶20(g∶mL)料液比加入0.1 mol/L HCl85 ℃水浴处理2 h去除果胶,3层纱布抽滤,滤渣用蒸馏水洗涤至中性,60 ℃烘干。取去果胶柚皮粉以1∶20(g∶mL)料液比加入94 g/L的NaOH溶液中,超声波功率200 W,提取温度84 ℃下提取77 min,向滤渣加入体积分数为8%的H2O2于30 ℃水浴条件下反应30 min,蒸馏水洗涤至中性,用体积分数95%的乙醇洗脱酯类及去除部分色素,60 ℃烘干后得到柚皮纤维素用于柚皮微晶纤维素的制备[10]。
1.3.3柚皮微晶纤维素制备工艺
将1.3.2方法中提取的柚皮纤维素在不同体积分数HCl(2%、4%、6%、8%、10%)下进行酸解,酸解时间分别为20、40、60、80、100 min,温度分别为20、40、60、80、100 ℃。酸解后3层纱布过滤,蒸馏水洗涤滤渣至中性,60 ℃烘箱干燥至恒重。以柚皮微晶纤维素的聚合度和得率变化为指标,在单因素试验结果的基础上,选择HCl体积分数、酸解时间和温度进行3因素3水平正交试验,优化制备工艺。
1.3.4分析方法
1.3.4.1聚合度(DP)测定
参照GB/T1548—1989《纸浆黏度的测定法》中铜乙二胺-毛细管黏度计法。
1.3.4.2得率
得到的柚皮微晶纤维素质量与未反应前柚皮纤维素质量的比值(百分率)。
1.3.4.3红外光谱(FTIR)
KBr压片法,扫描范围4 000~400 cm-1,分辨率4 cm-1。
1.3.4.4X-射线衍射(XRD)
扫描范围2θ为10~60°,步宽4°/min,步长0.02°,管压40 kV,电流30 mA。采用Segal公式(1)计算相对结晶度(crystallinity index, CI)。
(1)
式中:I002为002面(2θ=22.7°)晶格衍射峰强度;Iam为纤维素无定形区衍射峰强度(2θ=18°)。
1.3.4.5扫描电镜(SEM)
样品粉末喷金后,通过JSM-6510LV扫描电子显微镜进行形貌观察。
2 结果与分析
2.1单因素试验结果分析
2.1.1HCl浓度对柚皮微晶纤维素制备的影响
在料液比为1∶20(g∶mL),温度为60 ℃,酸解时间为60 min的固定条件下,考察HCl体积分数对制备柚皮微晶纤维素的影响。如图1所示,随着HCl体积分数的增加,柚皮纤维素得率不断减少,并在HCl体积分数大于6%后,下降趋势更为明显。另一方面,柚皮微晶纤维素的聚合度随HCl体积分数增加呈下降趋势,在HCl体积分数小于6%的酸度范围内,聚合度随HCl体积分数的增加急剧下降;当HCl体积分数大于6%以后,聚合度基本保持稳定,说明在HCl体积分数为6%时达到了极限聚合度。这是因为HCl作用于纤维素中葡萄糖残基之间以氧原子连接的地方,被逐渐水解为较小的分子,即表现为聚合度的下降。当酸浓度继续增加,聚合度变化较稳定,而得率发生显著下降,这是由于HCl的过度水解,使柚皮微晶纤维素水解成小分子的糖所致[11]。因此,综合考虑,初步确定最佳HCl体积分数为6%。
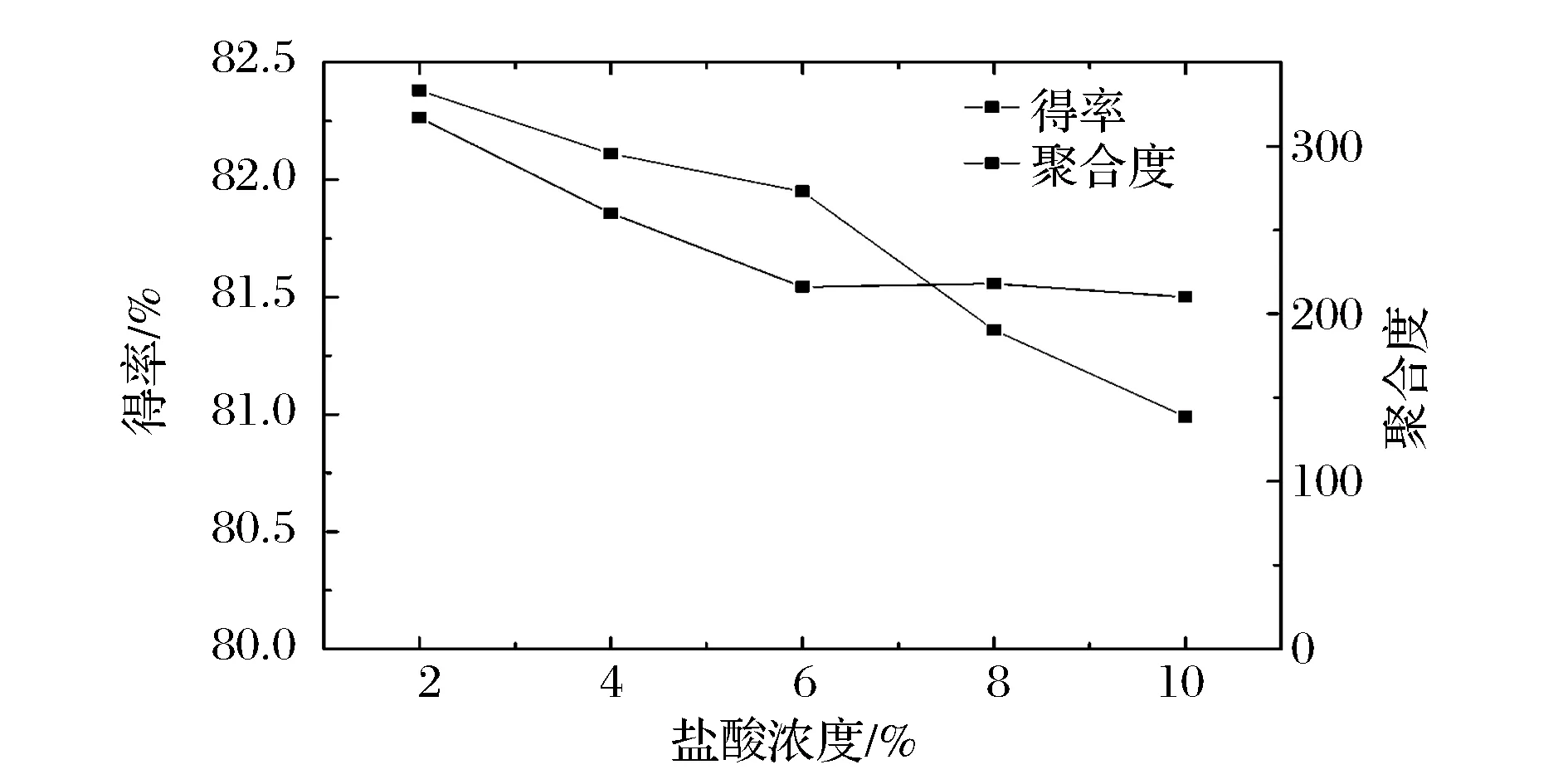
图1 盐酸浓度对柚皮微晶纤维素聚合度和得率的影响Fig.1 Effect of hydrochloric acid concentration on the degree of polymerization (DP) and yield of microcrystalline cellulose form pomelo peel
2.1.2酸解时间对柚皮微晶纤维素制备的影响
在料液比为1∶20(g∶mL),温度为60 ℃,HCl体积分数为6%的条件下,考察酸解时间对制备柚皮微晶纤维素的影响。如图2所示。
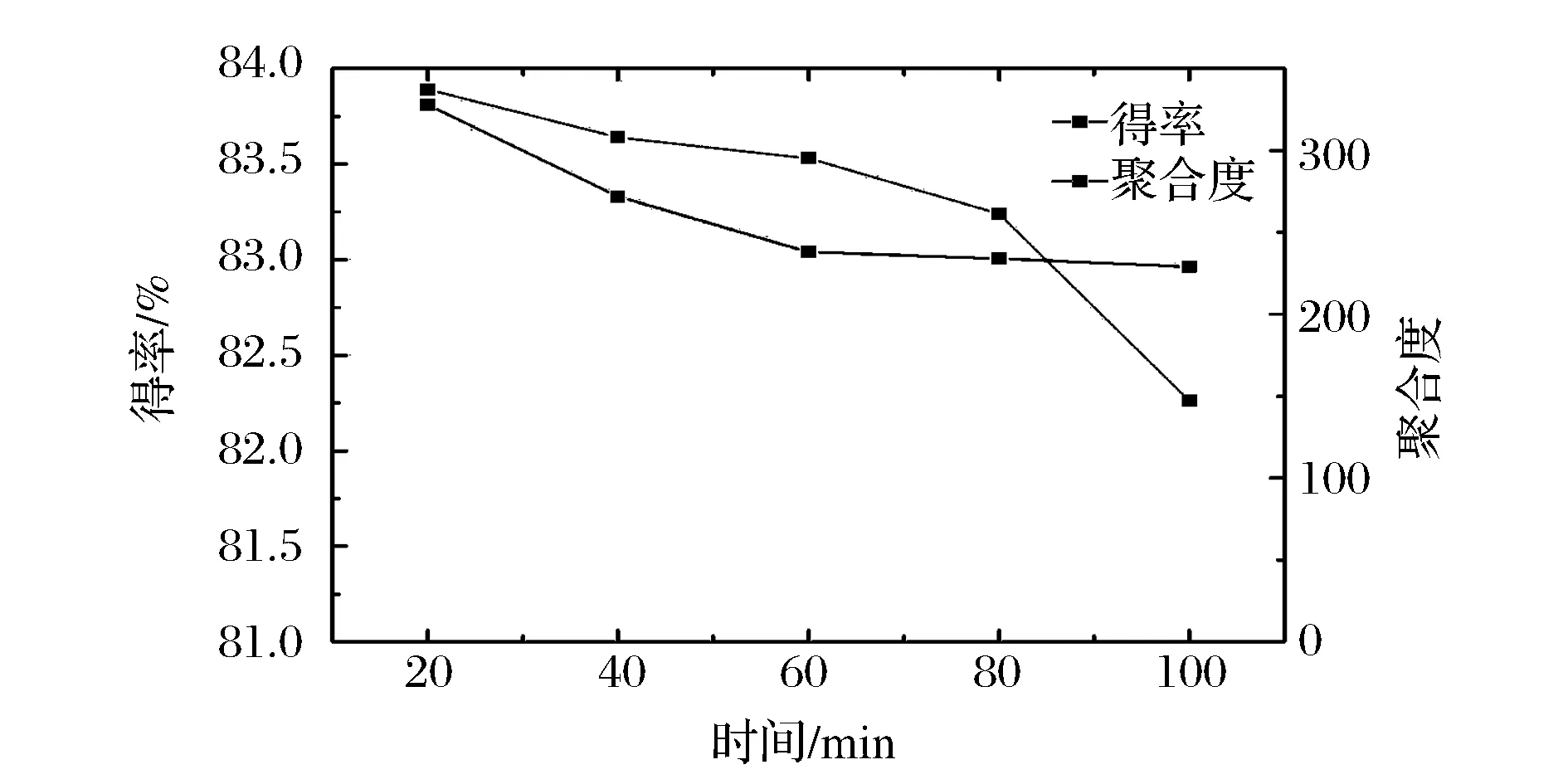
图2 酸解时间对柚皮微晶纤维素聚合度和得率的影响Fig.2 Effect of acid hydrolysis time on the degree of polymerization (DP) and yield of the pomelo peel microcrystalline cellulose
随着酸解时间的增加,柚皮微晶纤维素聚合度先下降后趋于平稳,在60 min时已达到极限聚合度。这是因为纤维素由排列紧密规则的结晶区和疏松堆砌的无定形区组成[12],无定形区具有较高的化学反应可及度,因此,盐酸首先破坏纤维素分子的无定形区,使得聚合度不断下降;若酸解时间继续延长,大于60 min后,不仅无定形区被水解,结晶区也会受到较大程度的破坏,一些受损的纤维素结晶区发生再结晶作用,并引发结晶区微纤分子之间的氢键断裂,导致纤维素过度水解,使得得率显著下降[13]。因此,综合聚合度及得率,初步确定酸解时间为60 min。
2.1.3酸解温度对柚皮微晶纤维素制备的影响
在料液比为1∶20(g∶mL),HCl体积分数为6%,酸解时间60 min的条件下,考察酸解温度对制备柚皮微晶纤维素的影响。如图3所示。

图3 温度对DGMCC聚合度和得率的影响Fig.3 Effect of temperature on the degree of polymerization (DP) and the yield of microcrystalline cellulose form pomelo peel
随着温度不断增加,聚合度及得率都不断下降,这是因为温度越高,氢离子活性越大,纤维素分子糖苷键断裂越快[14],当温度过高时,促使纤维素水解生成葡萄糖等小分子,使微晶纤维素的得率和聚合度减小。从图中可以看出柚皮微晶纤维素得率在较低温度时下降较平缓,当大于60 ℃后,得率急剧下降。同时发现,当温度达到80 ℃时,制备得到的柚皮微晶纤维素颜色加深,因此,综合考虑,确定最佳酸解温度为60 ℃。
2.2正交试验优化
根据单因素试验对柚皮微晶纤维素制备效果的影响,在单因素试验的基础上,选择HCl体积分数、酸解温度和酸解时间3个因素进行L9(33)正交试验,以聚合度作为评价指标,因素水平设计如表1所示,正交试验结果及方差分析见表2、表3。
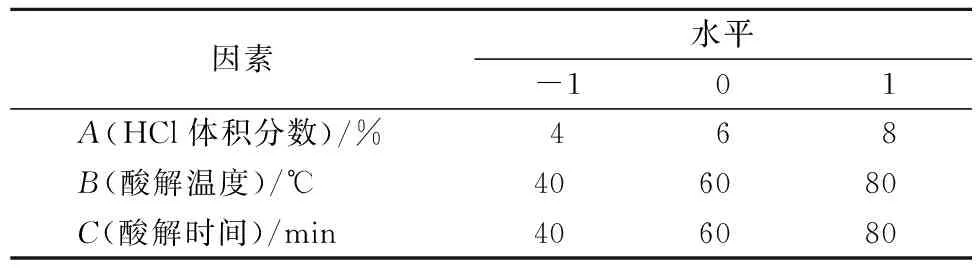
表1 正交试验因素水平表
由表2分析可知,对柚皮微晶纤维素聚合度的影响因素大小顺序为温度>HCl体积分数>时间,与极差分析结果一致,由表3方差分析结果可得显著性检验,HCl体积分数、酸解温度对柚皮微晶纤维素聚合度具有极显著影响,而酸解时间对柚皮微晶纤维素聚合度的影响不显著。聚合度越小,说明盐酸水解无定型区越彻底,生成的纤维素微晶化效果越好,以聚合度越小为指标[15]。因此,选择最优组合为A3B3C3,但由于温度过高,导致微晶纤维素颜色变深,且得率大幅降低,所以综合考虑为A3B2C3为最优组合即:HCl体积分数为8%,酸解温度为60 ℃,酸解时间为80 min。在此优化工艺条件下,柚皮微晶纤维素的聚合度为211。

表2 正交试验因素、水平及结果

表3 聚合度(DP)的方差分析
2.3结构特性分析
2.3.1红外光谱(FTIR)
柚皮纤维素及柚皮微晶纤维素的红外光谱图如图4所示。具体而言,柚皮纤维素在3 423.201 9 cm-1处的强宽峰为—OH伸缩振动,是所有纤维素具有的特征谱带[16],酸解作用使柚皮微晶纤维素的—OH伸缩振动蓝移至3 425.130 4 cm-1,说明—OH连接变弱[17]。柚皮纤维素在2 917.918 0 cm-1处吸收峰代表—CH2—的C—H对称伸缩振动峰,该吸收峰在柚皮微晶纤维素蓝移至2 921.775 1 cm-1。柚皮纤维素在1 631.565 5 cm-1的吸收峰是纤维素与水分子之间的水分子弯曲振动[18],1 594.922 8 cm-1处的吸收尖峰为苯环骨架伸缩振动,表明有木质素存在,柚皮微晶纤维素在1 596.851 3 cm-1附近的吸收峰减弱,说明木质素被部分去除,但仍有少量残留。柚皮纤维素在1 419.423 4 cm-1处为—CH2弯曲振动。898.711 0 cm-1的红外光谱带是β-D-葡萄糖基的特征光谱[19]。从图4中可以看出柚皮纤维素和柚皮微晶纤维素的红外光谱图的峰值基本相似,说明柚皮纤维素和柚皮微晶纤维素具有相同的化学结构,酸水解只是降解纤维素,而没有发生其他化学反应。

图4 柚皮纤维素和柚皮微晶纤维素的红外光谱图Fig.4 FTIR spectra of cellulose and microcrystalline cellulose form pomelo peel
2.3.2X-衍射(XRD)
为进一步确定柚皮微晶纤维素结构和晶型,对其进行了XRD分析,结果如图5所示,柚皮纤维素在衍射角2θ为14.96°、22.86°和34.97°有3个衍射峰,其中2θ=14.96°处的弱峰代表纤维素无定形区,22.86°代表结晶区强度的002面衍射峰,34.97°的衍射峰对应040晶面,根据文献[20]这种结晶类型属于纤维素I型,与FTIR结果一致。经酸解作用后,柚皮微晶纤维素在2θ为14.90°、22.84°和34.87°处出现3个衍射峰,与纤维素基本一致。其中2θ=14.90°和22.84°处的衍射峰强度增强,峰形基本一致,表明纤维素结构未发生改变。利用Segal公式X=[I002-Iam)/I002]×100,求得柚皮纤维素和柚皮微晶纤维素的相对结晶度分别为60.66%和71.26%,说明纤维素中无定形区被溶出后结晶度大幅升高。在柚皮微晶纤维素制备过程中,H+首先进攻无定形区,催化糖苷键断裂使纤维素分子发生降解,无定形区破坏以后,形成结晶结构较为完整的微晶纤维素,由于结晶区暴露在外,因而导致吸收强度增大,结晶度升高,对应于002面衍射峰强度增强[21]。


图5 柚皮纤维素(a)和柚皮微晶纤维素(b)的XRD 图谱Fig.5 XRD patterns of cellulose and microcrystalline cellulose form pomelo peel
2.3.3扫描电镜(SEM)
图6为柚皮纤维素及柚皮微晶纤维素的扫描电镜图。图6-a为柚皮纤维素300倍和1 500倍的结构表征,图6-b为柚皮微晶纤维素300倍和1 500倍的结构表征。从图6中可以看出,柚皮纤维素呈长杆状,表面结构光滑,HCl水解作用后,纤维素长链遭到破坏,无定型区被水解,链长变短,表面结构变得粗糙、疏松,增加了纤维素的比表面积,从而达到微晶纤维素许多物化性能的提高。

图6 柚皮纤维素和柚皮微晶纤维素的扫描电镜图Fig.6 SEM comparison of cellulose and microcrystalline cellulose form pomelo peel
3 结论
在单因素的试验基础上,通过正交试验优化,得到柚皮微晶纤维素制备的最佳工艺条件:HCl体积分数为8%、酸解温度为60 ℃、酸解时间为80 min,在此条件下,柚皮微晶纤维素的聚合度为211。红外光谱分析表明,柚皮微晶纤维素结构与柚皮纤维素结构一致,酸水解只是降解纤维素,没有发生其他化学反应;X衍射分析表明,柚皮微晶纤维素为纤维素I型结构,相对结晶度为71.26%;扫描电镜分析柚皮微晶纤维素为表面粗糙的长杆状结构。
[1]CHUAYJULJIT S, SU-UTHAI S, CHARUCHINDA S. Poly(vinyl chloride) film filled with microcrystalline cellulose prepared from cotton fabric waste: properties and biodegradability study[J]. Waste Management & Research the Journal of the International Solid Wastes & Public Cleansing AssociationIswa, 2010, 28(2): 109-117.
[2]EL-SAKHAWY M, HASSAN M L.Physical and mechanical properties of microcrystalline cellulose prepared from agricultural residues[J]. Carbohydrate Polymers, 2007, 67(1): 1-10.
[3]EJIKEME P M.Investigation of the physicochemical properties of microcrystalline cellulose from agricultural wastes I: orange mesocarp[J]. Cellulose, 2008, 15(1): 141-147.
[4]张丽君, 李爱军, 蒋文明, 等. 酸解法制备大豆皮微晶纤维素的研究[J]. 食品工业科技, 2011 (8): 298-300.
[5]闫广平, 李克贤, 黄科林, 等. 近临界水中蔗渣微晶纤维素的制备[J]. 安徽农业科学, 2012, 40(17): 9 470-9 472.
[6]AGBLEVOR F A, IBRAHIM M M, EL-ZAWAWY W K. Coupled acid and enzyme mediated production of microcrystalline cellulose from corn cob and cotton gin waste[J]. Cellulose, 2007, 14(3): 247-256.
[7]刘恩岐, 张建萍, 唐仕荣, 等. 酶法制备大豆皮微晶纤维素及其理化特性[J]. 食品科学, 2012, 33(24): 122-126.
[8]卫娜, 马莹. 大孔树脂对柚子内果皮柚皮苷的分离纯化[J]. 现代食品科技, 2010, 26(10): 1 096-1 099.
[9]张怡. 福建特产柚子加工及综合利用技术的研究[D]. 福州: 福建农林大学, 2009.
[10]曾小峰, 白小鸣, 盖智星, 等. 响应面试验优化超声辅助提取柚皮纤维素工艺[J]. 食品科学, 2015, 36(14): 34-38.
[11]刘欢, 王新伟, 魏静, 等. 胡萝卜渣微晶纤维素的制备[J]. 食品与发酵工业, 2011, 37(4): 135-138.
[12]KLEMM D, HEUBLEIN B, FINK H P, et al.Cellulose: fascinating biopolymer and sustainable raw material[J]. Angewandte Chemie International Edition, 2005, 44(36): 3 358-3 393.
[13]任海伟, 李金平, 张轶, 等. 白酒丢糟制备微晶纤维素工艺优化及结构特性[J]. 现代食品科技, 2013, 29(10): 2461-2468.
[14]黄明星. 沙柳制备微晶纤维素的工艺研究[D]. 郑州: 郑州大学, 2014.
[15]何晨雨, 顾正彪, 程力, 等. 马铃薯渣制备微晶纤维素的工艺研究[J]. 食品工业科技, 2015, 36(8): 230-234.
[16]刘羽, 邵国强, 许炯. 竹纤维与其它天然纤维素纤维的红外光谱分析与比较[J]. 竹子研究汇刊, 2010, 29(3): 42-46.
[17]AZUBUIKE C P, OKHAMAFE A O.Physicochemical, spectroscopic and thermal properties of microcrystalline cellulose derived from corn cobs[J]. International Journal of Recycling of Organic Waste in Agriculture, 2012, 1(1): 1-7.
[18]JOHAR N, AHMAD I, DUFRESNE A.Extraction, preparation and characterization of cellulose fibres and nanocrystals from rice husk[J]. Industrial Crops & Products, 2012, 37(1): 93-99.
[19]DAS K, RAY D, BANDYOPADHYAY N, et al. Study of the properties of microcrystalline cellulose particles from different renewable resources by XRD, FTIR, Nanoindentation,TGA and SEM[J]. Journal of Polymers and the Environment, 2010, 18(3): 355-363.
[20]宋佳臻, 戚大伟, 刘继云, 等. 微波-超声波辅助水解稻草制备微晶纤维素[J]. 安徽农学通报, 2014(5): 10-12.
[21]JAHAN M S, SAEED A, HE Z, et al.Jute as raw material for the preparation of microcrystalline cellulose[J]. Cellulose, 2011, 18(2): 451-459.
Preparation and structural properties of microcrystalline cellulose from pomelo peel
ZENG Xiao-feng,PENG Xue-jiao,TAN An-qun,WANG Hua*
(Citrus Research Institute, Chinese Academy of Agricultural Sciences, Chongqing 400712, China)
In this paper, the hydrochloric acid hydrolysis method has been used to prepare microcrystalline cellulose, and through the single factor experiments, the influence of hydrochloric acid concentration, acid solution time, and acid solution temperature to the preparation of microcrystalline cellulose from pomelo peel have been investigated respectively. On this basis, the preparation process conditions have been optimized by orthogonal experiments and the optimum conditions are: the hydrochloric acid concentration was 8%, acidolysis temperature was 60 ℃, acidolysis time was 80 min. Moreover, the crystal structure and micromorphology of microcrystalline cellulose from pomelo peel have been characterized by the FTIR, XRD and SEM. The results indicated that the microcrystalline cellulose were cellulose I structure, its relative crystallinity was 71.26 %, and the surface morphology was rough long strip.
pomelo peel;microcrystalline cellulose;polymerization degree;structural property
10.13995/j.cnki.11-1802/ts.201609017
硕士研究生(王华研究员为通讯作者,E-mail:wanghua40@126.com)。
公益性行业(农业)专项资金-园艺作物产品加工副产物综合利用(201503142-12)
2015-12-10,改回日期:2016-03-01
