天然提取物对γ-氨基丁酸转运体功能的作用筛选
2016-10-13胡静张劲松樊华
胡静,张劲松,樊华
1(江南大学 无锡医学院,江苏 无锡,214122)2(国家食用菌工程技术研究中心,国家食用菌加工技术研发分中心,上海市农业科学院食用菌研究所,上海,201403)3(柏林自由大学夏洛特医学院,德国 柏林,13353)
天然提取物对γ-氨基丁酸转运体功能的作用筛选
胡静1*,张劲松2,樊华3
1(江南大学 无锡医学院,江苏 无锡,214122)2(国家食用菌工程技术研究中心,国家食用菌加工技术研发分中心,上海市农业科学院食用菌研究所,上海,201403)3(柏林自由大学夏洛特医学院,德国 柏林,13353)
γ-氨基丁酸(γ-aminobutyric acid, GABA)是哺乳动物中枢神经系统中主要的抑制性神经递质。GABA转运蛋白(GABA transporters, GATs)通过摄取释放的GABA有效控制其在突触间隙的浓度,从而成为控制GABA能的信号传导的关键因素。大量研究表明:灵芝、虎杖等传统中草药的提取成分具有抗肿瘤、免疫调节、保护心血管系统等药理作用。该研究以稳定表达GABA转运蛋白(GAT1)的CHO细胞为模型,利用GABA摄取的定量分析测试来初步研究灵芝粗提物和虎杖主要有效成分白藜芦醇对GABA转运体功能的影响。白藜芦醇通过典型的非竞争性抑制的方式影响GAT1蛋白摄取GABA的功能。
γ-氨基丁酸;GABA转运蛋白;灵芝;白藜芦醇
γ-氨基丁酸(γ-aminobutyric acid, GABA)是广泛分布于哺乳动物中枢神经系统的主要的抑制性神经递质[1-3]。当GABA神经元兴奋时,GABA被神经末梢释放到突触间隙。终止递质的作用主要依赖突触前神经元细胞和胶质细胞摄取GABA。研究证明,许多中枢神经系统疾病如癫痫、抑郁、阿尔兹海默症等与GABA介导的抑制性突触传递作用的降低有密切关系[4-6]。GABA转运蛋白(GABA transporters, GATs)位于突触前膜或胶质细胞膜上,是一种依赖于Na+/Cl-调节GABA跨膜运输的重要糖蛋白分子[7]。通过摄取已释放的GABA,GATs能有效控制GABA在突触间隙的浓度,从而调控GABA能的信号传导。GATs共有4种亚型(GAT1-4)[8],其中GAT1是分布最广、研究最主要的一种[9-10]。对转运体蛋白功能的调节可能作为治疗中枢神经系统疾病的切入口。
传统中药中如灵芝、虎杖等作为中医药宝库中的珍品,在我国已有悠久的应用历史。研究表明,灵芝、虎杖的提取成分具有抗肿瘤、免疫调节、保护心血管系统等作用[11-12],而近年也有一些其对神经系统的作用的报道,包括对帕金森症、癫痫等疾病治疗的作用[13-16]。本文以已转染了GABA转运蛋白(GAT1)的CHO细胞(中国仓鼠卵巢细胞)为模型,利用3H同位素标记的GABA摄取定量分析测试来初步研究了灵芝提取物(LZ acid, LZ-2, LZ-3)和虎杖有效成分白藜芦醇对CHO细胞摄取抑制性神经递质GABA的影响,即对GABA转运体功能的影响作用。
1 材料与方法
1.1材料与试剂
灵芝粗提物(LZ-2, LZ-3和LZ acid),上海市农业科学院食用菌所深加工技术和发酵工程研究室提供;DEME培养基,德国Biochrom公司;胎牛血清,德国Perbio公司;G418硫酸盐,PAA公司;L-谷氨酰胺、丙酮酸钠、细胞培养用青霉素-链霉素,均购于德国PAN Biotech公司;转染试剂Superfect,购于Qiagen公司;[3H] GABA,[14C] sucrose,均购于Perkin Elmer公司;白藜芦醇,购于美国Merck公司;Anti-GAT1抗体,购于德国Alpha Diagnostic公司;HRP anti-rabbit(IgG),购于DakoCytomation公司;Western blot显色体系AEC及缓冲液,购于Calbiochem公司;Anti-GFP Ig抗体、超纯水为实验室自制。
1.2仪器
液体闪烁计数器(Liquid Scintillation Counter Tri-Carb 1900 CA),购于美国Packard公司;Axioobserver荧光显微镜,购于Carl Zeiss公司;HERAsafe生物安全柜,购于德国Thermo Scientific公司;超纯水器Milli-Q,购于Millipore公司。
1.3细胞系和培养条件
中国仓鼠卵巢细胞(CHO)来自ATCC。未转染细胞用含10% 灭活胎牛血清、1 mmol/L 丙酮酸钠、2 mmol/LL-谷氨酰胺、50 000U青霉素-链霉素(细胞培养用)的DMEM培养基;稳定表达GAT1的CHO细胞用含400 mg/L G418的生长培养基,均在37 ℃,5 %CO2及饱和湿度条件下培养。每3~4 d传代1次。
1.4实验方法
1.4.1建立GAT1稳定表达CHO细胞系
取CHO细胞,以每孔2 ×105个细胞的密度接种于6孔板,并培养过夜使其密度达到40%~50%,根据转染试剂Superfect用户指南转染5~10 μg 本实验组已构建好的pEGFP-N1-GAT1 DNA。方法大致如下:细胞经洗涤后,加入转染复合物并在室温下保持10 min。加入无血清培养基,将细胞在37 ℃,5 %CO2及饱和湿度条件下培养5 h后,再更换生长培养基,继续培养48 h。之后,细胞在含600 mg/L G418的选择性培养基中生长1~3周。继续进行单克隆筛选,细胞被稀释到10~30个细胞/mL并以每孔100μL接种于96孔板。仅含单细胞的孔被标记并通过荧光显微镜观察。待筛选到GAT1稳定表达的CHO细胞克隆后,用含400 mg/L G418的选择性培养基培养。
1.4.2免疫沉淀和Western Blot
约收集107个CHO细胞,用PBS缓冲液洗1~2次,然后加入含有1% n-dodecyl-β-D-maltoside的TBS缓冲液溶解,在4 ℃来回振荡至少4 h。溶解液离心18 000 g,4 ℃,1 h。上清液与结合有anti-GFP (IgG)单抗的protein-G-Sepharose在4 ℃孵育12 h。经过彻底洗涤,免疫沉淀在SDS样品缓冲液中加热至95 ℃,3 min。上清液可用于SDS/PAGE电泳,再通过Western blot将分离的蛋白转移硝化纤维素膜上。分别用anti-GAT1多抗和anti-GFP多抗抗体进行免疫染色,再与HRP anti-rabbit (IgG)孵育,最后用AEC体系显色。
1.4.3GABA摄取定量分析测试
[3H] GABA摄取定量分析测试依据文献报道[17-18],方法大致如下:以每孔5 ×104个细胞的密度将细胞接种于96孔板中,使细胞贴壁3~4 h。用洗液(128 mol/L NaCl, 5.2 mol/L KCl, 2.1 mol/L CaCl2, 2.9 mol/L MgSO4, 5 mol/L dextrose和10 mol/L Hepes, pH 7.4)洗细胞3次,然后在空白对照组加入200 μL反应液(含3.7×104Bq [3H] GABA, 10 μmol/L GABA,3.7×104Bq [14C] sucrose以及100 μmol/L sucrose的洗液),实验组所测样品LZ-2、LZ-3、LZ acid以及白藜芦醇均按照文中所标注浓度加入反应液,每组设3复孔,在室温下保持15min。唾液酸酶经报道可抑制GAT1蛋白的活性[13],此处作为抑制剂对照。摄取过程的终止通过用冰浴的洗液洗细胞3次,然后将细胞用100 μL5 g/L的SDS溶液4 ℃裂解。裂解液用于测定细胞内[3H] GABA、[14C] sucrose含量以及总蛋白量。GABA摄取活性单位为pmol/(μg蛋白·min)。
1.4.4数据分析
所有实验平行3次以上,结果以(平均值±标准偏差)表示,差异显著性采用student’s t检测分析。
2 结果与分析
2.1GAT1稳定表达CHO细胞系的建立及鉴定
转染pEGFP-N1-GAT1 cDNA后,GAT1稳定表达的CHO细胞通过单克隆技术筛选获得并可用荧光显微镜观察到该细胞膜带有绿色荧光,如图1A所示。GAT1蛋白的表达进一步通过免疫沉淀和Western blot进行鉴定,如图1B和1C所示,CHO细胞表达的GAT1/GFP重组蛋白经SDS-PAGE电泳后,呈现2个主要条带,且均可被anti-GFP和anti-GAT1的抗体所识别:在110 kDa位置有一个主要条带,应为带有成熟的N-糖链的肽链;在90 kDa位置的条带主要为仅含有寡甘露糖链的肽链。

A. GAT1稳定表达CHO细胞荧光照片;B.免疫沉淀样品Western blot结果,用anti-GFP抗体作为一抗检测;C.免疫沉淀样品Western blot结果,用anti-GAT1抗体作为一抗检测1-CHO细胞;2-GAT1稳定表达CHO细胞图1 GAT1在CHO细胞中稳定表达的鉴定Fig.1 The stable expression of GAT1 in CHO cells
稳定表达的GAT1蛋白功能通过进一步的[3H] GABA摄取定量分析测试测定,其结果如图2所示。与CHO对照细胞相比,CHO稳转细胞表现了很强的GABA摄取活性(0.24 pmol[3H] GABA /104cells)。因此,GAT1/GFP重组蛋白的表达具备功能性,可用于进一步的研究。

图2 稳转GAT1/GFP蛋白CHO细胞的功能测定Fig.2 Functional determination of GFP-tagged GAT1 in CHO cells by GABA uptake assay
2.2灵芝粗提物和白藜芦醇对GAT1摄取GABA功能的影响
LZ acid, LZ-2和LZ-3都是灵芝子实体的粗提物,LZ acid的主要成分为三萜类化合物,LZ-2和LZ-3则是多糖和蛋白质的混合物,白藜芦醇是虎杖中提取的有效成分之一,它们对淋巴细胞增殖或诱导肿瘤细胞凋亡都有一定的作用,因此在本研究中选取相应不影响细胞生长的最高浓度检测其对于GAT1蛋白功能的影响,初步结果如图3所示。
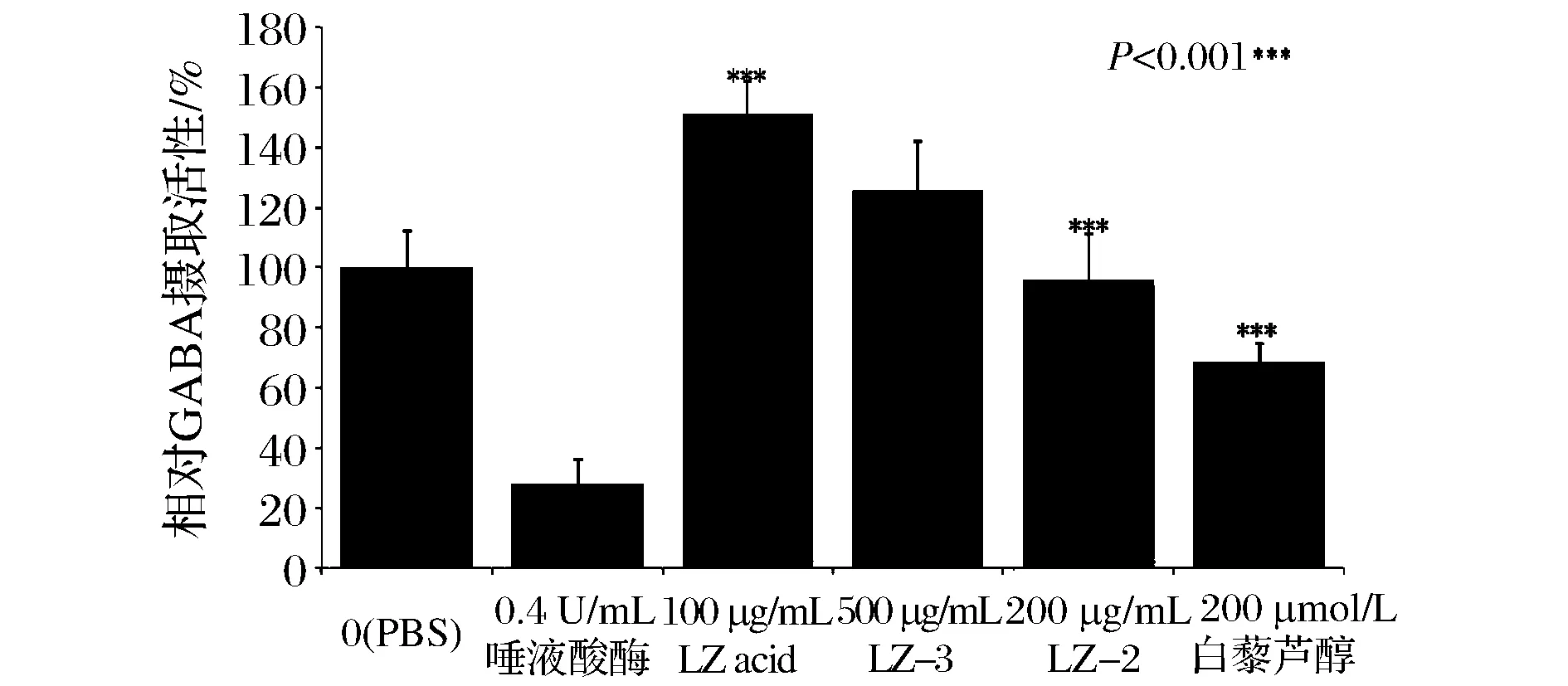
图3 灵芝粗提物和白藜芦醇对GAT1蛋白的GABA摄取功能的作用Fig.3 Effect of G. Lucidum fractions and resveratrol on GABA uptake of GAT1
以空白对照组的测定值为100%,0.2 U/ml唾液酸酶可将GAT1蛋白活性抑制到28%。LZ acid、LZ-3和白藜芦醇对于GAT1蛋白摄取GABA的功能均有不同程度的影响作用,而LZ-2对GAT1蛋白功能没有明显作用。其中LZ acid(100 μg/mL)可使GAT1蛋白的摄取功能提高约50%,LZ-3(200 μg/mL)也可将该功能提高至126%;而白藜芦醇(40 μmol/L)则可抑制该活性至69%。提高GABA能有抗癫痫、抗焦虑和抗疼痛等效果,而阻断神经突触间隙内GABA的回收是有效手段之一,同时该途径不影响GABA的正常生理释放,因此白藜芦醇对GAT1蛋白的摄取功能的抑制作用具有潜在的药用价值。而LZ acid和LZ-2均为复合物,它们对GAT1蛋白功能的促进作用应为一种协同作用,但其作用成分和机制尚不明确,对其中的作用成份的进一步明确有可能排除其可能对中枢神经系统引起的不良反应。
白藜芦醇对GAT1蛋白摄取GABA的功能的抑制作用通过加入不同浓度的白藜芦醇被进一步测定,如图4所示。

图4 不同浓度白藜芦醇对GAT1蛋白的GABA摄取功能的抑制作用Fig.4 Inhibition of GABA uptake of GAT1 protein by resveratrol with different concentrations
白藜芦醇以剂量依赖性方式影响和抑制稳定表达GAT1的CHO细胞对GABA的相对摄取速率。以空白对照组的相对GABA摄取速率为100%,在0.05、0.1、0.5、1和1.2 mol/L白藜芦醇存在下,相对GABA摄取速率分别被抑制到61%、54%、38%、20%和18%。白藜芦醇的IC50约为100 mol/L。
2.3白藜芦醇对GAT1蛋白功能抑制作用的动力学研究
GABA摄取过程中的动力学参数在空白对照组和100 mol/L白藜芦醇存在下进行测定,其中GABA浓度分别采用200、50、20、10、8、6、4和2 mol/L,结果如图5所示,动力学常数通过双倒数作图法,根据Michaelis-Menten方程计算得到。该结果显示,对照组的KmGABA为4.6 μmol/L,VmaxGABA为1.23 pmol/(μg蛋白·min);而100 mol/L白藜芦醇存在下KmGABA为4.8 μmol/L,VmaxGABA则降低至0.66 pmol/(μg蛋白·min)。因此白藜芦醇的作用仅降低VmaxGABA,但几乎不影响KmGABA,表明白藜芦醇是通过非竞争性抑制的方式来影响GAT1蛋白的GABA摄取作用的。
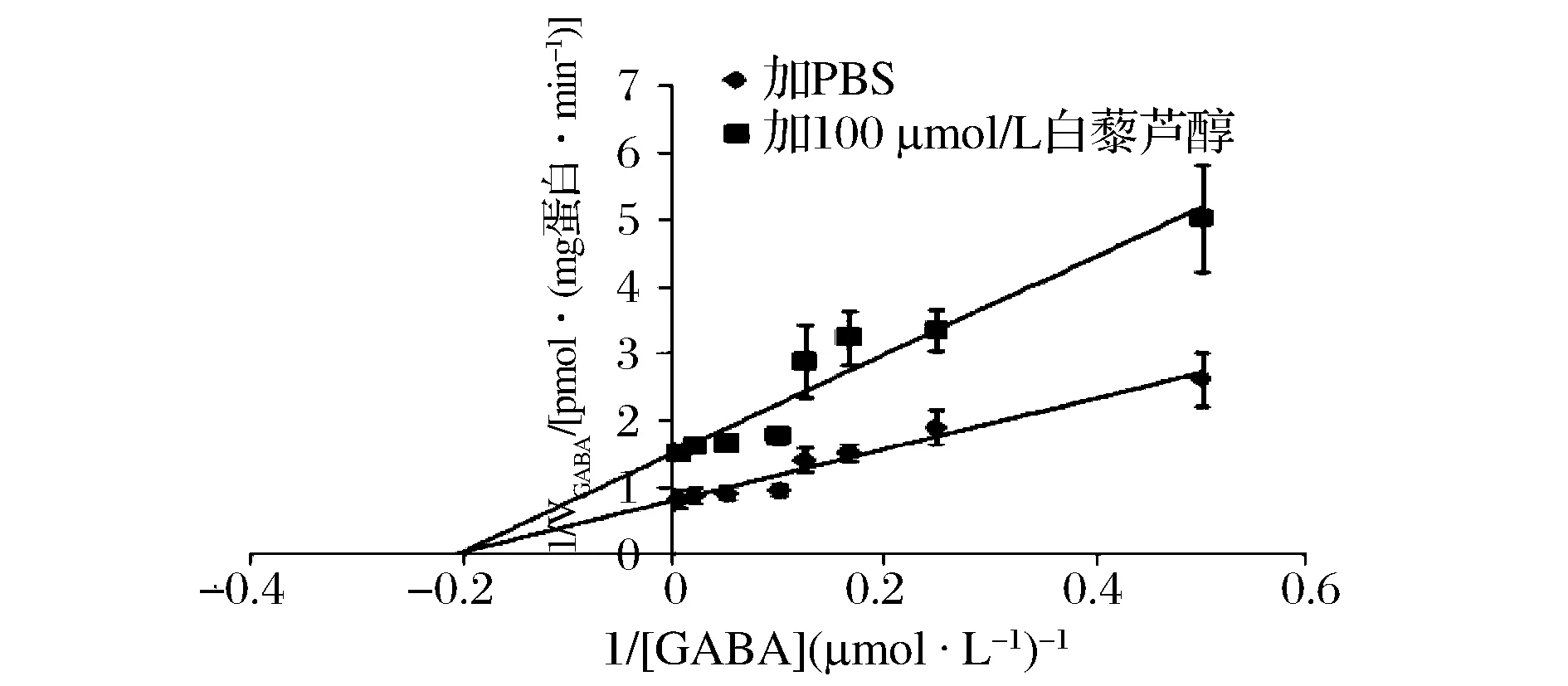
图5 白藜芦醇影响GAT1蛋白的GABA摄取功能的动力学研究Fig.5 Kinetic study of effect of resveratrol on GABA uptake of GAT1/GFP protein
3 结论
抑制性神经递质GABA以及GABA能中间神经元在神经网络活动中的作用一直是神经科学领域的一个热点。GATs是一种神经递质转运体和存在于膜上的重要的糖蛋白。有研究表明,GATs对GABA的摄取作用是突触间隙中降低GABA浓度的唯一途径。本研究揭示了灵芝粗提物LZ-3、LZ acid和白藜芦醇对GAT1活性都有影响作用。其中灵芝粗提物LZ-3和LZ acid主要增强GAT1蛋白功能。白藜芦醇主要通过典型的非竞争性抑制的方式影响GAT1蛋白功能,从而在一定程度上可以抑制细胞对GABA的摄取,这提示白藜芦醇对神经系统有一定的药用价值。
[1]HU Jia, OUICK M W. Substrate-mediated regulation of γ-aminobutyric acid transporter 1 in rat brain [J]. Neuropharmacology, 2008,54(2):309-318.
[2]CHIU C S,BRICKLEY S G, JENSEN K, et al. GABA transporter deficiency causes tremor, ataxia, nervousness, and increased GABA-induced tonic conductance in cerebellum [J]. The Journal of Neuroscience, 2005,25(12):3 234-3 245.
[3]BOWERY N G, SMART T G. GABA and glycine as neurotransmitters: a brief history [J]. British Journal of Pharmacology, 2006,147(S1):S109-S119.
[4]COPE D W, DI GIOVANNI G, FYSON S J, et al. Enhanced tonic GABAA inhibition in typical absence epilepsy [J]. Nature Medicine, 2009,15(12):1 392-1 398.
[5]MADSEN K K, HANSEN G H, DANIELSEN E M, et al. The subcellular localization of GABA transporters and its implication for seizure management [J]. Neurochemical Research. 2015,40(2):410-419.
[6]GARCIA-ALLOZA M, TSANG S W, GIL-BEA F J, et al. Involvement of the GABAergic system in depressive symptoms of Alzheimer's disease [J]. Neurobiology of Aging, 2006,27(8): 1 110-1 117.
[7]RADIAN R, KANNER B I. Stoichiometry of sodium- and chloride-coupledγ-aminobutyric acid transport by synaptic plasma membrane vesicles isolated from rat brain [J]. Biochemistry, 1983,22(5):1 236-1 241.
[8]LIU Q R, LOPEZ-CORCUERA B, MANDIYAN S, et al. Molecular characterization of four pharmacologically distinctgamma-aminobutyric acid transporters in mouse brain [corrected][J]. Journal of Biological Chemistry, 1993,268(3):2 106-2 112.
[9]GUASTELLA J, NELSON N, NELSON H, et al. Cloning and expression of a rat brain GABA transporter [J]. Science, 1990,249(4974):1 303-1 306.
[10]GROSSMAN T R, NELSON N. Effect of sodium lithium and proton concentrations on the electrophysiological properties of the four mouse GABA transporters expressed in Xenopus oocytes [J]. Neurochemistry International, 2003,43(4-5):431-443.
[11]叶鹏飞,张美萍,王康宇,等. 灵芝主要成分及其药理作用的研究进展综述[J]. 食药用菌,2013,21 (3) : 158-161.
[12]樊慧婷,丁世兰,林洪生. 中药虎杖的药理研究进展[J]. 中国中药杂志,2013,38 (15):2 545-2 548.
[13]ZHANG Rui-ping, XU Sheng-li, CAI Yan-ning, et al.Ganodermalucidumprotects dopaminergic neuron degeneration through inhibition of microglial activation[J]. Evidence-Based Complementary and Alternative Medicine[EB/OL]. 2011:156810. doi: 10.1093/ecam/nep075. Epub 2011 Jun 18.
[14]王芳芳,王淑秋,邵帅,等. 戊四氮致痫大鼠脑神经型钙黏附素和神经营养因子-4 表达的变化及灵芝孢子粉的干预作用[J]. 中国病理生理杂志,2011,27 (5):1 003-1 007.
[15]刘雪玲,李开飞,陈晓瑜,等. 苯妥英钠与灵芝孢子粉联合用药治疗癫痫大鼠的实验研究[J].临床医学工程,2014,21(4):428-430.
[16]曹方瑞,肖冰心,冯利,等. 灵芝中枢神经系统活性及其作用机制研究进展[J]. 中药材, 2015,38(5):1 092-1 095.
[17]CAI Guo-qiang, SALONIKIDIS P S, FEI Jian, et al. The role of N-glycosylation in the stability, trafficking and GABA-uptake of GABA-transporter 1. terminal N-glycans facilitate efficient GABA-uptake activity of the GABA transporter [J]. FEBS Journal, 2005,272(7):1 625-1 638.
[18]HU Jing, FEI Jian, REUTTER W, et al. Involvement of sialic acid in the regulation of γ-aminobutyric acid uptake activity of γ-aminobutyric acid transporter 1 [J]. Glycobiology, 2011,21(3):329-339.
The screening of natural extracts effects on the activity of γ-aminobutyric acid transporters (GATs)
HU Jing1*, ZHANG Jin-song2,FAN Hua3
1(Wuxi Medical School,Jiangnan University, Wuxi 214122, China)2(National R&D CenterforEdible Fungi Processing, National Engineering Research Center of Edible Fungi,Institute of Edible Fungi, Shanghai Academy of Agricultural Sciences, Shanghai 201403, China)3(Free University of Berlin,Charité Medical University of Berlin, Berlin 13353,Germany)
GABA (γ-aminobutyric acid) is the major inhibitory neurotransmitter in the central nervous system (CNS). GABA transporters (GATs) are key elements in the termination of the synaptic actions of GABA by re-uptake GABA, which is one important mechanism in the regulation of GABA concentration in the synaptic cleft. Various studies have showed that extracts from the traditional Chinese medicines such asGanodermalucidumandPolygonumcuspidatumhave certain improved effect on anti-tumor activity, regulation of immune system andcardiovascular systems. In this study, the effect on GABA uptake activity of GAT1 of crude extracts fromGanodermalucidumand resveratrol by the effective component ofPolygonumcuspidatumwere tested in CHO/GAT1 cells by GABA uptake assay. Resveratrol was found as a typical non-competitive inhibition on GABA uptake of GAT1.
γ-aminobutyric acid (GABA); GABA transporters (GATs);Ganodermalucidum; resveratrol
10.13995/j.cnki.11-1802/ts.201609015
博士,副教授(本文通讯作者,E-mail:hujing@jiangnan.edu.cn)。
江苏省自然科学基金(BK20150140)
2015-07-28,改回日期:2016-04-12
