鸢乌贼和杜氏枪乌贼蛋白分离及其性质初探
2016-10-13邱月曾少葵章超桦郝记明张静
邱月,曾少葵,章超桦,郝记明,张静
(广东海洋大学 食品科技学院,广东省水产品加工与安全重点实验室,广东普通高等学校水产品深加工重点实验室,南海生物资源开发与利用协同创新中心,广东 湛江,524088)
鸢乌贼和杜氏枪乌贼蛋白分离及其性质初探
邱月,曾少葵,章超桦*,郝记明,张静
(广东海洋大学 食品科技学院,广东省水产品加工与安全重点实验室,广东普通高等学校水产品深加工重点实验室,南海生物资源开发与利用协同创新中心,广东 湛江,524088)
以鸢乌贼(Symplectoteuthisoualaniensis)和杜氏枪乌贼(Loligoduvauceli)头足、胴体为原料,分离各蛋白组分,并对其性质进行研究。结果表明:鸢乌贼头足水溶性蛋白(WSP)、盐溶性蛋白(SSP)和不溶性蛋白(ISP)分别占总蛋白的19.01%、52.21%和13.23%,胴体中的分别为10.83%、58.68%和10.03%;杜氏枪乌贼头足三者的比例分别为37.62%、31.79%和18.08%,胴体中的分别为24.30%、54.23%和7.65%。2种乌贼头足、胴体均是WSP和SSP必需氨基酸占氨基酸总量的40%左右。SDS-PAGE电泳分析显示,鸢乌贼头足和胴体中SSP的肌球蛋白重链(MHC)的分子质量大于200 kDa、副肌球蛋白(PM)的在100 kDa左右、肌动蛋白(Actin)接近44 kDa;杜氏枪乌贼头足和胴体中SSP的MHC、PM、Actin蛋白条带颜色较浅,说明其蛋白含量较低。差示扫描量热法(DSC)结果表明,鸢乌贼头足WSP、SSP和ISP的变性温度分别为64.02 ℃、58.04 ℃和68.91 ℃;胴体中的分别为81.93 ℃、62.18 ℃和68.54 ℃;杜氏枪乌贼头足各蛋白组分的变性温度分别为81.36、83.24和78.18 ℃;胴体的分别为80.29、76.25和68.02 ℃,杜氏枪乌贼各蛋白组分的变性温度较鸢乌贼的高。鸢乌贼头足、胴体和杜氏枪乌贼头足WSP在pH 3溶解度最低,杜氏枪乌贼胴体的在pH 5最低,pH对SSP溶解度影响较大;在不同离子强度的溶液中,鸢乌贼头足SSP溶解性最好。
鸢乌贼;杜氏枪乌贼;蛋白分离;SDS-PAGE;DSC;溶解度
鸢乌贼(Symplectoteuthisoualaniensis)在中国南海和印度洋西北部海域的数量较大[1],我国南海年可捕捞量为130~200 万t[2]。但其表皮易发红,肉质较硬,氨味重,不合大众口味,其资源并未得到充分利用。杜氏枪乌贼(Loligoduvauceli)主要分布在南海,其色白,味道鲜美,是一种畅销的水产品。研究表明鸢乌贼和杜氏枪乌贼都是高蛋白、低脂肪的水产品,是良好的蛋白资源[3-4]。ISABEL等[5]探讨了从秘鲁鱿鱼肌肉中提取功能性蛋白浓缩物的方法;JUAN等[6]用酸溶解法和等电点沉淀法从秘鲁鱿鱼中提取蛋白,并对其相关理化指标进行测定;GUILLERMINA等[7]研究了冻藏对秘鲁鱿鱼肌肉蛋白变性及凝胶特性的影响;杨芳等[8]对阿根廷鱿鱼肌原纤维蛋白凝胶的保水性进行了研究;TATSUYA等[9]对鸢乌贼发光蛋白进行了提取及分析。对鱿鱼肌肉蛋白的提取方法、保水性、凝胶特性等进行了研究,但关于形成凝胶相关蛋白的特性的研究鲜有报道,因此本文对这2种乌贼的蛋白组成、分子质量分布、变性温度及溶解性进行了研究。
1 材料和方法
1.1材料
鸢乌贼(100~500 g/条),由广东海洋大学水产学院于2014年4月捕捞于南海,立即冻结后运回实验室,杜氏枪乌贼在湛江东风市场购买。挑选100~140 g/条的鸢乌贼和35~45 g/条的杜氏枪乌贼,去除外表皮、内脏、骨、眼、口球后,分为头足、胴体两部分,置于-20 ℃备用,冻藏时间不超过1个月。
1.2蛋白组分分离
参照SAITO[10]等方法的基础上稍作修改。将原料搅碎,取一定量的肉加入10倍的磷酸缓冲液(15.6 mmol/L Na2HPO4, 3.5 mmol/L NaH2PO4,pH 7.5)提取90 min,离心后沉淀S重复1次上述操作,合并2次的上清液加入1/2体积的质量分数15%的三氯乙酸,离心得到上清液为非蛋白氮溶液,沉淀即为水溶性蛋白(WSP)。沉淀S加入4倍的磷酸缓冲液(0.6 mol/L NaCl, 15.6 mmol/L Na2HPO4, 3.5 mmol/L NaH2PO4,pH 7.5),于4 ℃抽提18 h后离心,重复上述操作1次,合并2次上清液,脱盐即得到盐溶性蛋白(SSP)。分离后的沉淀用水漂洗离心得到不溶性蛋白(ISP)。将3种蛋白冷冻干燥后得到WSP、SSP和ISP,其蛋白含量用微量凯氏定氮法测定[11],其比例公式如下:
P/%=A/B×100
(1)
式中:P为蛋白含量比例,A为蛋白组分的含氮量,B为原料的含氮量。
1.3氨基酸组成分析
取WSP、SSP和ISP样品经6mol/L HCl水解后,用氨基酸自动分析仪(S-433D 德国sykam公司)测定16种氨基酸[12];另取样用6 mol/L NaOH水解后同机测定色氨酸[13]。
1.4SDS-PAGE电泳分析
将蛋白浓度约为2 mg/mL的水溶性、盐溶性和不溶性蛋白溶液(5%SDS溶解)用上样缓冲液处理。SDS-聚丙烯酰胺凝胶电泳条件:分离胶12%,浓缩胶5%,浓缩胶和分离胶的电压分别为65 V和120 V。考马斯亮蓝R-250染色1 h,脱色液(冰醋酸∶乙醇∶蒸馏水体积比=1∶1∶8) 脱色直至凝胶板蛋白质染色条带清晰为止,Gel Doc XR+凝胶成像系统拍照。
1.5热稳定性分析
差示扫描量热法(DSC):取5 mg左右的蛋白粉末置于铝坩埚中,用封压机密封,使试样与铝盒紧密接触,用差示扫描量热仪(TA Q2000 美国沃特斯公司)进行分析,检测条件为N2流速50 mL/min,升温速率0.5 ℃/min,温度扫描范围10~100 ℃,同时以空铝坩埚作为空白对照。
1.6溶解度的测定
取一定量的WSP和SSP,分别加入不同pH值的0.01 mol/L磷酸盐缓冲液和不同离子强度的磷酸盐缓冲液(0.01 mol/L,pH 7.0),使蛋白浓度为1 mg/mL,样品间或搅拌30 min,4 ℃冷冻离心,上清液用福林酚法测蛋白含量,总蛋白用微量凯氏定氮法测定,蛋白质的溶解度按上清液中蛋白含量与样品中总蛋白比来表示。
1.7数据统计分析
数据用Excel 2007进行处理,并采用(平均数±标准差)来表示,用Origin6.0作图。
2 结果与讨论
2.1各蛋白组分比例
对鸢乌贼和杜氏枪乌贼头足、胴体中的蛋白进行分离,得到非蛋白氮、水溶性蛋白、盐溶性蛋白和不溶性蛋白4个组分,各蛋白组分占粗蛋白的比例如图1所示。

图1 各蛋白组分占粗蛋白的比例Fig.1 The percentageof protein componentsin total protein
由图1可知,鸢乌贼头足、胴体和杜氏枪乌贼胴体中均是盐溶性蛋白比例最高,且存在显著性差异(P<0.05),均远远低于阿根廷鱿鱼的78.1%[14],而杜氏枪乌贼头足中水溶性蛋白所占比例最高。鸢乌贼胴体盐溶性蛋白所占比例高于头足的,也高于杜氏枪乌贼胴体。盐溶性蛋白又称肌原纤维蛋白,是肉中最具生物学功能的结构蛋白群,其结构、凝胶及流变学特性对肉制品品质有重要的影响,肉糜凝胶强度主要取决于肌肉中的盐溶性蛋白含量,因此可知,鸢乌贼的凝胶强度可能大于杜氏枪乌贼,小于阿根廷鱿鱼。鸢乌贼头足、胴体和杜氏枪乌贼胴体中盐溶性蛋白占总氮的比例分别为52.21%、58.68%和54.23%,与鲢鱼、鳙鱼、草鱼、鲫鱼、罗非鱼的50%~57%[15-16]持平。
2.2氨基酸组成
对从鸢乌贼和杜氏枪乌贼头足、胴体分离的各蛋白组分的氨基酸组成进行测定,结果见表1、表2。
由表1、表2可知,鸢乌贼和杜氏枪乌贼头足、胴体中WSP和SSP的必需氨基酸含量相差不大,但均大于ISP。鸢乌贼头足中3种蛋白各自的必需氨基酸含量均低于杜氏枪乌贼头足蛋白中的含量,但胴体中的含量高于杜氏枪乌贼胴体中的含量。根据FAO/WHO的理想模式,质量较好的蛋白质其氨基酸组成为必需氨基酸占总氨基酸的比在40%左右,因此可看出,鸢乌贼和杜氏枪乌贼头足、胴体的WSP和SSP的氨基酸比例恰当,营养齐全,是一种优质蛋白,可添加到食品中以提高其营养价值。据报道疏水性氨基酸含量高的蛋白质能形成强度高凝胶体系[17],Arg、Lys等碱性氨基酸有弹性增加效果[18]。鸢乌贼和杜氏枪乌贼头足、胴体盐溶性蛋白中碱性氨基酸比例分别18.99%、19.18%和18.44%、18.065%,疏水性氨基酸比例分别是34.74%、36.39%和37.54%、36.58%,与罗非鱼3种蛋白组分的持平[16],因此这2种乌贼形成凝胶能力可能与罗非鱼相似。
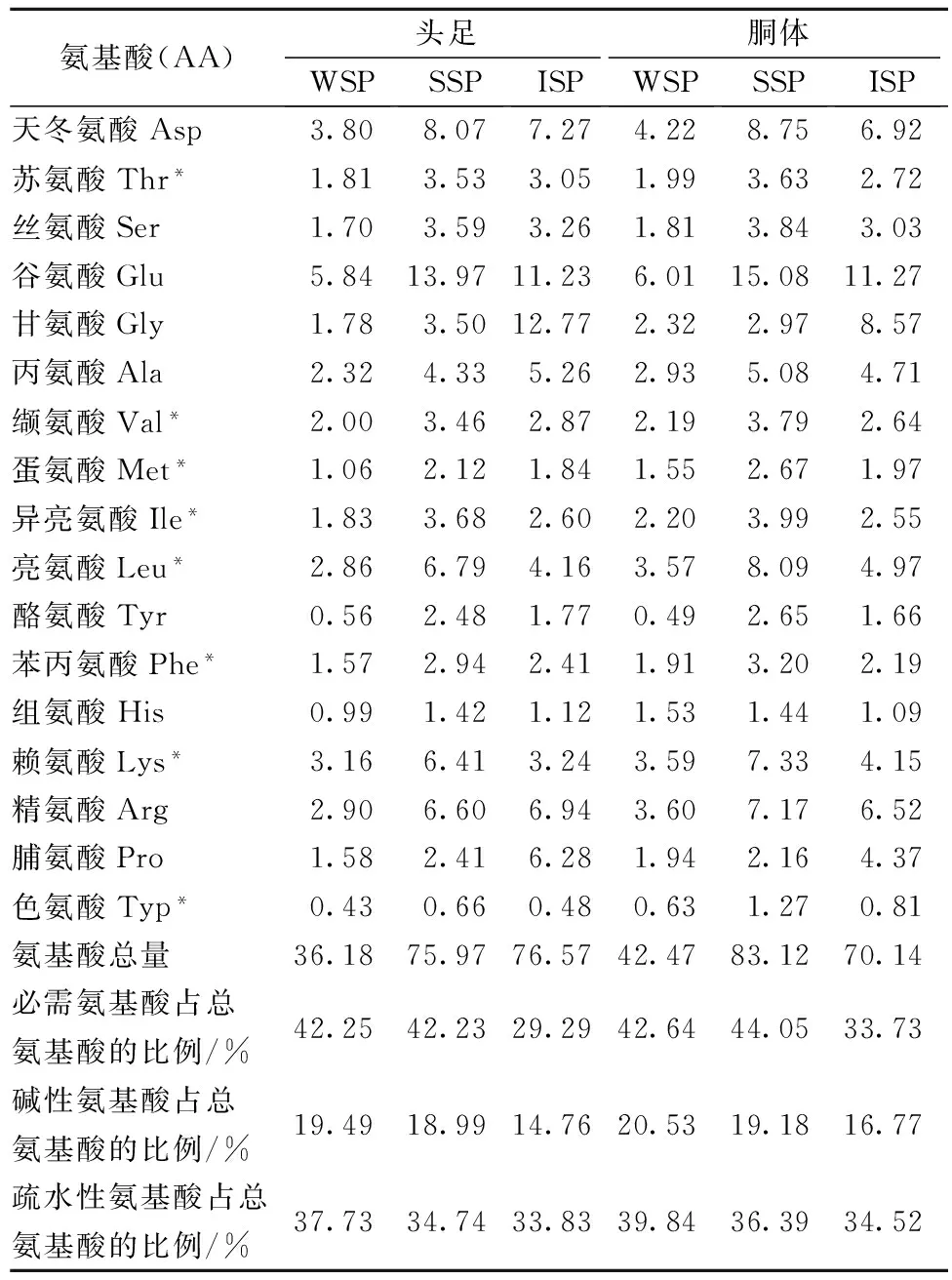
表1 鸢乌贼WSP、SSP和ISP的氨基酸组成 单位:g/100g
注:*表示必需氨基酸;碱性氨基酸:精氨酸、组氨酸、赖氨酸;疏水性氨基酸:蛋氨酸、色氨酸、苯丙氨酸、缬氨酸、异亮氨酸、亮氨酸、脯氨酸、丙氨酸。表2同。
2.4蛋白分子质量分布
对鸢乌贼和杜氏枪乌贼头足、胴体分离的各蛋白组分进行SDS-PAGE电泳分析,结果见图2。

0-Mark;1-头足的水溶性蛋白;2-盐溶性蛋白;3-不溶性蛋白;4-胴体的水溶性蛋白;5-盐溶性蛋白;6-不溶性蛋白图2 蛋白组分SDS-PAGE电泳图谱Fig.2 SDS-PAGE profile of protein components
由图2可知,鸢乌贼头足和胴体中蛋白组分分子质量的分布均存在一定的差异性,头足和胴体的水溶性蛋白在SDS-PAGE电泳中的条带较多、分子质量分布比较广泛,部分成连续带状,可能是水溶性蛋白中含有相近分子质量蛋白较多,在电泳中无法分开,出现模糊的蛋白条带只是在此分子质量范围相对含量比较集中。盐溶性蛋白主要是肌原纤维蛋白,由肌球蛋白重链(MHC)、轻链、肌动蛋白(Actin)和软体动物所特有的副肌球蛋白(PM)以及相对分子质量更小的原肌球蛋白等构成[19]。鸢乌贼头足和胴体盐溶性蛋白中MHC分子质量大于200 kDa、PM的分子质量在100 kDa左右、Actin分子质量接近44 kDa,与马静蓉等[20]报道的结果基本一致。PM、MHC和Actin条带较宽、颜色较深,说明其蛋白含量较高。
图2中杜氏枪乌贼头足和胴体中盐溶性蛋白的MHC、PM、Actin蛋白条带颜色较浅,表明其蛋白含量较低,特别是胴体中的MHC蛋白条带几乎完全消失,可能是因为肌原纤维蛋白在内源酶和细菌蛋白酶的共同作用下发生了降解。杜氏枪乌贼头足和胴体水溶性蛋白均集中分布在低分子质量范围29~97 kDa之间,不溶性蛋白的蛋白条带相似。
2.5变性温度
DSC是在一定的温度范围内,以一定的速度对试样加热,并记录试样在升温过程中所产生的细微热量变化,从而得到热流对温度的DSC扫描曲线。蛋白质结构的变化,将会导致自身热稳定性的变化,从而引起DSC扫描曲线形状的变化。所以,分析DSC扫描曲线形状的变化可知试样的热稳定性[21]。图3、图4分别为鸢乌贼和杜氏枪乌贼各蛋白组分的DSC扫描图谱,表3为各蛋白组分的变性温度。

图3 鸢乌贼蛋白组分DSC图Fig.3 DSC thermo gram for proteincomponents from Symplectoteuthis oualaniensi

图4 杜氏枪乌贼蛋白组分DSC图Fig.4 DSC thermo gram for protein components from Loligo duvaucel
大部分肌浆蛋白在40~60 ℃聚集变性,肌球蛋白的变性温度大约在40~45 ℃左右,肌动蛋白在70~75 ℃左右,胶原蛋白通常在53~63 ℃左右开始发生变性[22]。鸢乌贼头足和胴体的SSP变性温度分别为58.04 ℃和62.18 ℃,均低于杜氏枪乌贼头足的83.24 ℃和胴体的76.25 ℃,且本实验中2种乌贼SSP的DSC图谱中均只得到一个很宽的峰,可能是因为其肌球蛋白和肌动蛋白的变性温度很接近。2种乌贼蛋白组分变性温度的差异可能与物种、生存环境、蛋白的氨基酸组成等有关。
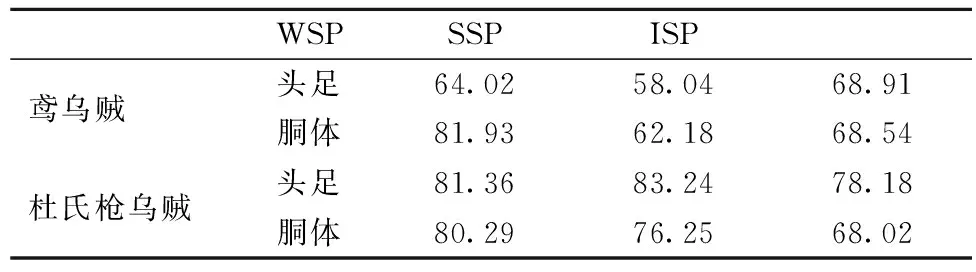
表3 各蛋白组分的变性温度 单位:℃
2.6pH值对WSP和SSP溶解度的影响
pH值对鸢乌贼和杜氏枪乌贼头足、胴体WSP和SSP的影响如图5、图6。

图5 pH值对WSP溶解度的影响Fig.5 Effect of pH on the solubility of WSP

图6 pH值对SSP溶解度的影响Fig.6 Effect of pH on the solubility of SSP
由图5可知,2种乌贼WSP溶解度的高低为杜氏枪乌贼头足>鸢乌贼头足>鸢乌贼胴体>杜氏枪乌贼胴体。蛋白质属于两性分子,当环境pH值高于(低于)其等电点时,蛋白质带负(正)电荷,水分子同这些电荷相互作用并起稳定作用,从而增加了蛋白质的溶解性;当pH值接近等电点时,蛋白质分子同水的作用比较弱,使得肽键相互靠拢,有时形成聚集体而导致蛋白质沉淀。由图5可知,鸢乌贼头足、胴体和杜氏枪乌贼头足WSP的等电点可能在pH 3,杜氏枪乌贼胴体的可能在pH 5。由图6可知,pH对SSP溶解度影响较大,在pH 4~11范围内,中性或碱性条件下SSP的溶解度高于酸性条件的,且2种乌贼头足SSP在pH 5条件下溶解度最低,胴体的在pH 4条件下最低。
2.7离子强度对SSP溶解度的影响
WSP是用离子强度很低的磷酸盐缓冲液提取的,SSP用盐溶液提取的,故未考虑离子强度对WSP溶解度的影响。NaCl浓度对SSP溶解度的影响如图7所示。
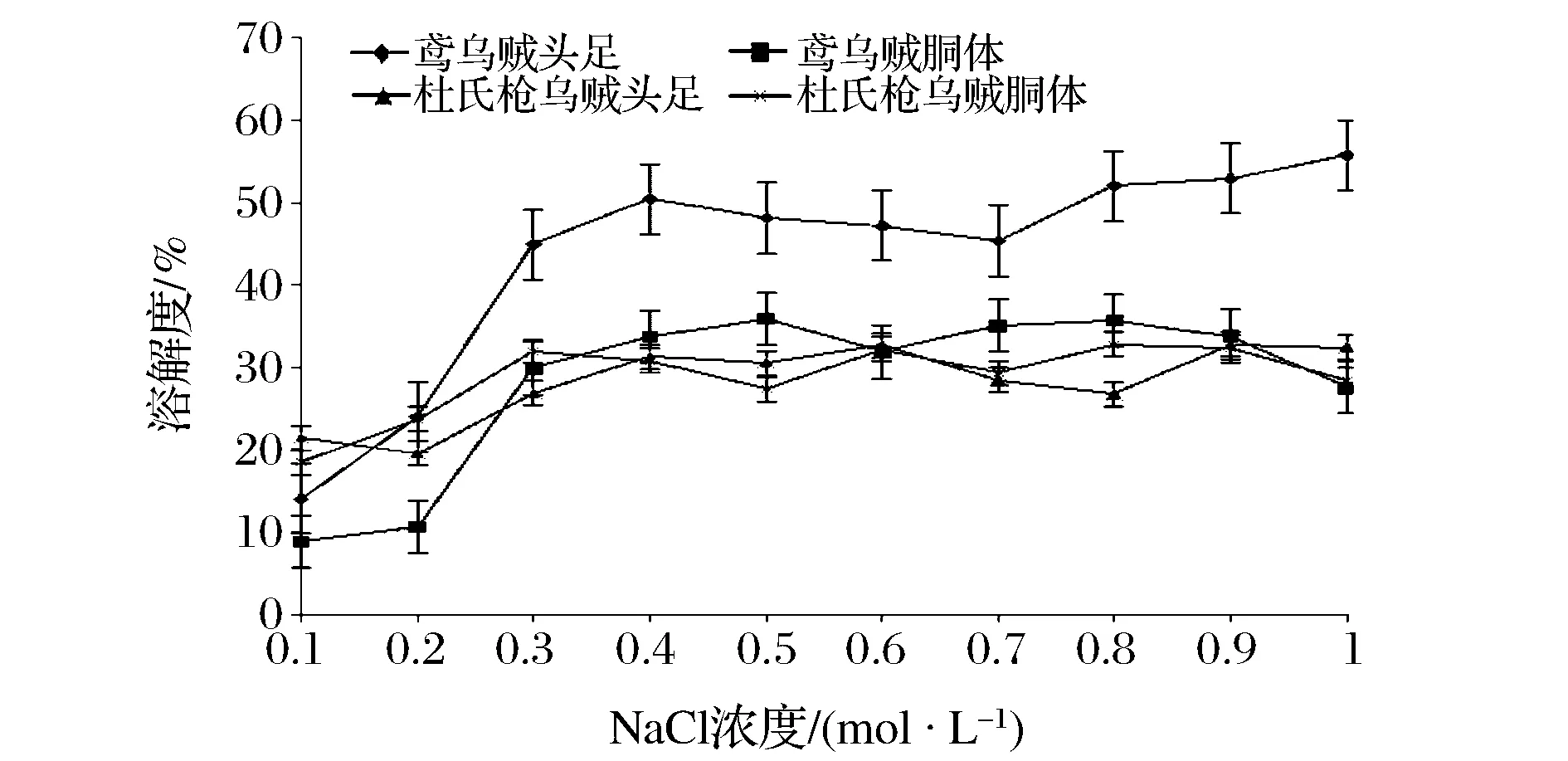
图7 NaCl浓度对SSP溶解度的影响Fig.7 Effect of NaCl concentration on the solubility of SSP
由图7可知,鸢乌贼头足SSP溶解性最好,其胴体与杜氏枪乌贼头足、胴体SSP溶解性相差不大。离子强度从0.1 mol/L增大到0.4 mol/L的过程中,2种乌贼的SSP溶解度显著增大,当离子强度大于0.4 mol/L时,溶解度变化不明显。这可能是因为在低离子强度下,盐离子与蛋白质份子的带电基团微弱结合,提高蛋白质与水的结合能力,增强蛋白水化,从而提高蛋白的溶解度;在高离子强度下,水盐相互作用大于水和蛋白质间的作用,蛋白质的溶解度降低。
3 结论
鸢乌贼头足和胴体及杜氏枪乌贼胴体中均是盐溶性蛋白占粗蛋白的比例高,可能具有良好的凝胶形成能力。2种乌贼头足、胴体均是WSP和SSP必需氨基酸比例在40%左右,是理想的优质蛋白,可添加到食品中提高其营养价值。鸢乌贼头足和胴体盐溶性蛋白中肌球蛋白重链、肌动蛋白和副肌球蛋白的含量比杜氏枪乌贼高,其变性温度较枪乌贼低。pH对WSP溶解度的影响不显著,SSP的溶解度受pH影响较大,在不同离子强度溶液中,鸢乌贼头足SSP溶解度较其胴体和杜氏枪乌贼头足、胴体的SSP溶解度高。对鸢乌贼蛋白特性的探讨为其凝胶性的研究提供理论依据。
[1]陈新军,刘必林,王尧耕.世界头足类[M].北京:海洋出版社,2009:312-313.
[2]张鹏,杨吝,张旭丰,等.南海金枪鱼和鸢乌贼资源开发现状及前景[J].南方水产,2010(1):68-74.
[3]于刚,张洪杰,杨少玲,等.南海鸢乌贼营养成分分析与评价[J].食品工业科技,2014(18):358-361.
[4]RAMAN M, MATHEW S. Study of chemical properties and evaluation of collagen in mantle, epidermal connective tissue and tentacle of Indian Squid,LoligoduvauceliOrbigny[J].Food Science and Technology, 2014, 51(8):1 509-1 516.
[6]CORTÉS-RUIZ J A, PACHECO-AGUILAR R, LUGO-SNCHEZ M E,et al. Production and functional evaluation of a protein concentrate from giant squid (Dosidicusgigas) by acid dissolution and isoelectric precipitation[J].Food Chemistry, 2008, 110:486-492
[8]杨芳,吴永沛,陈梅香,等.阿根廷鱿鱼肌原纤维蛋白及肌肉组织凝胶保水性研究[J].水产科学,2008,27(8):386-389.
[9]FUJII T, JUNG-YOUB A, MORI H, et al. A novel photoprotein from oceanic squid (Symplectoteuthisoualaniensis) with sequence similarity to mammalian carbon-nitrogen hydrolase domains [J].Biochemical and Biophysical Research Communications, 2002, 293(2): 874-879.
[10]SAITO T. Effect of thermal on extraction of proteins form meats[J].Bulletin of the Japan Society of Scientific Fisheries, 1983, 49(10):1 569-1 572.
[11]GB/T5009.5―2010.食品中蛋白质的测定[S].北京:中国标准出版社,2010.
[12]GB/T5009.124―2003.食品中氨基酸的测定[S].北京:中国标准出版社,2003.
[13]GB/T 18246―2000.饲料中氨基酸的测定[S].北京:中国标准出版社,2000.
[14]李桂芬.阿根廷鱿鱼生化成分的分析研究[J].现代食品科技,2005,1(12):120-121.
[15]刘海梅,严菁,熊善柏,等.淡水鱼肉蛋白质组成及其在鱼糜制品加工中的变化[J].食品科学,2007,28(2):40-44.
[16]唐小丹,周春霞,洪鹏志,等.罗非鱼肉蛋白的分离及其性质研究[J].食品科技,2011,36(6):156-159.
[17]李维平,吴道澄,袁静,等.蛋白质工程学[M].科学出版社,2013:39.
[18]章超桦,薛长湖.水产食品学[M].北京:中国农业出版社,2010:240.
[19]BLANCO-PASCUAL N, FERNNDEZ-MARTN F, Montero P. Jumbo squid(Dosidicusgigas) myofibrillar protein concentrate for edible packaging films and storage stability[J]. LWT-Food Science and Technology, 2014,55(2): 543-550.
[20]马静蓉,杨贤庆,马海霞,等.南海鸢乌贼肌原纤维蛋白热稳定性研究[J].食品与发酵工业, 2015,41(5):80-84.
[21]刘大松.草鱼肉在微冻和冰藏保鲜中的品质变化及其机理[D].无锡:江南大学,2012.
[22]姜启兴.鳙鱼肉热加工特性及其机理研究[D].无锡:江南大学,2015.
Proteins isolation fromSymplectoteuthisoualaniensisandandLoligoduvauceliand their characteristics
QIU Yue, ZENG Shao-kui, ZHANG Chao-hua*,HAO Ji-ming, ZHANG Jing
(College of Food Science and Technology, Guangdong Ocean University, Guangdong Provincial Key Laboratory of Aquatic Product Processing and Safety, Key Laboratory of Advanced Processing of Aquatic Product of Guangdong Higher Education Institution, South China Sea Bio-Resource Exploitation and Utilization Collaborative Innovation Center,Zhanjiang 524088, China)
According to the solubility, water soluble protein (WSP), salt soluble protein (SSP) and insoluble protein (ISP) were isolated from the cephalopodium and mantles muscle ofSymplectoteuthisoualaniensisandLoligoduvauceli. The results showed that inSymplectoteuthisoualaniensis, WSP, SSP and ISP component was 19.01%,52.21% and 13.23% in cephalopodium and 10.83%,58.68% and 10.03% in mantles muscle. InLoligoduvauceli, WSP, SSP and ISP percentage in cephalopodium and mantles muscle were 37.62%, 31.79%, 18.08% and 24.30%, 54.23%, 7.65%, respectively. In cephalopodium and mantles muscle ofSymplectoteuthisoualaniensisandLoligoduvauceli, the essential amino acids content in WSP and SSP was 40% of total amino acid. SDS-PAGE pattern showed that in cephalopodium and mantles muscle ofSymplectoteuthisoualaniensis, the molecular weight of MHC was more than 200 kDa, PM was about 100 kDa and Actin was close to 44 kDa. In cephalopodium and mantles muscle ofLoligoduvauceli, the MHC, PM and Actin protein bands of the SSP were lighter, indicating that the contents of the proteins were lower. As demonstrated by DSC, the denaturation temperature of WSP, SSP and ISP in cephalopodium ofSymplectoteuthisoualaniensiswere 64.02℃,58.04℃ and 68.91℃, and 81.93℃,62.18℃ and 68.54℃ in mantles muscle; forLoligoduvauceli,the denaturation temperature of WSP, SSP and ISP was 81.36℃,83.24℃ and 78.18℃ in cephalopodium and 80.29℃,76.25℃ and 68.02℃ in mantles muscle. The denaturation temperature of proteins fromLoligoduvauceliwere higher than that ofSymplectoteuthisoualaniensis. The solubility of WSP in cephalopodium and mantles muscle ofSymplectoteuthisoualaniensisand cephalopodium ofLoligoduvauceliwere at the minimum at pH 3; at pH 5, WSP solution in mantles muscle ofLoligoduvauceliwas the lowest. In different ionic strength solution, the solubility of SSP was better in cephalopodium ofSymplectoteuthisoualaniensis.
Symplectoteuthisoualaniensis;Loligoduvauceli; protein separation; SDS-PAGE; DSC; solubility
10.13995/j.cnki.11-1802/ts.201609014
硕士研究生(章超桦教授为通讯作者,E-mail: chz2382@126.com)。
广东省教育厅创新强校工程项目(2014GKXM047)
2015-11-30,改回日期:2016-02-14
