不同颜色糙米的酚类物质组成及抗氧化活性分析
2016-10-13叶玲旭刘兴训周素梅钟葵佟立涛刘丽娅周闲容马晓军
叶玲旭,刘兴训,周素梅,钟葵,佟立涛,刘丽娅,周闲容,马晓军
1(江南大学 食品学院,江苏 无锡,214122)2(中国农业科学院 农产品加工研究所/农业部农产品加工综合性重点实验室,北京, 100193)
不同颜色糙米的酚类物质组成及抗氧化活性分析
叶玲旭1,2,刘兴训2,周素梅2,钟葵2,佟立涛2,刘丽娅2,周闲容2,马晓军1*
1(江南大学 食品学院,江苏 无锡,214122)2(中国农业科学院 农产品加工研究所/农业部农产品加工综合性重点实验室,北京, 100193)
以8种不同颜色的糙米为研究对象,分别提取糙米中游离型和结合型酚,并对提取物中的酚类物质(总酚、总黄酮、总花青素、总原花青素、总酚酸)的含量以及ABTS自由基(ABTS+)清除能力与铁离子还原能力进行了研究,比较了不同颜色间糙米的酚类物质和抗氧化活性的差异以及两者与颜色参数间的相关性。研究结果表明:糙米的抗氧化活性与结合型、游离型的酚类物质含量呈正相关(P<0.05);结合型酚类物质的含量和抗氧化活性与糙米颜色均无显著相关(P>0.05);游离型酚类物质含量、组成以及抗氧化活性与糙米颜色有相关,糙米颜色越深酚含量越高、抗氧化活性越强,且原花青素主要存在于红色糙米或部分黑色糙米中。
糙米; 酚类物质;抗氧化活性; 颜色
我国是世界上第一大稻米生产国,稻米资源丰富、历史悠久、品种多样,按照种皮颜色分为普通稻和彩色稻两大类[1]。彩色稻常作为特殊稻,其糙米颜色可分为绿色、红色、紫色和黑色等[2];而普通糙米的颜色大多为浅棕色。研究表明,彩色糙米颜色的形成与糙米中酚类物质有关[3]。此外,长期食用糙米能降低Ⅱ型糖尿病、肥胖、冠心病等慢性疾病的风险,这与糙米中酚类物质的强抗氧化活性相关[4]。
糙米中的酚类物质包括酚酸、花青素和原花青素三大类[5]。酚酸以游离态和结合态的形式普遍存在于稻米中[6];花青素和原花青素主要以游离形式存在于深颜色糙米中[5]。目前,稻米中结合型酚的研究相对较少,但结合型酚能促进肠道微生物生长、预防结肠癌、抗氧化能力强于游离酚[7]。与其他彩色谷物一样,不同颜色糙米的酚类含量、组成以及抗氧化能力不同[2, 8-11]。SHEN[8]对黑色和红色糙米的研究表明:黑色和红色糙米的游离酚含量、抗氧化能力均高于普通糙米,游离酚含量与糙米籽粒颜色有关;MIN[10]的研究表明,彩色的结合酚含量高于普通糙米,但无显著差异。此外,有关绿色糙米酚类物质的报导较少。
本文选取了我国8种不同颜色的糙米为原料,分析了糙米中不同形态酚类物质的含量、组成及抗氧化活性,并对酚类含量、抗氧化能力、糙米颜色参数三者间的关系作了初步探索。
1 材料与方法
1.1材料与试剂
选取8种不同颜色的糙米,旋风磨磨粉,过80目,4 ℃保存备用,品种详细信息见表1。

表1 实验用彩色糙米样品
水溶VE(Trolox,纯度≥97%)、三吡啶三吖嗪(TPTZ,纯度≥98.5%)、没食子酸、原儿茶酸、绿原酸、咖啡酸、香草酸、丁香酸、p-香豆酸、阿魏酸、香草醛(色谱纯),Sigma-Aldrich公司;ABTS (2,2-联氮-二(3-乙基-苯并噻唑-6-硫磺)二铵盐)(分析纯),Sigma-Aldrich公司;芦丁(纯度≥98%)、矢车菊素葡萄糖苷(纯度≥98%)、儿茶素(纯度≥98%)(色谱纯),北京索莱宝生物有限公司;福林酚(分析纯),北京索莱宝生物有限公司;无水甲醇、Na2CO3、HaNO2、过硫酸钾、六水氯化铝和乙酸乙酯(分析纯),北京国药集团。
1.2仪器与设备
CT410旋风式样品磨,福斯赛诺分析仪器(苏州)有限公司;U-3010 紫外可见分光光度计,日本Hitachi 公司;SP-Max 2300A光吸收型全波长酶标仪,上海闪谱生物科技有限公司;D25LT型色彩色差仪,德国HunterLab公司;LXJ-ⅡB低速大容量多管离心机,上海安亭科学仪器厂;RE-52AA 旋转蒸发器,上海亚荣生化仪器厂;Agilent 1200高效液相色谱仪,美国安捷伦公司。
1.3实验方法
1.3.1糙米粉颜色测定
采用D25LT色差仪测定糙米样品的颜色,以L*、a*和b*三个参数表示。L*表示亮度(数值100表示白色,0表示黑色),a*表示红绿色,b*表示黄蓝色,C为颜色饱和度,C=(a*2+b*2)1/2。
1.3.2游离型和结合型酚的提取
游离酚的提取[12]:称取1 g样品加入15 mL 4 ℃酸化甲醇提取10 min,离心取上清液,重复3次合并上清液,于45 ℃下旋转蒸发,并用酸化甲醇定容至10 mL,放置-20 ℃保存。
结合酚的提取[12]:提取游离酚后所得残渣中,加入20 mL 2 mol/L NaOH,在N2保护下搅拌1 h后,调pH值至1.5~2.0,添加等体积的正己烷除脂,用等体积的乙酸乙酯萃取5次,合并提取液于45 ℃旋转蒸发至干,并用体积分数为50%的甲醇定容至10 mL,-20 ℃保存。
1.3.3总酚含量的测定
于1 mL稀释提取液[8]中,加入0.5 mL稀释1倍的福林酚试剂、2.5 mL 75 g/L Na2CO3,混合均匀,室温下反应2 h,于760 nm波长下测定混合液的吸光值。根据不同浓度的没食子酸绘制标准曲线,计算样品中总酚含量,结果表示为mg/100g。
1.3.4总黄酮含量的测定
于1 mL稀释提取液[8]中加入1.5 mL H2O(双蒸水)和0.15 mL 50 g/L NaNO2反应5 min,再加入0.15 mL 100g/L AlCl3·6H2O混匀反应5 min,于混合液中加入1 mL 1 mol/L NaOH 反应15 min。采用415 nm测定混合液的吸光值。根据不同浓度的芦丁绘制标准曲线,计算样品中总黄酮含量,结果表示为mg/100 g。
1.3.5总原花青素的提取及测定
参照文献[2, 13]提取并测定原花青素含量。称2.0 g糙米,加入25 mL体积分数为80%的甲醇提取8 h,离心取上清液,定容至25 mL,提取液过0.22 μm滤膜保存。取0.4 mL 提取液加入1 mL 4.5 mol/L硫酸甲醇溶液与1 mL 10 g/L香草醛甲醇溶液,于30 ℃反应15 min,并用纯甲醇溶液代替香草醛溶液作为样品的空白对照,于500 nm下测定吸光值。根据不同浓度的儿茶素绘制标准曲线,计算样品中总原花青素含量,结果表示为μg/g。
1.3.6总花青素的提取及测定
采用pH示差法测定总花青素[10]。0.5 g样品加入15 mL酸化甲醇提取3次,离心取上清液。提取液分别用pH1.0和pH 4.5的缓冲液稀释10倍,分别采用520 nm和700 nm测定稀释液的吸光值。以不同浓度的矢车菊素葡萄糖苷绘制标准曲线,得到摩尔消光系数,按公式(1)计算样品中总花青素含量,结果表示为μg /g。
总花青素浓度/(μg·g-1)=A×MW×V×DF/(ε×L×m×1 000)
(1)
式中:A,吸光度,A=(A520nm-A700nm)pH1.0-(A520nm-A700nm)pH 4.5;MW,矢车菊素葡萄糖苷(kuromanin)的分子质量;DF,稀释系数;V,提取液体积,mL;ε,摩尔消光系数,L/(cm×mol);L,比色皿宽度,cm;1 000,换算系数;m,样品质量,g。
1.3.7酚酸的组成
采用HPLC测定酚酸含量[12],8种酚酸(没食子酸、原儿茶酸、绿原酸、咖啡酸、香草酸、丁香酸、p-香豆酸和阿魏酸)作为外标。使用SB-C18柱(250 mm×4.6 mm,5 μm)色谱柱,检测波长280 nm和320 nm,柱温为40 ℃,进样量为10 μL,流动相A(2%甲酸)和流动相B(乙腈),梯度洗脱:A 95%~75%,0~30 min;A 60%,30~50 min;A 95%,50~60 min。流速为 0.8 mL/min。
1.3.8抗氧化活性评价
ABTS+清除能力(ABTS radical scavenging capacity,ARSC)测定[14]:ABTS溶液(7 mmol/L)与过硫酸钾溶液(7.35 mmol/L)按2∶1的体积混合后,黑暗条件下放置12~16 h,形成ABTS+,记为ABTS+母液。用甲醇调节ABTS+母液使其在734 nm下吸光值为(0.70±0.02),记为ABTS+工作液。3.9 mL ABTS+工作液与0.1 mL提取液混合,室温下反应6 min后立即测定吸光值,记为Asample。以甲醇作对照,吸光值记为Acontrol。按下列公式计算清除率。ABTS+清除率/%=(1-Asample/Acontrol)×100,以不同浓度的Trolox绘制标准曲线,根据清除率计算抗氧化能力,结果表示为μmol/g。
铁离子还原/抗氧化能力(ferric reducing antioxidant power,FRAP)测定[12]:制备FRAP试剂,在96孔板中加入20 μL提取液和260 μL FRAP试剂,反应30 min后在593 nm下测定吸光值。以不同浓度的Trolox溶液绘制标准曲线,根据吸光值计算样品的FRAP值,结果以μmol/g表示。
1.4数据分析
采用SPSS 20.0、Excel 2013 进行数据分析和图像处理,实验均进行2次重复,数值以(平均值±SD)表示。
2 结果与分析
2.1糙米颜色
采用糙米粉末测定的颜色参数值反应糙米籽粒的颜色,其结果见表2。L*表示亮度,a*表示红绿色,b*表示黄蓝色,C为颜色饱和度。从表2可以看出,绿色和普通糙米的L*值最高,黑色糙米最低,红色糙米居中;绿色糙米的a*为负,普通糙米其数值最低,深色(黑色和红色)糙米的a*较高,红色糙米的a*最高;黑米的b*值和C值最小,色彩饱和度和低。不同颜色糙米,其颜色参数存在显著差异(P<0.05),采用色差仪可以清晰的分辨糙米的颜色。

表2 不同颜色糙米的颜色参数
注:同一列相同字母表示无显著性差异(P>0.05),不同字母表示差异显著。表5同。
2.2不同颜色糙米的总酚含量
图1为不同颜色糙米游离型和结合型的总酚含量。从图1可以看出,所有样品的游离型总酚含量均明显大于结合型总酚含量。不同颜色糙米的游离型总酚含量存在明显的差异(P<0.05),而不同颜色间结合型总酚含量差异较小。所选的8种样品,黑色糙米游离型总酚含量最高,且远高于浅色(浅棕色和绿色)糙米,含量是浅色糙米的7~10倍,这与SHEN[8]和CHEN[11]等对彩色糙米游离型酚的研究结果相似。

图1 彩色糙米游离型和结合型总酚含量Fig.1 Total phenolic content in free and bound forms of pigmented rice varieties注:所有品种间游离型总酚和结合型总酚分别进行显著性分析(P<0.05)。
2.3不同颜色糙米的总黄酮含量
不同颜色糙米游离型和结合型总黄酮含量的变化趋势与总酚相同(结果见图2)。由图2可知,所有样品的游离型总黄酮含量均大于结合型总黄酮含量,其中深色(黑色和红色)糙米的游离型总黄酮含量与结合型的差异较大;不同颜色间结合型总黄酮含量差异小,而游离型总黄酮含量差异显著(P<0.05)。深色(黑色和红色)糙米游离型总黄酮含量远高于浅色(浅棕色和绿色)糙米,浅棕色与绿色糙米间游离型总黄酮差异小,黑色糙米是绿色糙米的2~3倍多,这与SHEN[8]等对彩色糙米游离型总黄酮含量的研究结果相近。

图2 彩色糙米游离型和结合型总酚含量Fig.2 Total flavoniod content in free and bound forms of pigmented rice varieties注:所有品种间游离型总黄酮和结合型总黄酮分别进行显著性分析(P<0.05)。
2.4总原花青素和总花青素含量
花青素是一类水溶性类黄酮物质,原花青素属于黄酮物质,主要由黄烷-3醇单元聚合而成,且两类物质主要以游离态形式存在于深色糙米中[10],如表3所示。
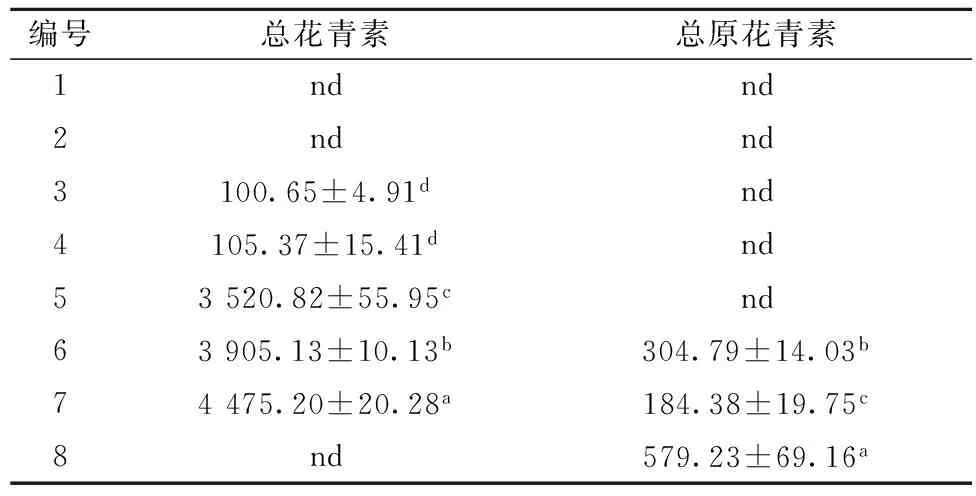
表3 不同颜色糙米总花青素含量和总原花青素 单位:μg/g
注:同一列相同字母表示无显著性差异(P>0.05),不同字母表示差异显著; nd-not detected,未检测出。
普通糙米未检测出TAC(总花青素含量)和TPAC(总原花青素含量);绿色糙米仅含有微量的TAC(值为100.65~105.37 μg/g);黑色糙米含较高的TAC(值为3 520.82~4 475.20 μg/g),为绿色糙米的30~40倍,同时检测出6和7号样品含有TPAC(值分别为304.79和184.38 μg/g);而红色糙米仅含有较高的TPAC(579.23 μg/g)。大多数研究指出花青素存在于黑色稻米、原花青素存在于红色稻米中[5],本研究发现花青素主要存在于黑色糙米并少量存在于绿色糙米中,原花青素主要存在于红色糙米以及部分黑色糙米中。深色糙米拥有高含量的花青素或原话花青素,进一步说明了深色糙米的游离型总酚和总黄酮含量显著高于浅色糙米。
2.5酚酸含量
酚酸是糙米中常见的酚类物质,采用HPLC法测定酚酸组成和含量(结果见表4)。表4中总酚酸含量为8种酚酸含量之和,总量为游离型和结合型2种形式的酚酸含量之和。从表4可知,糙米中结合型的酚酸主要为阿魏酸和p-香豆酸,且不同颜色间结合型总酚酸含量差异小,与前人[15]研究结果一致。不同颜色糙米游离型酚酸的含量和组成不同:普通糙米和绿色糙米的游离型酚酸主要是没食子酸、阿魏酸和p-香豆酸,红色糙米是阿魏酸、p-香豆酸、香草酸和原儿茶酸,黑色糙米是香草酸、原儿茶酸、阿魏酸和p-香豆酸;黑色糙米游离型总酚酸含量最高,普通糙米次之。上述结果与SOMPONG[16]和IRAKLI等[17]的研究结果相近。

表4 不同品种彩色糙米的酚酸含量 单位:μg/g
注:nd- 未检测出,tr-痕量;所有样品丁香酸未检测出。
2.6抗氧化活性
以Trolox(水溶VE)作为阳性对照,不同颜色糙米游离型和结合型提取物的ARSC、FRAP值如表5所示。结果显示,结合型提取物的ARSC与FRAP值变化范围小,不同颜色间的差异不显著;不同颜色间游离型提取物的ARSC和FRAP值差异显著(P<0.05),深色糙米远大于浅色糙米,浅色糙米中普通糙米的ARSC略大于绿色糙米,与CHEN[11]研究结果相似。

表5 不同品种糙米游离型和结合型提取物的ABTS+清除能力和铁离子还原能力
2.7相关性分析
糙米中酚类物质(总酚、总黄酮、总量酚酸、总花青素、总原花青素)、抗氧化能力、颜色参数三者间的相关性分析结果见表6。由表6可知,酚类物质(除原花青素外)与ARSC和FRAP值(极)显著相关(P<0.01或0.05),说明酚类物质是彩色糙米的主要抗氧化性物质,这与GUNARATME[2]研究结论一致。结合型酚类物质(总酚、总黄酮、总酚酸)以及抗氧化活性均与L*、a*、b*和C无显著相关(P>0.05),说明结合酚含量以及抗氧化活性与种皮颜色无关;游离型酚类物质(除总原花青素外)、抗氧化活性均与L*值、b*值、C呈极显著负相关(P<0.01),总酚、总黄酮、总原花青素含量、TEAC值分别与a*成正相关(P<0.05),说明糙米颜色越深游离型酚含量越高、抗氧化活性越强,且原花青素主要存在于红色糙米或部分黑色糙米中。SHEN[8]研究结果显示红色糙米其游离型的总酚、总黄酮、抗氧化能力与L*、b*、C无显著相关性(P>0.05),而与a*值显著相关(P<0.05),进一步解释了本研究中原花青素的含量与L*、b*、C无关而与a*相关。

表6 酚类含量与品种颜色以及抗氧化活性的相关性分析
注:*表示表示显著相关(P<0.05);**表示极显著相关(P<0.01)。
3 结论
(1)抗氧化活性与结合型和游离型的酚类物质含量呈正相关(P<0.05)。
(2)结合型酚类物质的含量和抗氧化活性与糙米颜色无显著相关(P<0.05)。
(3)游离型酚类物质含量、组成以及抗氧化活性与糙米颜色有相关。糙米颜色越深酚含量越高、抗氧化活性越强,且原花青素主要存在于红色糙米或部分黑色糙米中。
[1]戴蕴青, 何计国, 袁芳, 等. 五彩米营养成分分析与评价[J]. 中国粮油学报, 2006(1): 20-23.
[2]GUNARATNE A, WU Kao, LI Dong-qin, et al. Antioxidant activity and nutritional quality of traditional red-grained rice varieties containing proanthocyanidins[J]. Food Chemistry, 2013, 138(2/3): 1 153-1 161.
[3]ABDEL-AALl E S M, YOUNG J C, RABALSI I. Anthocyanin composition in black, blue, pink, purple, and red cereal grains[J]. Journal of Agricultural and Food Chemistry, 2006, 54(13): 4 696-4 704.
[4]BURLANDO B, CORNARA L. Therapeutic properties of rice constituents and derivatives (OryzasativaL.): A review update[J]. Trends in Food Science and Technology, 2014, 40(1): 82-98.
[5]SHAO Ya-Fang,BAO Jin-song. Polyphenols in whole rice grain: genetic diversity and health benefits[J]. Food Chemistry, 2015, 180: 86-97.
[6]AL-FARSI M A,LEE C Y. Optimization of phenolics and dietary fibre extraction from date seeds[J]. Food Chemistry, 2008, 108(3): 977-985.
[7]ACOSTA-ESTRADA B A, GUTIÉRREZ -URIBE J A, SERNA-SALDVA S O. Bound phenolics in foods, a review[J]. Food Chemistry, 2014, 152(6): 46-55.
[8]SHEN Yun, JIN Liang, XIAO Peng, et al. Total phenolics, flavonoids, antioxidant capacity in rice grain and their relations to grain color, size and weight[J]. Journal of Cereal Science, 2009, 49(1): 106-111.
[9]DE MIRA N V M, MASSARETTO I L, PASCUAL C d S C I, et al. Comparative study of phenolic compounds in different Brazilian rice (OryzasativaL.) genotypes[J]. Journal of Food Composition and Analysis, 2009, 22(5): 405-409.
[10]MIN B, GU Li-wei, MCCLUNG A M, et al. Free and bound total phenolic concentrations, antioxidant capacities, and profiles of proanthocyanidins and anthocyanins in whole grain rice (OryzasativaL.) of different bran colours[J]. Food Chemistry, 2012, 133(3): 715-722.
[11]CHEN Xiao-qiong, NAGAO N, ITANI T, et al. Anti-oxidative analysis, and identification and quantification of anthocyanin pigments in different coloured rice[J]. Food Chemistry, 2012, 135(4): 2 783-2 788.
[12]TI HUI-HUI, LI QING, ZHAN Ghang Rui-fen, et al. Free and bound phenolic profiles and antioxidant activity of milled fractions of different indica rice varieties cultivated in southern China[J]. Food Chemistry, 2014, 159(13): 166-174.
[13]SUN B, RICARDO-DA-SILVA J M, SPRANGER I. Critical factors of vanillin assay for catechins and proanthocyanidins[J]. Journal of Agricultural and Food Chemistry, 1998, 46(10): 4 267-4 274.
[14]RE R, PELLEGRINI N, PROTEGGENTE A, et al. Antioxidant activity applying an improved ABTS radical cation decolorization assay[J]. Free Radical Biology and Medicine, 1999, 26(9/10): 1 231-1 237.
[15]SOSULSKI F, KRYGIER K, and HOGGE L. Free, esterified, and insoluble-bound phenolic acids. 3. Composition of phenolic acids in cereal and potato flours[J]. Journal of Agricultural and Food Chemistry, 1982, 30(2): 337-340.
[16]SOMPONG R, SIEBENHANDL-EHN S, LINSBERGER-MARTIN G, et al. Physicochemical and antioxidative properties of red and black rice varieties from Thailand, China and Sri Lanka[J]. Food Chemistry, 2011, 124(1): 132-140.
[17]IRAKLI M N, SAMANIDOU V F, BILIADERIS C G, et al. Simultaneous determination of phenolic acids and flavonoids in rice using solid-phase extraction and RP-HPLC with photodiode array detection[J]. Journal of Separation Science, 2012, 35(13): 1 603-1 611.
Phenolic compounds and antioxidant activity of brown rice in different color of bran
YE Ling-xu1,2, LIU Xing-xun2, ZHOU Su-mei2, ZHONG Kui2, TONG Li-tao2,LIU Li-ya2, ZHOU Xian-rong2, MA Xiao-jun1*
1(School of Food Science and Technology, Jiangnan University, Wuxi 214122, China)2(Institute of Food Science and Technology (IFST), Chinese Academy of Agricultural Sciences (CAAS), Beijing 100193, China)
Eight different color brown rice were used to extract the free and compound form of phenolics. The content of phenolic compounds, including total phenolic , total flavonoids, total anthocyanins, total proanthocyanidin, total phenolic acids, and the capacity of ABTS+radical scavenging and ferric ion reduction were studied. We also compared the difference of phenolic compounds and antioxidant activity in different color brown rice as well as the correlation between color parameters, phenolic content and antioxidant activity. Those results shown that antioxidant activity and content of phenols in both free and bound forms were positively correlated (P<0.05); the compound form of phenols and antioxidant activity were unrelated with rice bran color (P>0.05); while the free phenolic content and composition, antioxidant activity were related with rice bran color. The more dark color of the rice, the more phenols, and the stronger antioxidant activity. Proanthocyanidin was mainly existed in red rice and some black rice varieties.
brown rice; phenolics; antioxidant activity; color
10.13995/j.cnki.11-1802/ts.201609013
硕士研究生(马晓军教授为通讯作者,E-mail: maxiaojun@jiangnan.edu.cn)。
农业部公益性行业科研专项经费:活性稻米、杂粮等食品加工及装备研究与示范(201403063);中国农业科学院基本科研业务费(2015ZL048);中央级公益性科研院所基本科研业务费专项资金(中国农业科学院农作物科学研究所)资助项目
2015-12-24,改回日期:2016-01-22
