浓缩乳清蛋白粉成分荧光光谱分析
2016-10-12赵挺
赵 挺
(蚌埠医学院 数理学院, 安徽 蚌埠 233030)
浓缩乳清蛋白粉成分荧光光谱分析
赵挺
(蚌埠医学院 数理学院, 安徽 蚌埠233030)
基于荧光光谱技术的浓缩乳清蛋白粉成分分析表明,浓缩乳清蛋白粉溶液荧光符合B类蛋白特点,其发射谱由4个单峰组成,强度最大的3个单峰对应的分别是酪氨酸残基和处于两种不同环境下的色氨酸残基。
浓缩乳清蛋白粉; 荧光光谱; 成分分析
0 引 言
浓缩乳清蛋白粉由牛奶乳清通过澄清、超滤、喷雾干燥等技术手段制成,其具有突出的生理功能特性和优质的生物利用价值[1-4],是生产婴幼儿配方奶粉、运动营养补剂、中老年营养品等食品的重要原料。原料质量与食品安全息息相关,目前,市场上浓缩乳清蛋白粉多产自国外,导致无法从生产源头监控其质量,同时由于市场的大量需求,出现了通过掺假(如加入奶精粉、大豆蛋白粉等)获取暴利的现象。因此,加强关于浓缩乳清蛋白粉质量检测方法的研究就显得十分迫切和必要。而当前检测方法(国标GBT11674-2010)大都是化学方法,繁琐耗时,而荧光光谱技术具有快速、灵敏、选择性高等特点。文中通过origin8.0软件利用高斯多峰拟合方法,明确了浓缩乳清蛋白粉水溶液发射谱中重叠荧光峰的位置、强度和宽度,并分析了对应荧光团的成分。希望本实验能为浓缩乳清蛋白粉的质量检测提供一定的依据。
1 实验过程
1.1样品制备
前期实验结果显示,不同品牌的浓缩乳清蛋白粉水溶液荧光光谱变化规律相似,说明成分几近相同,故采用市场上购买的Glanbia浓缩乳清蛋白粉(美国爱尔兰哥兰比亚营养有限公司生产),以实验室去离子水为溶剂,配制成浓度为1mg/mL的浓缩乳清蛋白粉水溶液。配制完成后,将溶液用滴管移入10mm石英皿中。
1.2仪器及设定
F-450荧光分光光度计,天津市津维电子仪表有限公司生产。
实验中设置激发波长为278nm;发射波长扫描范围为290~490nm;激发和发射波长扫描步距皆为1nm;两者狭缝缝宽均为5nm;扫描速率12 000nm/min。
2 数据处理
发射谱谱线如图1所示。
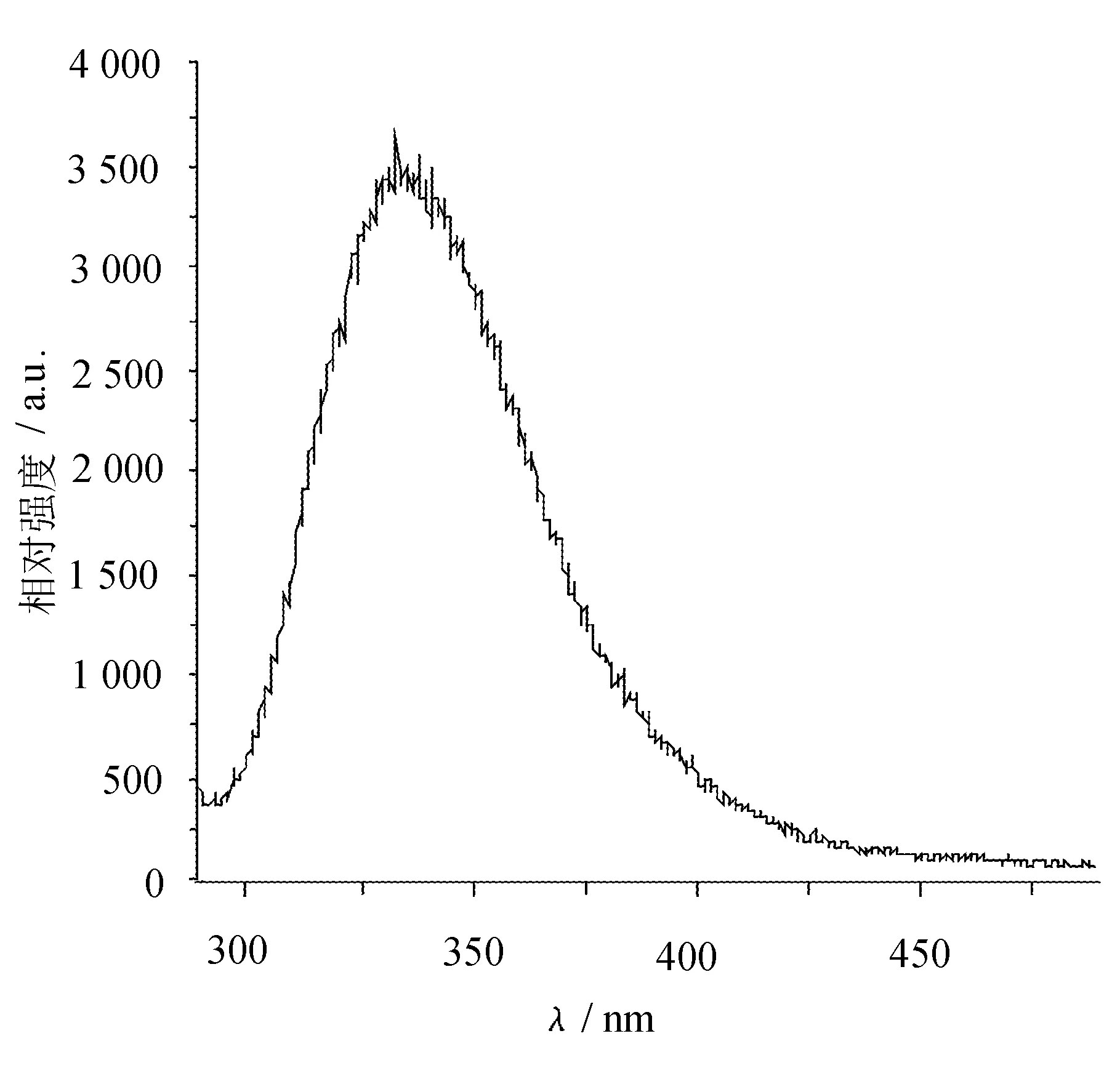
图1 发射谱谱线
由图1可以看出,浓度为1mg/mL的浓缩乳清蛋白粉水溶液在激发光为278nm时的发射谱,其荧光峰较宽,说明溶液中可能含有不同种类的荧光生色团,为了明确分别与之对应的荧光峰的强度和半峰宽,又对发射谱谱线进行了高斯多峰拟合,如图2所示。
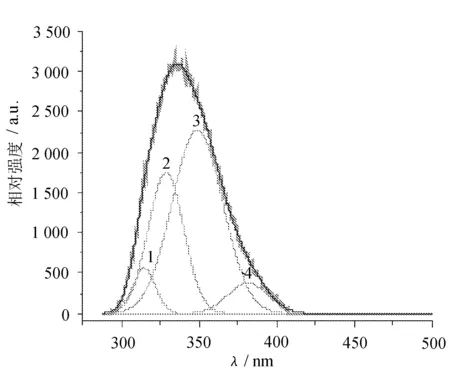
图2 高斯多峰拟合
由图2可以看出,其中深色曲线为高斯多峰拟合曲线,浅色曲线为发射光谱谱线。
两者非常符合,发射谱曲线经过高斯多峰拟合以后,被分解成4个高斯函数,即发射谱可看成由4个单峰叠加而成,其中每个单峰对应参数见表1。
表1 高斯多峰拟合各单峰参数
3 实验结果分析
3.1浓缩乳清蛋白粉水溶液发射光谱分析
一般在270~300nm紫外光的激发下,蛋白质会发出内源荧光,而色氨酸﹑酪氨酸﹑苯丙氨酸三者的残基正是这种荧光的主要来源[5]。比较三者的分子结构如图3所示。
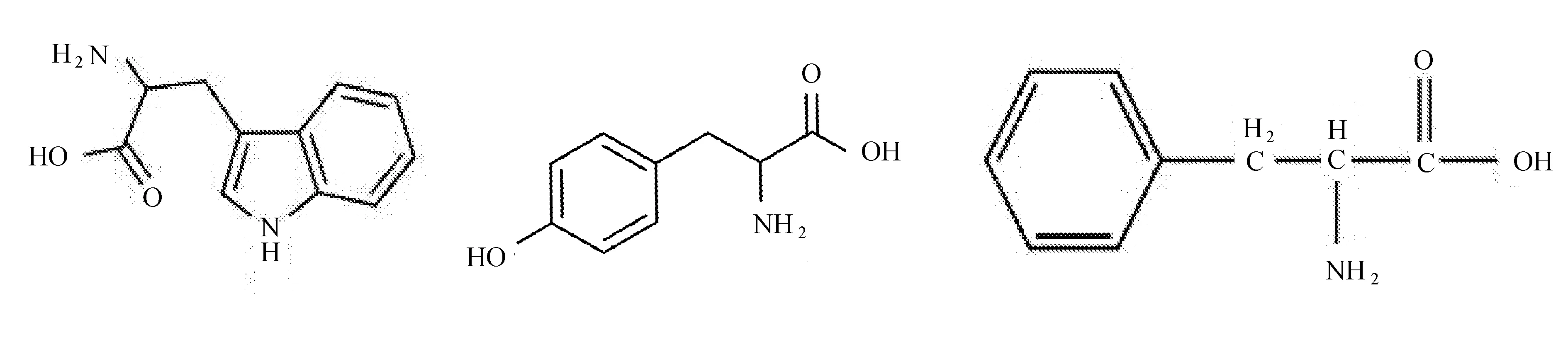
(a) 色氨酸结构式 (b) 酪氨酸结构式 (c) 苯丙氨酸结构式
图3芳香族氨基酸结构式
由图3可以发现,虽然3种氨基酸都具有苯环,然而由于酪氨酸多了一个羟基,色氨酸则多了一个吲哚环,根据荧光发射原理,分子的荧光效率会随着π电子共轭度以及分子平面度增加而增大[6],故在浓度相同时,三者荧光光强之比为100∶9∶0.5[5],因此在蛋白质的内源荧光中,一般很难发现苯丙氨酸残基的荧光,人们看到的蛋白质荧光主要来自于另外两种氨基酸残基。
在人们研究的大量蛋白质中,从结构上来说主要是球蛋白。根据以上3种残基的构成不同,球蛋白可以分成两种:一种只含有苯丙氨酸、酪氨酸,不含有色氨酸,被称为A类蛋白[7],这种蛋白更多的表现为酪氨酸的荧光特性,比如胰岛素、核酸组蛋白、原肌球蛋白等;另一种被称为B类蛋白,含有以上3种氨基酸残基[7],其中的色氨酸与酪氨酸残基由于发生能量转移现象,造成后者荧光淬灭,前者荧光增强,所以B类蛋白中主要体现的是色氨酸残基的荧光,当所处微环境极性发生改变时,色氨酸残基的荧光峰也会随之变化,一般变化范围在325~352nm[8]之间。
乳清蛋白主要由4种蛋白质构成,分别是牛β-乳球蛋白、牛α-乳白蛋白、牛乳血清白蛋白、免疫球蛋白,他们都属于球蛋白[9]。前3种蛋白质中对应芳香族氨基酸残基的数目见表2。

表2 3种球蛋白所含芳香族氨基酸残基数
免疫球蛋白的分子链很长,也同样存在着3种氨基酸的残基,因此可以确定,实验中所研究的蛋白质都是B类蛋白。
B类蛋白质中的酪氨酸残基,其荧光特征峰处于313nm[6],从图1中可以看到,实验中得到发射谱谱峰在336nm处,这说明浓缩乳清蛋白粉溶液荧光符合B类蛋白的特点,其发出的荧光主要来自于色氨酸残基。
3.2高斯多峰拟合结果的分析
高斯多峰拟合的结果(见图2)说明,相对于原始发射谱,高斯多峰拟合的方法能清楚地分辨重叠的荧光峰,并给出了这些荧光峰的准确位置,以及每个单峰的强度和半峰宽的数值。
3.2.1荧光峰1
游离态的酪氨酸在水溶液中的荧光峰位于303nm,当作为残基存在于蛋白质中时,其荧光特征峰位于313nm[6],比较两个数据,可推测314nm处的荧光峰1对应的是球蛋白中的酪氨酸残基。这说明在激发光为278nm时,酪氨酸残基也得到了激发,但因为能量转移和荧光效率相对不高等因素[6-7],造成在浓度相同的情况下,其荧光强度弱于色氨酸残基(见图2中荧光峰2、3),并且其荧光峰完全被峰2所覆盖,这也直观地说明了为什么在浓缩乳清蛋白粉水溶液的发射谱中,观察不到前者荧光峰。
3.2.2荧光峰2
当色氨酸处于游离态时,其发射峰在348nm处,而作为残基存在于蛋白质当中时,其发射峰的位置会随着所处的环境极性的改变而发生显著变化。当蛋白质所处溶剂的极性增加时,其荧光峰红移[9],因而其荧光峰的位置不是一个固定值,而是在325~352nm范围内有所变动[10],为此人们常常利用色氨酸荧光峰位置来判断蛋白质分子的构象。
Burstezin通过对蛋白质水溶液荧光光谱的研究,提出了色氨酸残基存在的3种基本微环境[11-12]:
1)当色氨酸残基处于蛋白质内部非极性区域时,发射峰位于330nm到332nm之处;
2)当色氨酸残基处于蛋白质表面区域,并与水溶液的相互接触受到限制时,其发射峰处于340nm到342nm之处;
3)当色氨酸残基整体处于水溶液中时,其发射峰位于350nm到352nm之处。
结合图2推断,图中329nm处的荧光峰2对应的是色氨酸残基,并且其所处的环境是位于疏水的非极性区域,此时色氨酸残基被包裹在B类蛋白分子的内部。
3.2.3荧光峰3
蛋白质所处环境的极性显著影响色氨酸的荧光峰的位置[9 ]。根据上面的分析可以看出,在色氨酸残基所在位置从蛋白质分子内部向水溶液移动的过程中,随着极性的增加,其发射峰持续红移,故351nm处的荧光峰3对应的也是色氨酸残基,其所处环境是极性区域,即完全暴露水溶液中。综合以上分析,乳清蛋白粉水溶液中的色氨酸的残基,一部分处于B类蛋白分子内部,一部分处于水溶液当中。
3.2.4荧光峰4
382nm处的荧光峰4对应的荧光团尚不清楚,可能在浓缩乳清蛋白粉中还含有不明确的成分,需进一步研究。
总结以上分析结果可知,相对原始发射光谱而言,利用高斯多峰拟合方法获得了更多关于荧光团的信息,这也为利用高斯多峰拟合方法测定浓缩乳清蛋白粉当中蛋白质结构以及质量检测提供了一定的参考。
4 结 语
利用高斯多峰拟合的方法,明确了浓缩乳清蛋白粉水溶液发射谱中各重叠荧光峰的位置、强度和宽度,并分析了对应荧光团的成分。
1)浓缩乳清蛋白粉溶液荧光符合B类蛋白质的特点,其发出的荧光主要来自于其中的色氨酸残基。
2)浓缩乳清蛋白粉溶液的发射谱由4个单峰叠加而成,其中强度最大的3个单峰对应的分别是酪氨酸残基和处于两种不同环境下的色氨酸残基,比较三者强度发现,因为能量转移和荧光效率相对较低等因素,造成在浓缩乳清蛋白粉水溶液发射谱中难于发现酪氨酸残基的荧光峰。
3)峰4对应的荧光团尚不清楚,需进一步研究。
[1]韩雪,孙冰.乳清蛋白的功能特性及应用[J].中国乳品工业,2003,31(3):28-30.
[2]任雁,赵丹,张烨,等.乳清蛋白的功能成分及其主要应用[J].中国食品添加剂开发应用,2007,12(3):142-146.
[3]龚广予,巫庆华,吴正钧,等.乳铁蛋白的生理功能[J].中国乳品工业,2001,29(1):20-23.
[4]TakadaY,MatsuyamaH,KatoK,etal.Milkwheyproteinenhancesthebonebreakingforceinovariectomizedrats[J].Nutr.Res.,1997,17:1709-1720.
[5]郭尧君.荧光实验技术及其在分子生物学中的应用[M].北京:科学出版社,1979:123-127,134-135.
[6]陈国珍,黄贤智,郑朱梓,等.荧光分析法[M].2版.北京:科学出版社,1990:18,105,502.
[7]王守业,徐小龙,刘清亮,等.荧光光谱在蛋白质分子构象研究中的应用[J].化学进展,2001,13(4):259-261.
[8]陶慰孙.蛋白质分子基础[M].北京:人民教育出版社,1981:229.
[9]蒲玲玲,郭长江.乳清蛋白的组成及其主要保健功能[J].中国食物与营养,2011,17(6):68-70.
[10]尹燕霞,向本琼,佟丽.荧光光谱法在蛋白质研究中的应用[J].实验技术与管理,2010,27(2):33-36.
[11]BurstezinEA,VedenkinaNS,LykovaMN.Fluorescenceandthelocationoftryptophanresiduesinproteinmolecules[J].PhorothemisrryandPhofobioloay,1973,18(4):263.
[12]薛泽春,程新胜.鸡肝脏谷胧甘肤转移酶的荧光光谱分析[J].光谱学与光谱分析,2007,27(1):99-103.
Analysis of condensed whey protein powder based onfluorescencespectroscopy
ZHAO Ting
(Section of Mathematics and Physics Teaching and Research, Bengbu Medical College, Bengbu 233030, China)
AnalysisoftheaqueoussolutionfromcondensedwheyproteinpowderbasedonfluorescencespectroscopyshowthatthefluorescenceofthesolutionisconsistentwiththecharacteristicsofBproteins,inwhichthespectrumisconsistedof4singlepeakswhilethethreemaximumstrengthemissionsarecorrespondenttotryptophanresiduesandtwo-conditionbasedtyrosineresiduesrespectively.
concentratedwheyproteinpowder;fluorescencespectrum;componentanalysis.
2016-05-06
赵挺(1981-),男,汉族,江苏无锡人,蚌埠医学院助教,硕士,主要从事光谱分析方向研究,E-mail:guangmingstar@163.com.
10.15923/j.cnki.cn22-1382/t.2016.4.06
O433.1
A
1674-1374(2016)04-0336-06
