2,3-二甲氧羰基-6,7-二氰基四硫富瓦烯衍生物合成
2016-10-12侯瑞斌李东风
于 慧,郭 佳,侯瑞斌,李东风
(长春工业大学 化学与生命科学学院, 吉林 长春 130012)
2,3-二甲氧羰基-6,7-二氰基四硫富瓦烯衍生物合成
于慧,郭佳,侯瑞斌,李东风*
(长春工业大学 化学与生命科学学院, 吉林 长春130012)
在亚磷酸三乙酯存在下,利用高度稀释技术,通过4,5-二氰基-1,3-二硫杂环戊烯-2-酮和4,5-二甲氧羰基-1,3-二硫环戊烯-2-硫酮的交叉偶联反应,成功地合成了关键前躯体二氰基四硫富瓦烯衍生物,用 NMR、TOF-Ms和IR表征了其结构,并用循环伏安法和紫外吸收光谱初步评价了四硫富瓦烯衍生物的电化学性质和光物理性质。
高度稀释; 四硫富瓦烯; 交叉偶联; 合成
0 引 言
四硫富瓦烯(Tetrathiafulvalene, TTF)及其衍生物因其特有的氧化还原性质一直受到人们极大的关注。所以,TTF及其衍生物的化学研究主要是围绕电荷转移复合物导电性展开,一直是有机导体和超导体的最主要研究候选化合物。最近几年,TTF衍生物修饰双功能基团化合物在光、电、磁方面的应用已经成为TTF化学领域研究的热点之一。尤其是把TTF衍生物骨架修饰到大环分子中开发具有特定功能性分子的研究仅有近40多年的历史。1985年,Otsubo实验组[1]首次把TTF衍生物结构单元和冠醚结构单元连接在一起,合成出了具有离子选择性的TTF——冠醚衍生物。此后,把TTF骨架修饰到大环化合物上合成具有特定功能超分子化合物(如化学传感器、分子导线、轮烷和索烃、分子开关等)已经成为材料界的研究热点之一[2-6]。
近年来,合成化学家们尝试着用连接基团把TTF结构单元与具有电、光、磁活性的卟啉、四氮杂卟啉(紫菜嗪))或者酞菁单元结合起来,得到了一系列结构新颖有机功能大环化合物。Becher课题组[7]首次报道了利用单吡咯并TTF衍生物作为前驱体分子把TTF骨架共轭连接到卟啉母体上。最近,我们利用较简便的溶剂高度稀释的方法成功地合成了一系列结构较为新颖二氰基取代四硫杂冠醚的TTF衍生物,并以此系列衍生物为反应关键前躯体,首次成功地合成了一系列TTF四硫杂冠醚(18-冠-6,12-冠-4)取代的均称四氮杂卟啉衍生物[8]。
基于以上研究现状,在这里我们报道二甲氧羰基和二氰基四取代的TTF衍生物的合成及其电化学性质和光物理性质初步研究。此TTF衍生物可看作是合成带有二甲氧羰基TTF骨架修饰的四氮杂卟啉衍生物的关键前驱体化合物,在合成TTF修饰均称四氮杂卟啉的时,由于在TTF的骨架上引入了羰基,由于羰基的吸电子相应,可以有效地提高目标化合物的稳定性,为进一步物性研究打下非常好的基础。
1 实验部分
1.1仪器与主要试剂
傅里叶变换FT-IR1730红外光谱仪;
瑞士布鲁克公司AVANCE 400 MHz(TMS为内标,CDC13为溶剂)核磁共振谱仪;
岛津Axima CFRTMPlus基质辅助激光解析飞行时间质谱仪;
Hitachi 3010型紫外分光光度仪;
Perkin Elmer potentiastat/Galvanostat model 273A电化学分析仪;
熔点用毛细管法测定,温度计未经校正。所有实验用试剂均为市售分析纯级别试剂,除了进口试剂以外,都做无水处理或精制;
柱层析用青岛海洋化工厂试剂级硅胶(100~200目)。
1.2合成路线
目标化合物(化合物1)的合成路线描述如下:
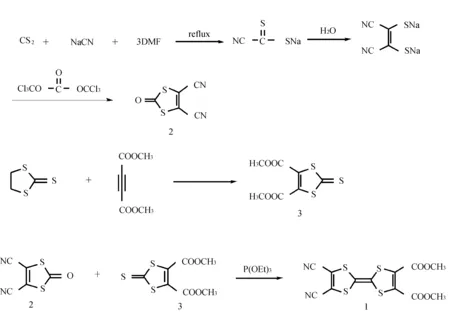
1.3合成方法
1.3.14,5-二氰基-1,3-二硫杂环戊烯-2-酮(化合物2)的合成[9]
在 100 mL反应器中,加入 3.0 g(61.2 mmol)氰化钠,5.0 g(65.78 mmol) 精制的CS2,搅拌,控制油浴温度65~70 ℃下回流, 在回流的情况下缓慢滴入15.0 g(205 mmol)N,N-二甲基甲酰胺(DMF),反应1 h以后冷却室温,缓慢加入无水乙醚,放置后抽滤得固体13.68 g,产率65.2%。取上述产物,加入 138 mL蒸馏水放置24 h,过滤,滤液加入大量苯,利用共沸减压蒸去H2O,干燥得到马来腈二钠盐7.05 g,产率68.6%。将得到的7.05 g(38.7 mmol)上述产物马来腈二钠盐加入69 mL精致苯,搅拌下,缓慢滴入溶在35 mL苯中的3.75 g(12.6 mmol) 三氯甲基碳酸酯溶液,在室温条件下, 搅拌反应2 h,抽滤减压浓缩蒸去苯后,进行硅胶柱层析[洗脱剂 CHCl3∶石油醚=1∶2 (v∶v)],四氯化碳重结晶,得到白色针状固体,产率 55%。
1.3.24,5-二甲氧羰基-1,3-二硫环戊烯-2-硫酮(化合物3)的合成[8]
在500 mL反应器中,加入丁炔二酸二甲酯24.16 g(0.17 mol), 1,3-环戊-2-硫酮23.17 g(0.17 mol),150 mL精制的甲苯。回流反应8 h, 冷却到室温,蒸出甲苯直到出现油状物后,加入石油醚出现黄色沉淀。33.46 g(78.66%),mp:85.2~86.8 ℃。1H NMR (400 MHz,CDCl3)δ:3.92 (s, 6H)。
1.3.32,3-二甲氧碳基-6,7-二氰基四硫富瓦烯(化合物1)的合成
在250 mL恒压滴液漏斗中加入用60 mL甲苯溶解的化合物4,5-二氰基-1,3-二硫-2-酮(336 mg,2 mmol)和化合物2(500.6 mg,2 mmol)。在氢气的保护下,缓慢滴加到温度为140~150 ℃的装有10 mL亚磷酸三乙酯和20 mL甲苯的250 mL的四口瓶中。保持油浴温度在140~150 ℃,并控制在1 h左右滴加完,继续搅拌1 h,放冷后浓缩,最后用油泵减压蒸出亚磷酸三乙酯。进行柱层析,洗脱剂CH2Cl2∶PE=1∶1(v∶v),收集Rf=0.63的紫色溶液,浓缩后得紫黑色固体。用石油醚重结晶,得紫黑色针状晶体。干燥后称重为133 mg(18%)。
m.p. 63.2 ℃;
1H NMR(CDCl3,400 MHz),δ:3.86(s, 6H);
13CNMR(CDCl3,80 MHz),δ:159.020,131.92,120.69,118.84,108.93;
IR(KBr;cm-1):2 959,2 870,2 216,1 734; ALDI-TOF MS m/z:370.9(M+,100%)。
1.4目标化合物的电化学性质检测
本研究用Perkin Elme rpotentiastat/Galvanostat model 273A 电化学仪分析,三电极体系分别以饱和甘汞电极、铂丝电极和玻碳电极为参比电极、辅助电极和工作电极。Bu4NPF6作支持电解质(0.1 mol/L),溶剂为乙腈-二氯甲烷 (1∶5,v∶v),扫描速率为100 mV/s,样品浓度为1.0×10-3mol/L。扫描温度为25 ℃。
1.5目标化合物的紫外吸收测定
将目标化合物配制成1.0×10-4mol/L二氯甲烷溶液,进行紫外吸收光谱测定。
2 结果与讨论
2.1目标化合物的合成
采用高度稀释方法(甲苯和亚磷酸三乙酯),经4,5-二氰基-l,3-二硫-2-酮(化合物2)和4,5-二甲氧羰基-1,3-二硫环戊烯-2-硫酮(化合物3)的交叉偶联反应,以较理想产率成功的合成二甲氧羰基和二氰基四取代的TTF衍生物。反应进行的最佳油浴温度为140~150 ℃之间,最佳反应时间1~2 h。利用NMR、IR和TOF-Ms对目标化合物1 的结构进行了充分表征,表征结果证明已经成功合成目标化合物。
2.2目标化合物的电化学性质
目标化合物1的循环伏安图如图1所示。
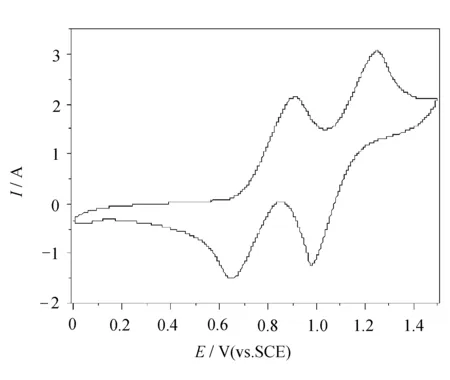
图1 目标化合物1的循环伏安图
氧化还原电位数据见表1。
表1 目标(化合物1)的氧化电位和ΔE
从图1中峰位可以看到,目标化合物1表现出最典型TTF的氧化还原性质,每一对氧化还原波都表示TTF单元有一个电子的得失,它们分别归属于TTF+/TTF,TTF2+/TTF+,但是目标化合物(化合物1)的第一对氧化还原电位之间的差值在27 mV,与Nerst 体系存在一定程度的偏差,因此不是严格的电化学可逆过程。
从表1中数据可以看出,化合物的半波电位在781 mV和1 115 mV,与在同等条件下测得四甲基四硫富瓦烯(TMT-TTF)氧化还原电位相比具有相当程度的正移,这是由于两个羰基和两个氰基的强吸电子作用使 TTF 基团的电子云密度降低,氧化还原电位均升高,这与理论是完全一致的。
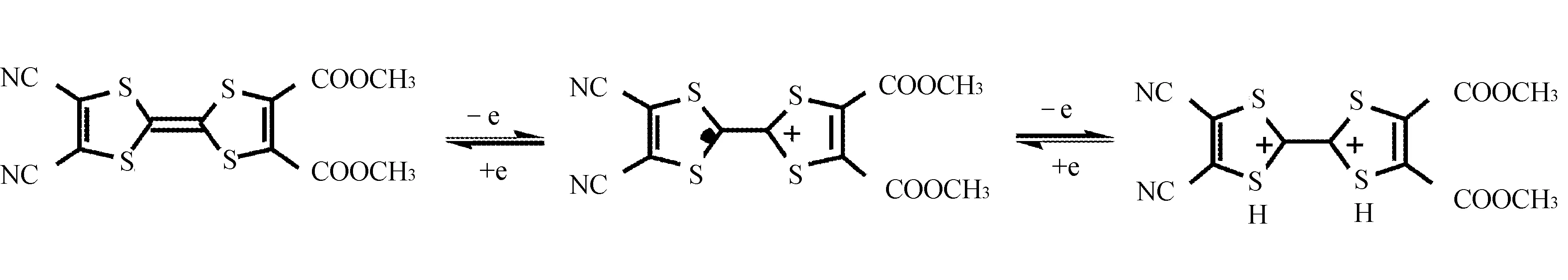
化合物1可能的电荷转移机理可推测为:
2.3目标化合物1的紫外光谱
溶液中的紫外吸收光谱反映了化合物在溶液中的电子跃迁的难易程度。从图2 可以看出化合物1 在CH2Cl2中有较大的吸光度值,说明了化合物1在溶液中相对易跃迁。但是相对于TTF 电子跃迁不易跃迁。
目标化合物 1最大吸收波长λmax=319 nm,为四硫富瓦烯化合物的π→π*电子跃迁,如图2所示。
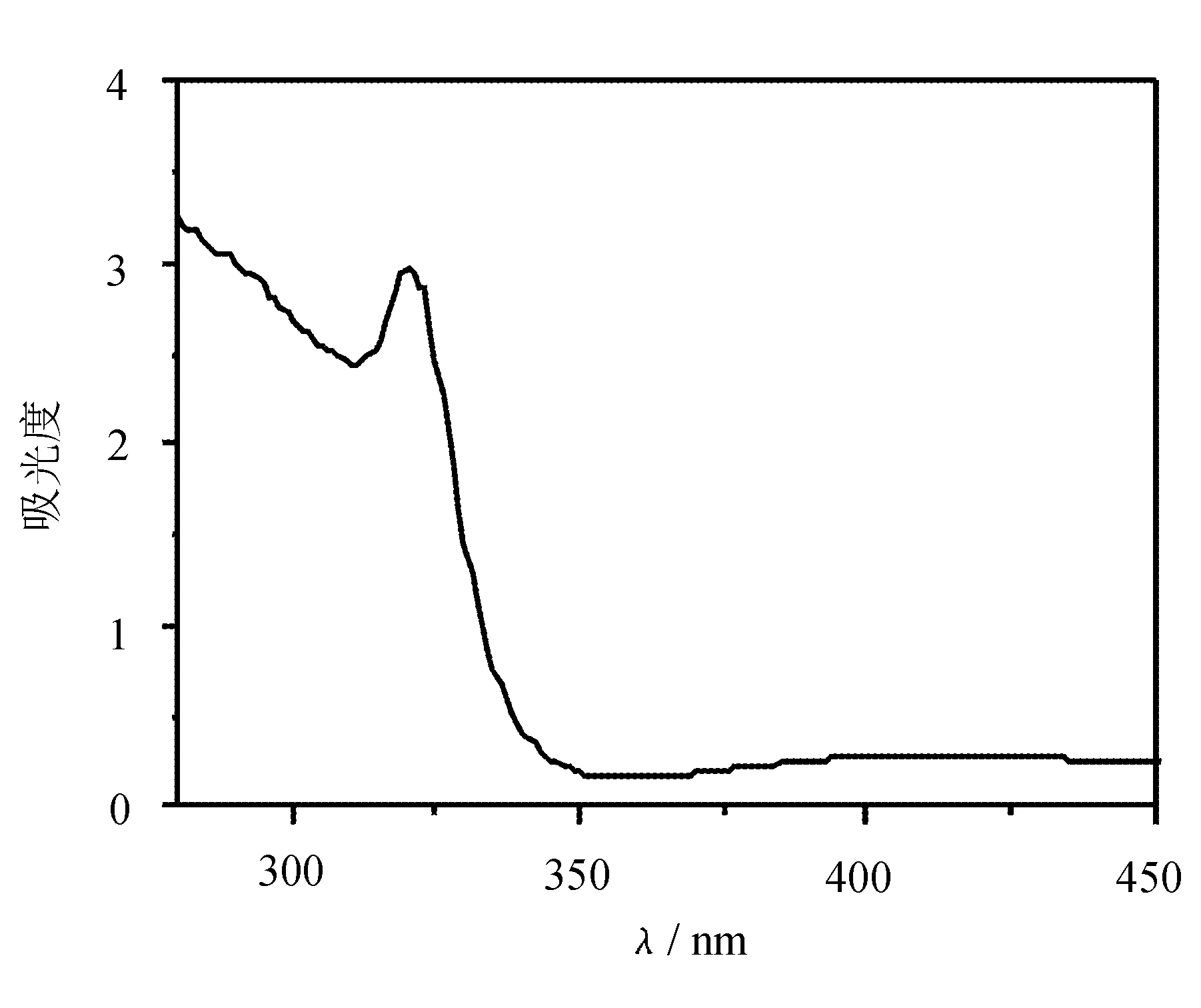
图2 目标化合物1(1.2×10-4 M)二氯甲烷中的紫外吸收光谱
3 结 语
采用高度稀释的方法,以较理想的产率成功地合成了结构新颖的二甲氧羰基和二氰基取代的四硫富瓦烯(TTF)衍生物(化合物1),通过 NMR,IR,Ms进行充分结构表征,利用循环伏安法(CV)初步研究了目标化合物1的电化学性质,结果表明,目标化合物显示出典型 TTF 衍生物的氧化还原性质,但不是严格的可逆过程,是准可逆过程。
目标化合物由于含有二氰基吸电子基,使化合物稳定性增强,该化合物的合成为研究TTF修饰四氮杂卟啉类化合物合成及性质研究奠定了基础。
[1]Otsubo T, Ogura F. Cromled tetrathiafulvalene derivatives[J]. Bul1.Chem.Soc.Jpn.,1985,58(4):1343-1344.
[2]Hansen T K, Joergensen T, Stein P C, et al. Crown ether defivatives of tetrathiafulvalene[J]. J. Org. Chem.,1992,57(24):6403-6409.
[3]Nieisen M B, Becher J. Two-and three-dimensional tetrathiafulvalene macrocycles[J]. Liebigs Ann. Recueil,1997:2177-2187.
[4]Jeppesen J O, Becher J. Pyrrolo-tetrathiafulvalenes and their applications in molecular and supmmolecular chemistry[J]. Eur. J. Org. Chem.,2003,17:3245-3266.
[5]Jørgensen T, Hansen K, Becher J. Tetrathiafulvalenes as building-blocks in supramolecular chemistry[J]. Chem. Soc. Revm,1994,23(1):41-51.
[6]李东风,侯瑞斌,黄卓.二氰基取代的硫杂冠醚并四硫富瓦烯(TTF)衍生物的合成[J].长春工业大学学报:自然科学版,2012,33(6):579-582.
[7]Becher J, Brimert T, Jeppesen J O, et al. Tetrathiafulvaleno-annelated porphyrins[J]. Angew. Chem. Int. Ed. ,2001,40(13):2497-2500.
[8]Hou Rui bin, Li Bao, Zhong Ke Li, et al. Tetrakis(tetrathiafulvalene-tetrathiacrown ether) porphyrazine Triads: Synthesis[J]. Photophysical and Electrochemical Properties. Eur. J. Org. Chem.,2012(6):1138-1146.
[9]Leng Fengshou, Hou Ruibin, Jin Longyi, et al. Synthesis, characterization and electrochemistry of the novel metalloporphyrazines annulated with tetrathiafulvalene having pentoxycarbonyl substituents[J]. Journal of Porphyrins and Phthalocyanines,2010,14:110-114.
Synthesis of dimethyl 2-(4,5-dicyano-1,3-dithiol-2-ylidene)-1,3-dithiole-4,5-dicarboxylate
YU Hui,GUO Jia,HOU Ruibin,LI Dongfeng*
(School of Chemistry & Life Science, Changchun University of Technology, Changchun 130012, China)
With high dilution technique, cross-coupling reaction happens between 4,5-dicyano-1,3-dithiol-2-one(2) and dimethyl 2-thioxo-1,3-dithiole-4,5-dicarboxylate(3) in toluene to produce the asymmetrical diycano tetrathiafolvalene derivative(1) in the presence of triethyl phosphate. The structures are characterized by NMR, TOF-Ms and IR. Electrochemical and photo physical properties are evaluated with cyclic voltammograms and UV absorption spectrum.
high dilution; tetrathiafulvalene; cross-coupling; synthesis.
2016-04-19
国家自然科学基金资助项目(21442004)
于慧(1990- ),女,汉族,吉林吉林人,长春工业大学硕士研究生,主要从事有机合成方向研究,E-mail:714070158@qq.com. *通讯作者:李东风(1964-),男,汉族,吉林长春人,长春工业大学教授,博士,主要从事有机合成方向研究,E-mail:lidongfeng@ccut.edu.cn.
10.15923/j.cnki.cn22-1382/t.2016.4.03
O 626
A
1674-1374(2016)04-0323-05
