CVD法制备硅硼碳氮陶瓷的化学反应热力学研究
2016-10-12任海涛刘家臣郭安然天津大学先进陶瓷加工技术教育部重点实验室天津30007西北工业大学超高温结构复合材料重点实验室西安7007
任海涛,刘家臣,郭安然天津大学 先进陶瓷加工技术教育部重点实验室,天津30007西北工业大学 超高温结构复合材料重点实验室,西安7007
CVD法制备硅硼碳氮陶瓷的化学反应热力学研究
任海涛1,2,刘家臣1,郭安然11天津大学 先进陶瓷加工技术教育部重点实验室,天津3000722西北工业大学 超高温结构复合材料重点实验室,西安710072
本文针对制备SiBCN 陶瓷所用的SiCl3CH3-BCl3-NH3-H2体系,基于已建立的热化学数据库,根据化学平衡原理,确定了不同工艺参数下各反应体系中一些重要产物的平衡产量分布,给出了相应体系的固相产物分布规律,为实验研究提供可靠的理论参考。
硅硼碳氮陶瓷;CVD;热力学计算
化学气相沉积 (Chemical Vapor Deposition,CVD) 是上世纪60年代发展起来的制备无机材料的新技术,它是在一定温度下通过一种或几种气体在固体表面进行化学反应 (包括分解反应、化合反应、化学输运反应等),在该固体表面生成固态沉积物的过程。如果固体是多孔材料,沉积也可以发生在固体的内部表面,这种沉积过程一般称为化学气相渗透 (Chemical Vapor Infiltration,CVI)。CVD具有以下突出优点[1-3]:(1) 实用性强,能在较低温度下 (900°C ~ 1100°C) 制备出熔点高达3000°C的陶瓷材料,如碳化物、氮化物、硼化物等,这是传统粉末冶金和陶瓷烧结技术都难以达到的;(2) 对基底几乎没有损伤,保证了材料结构的完整性;(3) 工艺灵活,能通过控制 CVD 工艺参数来控制沉积产物的晶体结构、表面形貌和晶体取向等;(4)能在复杂形状构件上制备均匀涂层。
采用CVD方法制备无机材料的反应过程涉及到的化学反应十分复杂,理解和掌握这些反应的机理对于先驱体的选择、反应器的设计、工艺参数的优化以及材料的微观尺度设计都有极其重要的意义。对于一个新的CVD体系,一般需要先进行反应热力学分析,根据化学平衡原理,即化学势 (吉布斯自由能) 最小化原理,计算在不同工艺参数 (温度、压力及进气比) 下一些重要产物尤其是固相产物的平衡产量分布,用来预测平衡条件下工艺参数对体系CVD产物类型与产量的影响。对于非动力学控制的过程,热力学分析可以定量描述沉积产物组成,有助于优化沉积条件和了解沉积机制。通过热力学计算,绘制不同工艺参数下产物相图可为实验研究提供参考和依据。在热力学可能的范围内进行实验,可有效减少实验数量,缩短实验周期和降低实验成本。
本文针对制备SiBCN 陶瓷的SiCl3CH3-BCl3-NH3-H2体系,基于已建立的热力学数据库 (其中包括Si-B体系[4]的211种,B-N体系[5]的136种,Si-N体系[6]的155种, Si-C-N体系[7]的438种,以及文献 [8] 中B-C体系的154种和文献 [9] 中Si-C体系的221种),综合考虑所有可能气相产物,再结合气相Si、B、C、N、H和Cl原子以及体系相关重要固相产物共14种 (固相硼、石墨碳、金刚石碳、固相硅、B4C、SiB3、SiB6、SiB14、两种结构的碳化硅α-SiC和β-SiC、氮化硅Si3N4,三种结构的氮化硼h-BN、c-BN和w-BN) 在JANAF[10]里的实验数据,得到典型工艺参数下的产物平衡产量分布以及重要固相产物生成量与工艺参数的关系。通过分析和总结,从理论上说明不同固相产物沉积的最佳热力学条件,揭示反应规律,优化制备工艺参数,为实验研究提供理论指导。
1 相关产物平衡产量算法
根据化学平衡原理,即体系总吉布斯自由能 (化学势) 最小的数学条件,由式 (1) 可获得所有产物的平衡产量分布:
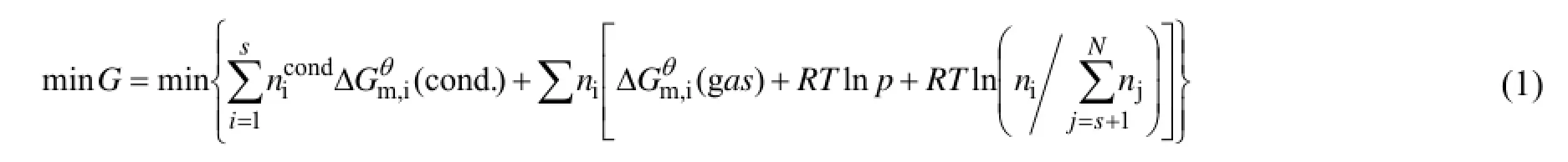
式中,s是体系的总固相物种数,N是体系总物种数,p是总压,ni是气相第i个物种物质的量,nicond.是固相第i个物种的质量,它们满足如下关系:

其中,aij是物种i中元素j的原子数,Bj是元素j的总原子数,M代表不同元素的总数。
气相 [ΔGmθ(gas)] 和固相 [ΔGmθ(cond.)] 的标准摩尔吉布斯自由能 (或在任意温度下的吉布斯自由能) 由Gibbs公式计算:

其中,

需说明的是,上式积分中的热容Cp,m并不是生成反应的产物与反应物的热容差,因此,计算结果并不是生成焓或生成吉布斯自由能数据。
2 结果与讨论
2.1典型工艺参数下的平衡产量分布
计算过程所选择的典型参数为:总压1000 Pa;温度300 K ~ 2000 K;先驱体进气比SiCl3CH3: BCl3: NH3: H2= 5:1:4:50,总进气量为1 mol。

图1 SiCl3CH3-BCl3-NH3-H2体系在300 K ~ 2000 K时最大产量大于10-2mol的平衡分布图Figure 1 Equilibrium concentration distribution of the species having a maximum concentration larger than 10-2mole for the system SiCl3CH3-BCl3-NH3-H2in the temperature range from 300 K to 2000 K
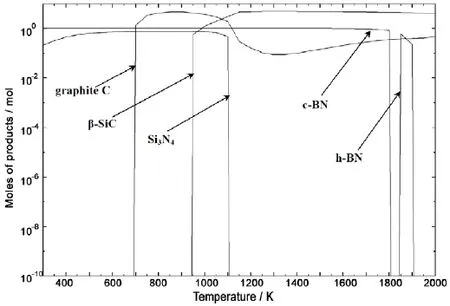
图2 SiCl3CH3-BCl3-NH3-H2体系固相产物的平衡产量分布图Figure 2 Equilibrium concentration distribution of the condensed phase in the system SiCl3CH3-BCl3-NH3-H2
图1为300 K ~ 2000 K体系最大产量大于10-2mol的产物平衡分布图。图2为体系固相产物的产量平衡分布图。
由图1可以看出,从300 K开始,没有发现反应物SiCl3CH3和BCl3,反而发现CH4和SiCl4,这说明在300 K时反应物SiCl3CH3和BCl3可能已分解为CH4和SiCl4。由图2可以看到:立方氮化硼 (c-BN) 的生成温度范围是300 K ~ 1810 K;六方氮化硼 (h-BN) 生成的温度范围为1860 K ~ 1910 K;石墨碳在大于690 K时可以生成;对于固相β-SiC,可以看出其生成条件为950 K以上;而Si3N4则只能在1110 K以下产生。由图2可知,在950 K ~ 1100 K可实现C + SiC + Si3N4+ BN四相共沉积,高于1100 K则可实现C + SiC + BN 三相共沉积,在700 K ~ 950 K,则可实现C + Si3N4+ BN三相共沉积。
热力学计算表明,在此工艺条件下,其它固相产物无法稳定存在。
2.2固相产物生成量与温度和进气比MTS/(MTS+NH3) 的关系
设定体系总压为 1000 Pa,保持SiCl3CH3(MTS) 与 NH3总进气量为 5 mol,BCl3进气量为 1 mol,稀释气体 H2进气量为 5 mol,进气比r = MTS/(MTS + NH3) 为变量,通过计算得到固相产物生成量与温度T (300 K ~ 2000 K) 和进气比r (0.0 ~ 1.0) 的关系如图3所示。
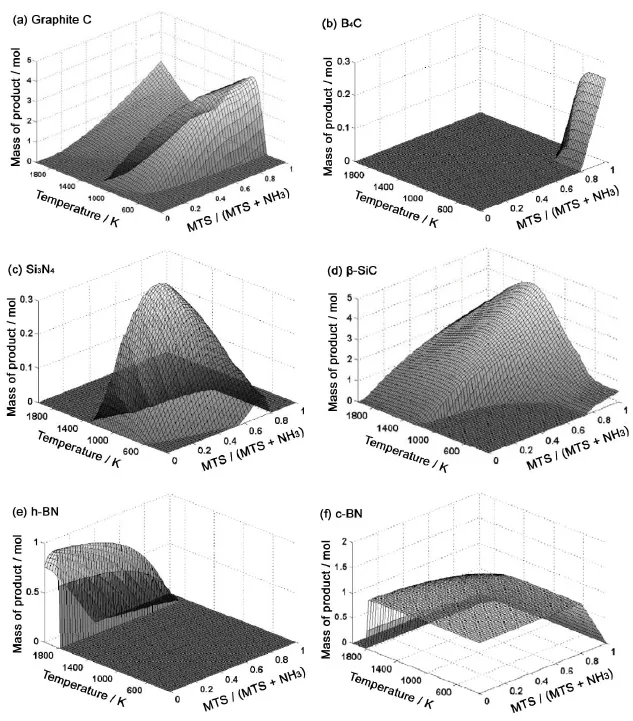
图3 固相产物生成量与温度T和进气比r = MTS/( MTS+ NH3)的关系Figure 3 Mass of production of the condensed phases as a function of temperature and r ratios
图3分别为石墨碳 (C)、B4C、固相Si3N4、β-SiC、h-BN和c-BN的生成量与温度T和进气比r关系的三维曲面图,而其它固相产物在设定工艺参数下无法稳定存在。由图3 (a) 可以看到,温度T和进气比r对石墨碳的生成有极大影响,石墨碳主要生成温度为650 K ~ 1300 K。由图3 (b) 可以看到,B4C的生成范围非常小,仅在r > 0.8且温度小于900 K才可能产生。由图3 (c) 可见,固相Si3N4只有T < 1400 K时才能产生,生成固相Si3N4的最佳进气比r = 0.7。由图3 (d) 可知,温度T和进气比r对固相β-SiC也有很大影响:在r < 0.7时,β-SiC生成温度为1200 K以上;当r > 0.8时,β-SiC在300 K以上即可产生。由图3 (e) 和图3 (f) 可以看出,对于固相c-BN和h-BN,以约1800 K为界限,高于1800 K生成固相h-BN,低于1800 K生成固相c-BN。
3 结束语
本文对SiCl3CH3-BCl3-NH3-H2体系进行了热力学产物平衡产量分布研究,计算得到CVD工艺参数与体系相关重要固相产物共14种 (固相硼、石墨碳、金刚石碳、固相硅、B4C、SiB3、SiB6、SiB14, 两种结构的碳化硅α-SiC和β-SiC、氮化硅Si3N4、三种结构的氮化硼h-BN、c-BN和w-BN)生成量之间的关系,从理论上说明不同固相产物沉积的最佳热力学条件,为实验研究提供理论指导。
需要说明的是热力学计算前提为化学平衡状态,揭示反应能否发生、可能的产物,计算结果仅是一种可能性。而CVD 是一个非平衡反应过程,化学反应体系复杂。CVD 动力学包括气相反应、基底表面反应、化学吸附和解吸附等,这些因素均会导致实验结果与热力学计算结果存在部分差异,热力学计算可作为 CVD 实验的前导和参考。
[1] 刘荣军, 周新贵, 张长瑞, 等. 化学气相沉积 (CVD) 法制备先进陶瓷材料[J]. 高科技纤维与应用,2002, (2): 16-20.
[2] CHOY KL. Chemical vapour deposition of coatings [J]. Progress in Materials Science, 2003, 48 (2): 57-170.
[3] 孟广耀. 化学汽相淀积与无机新材料[M]. 北京: 科学出版社, 1984.
[4] REN H, ZHANG L, SU K, et al. Thermodynamics investigation of the gas-phase reactions in the chemical vapor deposition of silicon borides with BCl3-SiCl4-H2precursors [J]. Structural Chemistry, 2014, 25 (5): 1369-1384.
[5] REN H, ZHANG L, SU K, et al. Thermodynamic study on the chemical vapor deposition of boron nitride from the BCl3-NH3-H2system [J]. Theoretical Chemistry Account, 2014, 133 (11): 1-13.
[6] REN H, ZHANG L, SU K, et al. Thermodynamic study on the chemical vapor deposition of silicon nitride from the SiCl4-NH3-H2system [J]. Computational and Theoretical Chemistry, 2015, 1051: 93-103.
[7] REN H, ZHANG L, SU K, et al. Thermodynamic study of the chemical vapor deposition in the SiCl3CH3-NH3-H2system [J]. Chemical Physics Letters, 2015, 623: 29-36.
[8] ZENG Y, SU K, DENG J, et al. Thermodynamic investigation of the gas-phase reactions in the chemical vapor deposition of boron carbide with BCl3-CH4-H2precursors [J]. Journal of Molecular Structure: THEOCHEM, 2008, 861 (1-3): 103-116.
[9] DENG J, SU K, WANG X, et al. Thermodynamics of the gas-phase reactions in chemical vapor deposition of silicon carbide with methyltrichlorosilane precursor [J]. Theoretical Chemistry Account, 2008, 122(1-2): 1-22.
[10] CHASE MW. NIST-JANAF thermochemical tables forth edition [J]. Journal of Physical and Chemical Reference Data, 1998, Monograph 9.
Thermodynamic Investigation of the Chemical Reactions in the Chemical Vapor Deposition of the Si-B-C-N System
REN Hai-Tao1,2, LIU Jia-Chen1, GUO An-Ran11Key Laboratory of Advanced Ceramics and Machining Technology of Ministry of Education, School of Materials Science and Engineering, Tianjin University, Tianjin 300072, China2Science and Technology on Thermostructure Composite Materials Laboratory, School of Materials Science and Engineering, Northwestern Polytechnical University, Xi’an 710072, China
The chemical reaction thermodynamic of the chemical vapor deposition in the SiCl3CH3-BCl3-NH3-H2system was investigated. Based on the thermochemistry data which are calculated in the early works, with the principle of chemical equilibrium, the distribution of the equilibrium concentration of the species and the production of the specific solid phases at different reaction parameters of the CVD process in the system are obtained respectively. It is instructive to experiments at any new conditions.
SiBCN ceramic; CVD; Thermodynamic
O642
1005-1198 (2016) 04-0290-06
A
10.16253/j.cnki.37-1226/tq.2016.06.006
2016-06-15
2016-06-18
国家自然科学基金 (50572089, 50642039)。
任海涛 (1982 -), 男, 河北保定人, 博士后。E-mail: renht0929@163.com。
