CXCR7表达增强促进内皮祖细胞血管生成能力
2016-10-09程鹏何露清凌骁林秀飞李校堃
程鹏,何露清,凌骁,林秀飞,李校堃
(温州医科大学 药学院 中美糖尿病并发症研究所,浙江 温州 325035)
CXCR7表达增强促进内皮祖细胞血管生成能力
程鹏,何露清,凌骁,林秀飞,李校堃
(温州医科大学药学院中美糖尿病并发症研究所,浙江温州325035)
目的:考察提高CXCR7表达能否提高内皮祖细胞(EPCs)血管生成能力。方法:利用高表达CXCR7的腺病毒转染至人脐带血来源的EPCs,建立CXCR7high-EPCs工程化细胞。比较CXCR7high-EPCs与对照组EPCs在无血清条件下存活、黏附、经基质细胞衍生因子-1(SDF-1)诱导的跨内皮迁移、管样结构形成以及一氧化氮(NO)生成能力。结果:高表达CXCR7能显著增强EPCs在无血清条件下细胞存活能力、黏附功能、SDF-1诱导的跨内皮迁移、管样结构形成以及EPCs生成NO的能力,并且与SDF-1有协同作用。结论:提高CXCR7在人脐带血来源的EPCs中表达能够增强其血管生成能力,这为临床治疗血管性疾病提供新思路。
CXCR7;内皮祖细胞;细胞存活;管样结构形成
早在1997年,内皮祖细胞(endothelial progenitor cells,EPCs)就能够从人的外周血中分离得到[1]。临床研究表明外周血中EPCs的数量和功能与心血管疾病风险及死亡率呈负相关[2-3]。动物实验也表明移植骨髓[4]、脐带血[5]或者外周血[6]来源的EPCs能够改善心肌缺血以及下肢缺血动物模型的血流再恢复情况。基质细胞衍生因子-1(Stromal cell-derived factor-1,SDF-1)在EPCs参与血管生成中发挥关键作用[7-11]。近新研究[12-13]发现:SDF-1的受体CXCR7也参与到SDF-1介导EPCs血管生成的过程中。尽管CXCR7在EPCs中表达量很低,但其介导SDF-1诱导细胞存活、与内皮细胞黏附、形成管样结构以及合成一氧化氮(NO)等功能不容忽视。本实验利用携带人CXCR7基因的腺病毒转染EPCs获得CXCR7高表达的EPCs。通过与空载腺病毒转染的EPCs进行比较发现:高表达CXCR7的EPCs其存活能力、黏附功能、跨内皮迁移能力、管样结构形成以及细胞生成NO能力显著得到提升,证明增强EPCs中CXCR7的表达量将显著提高细胞血管生成功能。
1 材料和方法
1.1材料 人脐带血来源于健康产妇;MCDB131培养基购自Gibco公司,人淋巴细胞分离液、荆豆凝集素(FITC-UEA-1)购自Sigma公司,EGM-2培养基购自Lonza公司,乙酰化低密度脂蛋白(Dil-ac-LDL)购自BT公司,MTT检测试剂盒购自凯基生物公司,CXCR7抗体购自Cell Signaling公司,基质胶购自Corning公司,NO检测试剂盒购自Promega公司;本实验用到超净台、细胞孵育箱、流式细胞仪、倒置显微镜、荧光倒置显微镜、电子天平、细胞超生破碎仪。
1.2方法
1.2.1EPCs的分离与培养:无菌条件下用抗凝血袋获取人脐带血约100 mL,用MCDB131培养基按1∶1的体积比稀释血液,将等体积的人淋巴细胞分离液Histopaque 1077轻微缓慢加至血液上层;500×g离心30 min,取中间白膜层细胞;培养基洗涤细胞后加入Single-Quots的EGM-2(含10% FBS)培养基重悬;铺板于预先用2 μg/cm2人纤维粘连蛋白包被的细胞培养皿中。培养的前7 d每天换液,之后每2 d 换1次液,显微镜下观察细胞形态并摄像。
1.2.2EPCs的鉴定:待EPCs传代后对其进行鉴定,利用细胞免疫荧光实验对细胞中EPCs特异性表面标记CD133及VEGFR-2的表达情况进行检测,并通过Dil-ac-LDL摄取实验和FITC-UEA-1结合实验对细胞进行EPCs内皮功能鉴定。
1.2.3转染:利用实验室设计的携带人CXCR7基因的腺病毒对EPCs进行转染,空载腺病毒转染EPCs作为阴性对照组。转染48 h后,利用免疫印迹实验检测EPCs中CXCR7的表达情况。
1.2.4EPCs凋亡检测实验:CXCR7high-EPCs和ctrl-EPCs培养至细胞密度达80%,并可进行细胞凋亡实验。实验分组情况:CXCR7high-EPCs组和ctrl-EPCs组用无血清的MCDB131培养基进行实验;CXCR7high-EPCs+SDF-1组和ctrl-EPCs+SDF-1组用含100 ng/mL SDF-1的无血清MCDB131培养基进行凋亡实验。EPCs培养48 h后,消化并收集,再用冰冷PBS洗涤2次,采用MTT检测试剂盒并利用流式细胞计数仪检测EPCs凋亡情况。
1.2.5EPCs黏附实验:原代培养出来的人脐静脉内皮细胞以1×105/孔的密度铺板于细胞24孔板中,培养至完全融合;用含有10 ng/mL TNF-α和10 ng/mL IL-1β的MCDB131培养基处理EPCs 5 h,活化内皮细胞单层;实验分组:CXCR7high-EPCs和ctrl-EPCs加至活化的内皮细胞单层上,加入不含血清的MCDB131;在CXCR7high-EPCs+SDF-1组和ctrl-EPCs+SDF-1实验组中加入含100 ng/mL SDF-1(Peprotech公司)的无血清MCDB131,37 ℃孵育15 min。实验结束后把未黏附的细胞用PBS洗去;荧光显微镜下观察,每个孔随机选取5个视野,对发绿色荧光的细胞进行计数统计。
1.2.6EPCs跨内皮迁移实验:将原代培养的人脐静脉内皮细胞以每孔5×104的密度铺板于细胞24孔板的transwell上腔,然后放在24孔板中培养至完全融合;取对数生长期的EPCs进行消化,PBS重悬;进行细胞计数,尽量保证各组别细胞数量一致;把EPCs加到transwell上腔。往CXCR7high-EPCs和ctrl-EPCs组的transwell下腔中加入无血清的MCDB131,往CXCR7high-EPCs+SDF-1和ctrl-EPCs+SDF-1组的transwell下腔中加入含有100 ng/mL SDF-1的无血清MCDB131,37 ℃孵育12 h,使EPCs穿过内皮细胞单层和transwell膜;孵育12 h后,取出transwell小室,用棉棒刮尽上腔中的细胞。荧光显微镜下,每个transwell孔随机选取5个不同视野,对穿过transwell发绿色荧光的细胞进行计数统计。
1.2.7EPCs管样结构形成实验:将包埋于碎冰中的基质胶放在4 ℃过夜解冻;移液器枪头,48孔板也放在4 ℃预冷;待第2天实验时向预冷的48孔板中每孔加入125 μL基质胶,“8”字型摇动孔板,使胶铺平,放入细胞培养箱中预热30 min,使基质胶充分凝固聚合;取对数生长期的EPCs用无血清MCDB131饥饿处理12 h,排除EGM-2培养基中血清以及生长因子对后续实验的干扰;CXCR7high-EPCs和ctrl-EPCs组别中加入无血清MCDB131;CXCR7high-EPCs+SDF-1和ctrl-EPCs+SDF-1组别中加入含100 ng/mL SDF-1的无血清MCDB131,充分混匀后以每孔2.5×105/mL的细胞密度取250 μL细胞悬液加入48孔板中,37 ℃培养12~24 h。随后把孔板放在光学显微镜下观察、拍照,用Image J测量管样结构的长度并进行统计学分析。
1.2.8EPCs NO检测实验:取各实验组细胞上清液50 μL,加入50 μL Griess Reagent I进行后续测试。空白对照组加60 μL样品稀释液,标准品组加60 μL标准品,实验各组加60 μL各组细胞上清液,将5 μL的NADPH(2 mmol/L)加至所有组别,随后各组加Nitrate Reductase 5 μL,充分混匀,37 ℃孵育30 min;孵育结束后,各组加入10 μL的LDH Buffer,接着加入10 μL的LDH,充分混匀,37 ℃孵育30 min;各组中加入Griess Reagent I、Griess Reagent I I 50 μL,充分混匀后室温孵育10 min,酶标仪在540 nm检测吸光度。进行数据统计学分析。
1.3统计学处理方法 采用SPSS18.0软件进行统计学处理。实验数据以±s表示,同一实验多组间的差异比较采用单因素方差分析,两两比较采用独立样本t检验。P<0.05为差异有统计学意义。
2 结果
2.1EPCs的分离与培养结果 分离的细胞在人纤维黏连蛋白包被的培养皿中培养7 d后,开始出现典型的细胞集落,随后原本梭形的细胞逐渐消失,最终成铺路石样(见图1A)。通过EPCs特异性表面标记抗体CD133和VEGFR2鉴定该细胞,并运用摄取Dil-ac-LDL和结合FITC-UEA-1来鉴定细胞的内皮功能。结果表明原代分离的细胞能够摄取Dil-ac-LDL以及结合FITC-UEA-1(见图1B),并且该种细胞大都表现出CD133和VEGFR2双阳性(见图1C),从人脐带血分离的单个核细胞经过诱导培养可以获得高纯度的EPCs。

图1 EPCs的分离与培养
2.2腺病毒转染获得CXCR7高表达的EPCs 利用实验室构建的携带人CXCR7基因的腺病毒和空腺病毒转染EPCs,获得CXCR7high-EPCs和Ctrl-EPCs模型。免疫印迹实验表明:携带人CXCR7基因的腺病毒在转染EPCs后明显上调细胞中CXCR7的表达量,但对CXCR4的表达并没有影响(P<0.01),见图2。
2.3提高CXCR7表达增强EPCs存活 不含血清的培养基诱导EPCs凋亡,MTT法检测活细胞数量,计算细胞凋亡率。结果显示:在无血清条件下,CXCR7high-EPCs凋亡率比ctrl-EPCs低;加入外源性的SDF-1能够显著降低CXCR7high-EPCs和ctrl-EPCs的细胞凋亡率。SDF-1存在时,CXCR7high-EPCs的凋亡率与ctrl-EPCs相比,差异无统计学意义(P>0.05),见图3。2.4 提高CXCR7表达增强EPCs黏附作用 本研究中通过比较不同CXCR7浓度的EPCs在活化的人脐静脉内皮细胞表面黏附能力,研究提高EPCs中CXCR7的表达在促进与活化内皮细胞黏附的作用。实验结果表明:CXCR7high-EPCs与活化内皮细胞的黏附能力要显著强于ctrl-EPCs;SDF-1能明显增强CXCR7high-EPCs与ctrl-EPCs与活化的人脐静脉内皮细胞的黏附功能,且CXCR7high-EPCs的黏附能力比ctrl-EPCs更显著(见图4)。
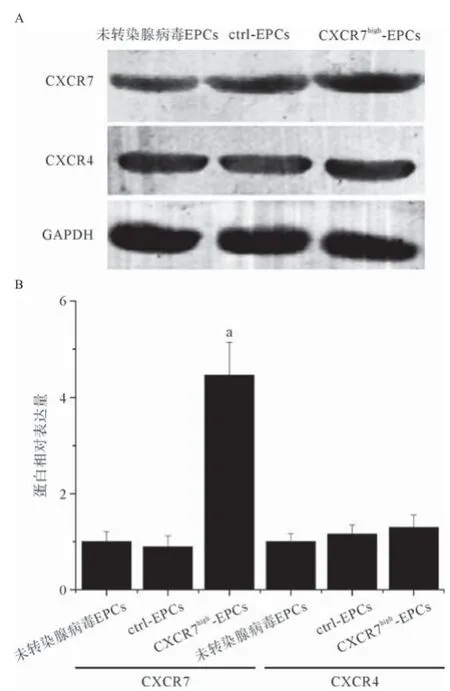
图2 不同腺病毒转染对EPCs中CXCR7、CXCR4表达的影响

图3 不同CXCR7表达水平对EPCs在无血清条件下对细胞凋亡率的影响
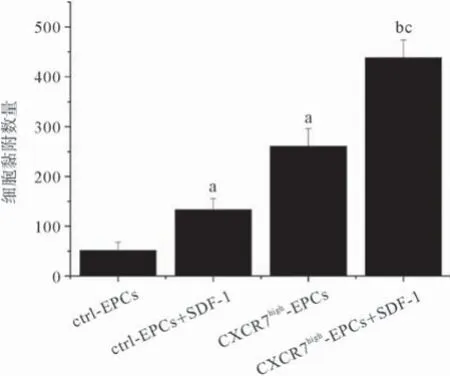
图4 不同CXCR7浓度对EPCs与活化人脐静脉内皮细胞黏附功能的影响
2.5提高CXCR7表达增强EPCs跨内皮迁移 实验中通过transwell实验比较不同CXCR7表达的EPCs跨内皮单层能力,考察提高CXCR7表达能否促进EPCs跨内皮迁移能力。结果显示:没有SDF-1存在时,CXCR7high-EPCs与ctrl-EPCs的跨内皮迁移能力没有显著差异;在给予SDF-1后,CXCR7high-EPCs与ctrl-EPCs跨内皮迁移能力均得到提升,且CXCR7high-EPCs跨内皮迁移能力也明显强于ctrl-EPCs(见图5)。
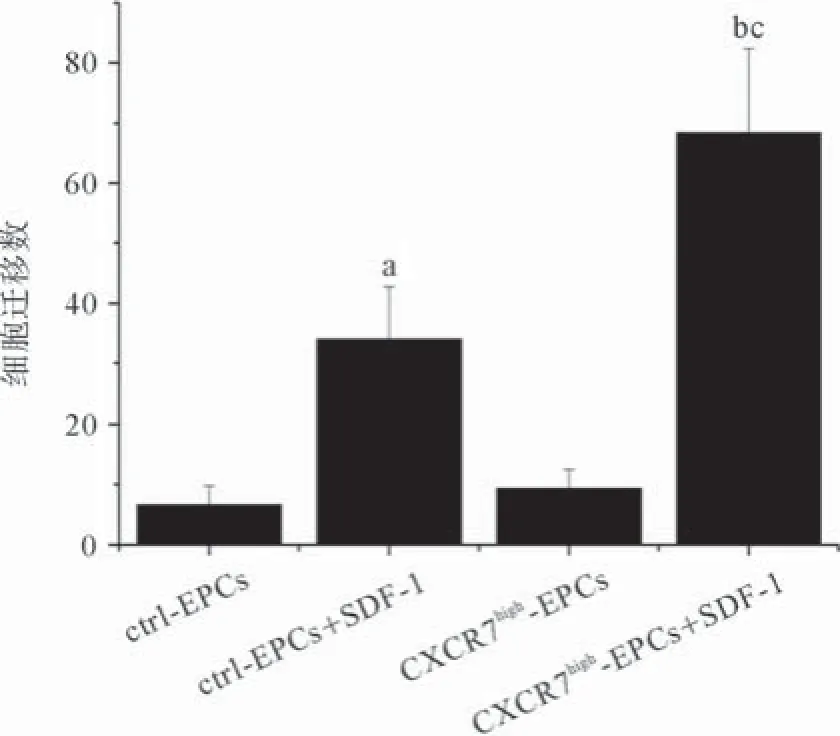
图5 不同CXCR7表达水平对EPCs跨内皮迁移能力的作用
2.6提高CXCR7表达增强EPCs管样结构形成 实验通过考察不同CXCR7表达水平的EPCs在基质胶中形成管样结构的能力,研究增加EPCs中CXCR7的表达是否可以促进细胞血管形成。实验结果证实:CXCR7high-EPCs在基质胶中成管能力显著高于ctrl-EPCs;SDF-1能显著促进CXCR7high-EPCs与ctrl-EPCs体外管样结构的形成。SDF-1存在时,CXCR7high-EPCs管样结构形成能力强于ctrl-EPCs,但差异无统计学意义(见图6)。
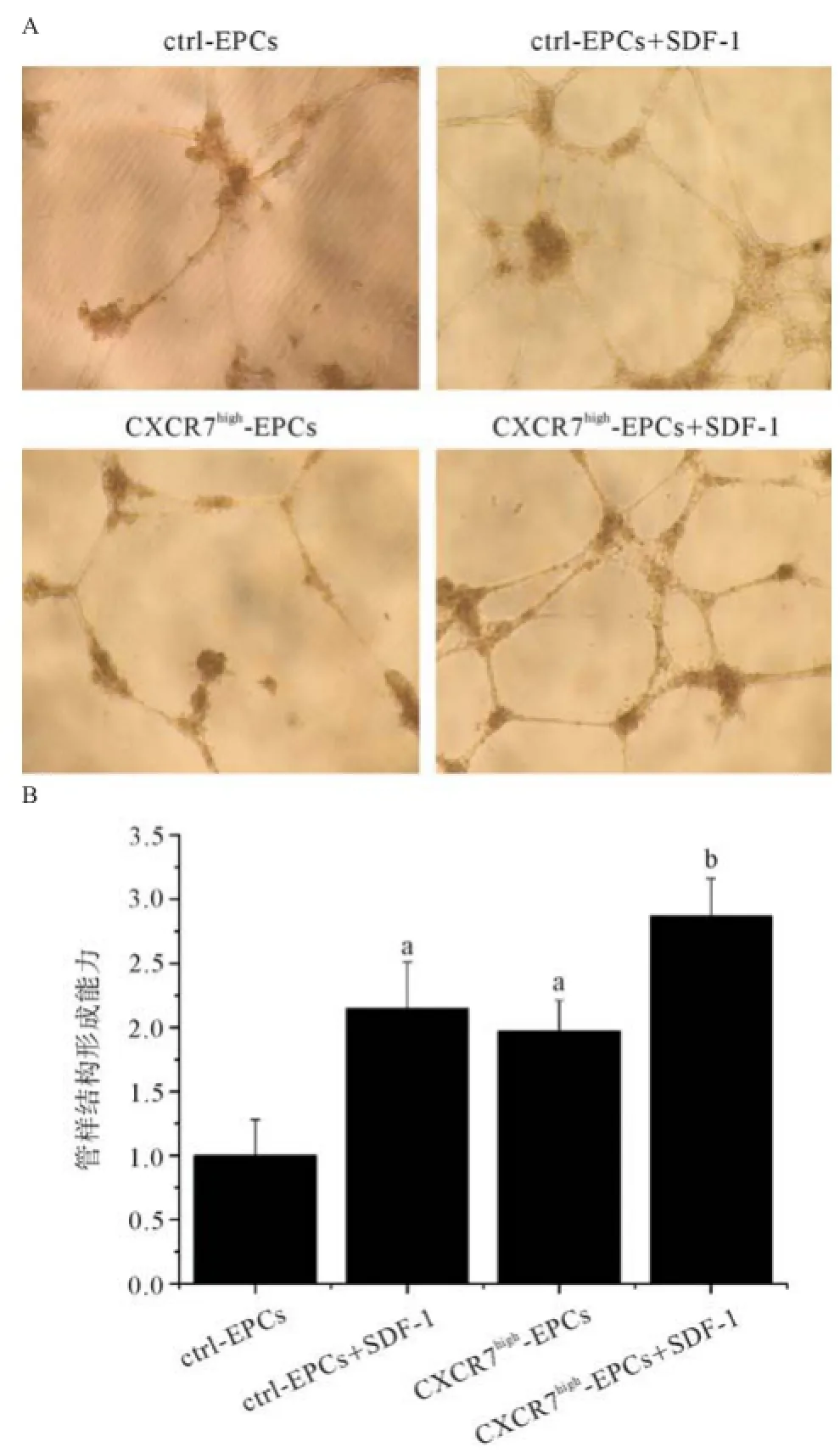
图6 不同CXCR7表达水平对EPCs体外管样结构形成能力的作用
2.7提高CXCR7表达增强EPCs生成NO的能力 通过比较不同CXCR7表达水平的EPCs生成NO的能力,研究增加CXCR7在EPCs中的表达量是否能上调细胞促血管功能。结果显示:CXCR7high-EPCs组别中NO的含量显著高于ctrl-EPCs;SDF-1诱导能够显著促进CXCR7high-EPCs与ctrl-EPCs产生NO的能力。SDF-1存在的条件下,CXCR7high-EPCs组的NO含量显著高于ctrl-EPCs,差异有统计学意义(P<0.05),见图7。
3 讨论
本实验利用CXCR7高表达的腺病毒转染EPCs,成功建立高表达CXCR7的EPCs模型(CXCR7high-EPCs)。研究发现提高CXCR7表达能够极大程度提高EPCs的存活能力,这与前期研究[13]证明CXCR7单独介导SDF-1诱导EPCs存活的结论保持一致。本研究中给予细胞外源性SDF-1能显著增强CXCR7high-EPCs的黏附及跨内皮迁移能力,并能与高表达的CXCR7发挥协同作用,这与前期研究[13]证明CXCR7单独介导SDF-1诱导EPCs黏附的结论也是一致的,与Zabel等[5]对肿瘤细胞研究结果同样相符。EPCs黏附及跨内皮迁移能力是生成血管的起始步骤,高表达CXCR7促进EPCs与活化的内皮黏附、跨内皮迁移,很可能是由于增强了细胞的血管生成能力。
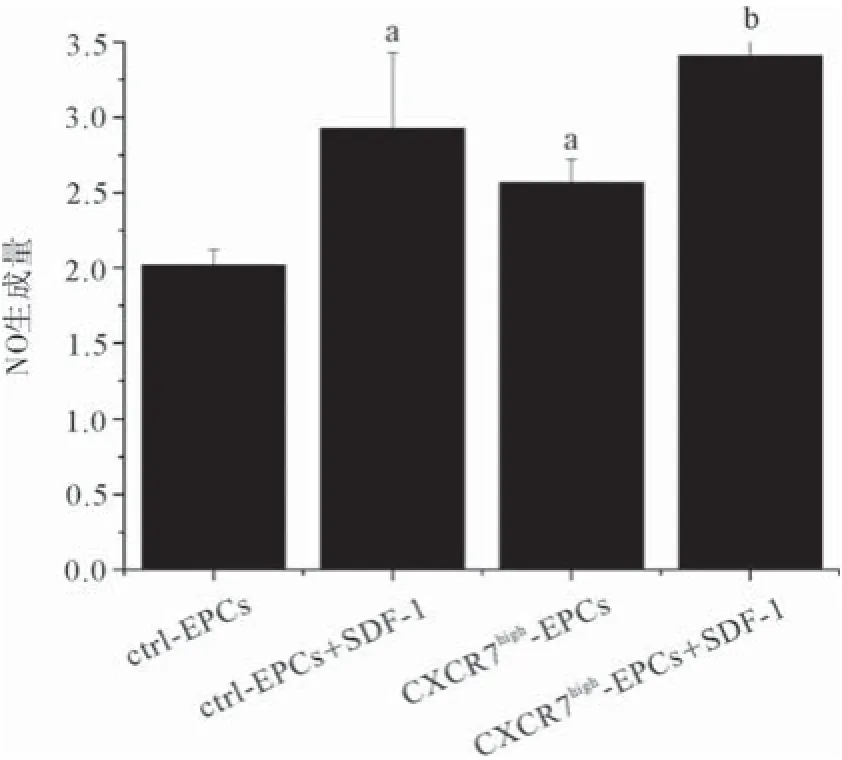
图7 不同CXCR7表达水平对EPCs生成NO能力的影响
实验中运用管样结构形成实验考察提高CXCR7表达对EPCs成血管能力的影响。结果表明:高表达CXCR7的EPCs其管样结构形成得到显著增强,并与SDF-1发挥协同作用。Watanabe等[14]在炎症研究中发现提高CXCR7表达对内皮类细胞血管生成有促进作用,这与本实验结果相符。最后,通过检测NO含量,结果也表明转染CXCR7的EPCs体内NO生成量显著增加并与SDF-1发挥协同作用,表明CXCR7高表达可能通过提高EPCs合成NO增强其成血管功能。
提高EPCs中CXCR7的表达量显著提高EPCs的存活能力、与活化内皮的黏附功能、SDF-1介导细胞跨内皮迁移能力、管样结构形成能力以及NO生成能力,这种作用与SDF-1一起发挥协同效应。提高CXCR7表达很可能是增强EPCs血管生成能力的有效方法,同时也为改造EPCs用于临床干细胞移植治疗血管性疾病提供新思路。
[1]ASAHARA T, MUROHARA T, SULLIVAN A, et al. Isolation of putative progenitor endothelial cells for angiogenesis[J]. Science, 1997, 275(5302): 964-967.
[2]SUN Y X, WANG J, SHELBURNE C E, et al. Expression of CXCR4 and CXCL12 (SDF-1) in human prostate cancers (PCa) in vivo[J]. J Cell Biochem, 2003, 89(3): 462-473.
[3]WERNER N, KOSIOL S, SCHIUEGL T, et al. Circulating endothelial progenitor cells and cardiovascular outcomes [J]. N Engl J Med, 2005, 353(10): 999-1007.
[4]WANG Y, LI G, STANCO A, et al. CXCR4 and CXCR7 have distinct functions in regulating interneuron migration [J]. Neuron, 2011, 69(1): 61-76.
[5]ZABEL B A, WANG Y, LEWEN S, et al. Elucidation of CXCR7-mediated signaling events and inhibition of CXCR4-mediated tumor cell transendothelial migration by CXCR7 ligands[J]. J Immunol, 2009, 183(5): 3204-3211.
[6]KAMIHATA H, MATSUBARA H, NISHIUE T, et al. Improvement of collateral perfusion and regional function by implantation of peripheral blood mononuclear cells into ischemic hibernating myocardium[J]. Arterioscler Thromb Vasc Biol, 2002, 22(11): 1804-1810.
[7]ZHENG H, DAI T, ZHOU B, et al. SDF-1 alpha/CXCR4 decreases endothelial progenitor cells apoptosis under serum deprivation by PI3K/Akt/eNOS pathway[J]. Atherosclerosis,2008, 201(1): 36-42.
[8]DE FALCO E, PORCELLI D, TORELLA A R, et al. SDF-1 involvement in endothelial phenotype and ischemia-induced recruitment of bone marrow progenitor cells[J]. Blood, 2004, 104(12): 3472-3482.
[9]MOHLE R, BAUTZ F, RAFII S, et al. The chemokine receptor CXCR-4 is expressed on CD34+ hematopoietic progenitors and leukemic cells and mediates transendothelial migration induced by stromal cell-derived factor-1[J]. Blood,1998, 91(12): 4523-4530.
[10]ZHAO X, QIAN D, WU N, et al. The spleen recruits endothelial progenitor cell via SDF-1/CXCR4 axis in mice[J]. J Recept Signal Transduct Res, 2010, 30(4): 246-254.
[11]YIN Y, ZHAO X, FANG Y, et al. SDF-1 alpha involved in mobilization and recruitment of endothelial progenitor cells after arterial injury in mice[J]. Cardiovasc Pathol, 2010,19(4): 218-227.
[12]DAI X, TAN Y, CAI S, et al. The Role of CXCR7 on the adhesion, proliferation and angiogenesis of endothelial progenitor cells[J]. J Cell Mol Med, 2011, 15(6): 1299-1309.
[13]YAN X, CAI S, XIONG X, et al. Chemokine receptor CXCR7 mediates human endothelial progenitor cells survival,angiogenesis, but not proliferation[J]. J Cell Biochem, 2012,113(4): 1437-1446.
[14]WATANABE K, PENFOLD M E, MATSYDA A, et al. Pathogenic role of CXCR7 in rheumatoid arthritis[J]. Arthritis Rheum, 2010, 62(11): 3211-3220.
(本文编辑:赵翠翠,丁敏娇)
Increasing CXCR7 expression in endothelial progenitor cells can enhances its angiogenic capability
CHENG Peng, HE Luqing, LING Xiao, LIN Xiufei, LI Xiaokun. Sine-American Research Institute for Diabetic Complication, School of Pharmaceutical Sciences, Wenzhou Medical University, Wenzhou, 325035
Objective: To investigate whether increasing CXCR7 expression in endothelial progenitor cells (EPCs) can improve its angiogenic capability. Methods: CXCR7high-EPCs were constructed by transfecting with adenovirus carring human CXCR7 gene. The differences between CXCR7high-EPCs and wt-EPC in cell survival under serum deprivation condition, adhesion, SDF-1 induced trans-endothelial migration, tube formation and nitric oxide (NO) production were compared. Results: Compared with ctrl-EPCs, CXCR7high-EPCs has superiority in cell survival under serum-free condition, cell adhension to activated endothelial cells, trans-endothelial migration, tube formation and NO production, which could be further enhanced by SDF-1. Conclusion: Increasing expression of CXCR7 can enhance the angiogenic capacity of EPCs. The performance of present research may provide a new idea for the treatment of vascular diseases.
CXCR7; endothelial progenitor cells; cell survival; tube formation
R96
A DOI: 10.3969/j.issn.2095-9400.2016.07.007
2016-02-07
温州市公益性科技计划项目(Y20140654);国家自然科学基金青年基金资助项目(81200239)。
程鹏(1990-),男,浙江杭州人,硕士生。
李校堃,教授,Email:xiaokunli@163.net。
