姜黄素衍生物WZ01对哮喘气道炎症介质IL-13和组胺及糖皮质激素受体的影响
2016-10-09李园湛美正叶乐平葛仁山李昌崇
李园,湛美正,叶乐平,葛仁山,李昌崇
(温州医科大学附属第二医院育英儿童医院,浙江 温州 325027,1.儿童呼吸科;2.科研中心)
姜黄素衍生物WZ01对哮喘气道炎症介质IL-13和组胺及糖皮质激素受体的影响
李园1,湛美正1,叶乐平1,葛仁山2,李昌崇1
(温州医科大学附属第二医院育英儿童医院,浙江温州325027,1.儿童呼吸科;2.科研中心)
目的:研究姜黄素衍生物WZ01对哮喘气道炎症反应、白细胞介素(IL)-13、组胺及糖皮质激素受体(GR)的影响,探讨WZ01抑制哮喘气道炎症的机制。方法:30只小鼠,随机分为:正常对照组、哮喘组、低剂量WZ01组、中剂量WZ01组、高剂量WZ01组,每组6只。在第21~第27天1%卵清白蛋白(OVA)雾化激发,每次雾化前30 min予腹腔注射相应剂量0.9%氯化钠溶液或WZ01。末次激发24 h内,麻醉并处死小鼠,留取肺组织标本HE染色检测炎症病理改变,留取支气管肺泡灌洗液(BALF)进行细胞分类计数,ELISA法检测IL-13和组胺浓度,Western blot和免疫组织化学染色检测肺组织GR蛋白的表达。结果:与正常对照组比较,哮喘组小鼠气道周围可见明显炎症细胞浸润及黏液分泌,BALF中炎症细胞数量、IL-13及组胺水平均显著升高(P<0.01)。与哮喘组相比,各剂量WZ01组气道周围炎症细胞浸润及黏液分泌显著减少,BALF中淋巴细胞和嗜酸性粒细胞数量明显减少,BALF中IL-13和组胺浓度显著下降,差异均有统计学意义(P<0.01);BALF中淋巴细胞数量与IL-13和组胺浓度均呈显著正相关(r值分别为0.886、0.886,P均<0.01),嗜酸性粒细胞数量与IL-13和组胺浓度均呈显著正相关(r值分别为0.897、0.898,P均<0.01)。Western blot和免疫组织化学染色结果显示,哮喘小鼠肺组织GR表达明显降低,与哮喘组相比,不同剂量WZ01均能显著上调哮喘小鼠肺组织GR表达水平。结论:姜黄素衍生物WZ01可显著抑制哮喘气道炎症细胞浸润和黏液分泌,可能与其降低炎症介质IL-13和组胺浓度及上调哮喘小鼠肺组织GR表达水平有关,WZ01可能有望成为防治哮喘气道炎症的新药。
哮喘;姜黄素衍生物WZ01;白细胞介素13;组胺;糖皮质激素受体
支气管哮喘(简称哮喘)是由嗜酸性粒细胞、T淋巴细胞等多种炎症细胞及炎症介质参与的气道炎症性疾病。2010年全国哮喘流行病学调查显示,我国哮喘儿童的患病率为3.02%,较十年前翻了一番;同年温州城区儿童哮喘患病率为3.3%,并呈逐年上升趋势[1-2]。哮喘时炎症细胞被募集并活化,释放白细胞介素(interleukin,IL)-4、IL-13及组胺等多种炎症介质,诱发并加剧气道炎症反应[3]。糖皮质激素受体(glucocorticoid receptor,GR)与有活性的糖皮质激素结合并进入细胞核而发挥抗炎作用[4]。许多哮喘患者GR表达常下调,是导致糖皮质激素疗效不佳的重要因素之一。因此,如何上调哮喘患者GR的表达,恢复糖皮质激素的药物敏感性,是哮喘治疗研究的重要课题。WZ01是本课题组新研发的姜黄素衍生物,在代谢综合征动物模型中显示出强大的抗炎效应[5],但在哮喘中的作用尚未见报道。因此,本研究对WZ01在哮喘小鼠气道炎症中的影响及对炎症介质IL-13和组胺浓度及GR的调节进行了初步探讨,旨在为进一步临床应用提供实验依据。
1 材料和方法
1.1实验材料 卵清白蛋白(ovalbumini,OVA)购自美国Sigma公司,ELISA试剂盒(组胺、IL-13)购自上海西唐生物科技有限公司,瑞氏-吉姆萨染色试剂盒购自南昌雨露实验器材有限公司,姜黄素衍生物WZ01为我院科研中心葛仁山教授惠赠,余试剂均为市售分析纯。
1.2哮喘模型的制备与分组 30只4周龄SPF级 BALB/c小鼠购自上海史莱克动物实验公司(动物合格证号:SCXK(沪)2012-0002),适应性饲养1周后随机分为5组:正常对照组组、哮喘组、低剂量(10 mg/kg)WZ01组、中剂量(15 mg/kg)WZ01组、高剂量(20 mg/kg)WZ01组。哮喘造模参照Chong等[6]的方法分为致敏和激发2个阶段:第7天和第14天分别予0.1% OVA+Al(OH)3凝胶0.1 mL腹腔注射致敏,第21天起将各组小鼠置入有机玻璃雾化箱内予1% OVA溶液雾化激发,每次30 min,持续7 d。正常组以0.9%氯化钠溶液替代。各组雾化前30 min予腹腔注射相应剂量药物。本实验通过本院动物伦理委员会批准。
1.3标本留取及肺组织病理检查 末次激发24 h内,腹腔注射10%水合氯醛溶液4 mL/kg麻醉后,眼球摘除取血并处死。暴露胸腔后结扎右侧主气管,200 μL PBS灌洗左肺3次,保证每次灌洗液回收率大于90%(如标本不合格则废弃),收集于1.5 mL EP管内,4 ℃ 12 000 r/min离心5 min,取上清液置-80 ℃保存备用。留取右肺固定、包埋后苏木素-伊红(HE)染色。
1.4支气管肺泡灌洗液(BALF)细胞分类计数 50 μL PBS重悬离心后BALF中细胞沉淀,滴于干净载玻片上涂片,待干燥后瑞氏-吉姆萨染色,显微镜下观察细胞形态并计数。每张玻片由同一名观察者在光镜下(×200)随机选择10个视野,分别计算各细胞的数量。取平均值作为该片计量值。
1.5ELISA法测BALF中IL-13和组胺浓度 每孔各加入标准品或待测样品100 μL,将反应板充分混匀后置37 ℃ 40 min。用洗涤液将反应板洗涤4~6次,印干。每孔加入蒸馏水和一抗工作液各50 μL(空白除外),充分混匀后置37 ℃ 20 min。再次用洗涤液将反应板充分洗涤4~6次。每孔加酶标抗体工作液100 μL,置37 ℃ 10 min,再次洗板,印干。每孔加入底物工作液100 μL,暗处37 ℃反应15 min。每孔加入100 μL终止液混匀,30 min内用酶标仪在450 nm处测吸光值。
1.6Western blot法检测GR蛋白表达 每组各称取50 mg肺组织,加入500 μL细胞裂解液后置于匀质器中匀浆,常规方法提取总蛋白。BCA法测定蛋白浓度后,加入5×loading buffer并调整蛋白浓度至2.5 μg/μL,100 ℃加热10 min,-20 ℃保存。在10% SDS-PAGE电泳胶孔道中分别加入各组蛋白20 μL,湿转法将蛋白转移至0.45 nm的PVDF膜上,转膜完毕后置于5%牛奶中封闭1~2 h,TBST洗涤3次后,一抗孵育过夜,α-tublin(碧云天公司)工作浓度为1∶5 000,GR(Abcam公司)工作浓度为1∶1 000。TBST洗涤后,相应二抗室温孵育1 h,再次TBST洗涤后置于干净透明玻璃板均匀滴上ECL发光液,迅速置于曝光机中曝光,保存图像并分析。
1.7免疫组织化学染色(Envision二步法)检测GR蛋白 留取的肺组织置于二甲苯液、不同浓度梯度的酒精及0.01 mol/L pH值7.4的PBS液脱蜡水化后,置于3%的过氧化氢甲醇液中,采用枸橼酸盐(pH值6.0)微波抗原修复,10%的小牛血清封闭非特异性抗原,室温30 min;滴加GR(Abcam公司,1∶200)一抗工作液,置4 ℃冰箱中过夜后用PBS液洗涤,滴加Envision加强型二抗工作液,室温下孵育10 min 并PBS液洗涤;滴通用型二抗,37 ℃孵育30 min并PBS洗涤,每片滴加新鲜配制的DAB显色液显色,自来水冲洗30 min终止显色,置于Gill改良苏木素复染及依次经梯度酒精脱水干燥,二甲苯透明后中性树胶封片,光学显微镜下观察结果。

图1 小鼠肺组织HE染色(×400)
1.8统计学处理方法 采用GraphPad Prism 5.0 及SPSS19.0软件进行处理。各组计量资料数据以±s表示,均数间比较采用单因素方差分析(oneway ANOVA),方差齐性者两两比较采用LSD检验,方差不齐者采用Dunnett’s-T3检验。两变量的相关分析采用Pearson直线相关法。P<0.05为差异有统计学意义。
2 结果
2.1各组小鼠生物学行为判断 OVA诱导哮喘急性期小鼠模型建立成功。哮喘组小鼠激发时多表现为呼吸急促、抓耳挠腮、烦躁不安等,严重时甚至出现行动迟缓、四肢瘫软等。相较于哮喘组,各剂量WZ01组小鼠激发后症状不明显。正常对照组小鼠无明显异常。
2.2WZ01抑制哮喘小鼠气道炎症反应和黏液分泌正常对照组小鼠气道和肺泡壁结构完整,气道及血管周围无明显炎症细胞浸润,管腔内未见黏液分泌(见图1A)。哮喘组小鼠气道及血管周围和肺泡间隔大量炎症细胞浸润,以淋巴细胞和嗜酸性粒细胞为主,气道狭窄,高柱状支气管上皮细胞增生并分泌大量黏液,堵塞管腔(见图1B)。与哮喘组相比,各剂量WZ01组均明显抑制哮喘气道炎症反应,表现为气道、血管周围和肺泡间隔炎症细胞浸润明显减少,气道腔内可见少许黏液,以中剂量和高剂量组最为显著(见图1C-E)。
2.3WZ01对BALF中炎症细胞的影响 哮喘组BALF淋巴细胞数计数及比率、嗜酸粒细胞计数及比率均高于正常对照组,差异均有统计学意义(P<0.01)。而低、中、高剂量WZ01组显著抑制BALF炎症细胞浸润,表现为淋巴细胞计数及百分比、嗜酸性粒细胞计数及百分比均明显低于哮喘组,差异均有统计学意义(P<0.05)。各WZ01组抑制嗜酸性粒细胞浸润作用呈剂量依赖性(P<0.05),见表1。
2.4WZ01对BALF中IL-13和组胺的影响 ELISA结果显示,哮喘组BALF中IL-13和组胺浓度均较正常对照组升高,差异有统计学意义(P<0.01)。相较于哮喘组,低、中、高剂量WZ01组BALF中IL-13水平和组胺浓度均显著降低(P<0.01),见表2。
表1 WZ01对哮喘小鼠BALF炎症细胞的影响(n=6,±s,个/200倍视野)

表1 WZ01对哮喘小鼠BALF炎症细胞的影响(n=6,±s,个/200倍视野)
与正常对照组比:aP<0.01;与哮喘组比:bP<0.01;与低剂量WZ01组比:cP<0.05,dP<0.01
组别 淋巴细胞计数 淋巴细胞比率(%) 嗜酸性粒细胞计数 嗜酸性粒细胞比率(%)正常对照组8.92±1.94 14.58±1.620.91±0.37 1.260±0.52哮喘组 40.76±4.61a 30.26±0.82a 12.25±0.98a 8.370±0.75a低剂量WZ01组 19.47±3.94ab 21.65±2.29ab5.77±0.78ab 5.630±0.64ab中剂量WZ01组 13.25±3.21bc 17.80±2.40ab4.01±0.78abd 4.630±0.65ab高剂量WZ01组 11.92±3.46bd 17.17±3.71abc3.29±0.65abd 4.032±0.69abd
2.5相关性分析 BLAF中淋巴细胞数量与IL-13、组胺浓度呈显著正相关(分别r=0.886,r=0.886,均P<0.01),嗜酸性粒细胞数量与IL-13、组胺浓度亦呈显著正相关(分别r=0.897,r=0.898,均P< 0.01)。
2.6WZ01对肺组织GR表达的影响 Western blot结果显示,各剂量WZ01组能显著上调肺组织GR蛋白的表达(见图2);免疫组织化学染色结果表明,与正常对照组相比,哮喘组支气管上皮细胞胞浆和胞核GR表达水平显著下降,而不同剂量WZ01处理后,支气管上皮细胞胞浆和胞核GR表达水平上调(见图3)。
表2 各组BALF中IL-13和组胺浓度比较(n=6,±s,pg/mL)

表2 各组BALF中IL-13和组胺浓度比较(n=6,±s,pg/mL)
与正常对照组比:aP<0.05,bP<0.01;与哮喘组比:cP<0.01;与低剂量WZ01组比:dP<0.05
组别 IL-13 组胺正常对照组 16.93± 4.3293.50±18.98哮喘组 74.75±11.26b 447.70±44.17b低剂量WZ01组 43.69±7.91bc 269.30±76.43bc中剂量WZ01组 35.32±7.32bc 195.20±36.76ac高剂量WZ01组 21.86±9.51cd 160.10±56.61cd
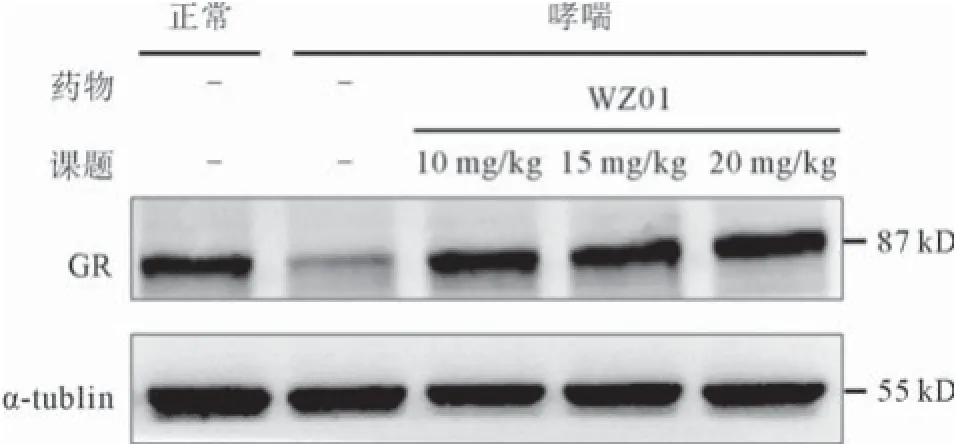
图2 Western blot法检测各组GR的表达
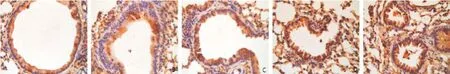
图3 免疫组织化学染色检测各组支气管上皮细胞胞浆和胞核GR表达水平(Envision,×400)
3 讨论
姜黄素是姜科植物姜黄的主要活性物质,具有强效抗炎作用,其通过抑制一氧化氮、核因子-κB (NF-κB)、Notch1-GATA3等炎症相关信号通路而抑制气道和肺组织的急慢性炎症及气道高反应性[6-8]。在高脂饮食诱导的代谢综合征大鼠中,姜黄素衍生物WZ01较姜黄素有更显著的抗炎效果[4]。炎症细胞浸润在哮喘黏液栓形成、气道高反应、气道重塑等病理过程中起重要作用,如嗜酸性粒细胞浸润与气道重塑密切相关[9-10],B淋巴细胞在哮喘气道炎症反应、2型辅助性T淋巴细胞(Th2细胞)的产生和气道高反应性等过程中起关键作用[11]。本研究HE结果显示,哮喘组小鼠气道、血管周围和肺泡间隔大量淋巴细胞和嗜酸性粒细胞浸润,气道腔内黏液分泌明显增多甚至堵塞管腔,而低、中、高剂量WZ01均可显著抑制炎症细胞浸润及黏液分泌。BALF细胞分类计数也表明,WZ01明显抑制BALF淋巴细胞、嗜酸性粒细胞等炎症细胞渗出。因此,WZ01在哮喘小鼠中显示出强效抗炎效应。
IL-13是Th2细胞分泌的重要的炎症介质,其表达水平与哮喘严重程度呈正相关,可作为哮喘严重程度指标之一[12]。雾化吸入IL-13可诱导新西兰白兔出现气道高反应、气道炎症细胞(尤其是嗜酸性粒细胞)浸润、黏液分泌等类哮喘症状[13]。IL-13主要通过刺激细胞外基质蛋白分泌、增加黏蛋白生成及协同IL-4、IL-5募集活化肥大细胞和嗜酸性粒细胞等多种方式促进哮喘发生、发展[14-16]。阻断IL-13相关信号通路中任意一个环节可能抑制气道高反应及炎症反应[17-18]。组胺主要由肥大细胞和嗜碱性粒细胞存储和释放,是最早发现的与哮喘密切相关的炎症介质之一,气道中组胺水平升高可明显加剧气道内炎症反应[19]。抑制组胺释放或阻断其与特异受体结合可改善哮喘气道炎症、黏液高分泌、肺通气功能和气道重塑[20-21]。研究发现,OVA诱导小鼠哮喘肺组织GR表达下降,运动可增加GR表达并减轻气道炎症和改善气道重塑[22];糖皮质激素耐药的儿童的B淋巴细胞胞核内GR比糖皮质激素敏感的儿童的B淋巴细胞胞核内GR表达水平更低且降解更快[23],而提高糖皮质激素表达水平可显著提高哮喘治疗效果[24],这提示上调GR可作为潜在的哮喘治疗靶点。本研究结果表明,各剂量组特别是高剂量WZ01组不仅明显抑制哮喘小鼠气道炎症细胞浸润及黏液分泌,而且显著降低BALF中IL-13和组胺浓度,BLAF中淋巴细胞和嗜酸性粒细胞数量与IL-13、组胺浓度呈显著正相关;同时,各剂量WZ01能显著上调哮喘小鼠肺组织GR表达水平。其机制可能是,WZ01通过抑制淋巴细胞、嗜酸性粒细胞等炎症细胞募集,阻断炎症介质IL-13和组胺的释放,进而阻断了炎症细胞释放炎症介质和炎症介质募集活化炎症细胞之间的恶性循环,同时显著上调肺组织GR表达水平,改善了哮喘气道炎症细胞浸润、黏液分泌等病理改变,最终在哮喘中起到强大的抗炎、抗过敏作用。因此,本研究首次发现并初步揭示了WZ01在哮喘治疗中抗炎、抗过敏的机制,具有十分重要的潜在临床应用价值。但本研究小鼠样本数相对较少,且哮喘的分子机制十分复杂,因此,对WZ01在哮喘中的作用及分子机制有待深入研究。
综上所述,WZ01不仅明显抑制哮喘小鼠气道炎症细胞浸润及黏液分泌,而且显著降低BALF中IL-13和组胺浓度,阻断炎症细胞释放炎症介质和炎症介质募集活化炎症细胞之间的恶性循环,上调肺组织GR蛋白表达水平,最终发挥显著抗炎作用,极具临床应用价值。因此,进一步深入阐明WZ01调控哮喘炎症反应及炎症介质的分子机制可为其临床应用提供理论基础。
[1]全国儿科哮喘协作组. 第三次中国城市儿童哮喘流行病学调查[J]. 中华儿科杂志, 2013, 51(10): 729-735.
[2]胡晓光, 张海邻, 李昌崇, 等. 温州城区哮喘儿童流行病学调查[J]. 温州医科大学学报, 2014, 44(11): 804-810.
[3]BORRIELLO F, LONGO M, SPINELLI R, et al. IL-3 synergises with basophil-derived IL-4 and IL-13 to promote the alternative activation of human monocytes[J]. Eur J Immunol, 2015, 45(7): 2042-2051.
[4]RANDALL M J, KOSTIN S F, BURGESS E J, et al. Antiinflammatory effects of levalbuterol-induced 11beta-hydroxysteroid dehydrogenase type 1 activity in airway epithelial cells[J]. Front Endocrinol (Lausanne), 2015, 5: 236.
[5]HU G X, LIN H, LIAN Q Q, et al. Curcumin as a potent and selective inhibitor of 11beta-hydroxysteroid dehydrogenase 1: improving lipid profiles in high-fat-diet-treated rats[J]. PLoS One, 2013, 8(3): e49976.
[6]CHONG L, ZHANG W, NIE Y, et al. Protective effect of curcumin on acute airway infl ammation of allergic asthma in mice through Notch1-GATA3 signaling pathway[J]. Infl ammation, 2014, 37(5): 1476-1485.
[7]MOON D O, KIM M O, LEE H J, et al. Curcumin attenuates ovalbumin-induced airway infl ammation by regulating nitric oxide[J]. Biochem Biophys Res Commun, 2008, 375 (2): 275-279.
[8]OH S W, CHA J Y, JUNG J E, et al. Curcumin attenuates allergic airway inflammation and hyper-responsiveness in mice through NF-kappaB inhibition[J]. J Ethnopharmacol,2011, 136(3): 414-421.
[9]YASUKAWA A, HOSOKI K, TODA M, et al. Eosinophils promote epithelial to mesenchymal transition of bronchial epithelial cells[J]. PLoS One, 2013, 8(5): e64281.
[10]GON Y, ITO R, HATTORI T, et al. Serum eosinophil-derived neurotoxin: Correlation with persistent airflow limitation in adults with house-dust mite allergic asthma[J]. Allergy Asthma Proc, 2015, 36(6): 113-120.
[11]DRAKE L Y, IIJIMA K, HARA K, et al. B cells play key roles in th2-type airway immune responses in mice exposed to natural airborne allergens[J]. PLoS One, 2015, 10(3):e0121660.
[12]BARTEMES K R, KEPHART G M, FOX S J, et al. Enhanced innate type 2 immune response in peripheral blood from patients with asthma[J]. J Allergy Clin Immunol, 2014,134(3): 671-678.
[13]HU A, FATMA S, CAO J, et al. Th2 cytokine-induced upregulation of 11beta-hydroxysteroid dehydrogenase-1 facilitates glucocorticoid suppression of proasthmatic airway smooth muscle function[J]. Am J Physiol Lung Cell MolPhysiol, 2009, 296(5): L790-803.
[14]LEE M Y, SEO C S, LEE N H, et al. Anti-asthmatic effect of schizandrin on OVA-induced airway inflammation in a murine asthma model[J]. Int Immunopharmacol, 2010, 10 (11): 1374-1379.
[15]OESER K, MAXEINER J, SYMOWSKI C, et al. T cells are the critical source of IL-4/IL-13 in a mouse model of allergic asthma[J]. Allergy, 2015, 70(11): 1440-1449.
[16]ASHRAF M I, SHAHZAD M, SHABBIR A. Oxyresveratrol ameliorates allergic airway infl ammation via attenuation of IL-4, IL-5, and IL-13 expression levels[J]. Cytokine, 2015,76(2): 375-381.
[17]OH C K, GEBA G P, MOLFINO N. Investigational therapeutics targeting the IL-4/IL-13/STAT-6 pathway for the treatment of asthma[J]. Eur Respir Rev, 2010, 19(115): 46-54.
[18]MAY R D, FUNG M. Strategies targeting the IL-4/IL-13 axes in disease[J]. Cytokine, 2015, 75(1): 89-116.
[19]TSURIKISAWA N, OSHIKATA C, TSUBURAI T, et al. Physiologic airway responses to inhale histamine and acetylcholine in patients with mild asthma as analyzed by forced osciliation[J]. Arerugi, 2015, 64(7): 952-970.
[20]BENKO R, MOLNAR T F, SZOMBATI V, et al. Combined inhibition of histamine H1 receptors and leukotrienes reduces compound 48/80-induced contraction of the human bronchus in vitro[J]. Pharmacology, 2015, 96(5-6): 253-255. [21]HORIE M, SAITO A, YAMAUCHI Y, et al. Histamine induces human lung fi broblast-mediated collagen gel contraction via histamine H1 receptor[J]. Exp Lung Res, 2014,40(5): 222-236.
[22]SILVA R A, ALMEIDA F M, OLIVO C R, et al. Exercise reverses OVA-induced inhibition of glucocorticoid receptor and increases anti-infl ammatory cytokines in asthma[J]. Scand J Med Sci Sports, 2016, 26(1): 82-92.
[23]CORNEJO S, TANTISIRA K, RABY B A , et al. Nuclear bioavailability of the glucocorticoid receptor in a pediatric asthma cohort with variable corticosteroid responsiveness[J]. Pediatr Res, 2015, 78(5): 505-512.
[24]JOSHI T, JOHNSON M, NEWTON R, et al. The long-acting beta2 -adrenoceptor agonist, indacaterol, enhances glucocorticoid receptor-mediated transcription in human airway epithelial cells in a gene- and agonist-dependent manner[J]. Br J Pharmacol, 2015, 172(10): 2634-2653.
(本文编辑:丁敏娇)
Effects of curcumin derivative WZ01 on asthmatic airway infl ammatory mediators IL-13, histamine and glucocorticoid receptor
LI Yuan1, ZHAN Meizheng1, YE Leping1, GE Renshan2, LI Changchong1. 1.Department of Pediatric Pulmonology, the Second Affi liated Hospital & Yuying Children’s Hospital of Wenzhou Medical University, Wenzhou, 325027; 2.Research Center, the Second Affi liated Hospital & Yuying Children’s Hospital of Wenzhou Medical University, Wenzhou, 325027
Objective: To investigate the effects of curcumin derivative WZ01 on asthmatic airway infl ammation, infl ammatory mediators IL-13 and histamine, and glucocorticoid receptor (GR). Methods: Thirty mice were randomly divided into: control group, asthma group, low dose WZ01 group, moderate dose WZ01 group and high dose WZ01 group. Each group was 6 mice, respectively. After sensitized with OVA, the mice were challenging with 1% OVA from the 21th to 27th day. Each mouse was intraperitoneally injected with corresponding drugs or normal saline half an hour before atomizing. After the last challenging, mice were anesthetized and sacrifi ced within 24 hours, lung tissues were obtained for detecting infl ammatory alteration with hematoxylin-eosin staining, and the BALF for cellular classifi cation and counting and the concentrations of IL-13 and histamine by ELISA assay, the expression of GR in lung tissues was detected with immumohistochemical staining and Western blot. Results: Compared with the normal control group, HE staining showed massive infl ammatory cellular infi ltration and mucous secretion accumulated in the asthma group, ELISA analysis showed signifi cantly increased number of infl ammatory cells and concentrations of IL-13 and histamine in the BALF (P<0.01). Compared withthe asthma group, each dose of WZ01 markedly inhibited the infl ammatory cellular infi ltration and mucous secretion in the airway; In each dose WZ01 group, the number of lymphocytes and eosinophils in BALF were distinctly decreased (P<0.01), accompanied by the remarkable decline of the concentrations of IL-13 and histamine (P<0.01); the number of lymphocytes had remarkably positive relationships with the concentrations of IL-13 and histamine in the BALF (r values were 0.886 and 0.886, respectively, P<0.01). The number of esoinophils had also remarkably positive relationships with the concentrations of IL-13 and histamine in the BALF (r values were 0.897 and 0.898, respectively, P<0.01). The results of immumohistochemical staining and Western blot showed that GR expression in the lung tissues of asthmatic mice was decrease. Compare with the asthma group, different doses of WZ01 could predominantly reverse and up-regulate the expression of GR in the lung tissues of asthmatic mice. Conclusion: WZ01 can signifi cantly inhibit the infl ammatory cellular infi ltration and mucus secretion in asthma,which may be attributable to the decline of the infl ammatory mediators IL-13 and histamine and the up-regulated expression of GR in the lung tissues of asthmatic mice. WZ01 may be a new drug of prevention and treatment for airway infl ammation in asthma.
asthma; curcumin derivative WZ01; interleuterkin 13; histamine; glucocorticoid receptor
R725.6
A DOI: 10.3969/j.issn.2095-9400.2016.07.005
2016-01-31
浙江省自然科学基金资助项目(LY14H010004);浙江省“钱江人才计划”项目(QJD1402012);2015年度温州市高层次人才创新技术重点资助项目。
李园(1989-),女,广西南宁人,硕士生。
叶乐平,教授,主任医师,硕士生导师,Email:yeleping@163.com。
