2005—2014年CHINET肠球菌属细菌耐药性监测
2016-09-26俞云松倪语星孙景勇徐英春张小江孙自镛陈中举朱德妹胡付品蒋晓飞王传清王爱敏苏丹虹胡云建艾效曼黄文祥0蓓0张朝霞魏莲花徐元宏沈继录胡志东韩艳秋郭素芳褚云卓田素飞
杨 青, 俞云松, 林 洁, 倪语星, 孙景勇, 徐英春, 张小江, 孙自镛, 陈中举,汪 复, 朱德妹, 胡付品, 蒋晓飞, 王传清, 王爱敏, 卓 超, 苏丹虹, 胡云建,艾效曼, 黄文祥0, 贾 蓓0, 张朝霞, 季 萍, 张 泓, 孔 菁, 魏莲花, 吴 玲,徐元宏, 沈继录, 单 斌, 杜 艳, 胡志东, 李 金, 谢 轶, 康 梅, 韩艳秋,郭素芳, 褚云卓, 田素飞
·论著·
2005—2014年CHINET肠球菌属细菌耐药性监测
杨 青1, 俞云松2, 林 洁2, 倪语星3, 孙景勇3, 徐英春4, 张小江4, 孙自镛5, 陈中举5,汪 复6, 朱德妹6, 胡付品6, 蒋晓飞6, 王传清7, 王爱敏7, 卓 超8, 苏丹虹8, 胡云建9,艾效曼9, 黄文祥10, 贾 蓓10, 张朝霞11, 季 萍11, 张 泓12, 孔 菁12, 魏莲花13, 吴 玲13,徐元宏14, 沈继录14, 单 斌15, 杜 艳15, 胡志东16, 李 金16, 谢 轶17, 康 梅17, 韩艳秋18,郭素芳18, 褚云卓19, 田素飞19
目的 总结2005—2014年中国主要地区临床分离肠球菌属对各类抗菌药物的耐药性变迁。方法 CHINET细菌耐药性监测网各医院按统一方案、采用统一的材料、方法(K-B法)和判断标准进行肠球菌属细菌的耐药性监测。结果 2005—2014年共分离到42 185株非重复肠球菌属细菌,最常见菌种为粪肠球菌(47.3%)、屎肠球菌(43.5%)、鸟肠球菌(1.9%)、鹑鸡肠球菌(1.8%)、铅黄肠球菌(0.6%)。10年间,肠球菌属细菌的检出率呈下降波动趋势:2005年为9.1%,2014年为8.7%。肠球菌属对利奈唑胺、万古霉素、替考拉宁、替加环素仍高度敏感,耐药率<4%,万古霉素耐药粪肠球菌和屎肠球菌检出率分别为0.3%、3.2%。粪肠球菌对氨苄西林、高浓度庆大霉素耐药率分别为10.9%、38.0%,尿液标本分离株对呋喃妥因、磷霉素耐药率低,分别4.8%、6.2%,粪肠球菌耐药率有逐年下降趋势;屎肠球菌耐药率明显高于粪肠球菌,对氨苄西林、环丙沙星、利福平耐药率>80%,对高浓度庆大霉素耐药率为60.8%,对氯霉素耐药率为7.0%,对万古霉素耐药率从2005年0.6%上升至2014年4.2%。结论 肠球菌对利奈唑胺、万古霉素、替考拉宁、替加环素依然保持较好的敏感性,但屎肠球菌中万古霉素耐药率有逐年增加趋势,应引起重视。
肠球菌属; 细菌耐药性监测; 抗菌药物
肠球菌是医院感染常见的条件致病菌,对多种抗菌药物如头孢菌素类、氨基糖苷类固有耐药,可供临床选择的抗菌药物较少,因此对肠球菌进行长期动态的耐药性监测,指导临床合理使用抗菌药物具有重要意义。本文总结2005—2014年CHINET细菌耐药性监测网肠球菌属细菌的耐药性监测结果。
1 材料与方法
1.1 菌株来源
收集2005年1月1日—2014年12月31日CHINET细菌耐药性监测网中各医院临床标本分离的肠球菌属细菌,剔除重复菌株。
1.2 抗菌药物纸片和培养基
抗菌药物纸片为英国OXOID公司或美国BD公司产品。药敏试验用MH琼脂、万古霉素、替考拉宁和利奈唑胺E试验条均购自法国生物梅里埃公司。
1.3 药敏试验
采用CLSI推荐的纸片扩散法(K-B法),部分医院采用仪器法行药敏试验。以粪肠球菌ATCC 29212为质控菌,药敏试验结果按CLSI 2014年版标准判断结果[1]。万古霉素、替考拉宁、利奈唑胺纸片测定结果如为不敏感株,则要求各医院对菌株进行菌种复核鉴定,并采用万古霉素、替考拉宁、利奈唑胺E试验条测定MIC值确认。所有数据采用WHONET 5.6软件统计分析。
2 结果
2.1 肠球菌属菌种分布
10年间CHINET耐药监测网共分离肠球菌属细菌42 185株,其中粪肠球菌19 947株(47.3%),屎肠球菌18 370株(43.5%),鸟肠球菌 822(1.9%),鹑鸡肠球菌754株(1.8%),铅黄肠球菌268株(0.6%);10年间,肠球菌属细菌的检出率呈波动下降趋势:2005年为9.1%,2014年为8.7%,见表1。主要标本来源为尿液20 270株(48.0%)、伤口脓液分泌物4 003株(9.5%)、血液3 838株(9.1%)、胆汁和腹水3 206株(7.6%)、各种引流液2 171 (5.1%),来自血液、胆汁和腹水引流液标本中屎肠球菌的分离率已超过粪肠球菌,见表2。
分离自门急诊患者5 598株(13.3%),其中粪肠球菌66.6%,屎肠球菌26.4%,主要分离自尿液(63.4%)。分离自住院非ICU患者31 576株(74.9%),粪肠球菌和屎肠球菌分别为47.1% 和43.5%,主要来自尿液(48.2%)、伤口脓液分泌物(10.1%)、胆汁和腹水(8.0%)、血液(8.4%)、引流液(4.7%)。分离自ICU患者5 011株(11.8%),其中 63.3%菌株为屎肠球菌,粪肠球菌仅占26.7%,主要分离自尿液(30.4%)、血液(17.4%)、引流液(12.5%)、胆汁和腹水(10.8%)。

表1 肠球菌属在所有临床分离株中的检出率Table 1 Prevalence of Enterococcus spp. among all clinical isolates
2.2 肠球菌属细菌对各种抗菌药物的敏感性
粪肠球菌对万古霉素、替考拉宁、利奈唑胺、替加环素耐药率均<1%,对氨苄西林耐药率为10.9%,对高浓度庆大霉素耐药率为38.0%,对环丙沙星、左氧氟沙星、氯霉素耐药率约30%,对红霉素、利福平耐药率超过50%,尿液标本分离株对呋喃妥因、磷霉素耐药率较低,分别为4.8%、6.2%,见表3。10年耐药监测数据表明,粪肠球菌除对利福平外,对其他抗菌药物耐药率有下降趋势,对万古霉素、替考拉宁、利奈唑胺耐药率均保持较低的水平,见表4。
屎肠球菌耐药率明显高于粪肠球菌,对万古霉素、替考拉宁耐药率分别为3.2%、1.6%,对利奈唑胺、替加环素耐药率<1%,对高浓度庆大霉素耐药率为60.0%,对环丙沙星、左氧氟沙星、利福平耐药率>80%,对氨苄西林、红霉素耐药率>90%,但对氯霉素耐药率明显低于粪肠球菌,仅为7.0%,见表3。10年耐药监测数据显示,屎肠球菌对万古霉素耐药率从2005年的0.6%上升至2014年的4.2%,但对高浓度庆大霉素耐药率从2005年69.8%下降至2014年49.5%,对利奈唑胺均保持较低的耐药水平,见表5。

表2 肠球菌属细菌在各类标本中的分布Table 2 Species distribution of the Enterococcus strains by specimen type
鸟肠球菌对万古霉素、替考拉宁、利奈唑胺、替加环素耐药率<1%,对氯霉素耐药率11.5%。鹑鸡肠球菌和铅黄肠球菌对万古霉素耐药率分别为5.0%、2.6%,敏感率相对较低分别为83.7%、 90.8%,对替考拉宁、利奈唑胺、替加环素高度敏感(耐药率<3%),对氯霉素耐药率<15%,见表3。
2.3 万古霉素耐药粪肠球菌和屎肠球菌
10年共检出万古霉素耐药粪肠球菌61株、屎肠球菌579株,除甘肃、上海一所儿童医院未检出外,其他医院均有检出,主要来自北京医院(粪肠球菌12株、屎肠球菌105株)、北京协和医院(粪肠球菌11株、屎肠球菌79株)、浙江大学附属第一医院(粪肠球菌7株、屎肠球菌65株)、华中科技大学同济医学院附属同济医院(粪肠球菌7株、屎肠球菌51株)、上海交通大学医学院附属瑞金医院(粪肠球菌1株、屎肠球菌52株)、复旦大学附属华山医院(粪肠球菌1株、屎肠球菌44株)。上海2所医院万古霉素耐药屎肠球菌增加趋势明显,分别由2005年的1.0%、0.8%上升至2014年的8.7%、10.7%,而北京医院、华中科技大学同济医学院附属同济医院最近2年有所下降,四川大学华西医院2014年万古霉素耐药屎肠球菌分离率最高,为13.7%,见表6。
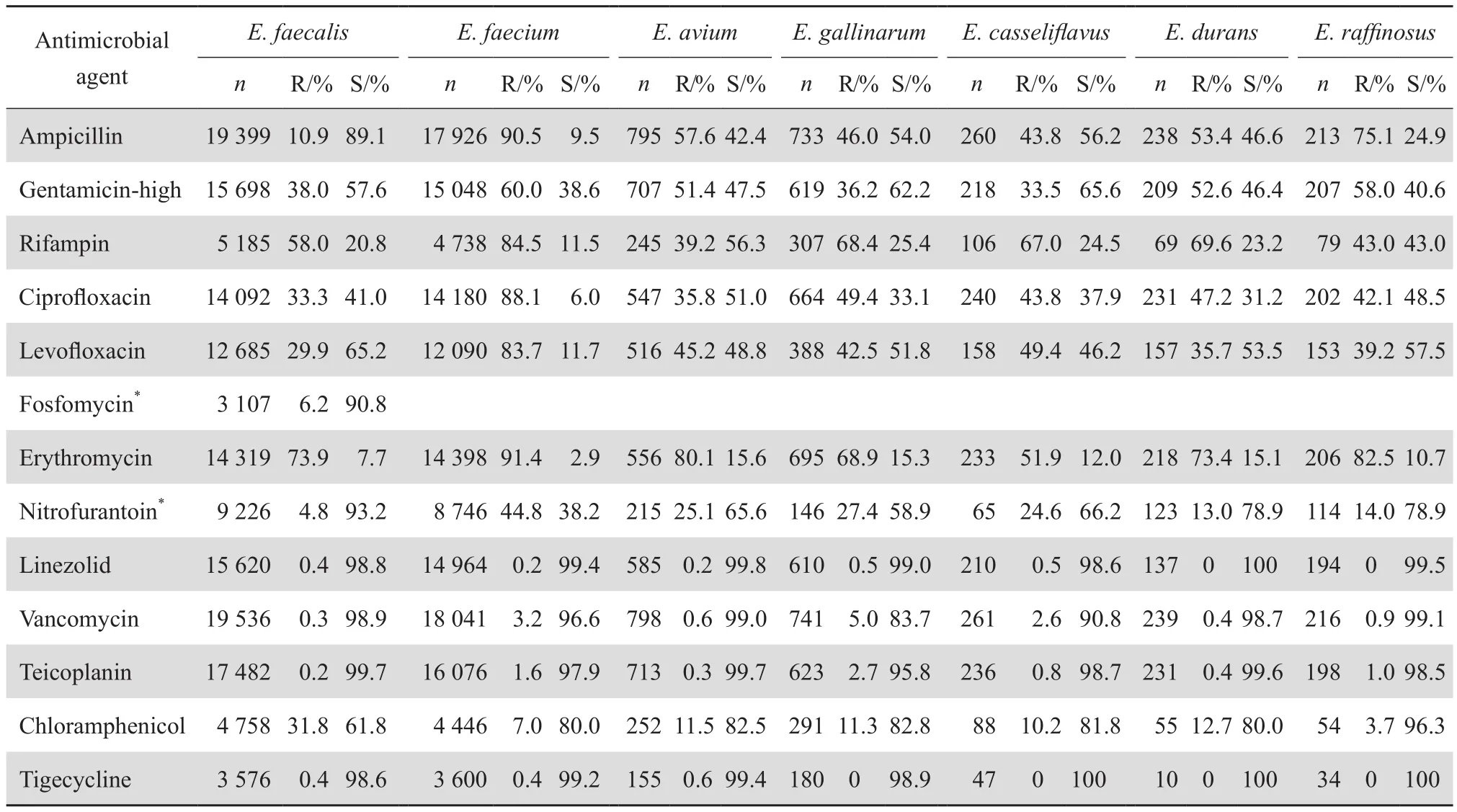
表3 主要肠球菌属细菌对各种抗菌药物的耐药率和敏感率Table 3 Susceptibility of the main Enterococcus species to antimicrobial agents
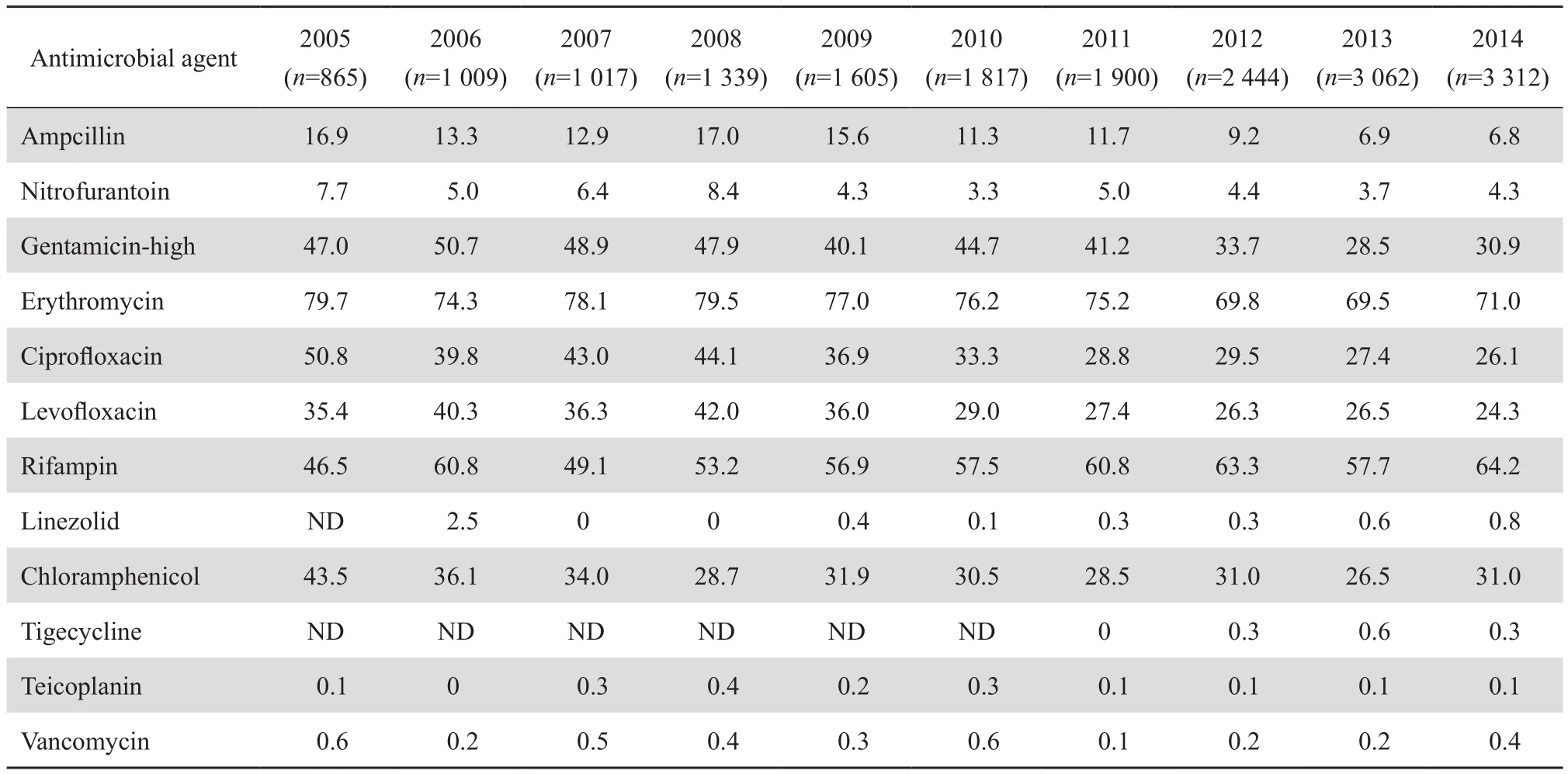
表4 2005—2014年粪肠球菌对抗菌药物的耐药率变迁Table 4 Changing resistance rate of E. faecalis strains to various antimicrobial agents from 2005 through 2014 (%)
万古霉素耐药粪肠球菌和屎肠球菌对替考拉宁、利奈唑胺、氯霉素耐药率分别为33.3%和53.2%、11.1%和1.2%、12.5%和2.7%,见表7。

表5 2005—2014年屎肠球菌对抗菌药物的耐药率变迁Table 5 Changing resistance rate of E. faecium strains to various antimicrobial agents from 2005 through 2014 (%)

表6 2005—2014年不同医院屎肠球菌万古霉素耐药率变迁Table 6 Changing resistance rate of E. faecium strains to vancomycin from 2005 through 2014 in different hospitals (%)
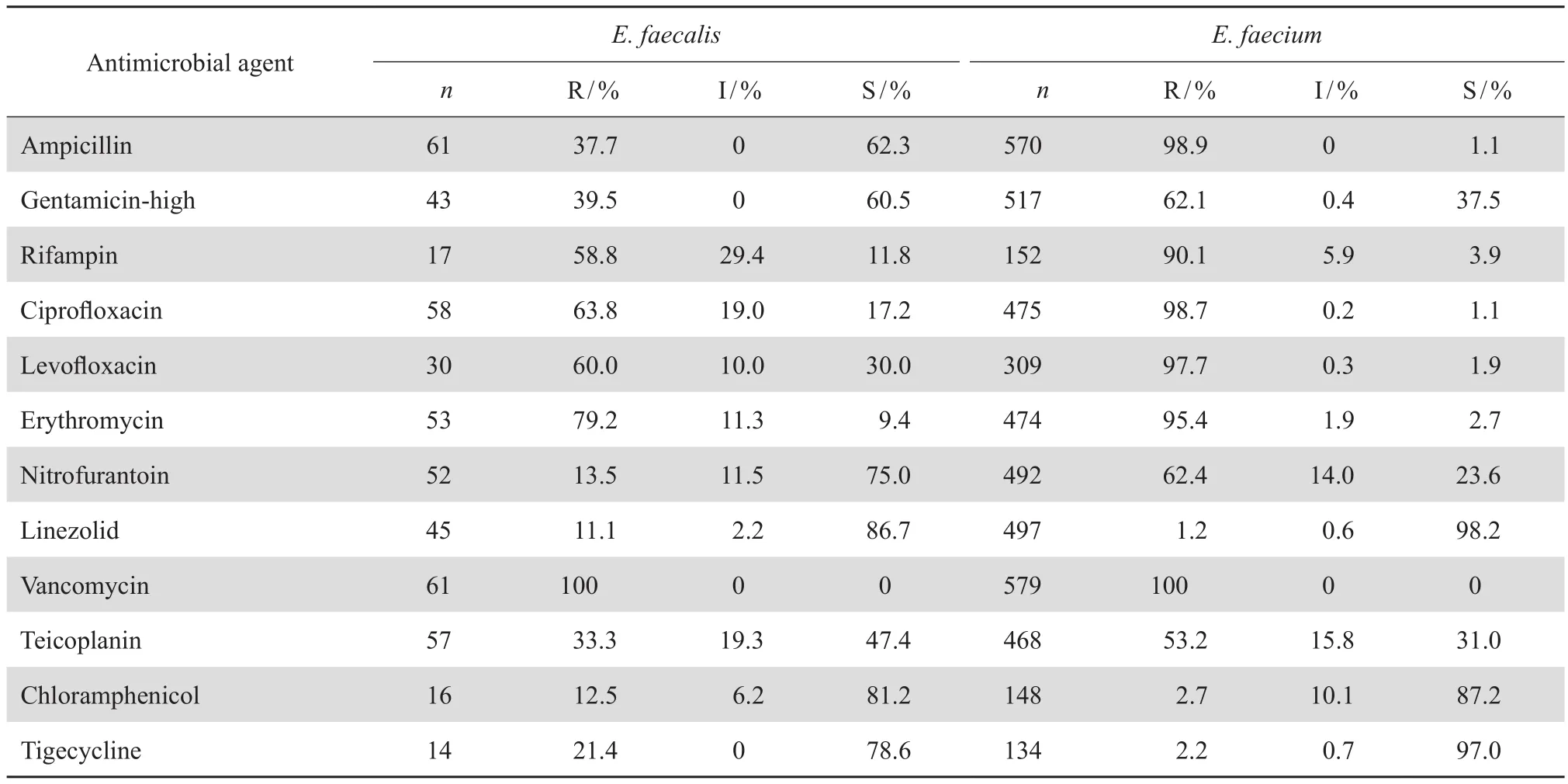
表7 万古霉素耐药屎肠球菌和粪肠球菌对抗菌药物的耐药率和敏感率Table 7 Susceptibility of vancomycin-resistant E. faecium and E. faecalis strains to antimicrobial agents
3 讨论
随着抗菌药物的广泛应用、各种侵袭性医用装置的使用以及免疫缺陷人群的增加,肠球菌所致感染逐渐增多,大部分为医疗相关性感染,包括血流感染、手术部位感染、尿路感染及腹腔感染等[2-3]。粪肠球菌和屎肠球菌仍是最主要的菌种,本文监测结果表明,粪肠球菌分离率从2005年的52.7%下降至2014年的45.4%,而屎肠球菌分离率从2005年的41.5%上升至2014年的48.6%,尿液标本以粪肠球菌为主,而血液和腹腔引流液中屎肠球菌更为常见。
自1988年英国和法国[4-5]首次报道万古霉素耐药肠球菌(VRE)以来,VRE已成为严重威胁人类健康的耐药菌,据估算美国每年VRE引起的医疗相关性感染约为20 000例,约1 300例因VRE感染而丧生[6]。VRE通常都以万古霉素耐药屎肠球菌(VREfm)为主,不同国家地区万古霉素耐药株发生率不同,美国2012年LEADER耐药监测结果表明屎肠球菌、粪肠球菌中万古霉素耐药株检出率分别为73.7%、3.6%[7],而2013年欧洲抗菌药物耐药网(EARS-Net)结果显示VREfm检出率为8.9%,比2010年5.6%明显上升,部分国家如爱尔兰高达42.7%[8]。我国台湾地区耐药监测结果也表明VREfm检出率显著增加,从2004 年0.3%上升至2010年24.9%[9]。相对于其他国家和地区,国内VRE分离率仍较低,本文监测结果表明,粪肠球菌万古霉素耐药株总检出率为0.3%,10年间耐药率均在1.0%以下,而屎肠球菌万古霉素耐药株检出率为3.2%,其耐药株检出率有一定的增高趋势,从2005年的0.6%上升至2014年的4.2%,特别是上海2所医院分别由2005年的1.0%、0.8%上升至2014年的8.7%、10.7%,四川大学华西医院2014年分离率最高为13.7%,但也有部分医院呈下降趋势,如北京医院从2008年的21.7%下降至2014年的6.8%,华中科技大学同济医学院附属同济医院从2011年的9.8%下降至2014年的2.1%。国内外分子流行病学证实大多数引起人类感染的VRE是CC17克隆群屎肠球菌,除对万古霉素耐药外,还对氨苄西林、高浓度氨基糖苷类和喹诺酮类抗菌药物耐药,而且这些菌株通常携带有esp毒力基因[10-11]。本文监测资料表明VREfm仅对利奈唑胺、替加环素、氯霉素敏感,耐药率<3%,对替考拉宁耐药率为53.2%,推测其耐药机制可能以VanA或VanM为主[12]。
利奈唑胺在体外对粪肠球菌及屎肠球菌包括万古霉素耐药株均有较好的抗菌活性,但本次监测结果也发现少量的利奈唑胺不敏感株,文献报道其耐药机制主要包括靶位点23SrRNA核糖体点G2576点突变,以及cfr基因介导的23SrRNA核糖体A2503残基甲基化[7,13]。2011年开始监测替加环素对肠球菌的敏感性,结果表明替加环素对肠球菌也保持非常好的敏感性。
本文资料显示,粪肠球菌对呋喃妥因、磷霉素和氨苄西林也保持较高的敏感率,且耐药率有逐年下降趋势,对高浓度庆大霉素耐药率也有下降趋势。屎肠球菌耐药性明显高于粪肠球菌,对青霉素、氨苄西林、氟喹诺酮类、红霉素、利福平耐药率均>80%,对氯霉素耐药率低于粪肠球菌,对高浓度庆大霉素耐药率有所下降。
鹑鸡肠球菌和铅黄肠球菌引起的感染非常少见,但由于其携带染色体介导的VanC基因,对万古霉素天然低水平耐药,MIC介于8~16 mg/L[12]。本文结果显示鹑鸡肠球菌、铅黄肠球菌对万古霉素敏感率分别为83.7%、90.8%,提示纸片法药敏试验可能不易检测出万古霉素低水平耐药株。
[1]Clinical and Laboratory Standards Institute. Performance standards for antimicrobial susceptibility testing: twenty-first Information Supplement[S]. 2014, M100-S24.
[2]WOODFORD N, LIVERMORE DM. Infections caused by Gram-positive bacteria: a review of the global challenge[J]. J Infect,2009,59(Suppl 1):s4-s16.
[3]李光辉,朱德妹,汪复,等. 2012年中国CHINET血培养临床分离菌的分布及耐药性[J].中国感染与化疗杂志,2014,14(6):474-481.
[4]LECLERCQ R, DERLOT E, DUVAL J, et al. Plasmid-mediated resistance to vancomycin and teicoplanin in Enterococcus faecium[J]. N Engl J Med,1988,319(3):157-161.
[5]UTTLEY AH, COLLINS CH, NAIDOO J, et al. Vancomycinresistant enterococci[J]. Lancet,1988,1(8575-6):57-58
[6]CDC. Antibotic resistance threats in the United States, 2013. [EB/OL]. [2014-07-17]. http://www.cdc.gov/ drugresistance/ threat-report-2013 .
[7]MENDES RE, FLAMM RK, HOGAN PA, et al. Summary of linezolid activity and resistance mechanisms detected during the 2012 LEADER surveillance program for the United States[J]. Antimicrob Agents Chemother,2014,58(2):1243-1247.
[8]European Centre for Disease Prevention and Control( ECDC). Antimicrobial resistance surveillance in Europe 2013. Annual Report of the European Antimicrobial Resistance SurveillanceNetwork( EARS-Net)[EB/OL]. [2014-07-17]. http://www.ecdc.europa.eu/en/publications/Publications / antimicrobial-resistance-surveillance-europe-2013.pdf.
[9]WANG JT, CHANG SC, WANG HY, et al. High rates of multidrug resistance in Enterococcus faecalis and E. faecium isolated from inpatients and outpatients in Taiwan[J]. Diagn Microbiol Infect Dis, 2013,75(4):406-411.
[10]KANG M, XIE Y, HE C, et al. Molecular characteristics of vancomycin-resistant Enterococcus faecium from a tertiary care hospital in Chengdu, China[J]. Eur J Clin Microbiol Infect Dis. 2014,33(6):933-939.
[11]WILLEMS RJ, BONTEN MJ. Glycopeptide-resistant enterococci: deciphering virulence,resistance and epidemicity[J]. Curr Opin Infect Dis,2007;20(4):384-390.
[12]CATTOIR V, LEELERCQ R. Twenty-five years of shared life with vancomycin-resistant enterococci:is it time to divorce?[J]. J Antimicrob Chemother, 2013, 68(4):731-742.
[13]CATTOIR V, GIARD J C. Antibiotic resistance in Enterococcus faecium clinical isolates[J]. Expert Rev Anti Infect Ther, 2014,12(2):239-248.
Resistance profile of Enterococcus in hospitals across China: results of CHINET Antimicrobial Resistance Surveillance Program, 2005-2014
YANG Qing, YU Yunsong, LIN Jie, NI Yuxing, SUN Jingyong, XU Yingchun, Zhang Xiaojiang, SUN Ziyong, CHEN Zhongju, WANG Fu, ZHU Demei, HU Fupin, JIANG Xiaofei, WANG Chuanqing, WANG Aimin, ZHUO Chao, SU Danhong, HU Yunjian,AI Xiaoman, HUANG Wenxiang, JIA Bei, ZHANG Zhaoxia, JI Ping, ZHANG Hong, KONG Jing, WEI Lianhua, WU Ling, XU Yuanhong, SHEN Jilu, SHAN Bin, DU Yan, HU Zhidong, LI Jin, XIE Yi, KANG Mei, HAN Yanqiu, GUO Sufang, CHU Yunzhuo, TIAN Sufei. (State Key Laboratory for Diagnosis and Treatment of Infectious Diseases, the First Affiliated Hospital, Zhejiang University School of Medicine, Hangzhou 310003, China)
Objective To investigate the antimicrobial resistance of Enterococcus strains isolated from hospitals across China during the period from 2005 through 2014. Methods Antimicrobial susceptibility testing was carried out by means of Kirby-Bauer method according to the unified protocol. The data were analyzed by using WHONET 5.6 software according to CLSI 2014 breakpoints. Results A total of 42 185 nonduplicate Enterococcus isolates were collected from 2005 through 2014. The most frequently isolated species were E. faecalis (47.3%), E. faecium (43.5%), E. avium (1.9%), E. gallinarum (1.8%) and E. casseliflavus (0.6%). The prevalence of Enterococcus spp. decreased with time from 9.1% in 2005 to 8.7% in 2014. The strains of Enterococcus were still highly susceptible to linezolid, vancomycin, teicoplanin and tigecycline (overall < 4% resistant). The prevalence of vancomycinresistant E. faecalis and E.faecium was 0.3% and 3.2%, respectively. And 10.9% and 38.0% of the E. faecalis isolates were resistant to ampicillin and gentamicin (high level), respectively. Only 4.8% and 6.2% of the E. faecalis strains isolated from urine were resistant to nitrofurantoin and fosfomycin, respectively. E. faecalis showed deceasing resistance rate to these agengts during the period from 2005 through 2014. The E. faecium strains were more resistant than E. faecalis to most of the antibiotics tested. More than 80% of the E. faecium strains were resistant to ampicillin, ciprofloxacin and rifampin, and 60.8% resistant to gentamicin (high level). But only 7.0% of these strains were resistant to chloramphenicol. The prevalence of vancomycin-resistant strain in E. faecium increased from 0.6% in 2005 to 4.2% in 2014. Conclusions Linezolid, vancomycin, teicoplanin and tigecycline are still highly active against Enterococcus isolates, but attention should be paid to the increasing vancomycin resistance in E. faecium.
Enterococcus; antibiotic resistance surveillance; antimicrobial agent
R378.1
A
1009-7708(2016)02-0146-07
10.16718/j.1009-7708.2016.02.006
2015-04-07
2015-10-09
1. 浙江大学附属第一医院传染病诊治国家重点实验室,杭州 310003;
2. 浙江大学医学院附属邵逸夫医院;
3. 上海交通大学医学院附属瑞金医院;
4. 北京协和医院;
5. 华中科技大学同济医学院附属同济医院;
6. 复旦大学附属华山医院;
7. 复旦大学附属儿科医院;
8. 广州医科大学附属第一医院;
9. 北京医院;
10. 重庆医科大学附属第一医院;
11. 新疆医科大学第一附属医院;
12. 上海交通大学附属儿童医院;
13. 甘肃省人民医院;
14. 安徽医科大学第一附属医院;
15. 昆明医科大学第一附属医院;
16. 天津医科大学总医院;
17. 四川大学华西医院;
18. 内蒙古医科大学附属医院;
19. 中国医科大学附属第一医院
杨青(1972—),男,副主任技师,主要从事病原菌检测和病原菌耐药机制研究。
俞云松,E-mail:yvys119@163.com。
