2005—2014年CHINET流感嗜血杆菌和卡他莫拉菌耐药性监测
2016-09-26王传清王爱敏徐英春张小江苏丹虹胡云建艾效曼孙自镛陈中举魏莲花俞云松0洁0徐元宏沈继录韩艳秋郭素芳黄文祥倪语星孙景勇张朝霞褚云卓田素飞胡志东胡付品朱德妹
孙 燕, 孔 菁, 张 泓, 王传清, 王爱敏, 徐英春, 张小江, 卓 超, 苏丹虹,胡云建, 艾效曼, 孙自镛, 陈中举, 谢 轶, 康 梅, 魏莲花, 吴 玲, 单 斌,杜 艳, 俞云松0, 林 洁0, 徐元宏, 沈继录, 韩艳秋, 郭素芳, 杨 青, 贾 蓓,黄文祥, 倪语星, 孙景勇, 张朝霞, 季 萍, 褚云卓, 田素飞, 胡志东, 李 金,汪 复, 胡付品, 朱德妹
·论著·
2005—2014年CHINET流感嗜血杆菌和卡他莫拉菌耐药性监测
孙 燕1, 孔 菁1, 张 泓1, 王传清2, 王爱敏2, 徐英春3, 张小江3, 卓 超4, 苏丹虹4,胡云建5, 艾效曼5, 孙自镛6, 陈中举6, 谢 轶7, 康 梅7, 魏莲花8, 吴 玲8, 单 斌9,杜 艳9, 俞云松10, 林 洁10, 徐元宏11, 沈继录11, 韩艳秋12, 郭素芳12, 杨 青13, 贾 蓓14,黄文祥14, 倪语星15, 孙景勇15, 张朝霞16, 季 萍16, 褚云卓17, 田素飞17, 胡志东18, 李 金18,汪 复19, 胡付品19, 朱德妹19
目的 了解2005—2014年国内不同地区临床分离流感嗜血杆菌和卡他莫拉菌的耐药性变迁。方法 收集17所综合性医院和2所儿童医院临床分离的7 983株流感嗜血杆菌和1 713株卡他莫拉菌,采用纸片扩散法或自动化仪器法按统一方案进行药敏试验,依照CLSI 2014版标准判断结果。头孢硝噻吩纸片法测定β内酰胺酶。结果 10年间,流感嗜血杆菌的检出率呈上升趋势:2005年为0.69%,2014年上升至1.57%;10年间,卡他莫拉菌的检出率呈上升趋势:2005年为0.03%,2014年上升至0.41%。7 983株流感嗜血杆菌对甲氧苄啶-磺胺甲唑耐药率最高且上升趋势最明显,由2005年的44.4%上升至2014年的64.6%;对氨苄西林、氨苄西林-舒巴坦和阿奇霉素耐药率呈上升趋势,分别由2005年的20.6%、11.8%和2.2%上升至2014年的41.8%、24.8%和14.2%;对头孢噻肟、环丙沙星和氯霉素耐药率近年有下降趋势;对阿莫西林-克拉维酸和头孢呋辛耐药率虽略有上升趋势,但仍低于25%。儿童分离株对氨苄西林的耐药率和产酶率(36.7%、 33.8%)均高于成人分离株(25.7%、22.5%),对环丙沙星的耐药率(4.7%)低于成人分离株(15.8%),耐药率差异均有统计学意义(P<0.05)。β内酰胺酶总检出率为29.9%。383株为β内酰胺酶阴性氨苄西林耐药株(BLNAR)。1 713株卡他莫拉菌对第二和第三代头孢菌素、阿莫西林-克拉维酸、左氧氟沙星和甲氧苄啶-磺胺甲唑均高度敏感(敏感率为80%~100%),耐药率变化较小,但对阿奇霉素的耐药率较高且呈上升趋势,由2006年的41.2%增至2013年的57.8%。该菌产β内酰胺酶的检出率为93.3%。结论 流感嗜血杆菌对头孢菌素类、阿莫西林-克拉维酸、阿奇霉素、氯霉素及环丙沙星耐药率较低,可作为临床的首选用药,而对甲氧苄啶-磺胺甲唑耐药率已上升至60%左右,不适于临床用药。卡他莫拉菌对所测试药物耐药率变化较小。
流感嗜血杆菌; 卡他莫拉菌; β内酰胺酶; 耐药性
流感嗜血杆菌是寄居于人类上呼吸道的条件致病菌,可引起成人和儿童社区获得性肺炎、鼻窦炎和化脓性中耳炎等。卡他莫拉菌是仅次于肺炎链球菌和流感嗜血杆菌的第三位呼吸道感染病原体。这2种细菌对抗菌药物的耐药率及产β内酰胺酶率不断上升的趋势在临床上受到越来越多的重视。现将2005—2014年CHINET流感嗜血杆菌和卡他莫拉菌耐药性监测结果报道如下。
1 材料与方法
1.1 材料
1.1.1 细菌来源 收集2005—2014年国内主要地区19所教学医院临床分离的流感嗜血杆菌和卡他莫拉菌,剔除同一患者分离的重复菌株。
1.1.2 培养基和药敏试验用材料 培养基药敏试验用MH琼脂,购于英国OXOID公司。流感嗜血杆菌药敏试验培养基和营养补充剂SR158购于英国OXOID公司。
1.1.3 抗菌药物纸片 抗菌药物纸片及测定β内酰胺酶的头孢硝噻吩试剂购于美国BD公司或英国OXOID公司。
1.2 方法
参照CLSI 2014年推荐的药敏试验方法进行。
1.2.1 药敏试验 采用纸片扩散法(K-B法)或自动化仪器法。质控菌株为流感嗜血杆菌ATCC49247,药敏试验结果按CLSI 2014年版标准判断[1]。
1.2.2 β内酰胺酶检测 采用头孢硝噻吩试验定性检测流感嗜血杆菌的β内酰胺酶。
1.2.3 结果统计分析 试验结果数据用WHONET5.6软件统计分析。
2 结果
2.1 细菌及其分布
参与本研究的19所医院2005—2014年共收集到流感嗜血杆菌7 983株,卡他莫拉菌1 713株,在各医院的分布见表1。10年间,流感嗜血杆菌的检出率呈上升趋势:2005年为0.69%,2014年上升至1.57%;10年间,卡他莫拉菌的检出率呈上升趋势:2005年为0.03%,2014年上升至0.41%,见表2。
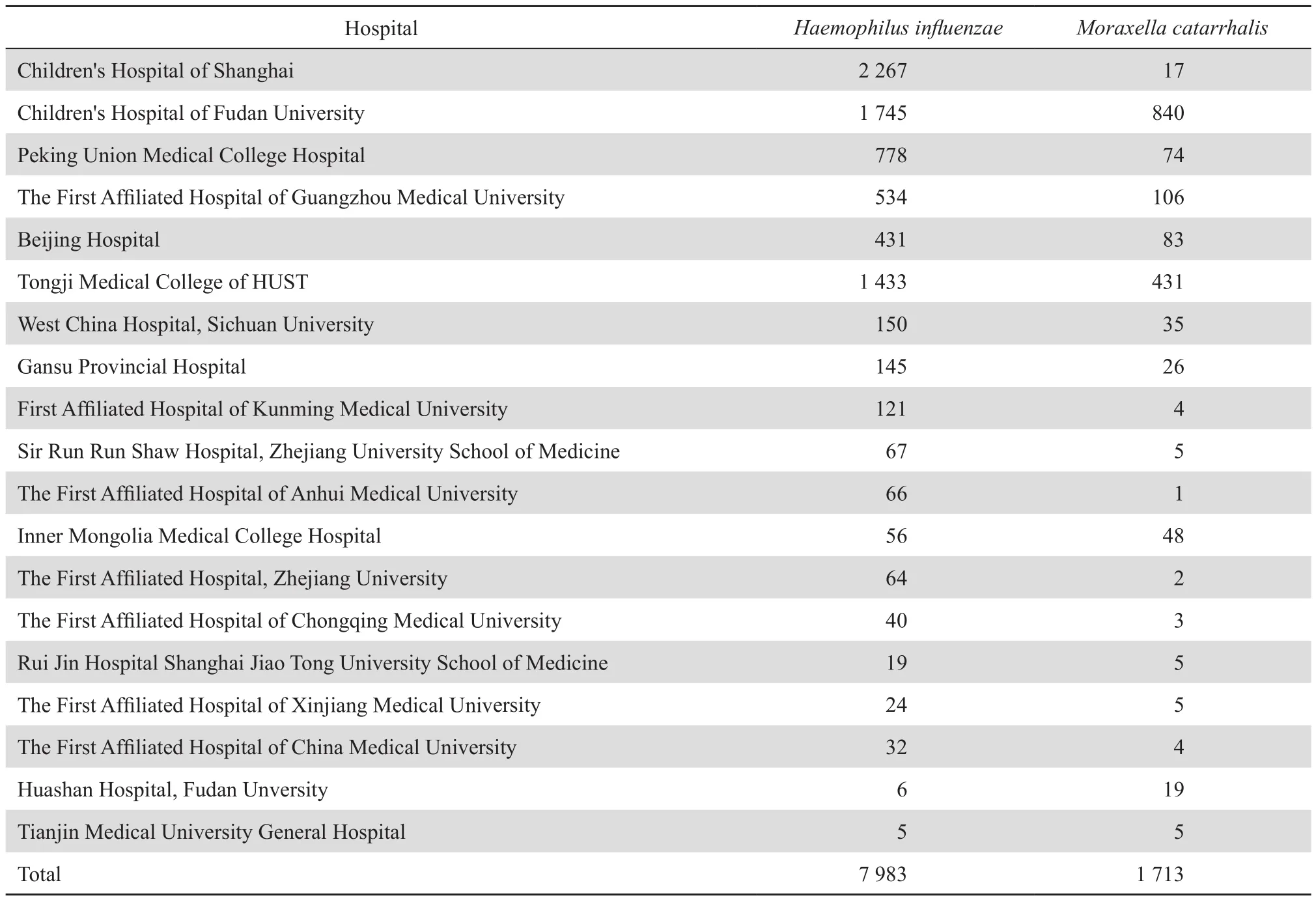
表1 2005—2014年流感嗜血杆菌和卡他莫拉菌在不同医院的分布Table 1 Distribution of Haemophilus influenzae and Moraxella catarrhalis by hospital from 2005 to 2014
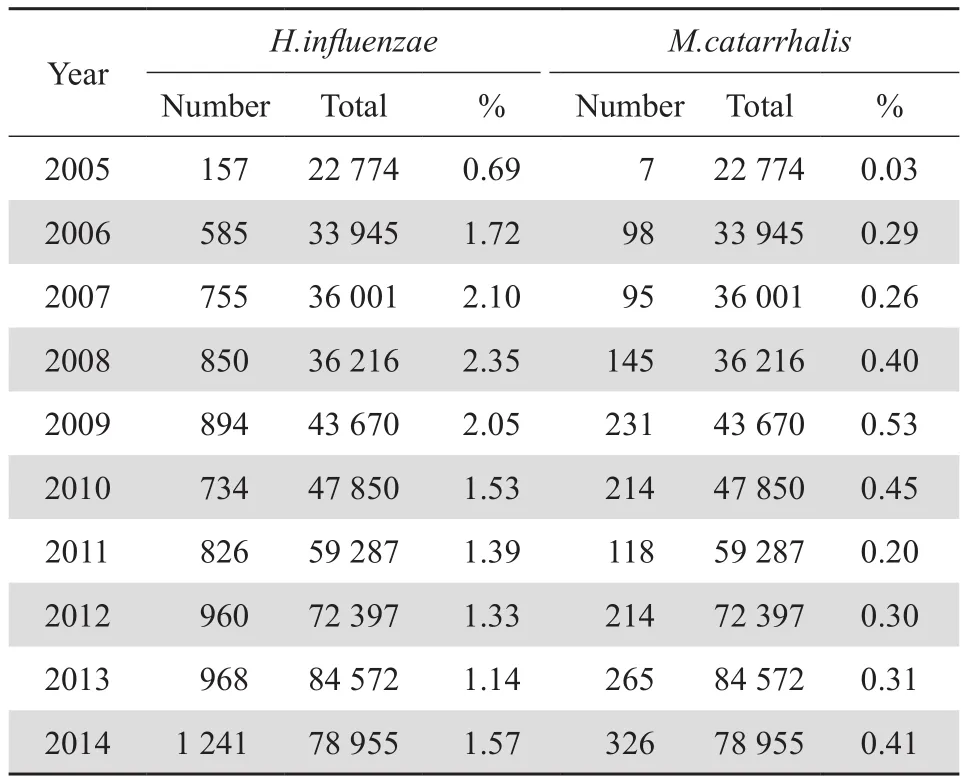
表2 流感嗜血杆菌和卡他莫拉菌在所有临床分离株中的检出率Table 2 Prevalence of H. influenzae and M. catarrhalis among all clinical isolates
7 983株流感嗜血杆菌中,儿童(<18岁)分离株5 277株,占66.1%,成人(≥18岁)分离株2 706株,占33.9%。儿童分离株中, 分离自3岁及以下儿童3 750株,占儿童分离株的71.1%;4~10岁958株, 占18.2%;11~18岁569株,占10.7%。分离自住院患者6 575株,占82.4%,分离自门急诊患者1 408株,占17.6%。流感嗜血杆菌主要分离自呼吸道标本,占89.6%(7 153/ 7 983),其次为生殖道标本占5.5%(438/7 983)、脓液标本占0.7%(55/7 983)、血液标本占0.5%(38/ 7 983),其他标本占3.7%(299/7 983)。
1 713株卡他莫拉菌中,儿童(<18岁)分离株1 173株,占68.5%,成人(≥18岁)分离株540株,占31.5%。儿童分离株中,分离自3岁及以下儿童941株,占儿童分离株的80.2%;4~10岁180株,占15.3%;11~18岁52株,占4.5%。分离自住院患者的菌株为1 561株,占91.1%,分离自门急诊患者的菌株为152株,占8.9%。卡他莫拉菌主要分离自呼吸道标本,占93.8%(1 607/ 1 713),其次为血液占0.5%(9/1 713)、脓液占0.5% (8/1 713)和生殖道标本占0.2%(3/1 713),其他标本占5.0%(86/1 713)。
2.2 流感嗜血杆菌和卡他莫拉菌β内酰胺酶检测结果
7 983株流感嗜血杆菌中有6 399株做了β内酰胺酶的检测,其中儿童株4 218株,成人株2 181株;儿童分离株和成人分离株β内酰胺酶检测率分别为33.8%(1 425/4 218)和22.5%(490/ 2 181);总检出率29.9%(1 915/6 399)。对氨苄西林耐药流感嗜血杆菌中,儿童分离株产酶率为83.4%(1 338/1 605),成人分离株为76.5% (378/494)。1 713株卡他莫拉菌中有1 289株做了β内酰胺酶检测,β内酰胺酶检出率为93.2% (1 202/1 289);其中儿童株检出率为94.6% (850/898),成人株为90.0%(352/391)。
2.3 流感嗜血杆菌对各种抗菌药物的耐药性变迁
7 983株流感嗜血杆菌对氨苄西林、氨苄西林-舒巴坦、甲氧苄啶-磺胺甲唑、阿莫西林-克拉维酸、头孢呋辛及阿奇霉素耐药率均呈上升趋势,其中以氨苄西林和甲氧苄啶-磺胺甲唑上升最明显,分别由2005年的20.6%和44.4%上升到2014年的41.8%和64.6%。对头孢噻肟、环丙沙星和氯霉素耐药率呈下降趋势,见表3。

表3 2005—2014年流感嗜血杆菌对常用抗菌药物的耐药率和敏感率Table 3 Susceptibility of of Haemophilus influenzae to antimicrobial agents by year from 2005 to 2014 (%)
分离于儿童患者的流感嗜血杆菌对氨苄西林、氨苄西林-舒巴坦、头孢呋辛和甲氧苄啶-磺胺甲唑耐药率上升的趋势比成人分离株明显,尤以甲氧苄啶-磺胺甲唑最明显,由2005年的39.3%增至2014年的67.8%;儿童分离株和成人分离株对头孢噻肟、阿奇霉素和氯霉素耐药率的变化较为平稳,但儿童分离株对这3种药物的耐药率皆高于成人。成人分离株和儿童分离株对环丙沙星的耐药率都呈下降趋势,分别由2005年的30.9%和14.8%下降至2014年的15.3%和4.9%,见表4。
2.4 卡他莫拉菌对各种抗菌药物的耐药性和敏感性变迁
卡他莫拉菌除了对阿奇霉素耐药率在30%~ 60%外,对其他抗菌药物,包括第二、第三代头孢菌素,阿莫西林-克拉维酸,左氧氟沙星和甲氧苄啶-磺胺甲唑耐药率均较低且变化不大,见表5。
3 讨论
本次监测结果显示,7 983株流感嗜血杆菌和1 713株卡他莫拉菌主要分离于呼吸道标本,分别占89.6%和93.8%;主要分离于≤3岁儿童群体,分别占71.1%和80.2%,提示这2种细菌均为3岁及以下儿童患者呼吸道感染的主要病原体,这与2010年CHINET细菌耐药监测结果相仿[2]。流感嗜血杆菌对甲氧苄啶-磺胺甲唑耐药率由2005年的44.4%上升至2014年的64.6%;成人分离株和儿童分离株对氨苄西林耐药率分别由2005年的23.0%和16.4%上升至2014年36.0%和45.3%;而对头孢菌素类、阿莫西林-克拉维酸、阿奇霉素、氯霉素及环丙沙星耐药率均低于30%,提示临床上治疗流感嗜血杆菌感染可以根据药敏结果选用上述药物,但应控制甲氧苄啶-磺胺甲唑和氨苄西林的使用。
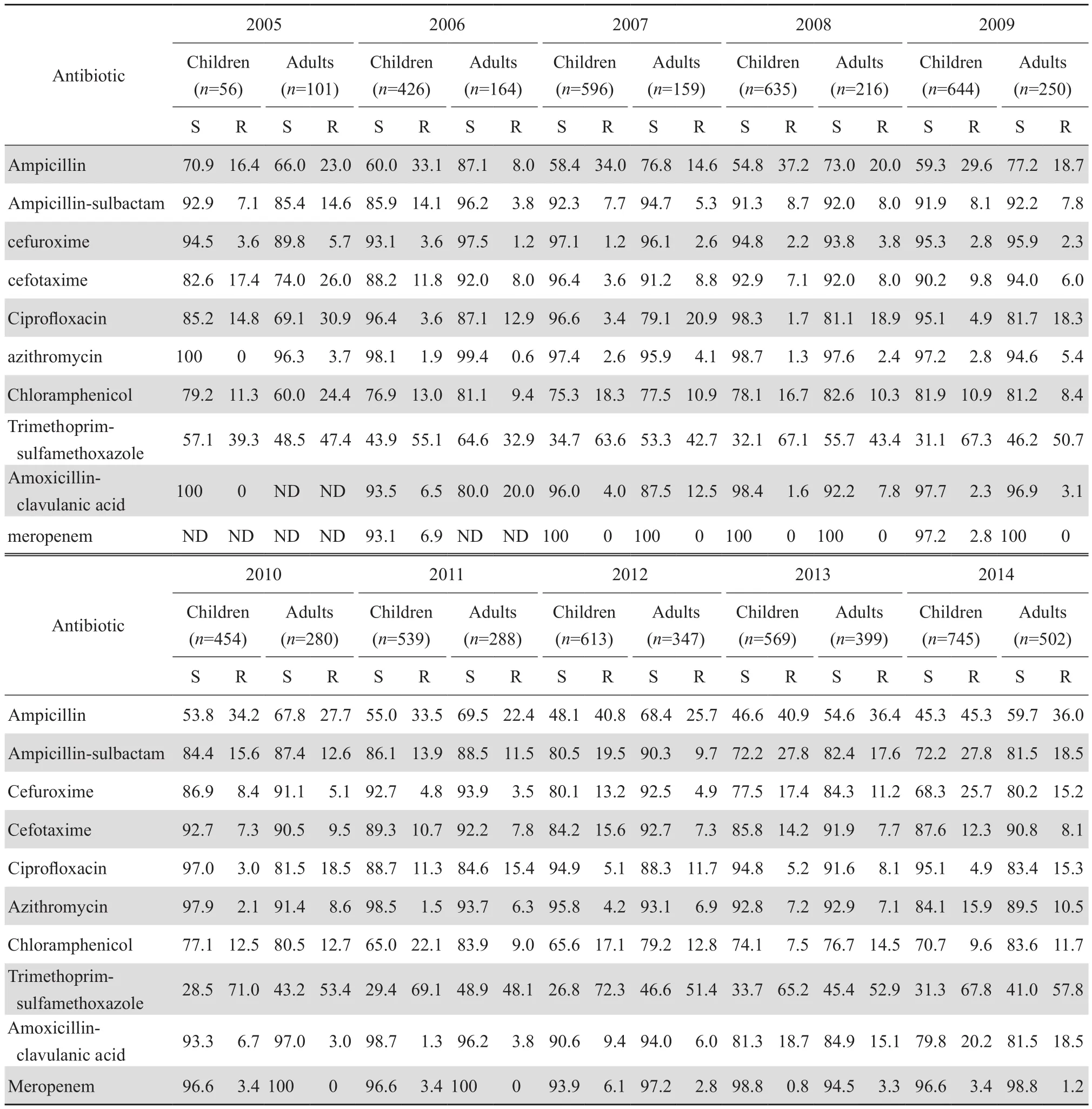
表4 2005—2014年分离自儿童和成人的流感嗜血杆菌对常用抗菌药物的敏感率和耐药率Table 4 Susceptibility of Haemophilus influenzae isolates from children and adults by year from 2005 to 2014 (%)
氨苄西林曾是治疗流感嗜血杆菌的首选药物,随着它在临床上的广泛使用,国内外各地区关于其耐药率呈上升趋势的报道也不断增多。ZHU等[3]报道北京地区流感嗜血杆菌对氨苄西林敏感率由2000年的96%降至2012年的61%的同时,产β内酰胺酶率由4%上升至31%,与本组结果相仿。流感嗜血杆菌对氨苄西林耐药的主要机制是产β内酰胺酶水解β内酰胺类抗生素,常见的β内酰胺酶有TEM-1和ROB-1型2种,其中90%以上为TEM-1型。而β内酰胺酶阴性氨苄西林耐药菌株( β-lactamase negative ampicillin-resistant, BLNAR)的耐药机制主要是青霉素结合蛋白(PBP)的结构改变使与氨苄西林及其他β内酰胺类抗生素的亲和力降低,不能被β内酰胺酶抑制剂所抑制。国外有报道显示,BLNAR+β内酰胺酶阴性氨苄西林中介菌株( β-lactamase negative ampicillin-intermediate,BLNAI)分离率由2000年的28.8%快速上升至2012年的63.5%[4]。本研究中,2005—2014年共7 983株流感嗜血杆菌中有383株为BLNAR,占4.8%,490株为BLNAI,占6.1%,BLNAR+BLNAI共占10.9%,提示BLNAR 和BLNAI分离率存在地区差异性。

表5 2005—2014年卡他莫拉菌对常用抗菌药物的耐药率和敏感率Table 5 Susceptibility of Moraxella catarrhalis to antimicrobial agents by year from 2005 to 2014 (%)
卡他莫拉菌对阿奇霉素耐药率较高但变化较平稳,在34.7%~57.8%;而对其他测试药物耐药率较低,提示临床上治疗卡他莫拉菌感染可将第二、第三代头孢菌素,阿莫西林-克拉维酸,左氧氟沙星和甲氧苄啶-磺胺甲唑作为首选药物。PINGAULT等[5]及SHEIKH等[6]研究显示,卡他莫拉菌产β内酰胺酶率分别为97.7%和84%,本组资料产酶率为93.3%,提示卡他莫拉菌产β内酰胺酶存在明显的地区差异性。卡他莫拉菌产生的β内酰胺酶被称为BRO酶,是由染色体基因编码合成的脂蛋白,可快速水解氨苄西林,导致氨苄西林耐药率增高。BRO酶主要为 BRO-1型和BRO-2型。BRO基因阳性菌株不仅影响β内酰胺类还能影响大环内酯类抗生素的抗菌活性,但不同的基因型对不同的抗生素抗菌活性的影响不同[7-8]。此外,最新研究发现卡他莫拉菌感染好发于冬春季,且月感染率与月平均气温、月平均风速、日照时间均呈负相关[9]。卡他莫拉菌引起儿童患者呼吸道疾病的特点及耐药率的变迁仍需进一步研究。
[1]Clinical and Laboratory Standards Institute.Performance standards for antimicrobial susceptibility testing[S]. Twentyfourth informational supplement, 2014 , M100-S24.
[2]张泓,孔菁,王传清,等. 2010中国CHINET流感嗜血杆菌和卡他莫拉菌耐药性监测[J].中国感染与化疗杂志, 2012,12(3): 180-184.
[3]ZHU H, WANG A, TONG J, et al. Nasopharyngeal carriage and antimicrobial susceptibility of Haemophilus influenzae among children younger than 5 years of age in Beijing, China [J].BMC Microbiol, 2015, 15(1): 6.
[4]SHIRO H, SATO Y, TOYONAGA Y, et al. Nationwide survey of the development of drug resistance in the pediatric field in 2000-2001, 2004, 2007, 2010, and 2012: Evaluation of the changes in drug sensitivity of Haemophilus influenzae and patients' background factors [J]. J Infect Chemother,2015, 21 (4):247-256.
[5]PINGAULT NM, BOWMAN JM, LEHMANN D, et al. Antimicrobial susceptibility of Moraxella catarrhalis isolated from children in Kalgoorlie-Boulder, Western Australia [J]. Pathology,2010,42(3): 273-279.
[6]SHEIKH SO, FASIH N, IRFAN S, et al. β-Lactamase production and antimicrobial susceptibility pattern of Moraxella catarrhalis isolates: report from Pakistan [J]. Asian Pac J Trop Med, 2014, 7S1:s228-s231.
[7]王频佳,谢成彬,吴雨露.儿童呼吸道卡他莫拉菌分离株耐药性与BRO基因分型研究[J].临床儿科杂志, 2013,31(8):719-722.
[8]VERDUIN CM, HOL C, FLEER A, et al.Moraxella catarrhalis: from emerging to established pathogen [J]. Clin Microbiol Rev,2002,15(1):125-144.
[9]孙慧明,周卫芳,季伟,等.苏州地区下呼吸道感染住院患儿卡他莫拉菌感染与气候因素相关性研究[J].临床儿科杂志,2014,32(6):524-527.
Antibiotic resistance profile of Haemophilus influenzae and Moraxella catarrhalis in hospitals across China:data from CHINET Antimicrobial Resistance Surveillance Program from 2005 through 2014
SUN Yan, KONG Jing, ZHANG Hong, WANG Chuanqing, WANG Aimin, XU Yingchun, ZHANG Xiaojiang, ZHUO Chao, SU Danhong, HU Yunjian, AI Xiaoman, SUN Ziyong, CHEN Zhongju, XIE Yi, KANG Mei, WEI Lianhua,WU Ling, SHAN Bin, DU Yan, YU Yunsong, LIN Jie, XU Yuanhong, SHEN Jilu, HAN Yanqiu, GUO Sufang,YANG Qing, JIA Bei, HUANG Wenxiang, NI Yuxing, SUN Jingyong, ZHANG Zhaoxia, JI Ping, CHU Yunzhuo,TIAN Sufei, HU Zhidong, LI Jin, WANG Fu, HU Fupin, ZHU Demei. (Children′s Hospital, Shanghai Jiaotong University, Shanghai 200040, China)
Objective To investigate the changing antibiotic resistance profile of Haemophilus influenzae and Moraxella catarrhalis strains collected from hospitals across China from 2005 through 2014. Methods A total of 7 983 strains of H. influenzae and 1 713 strains of M. catarrhalis were collected from 17 general hospitals and 2 children's hospitals. Antimicrobial susceptibility testing was carried out according to a unified protocol using Kirby-Bauer method or automated systems. Results were analyzed according to CLSI 2014 breakpoints. Beta-lactamases were detected by nitrocefin disk test. Results The prevalence of H. influenzae increased with time from 0.69% in 2005 to 1.57% in 2014. The prevalence of M. catarrrhalis increased with time from 0.03% in 2005 to 0.41% in 2014. Among the 7 983 clinical strains of H. influenzae, the the highest resistance rate was to trimethoprimsulfamethoxazole, which increased significantly from 44.4% in 2005 to 64.6% in 2014. The resistance rate to ampicillin, ampicillinsulbactam and azithromycin also increased from 20.6%, 11.8% and 2.2% in 2005 to 41.8%, 24.8% and 14.2% in 2014, respectively. However, the resistance rate to cefotaxime, ciprofloxacin and chloramphenicol decreased in recent years. The resistance rate of H. influenzae strains to amoxicillin-clavulanic acid and cefuroxime increased slightly but still lower than 25%. The resistance rate to ampicillin and the prevalence of β-lactamases in the H. influenzae strains from children (36.7%, 33.8%) were higher than in the strains from adults (25.7%, 22.5%). The resistance rate to ciprofloxacin was 4.7% in the H. influenzae strains from children,significantly lower than that in the strains from adults (15.8%). The overall prevalence of β-lactamases was 29.9% in the H. influenzae strains. A total of 383 H. influenzae strains were found resistant to ampicillin but β-lactamase negative. The 1 713 clinical strains of M. catarrhalis remained highly susceptible to the second and third generation cephalosporins, amoxicillin-clavulanic acid, levofloxacin and trimethoprim-sulfamethoxazole (80%-100% susceptible). The resistance rate to azithromycin increased from 41.2% in 2006 to 57.8% in 2013. The prevalence of β-lactamases was 93.3% in these M. catarrhalis. Conclusions H. influenzae and M. catarrhalis are still susceptible to cephalosporins, amoxicillin-clavulanic acid, azithromycin, chloramphenicol and ciprofloxacin, which can be used as the first choice in clinical practice. Nearly 60% of these strains were resistant to trimethoprim-sulfamethoxazole, which is inappropriate for clinical therapy. The resistance profile of M. catarrhalis does not change much in the 10-year period.
Haemophilus influenzae; Moraxella catarrhalis; β-lactamase; antibiotic resistance
R378.41
A
1009-7708(2016)02-0153-07
10.16718/j.1009-7708.2016.02.007
2015-04-15
2015-11-12
1. 上海市儿童医院,上海交通大学附属儿童医院,上海 200040;
2. 复旦大学附属儿科医院;
3. 北京协和医院;
4. 广州医科大学第一附属医院;
5. 北京医院;
6. 华中科技大学同济医学院附属同济医院;
7. 四川大学华西医院;
8. 甘肃省人民医院;
9. 昆明医科大学第一附属医院;
10. 浙江大学医学院附属邵逸夫医院;
11. 安徽医科大学第一附属医院;
12. 内蒙古医科大学附属医院;
13. 浙江大学附属第一医院;
14. 重庆医科大学附属第一医院;
15. 上海交通大学医学院附属瑞金医院;
16. 新疆医科大学第一附属医院;
17. 中国医科大学附属第一医院;
18. 天津医科大学总医院;
19. 复旦大学附属华山医院。
孙燕(1981—),女,本科,技师,主要从事细菌耐药机制分子流行病学分析。
张泓,E-mail: zhanghong3010@126.com。
