碳青霉烯类耐药阴沟肠杆菌耐药机制研究
2016-09-26林伯熹刘秀琴徐小红曹颖平
林伯熹, 李 彬, 刘秀琴, 徐小红, 曹颖平
·论著·
碳青霉烯类耐药阴沟肠杆菌耐药机制研究
林伯熹1,2, 李 彬1, 刘秀琴1, 徐小红1, 曹颖平1,2
目的 研究碳青霉烯类耐药阴沟肠杆菌的耐药机制。方法 收集福建医科大学附属协和医院2011年8月-2012 年8月的碳青霉烯类耐药阴沟肠杆菌,采用琼脂稀释法进行药敏试验;改良Hodge试验筛查菌株是否产碳青霉烯酶;利用PCR扩增碳青霉烯酶基因(KPC、IMP、VIM、NDM)及其他β内酰胺酶基因(SHV、TEM、CTX-M-1组、CTX-M-2组、CTX-M-9组);利用肠杆菌基因重复一致序列分析(ERIC-PCR)进行菌株同源性分析;通过接合试验验证碳青霉烯酶基因是否能水平转移。结果 共收集29株阴沟肠杆菌,药敏结果显示对检测抗菌药物耐药率>90 %的有3种,分别为头孢他啶(93.1 %)、头孢西丁(100 %)和氨曲南(93.1 %);多黏菌素B耐药率最低为3.4 %。改良Hodge试验阳性率为79.3 % (23/29)。29株实验菌共检出23株含有β内酰胺酶基因,其中IMP基因阳性17株、KPC基因阳性1株。29株阴沟肠杆菌可分为23个不同的型别,其中1株未能分型。接合试验成功率48.3 %(14/29)。结论 该院碳青霉烯类耐药阴沟肠杆菌携带碳青霉烯酶基因,以IMP基因较常见。
阴沟肠杆菌; 碳青霉烯酶; 金属酶IMP; 耐药机制
阴沟肠杆菌是临床上重要的感染病原体,常对多种抗菌药物耐药,引起难治性感染[1]。其耐药机制主要由产生β内酰胺酶引起,如产ESBL 和AmpC。新一代的碳青霉烯类抗生素凭借其良好的抗菌活性,对产ESBL和AmpC的革兰阴性杆菌有很强的治疗效果。随着碳青霉烯类药物的广泛应用,新型的耐药菌开始出现。2003年JEONG等[2]报道了产VIM-2型金属酶的阴沟肠杆菌,使碳青霉烯类耐药的阴沟肠杆菌开始受到广泛的关注。之后, 很多文献报道了携带碳青霉烯酶基因(如IMP、KPC、VIM、NDM)的阴沟肠杆菌[3-5],且此类细菌往往同时携带有其他β内酰胺酶基因,这使得临床出现越来越多的多重耐药菌。本实验对碳青霉烯类耐药阴沟肠杆菌进行耐药机制的研究,旨在为临床治疗该菌感染提供依据。
1 材料与方法
1.1 材料
1.1.1 菌株来源 收集2011年8月-2012年8月福建医科大学附属协和医院临床分离出对亚胺培南和厄他培南2种药物出现任一种耐药的阴沟肠杆菌29株,剔除同一患者同一部位的重复菌株。细菌培养标本包括痰、脓液、尿液、胆汁等。菌株均用法国生物梅里埃公司的全自动微生物分析系统VITEK-2 Compact进行鉴定。质控菌株为大肠埃希菌ATCC 25922。
1.1.2 仪器与试剂 MH琼脂、伊红亚甲蓝琼脂、亚胺培南、厄他培南纸片10 μg均购自杭州天和微生物试剂有限公司,dNTP Mix(10 mmol/L)、TaqDNA聚合酶(5 U/μg)、Loading Buffer(6×)均购自TaKaRa宝生物工程大连有限公司,基因扩增引物、琼脂糖、Maker(100~1 500 bp)均购自上海生工生物工程技术服务有限公司,PCR扩增仪和凝胶成像分析系统为美国BIO-RAD公司产品。
1.2 方法
1.2.1 药敏试验 采用琼脂稀释法进行药敏试验。药敏试验所用抗菌药物分别购于杭州默沙东制药有限公司、中国药品生物制品检定研究所、惠氏制药有限公司。制备0.5麦氏浊度的菌悬液,然后1∶10稀释,使用移液枪吸取制备好的菌液(约1~2 μL)接种于琼脂平皿表面,每点菌量约为104CFU/点,形成直径大约为5~8 mm的菌斑,待菌液被琼脂吸收后置35℃温箱孵育16~20 h,将平皿置于暗色、无反光物体表面上判断试验终点,获取药物的MIC值,判断标准参照CLSI 2011年版[6]。
1.2.2 改良Hodge试验 用此法进行碳青霉烯酶表型筛查。配制0.5麦氏浊度的大肠埃希菌ATCC25922的菌悬液,然后将其稀释10倍后均匀涂布在MH平皿上,室温放置待菌液吸收后,于平皿中间贴厄他培南(10 µg)纸片,而后用接种环挑取3~5个过夜生长的实验菌株以厄他培南纸片为起点,沿离心方向划线长度20~25 mm,置35 ℃温箱孵育16~20 h;如果受试菌株与大肠埃希菌ATCC25922抑菌圈交汇处,大肠埃希菌生长增强,即为产碳青霉烯酶[6]。
1.2.3 β内酰胺酶基因的检测 采用PCR法扩增常见的β内酰胺酶基因,包括TEM、SHV、CTXM-1组、CTX-M-2组、CTX-M-9组 以 及KPC、IMP、VIM、NDM。煮沸法制备PCR模板,引物序列见表1。反应体系为:总体积50 μL,引物(20 μmol/L)各1 μL,dNTP Mixture(各2.5 mmol/L)0.4 μL,PCR Buffer (Mg2+Free) 5 μL,Taq DNA聚合酶(5 U/μL)0.25 μL,MgCl2(25 mmol/L)3 μL,无菌水38.35 μL,模板DNA 1 μL。热循环参数:94 ℃预变性3 min,然后94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸30 s,共30个循环,最后72 ℃延伸10 min。PCR扩增产物经2 %琼脂糖凝胶电泳后观察结果,选取与目的片段大小一致的PCR阳性产物送上海生工生物工程技术服务有限公司测序,根据所测序列与GenBank中BLAST程序中的序列比对,确定所测细菌耐药基因的基因型。
1.2.4 接合试验 本实验利用LB液相接合方法,受体菌为大肠埃希菌J53 Azr(对叠氮钠耐药)。挑取供体菌和受体菌单个菌落分别接种于2 mL LB肉汤中,35 ℃摇床180 r/min孵育4 h。取0.5 mL的供体菌和受体菌菌液混合于另一管4 mL LB肉汤中,温箱中35 ℃温箱静置孵育18 h。取0.1 mL的混合菌液涂布于含100 mg/L的叠氮钠和1 mg/L头孢噻肟的MH琼脂平皿上,同时将受体菌和供体菌株等量涂布于筛选平皿上做对照,35 ℃温箱孵育过夜。挑取单个克隆,制备DNA模板用PCR进行阳性接合子的验证。
1.2.5 菌株同源性分析 利用肠杆菌基因重复一致序列分析(ERIC-PCR)对受试菌进行同源性分析。采用煮沸法提取细菌总DNA作为模板,引物序列为ERIC-F:5'-ATGTAAGCTCCTGGGGATTCAC-3',ERIC-R:5'-AAGTAAGTGACTGGGGTGAGCG-3'。反应体系同1.2.3。扩增条件:94 ℃预变性5 min;94 ℃变性1 min、26 ℃退火1 min、72 ℃延伸1 min,共4个循环;94 ℃变性30 s、40 ℃退火30 s、72 ℃延伸1 min,共40个循环;最后72 ℃延伸10 min。PCR产物经2 %琼脂糖凝胶电泳后观察结果。理论上,具有同源性的菌株应有相同的主带,且副带差异不多于3条[16]。

表1 所用PCR引物序列Table 1 The primers and corresponding sequence used in PCR
2 结果
2.1 药敏试验结果
结果显示,对β内酰胺类抗生素耐药率达50%以上;对3种碳青霉烯类抗生素的耐药率由高到低依次为厄他培南、亚胺培南、美罗培南。药敏结果见表2。

表2 29株碳青霉烯耐药阴沟肠杆菌对17种抗菌药物的耐药率Table 2 Susceptibility of 29 strains of carbapenem-resistant Enterobacter cloacae to 17 antimicrobial agents
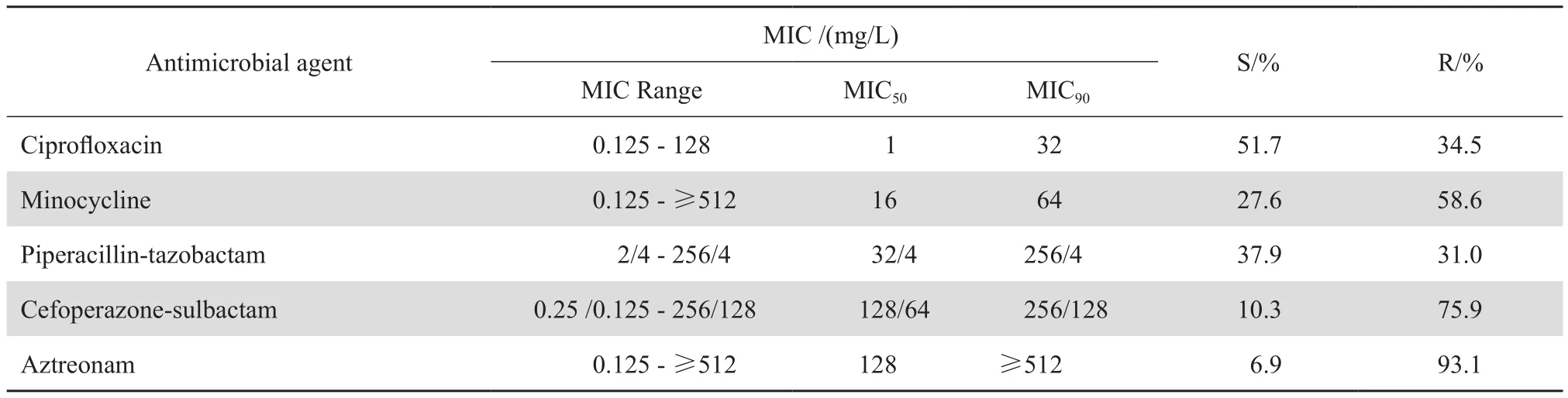
表2(续)Table 2(continued)
2.2 改良Hodge试验
29株碳青霉烯类耐药阴沟肠杆菌中,23株改良Hodge试验阳性,包括21株强阳性和2株弱阳性,6株阴性,阳性率为79.3 %,见图1。

图1 改良Hodge试验结果图Figure 1 The modified Hodge test
2.3 β内酰胺酶基因检测结果
2.3.1 碳青霉烯酶基因检测结果 29株碳青霉烯类耐药阴沟肠杆菌中,18株菌检出碳青霉烯酶基因(6株IMP-8、11株IMP-4、1株KPC-2),结果见表3。

表3 29株碳青霉烯类耐药阴沟肠杆菌耐药基因阳性率Table 3 The resistance genes identified in 29 strains of carbapenem-resistant Enterobacter cloacae
2.3.2 其他β内酰胺酶基因检测结果 29株碳青霉烯类耐药阴沟肠杆菌中21株菌携带其他β内酰胺酶基因,结果见表3,电泳图见图2。检出了CTX-M-1组基因3株(CTX-M-3型2株和CTXM-22型1株),检出了CTX-M-9组基因1株为CTX-M-14型;13株携带TEM基因,均为TEM-1基因型;14株携带SHV基因(SHV-12型12株和SHV-11型2株)。在IMP基因阳性的菌株中同时携带其他β内酰胺酶基因的占94.1%(16/17)。

图2 碳青霉烯类耐药阴沟肠杆菌耐药基因PCR电泳图Figure 2 Electrophoretogram of the PCR products of resistance genes in carbapenem-resistant Enterobacter cloacae
2.4 接合试验结果
对能在选择性平皿上生长的细菌通过耐药基因PCR和ERIC-PCR进行验证。筛选的接合子与供体菌具有相同的碳青霉烯酶基因;且ERIC-PCR结果显示筛选的接合子与受体菌属于同一型。本研究收集的29株阴沟肠杆菌中有14株(IMP型8株,KPC型1株,其他型5株)接合成功,接合率达48.3%。
2.5 菌株同源性分析结果
根据ERIC-PCR结果分析,29株阴沟肠杆菌可分为23个不同的型别,其中1株未能分型。电泳图见图3。

图3 部分实验菌ERIC-PCR电泳图Figure 3 Electrophoretogram of ERIC-PCR products of some carbapenem-resistant Enterobacter cloacae strains
3 讨论
阴沟肠杆菌是临床上常见的引起感染的革兰阴性杆菌,因其能引起人体多器官、多部位的感染而被临床重视。现今临床上出现越来越多的碳青霉烯类耐药阴沟肠杆菌,引起难治性感染[3-4]。
从药敏结果中显示,大多数受试菌为多重耐药菌,且对多种抗生素都产生了高水平的耐药,头孢西丁、头孢他啶、氨曲南对受试菌几乎无作用,受试菌对头孢吡肟的耐药率也超过了50 %,造成这种情况的原因可能与抗菌药物过度使用密切相关,临床抗感染时应酌情使用这些药物。该菌对多黏菌素B耐药率为3.4 %,但高毒性使其在临床上的应用受到一定限制。另外,阿米卡星的耐药率很低(10.3 %),与其他文献相似[17-19]。此外,左氧氟沙星对实验菌也有较好的抗菌活性,是因为氟喹诺酮类抗菌药物是全人工合成,其特有的分子结构少有天然耐药和交叉耐药的存在[20]。同时,本研究还发现,同属碳青霉烯类药物的亚胺培南、厄他培南的耐药率(>50 %)高于美罗培南,可能原因是亚胺培南较早应用在临床,而且美罗培南的抗菌作用靶位为PBP2和PBP3而亚胺培南的抗菌作用靶位仅为PBP2[21];而细菌的外膜相关机制是引起厄他培南耐药的重要原因[22],这可以解释本研究中厄他培南耐药率高于美罗培南。
改良Hodge试验的假阳性可由菌株携带并表达高水平的ESBL(如CTX-M,尤其是CTXM-2、CTX-M-15、CTX-M-59)和(或)AmpC酶、细菌外膜蛋白的缺失等机制引起[23-24]。本试验中,有6株假阳性菌株,其中4株携带有CTX-M基因;2株假阳性菌株未检出ESBL或AmpC酶基因,可能由于外膜蛋白缺失的原因[23]。另外,本研究检出1株携带IMP-4基因的假阴性菌株,可能由于细菌水解酶的表达水平不高所致。据DOYLE等[25]报道,改良Hodge试验在检测KPC型和OXA型碳青霉烯酶时具有良好的效果,但对金属酶IMP、VIM、NDM-1检测效果并不明显。
本实验中在阴沟肠杆菌中检出携带有IMP和KPC的菌株,与以往研究多次报道类似[26-28],且在各地都有相关的报道[3-5]。虽然没有出现大范围暴发的情况,但考虑到其通过质粒传播的可能性,应引起足够的重视。
耐药基因能够通过细菌的可移动序列实现跨菌种之间传播,这也是近年肠杆菌科细菌碳青霉烯类药物耐药增多的原因之一[29]。本实验中阴沟肠杆菌接合成功率较高(48.3 %)。通过接合试验证明了IMP及KPC基因发生水平转移可能性。通过ERIC-PCR,29株阴沟肠杆菌可被分为23个型别,尚未发现明显的克隆性传播。可以认为本实验收集的菌株来自不同的克隆个体,耐药菌株可能通过水平传播机制将耐药基因传给原本敏感的细菌。
肠杆菌科细菌常携带有ESBL和AmpC酶,所以碳青霉烯类抗生素在肠杆菌科细菌感染的治疗中起很大的作用。但从本次研究结果可以看出,福建医科大学附属协和医院收集的阴沟肠杆菌对碳青霉烯类抗生素产生耐药,为避免出现耐药菌的播散及耐药谱的扩大,临床及实验室应建立起本地区的碳青酶烯类耐药细菌情况调查及适合的检测体系,为防控提供客观依据。
[1]李岩, 许淑珍, 苏建荣,等. 阴沟肠杆菌产超广谱β-内酰胺酶、AmpC酶的检测及耐药性分析[J]. 中华医院感染学杂志,2007, 17(12):1586-1589.
[2]JEONG SH, LEE K, CHONG Y, et al. Characterization of a new integron containing VIM-2, a metallo-β-lactamase gene cassette, in a clinical isolate of Enterobacter cloacae [J]. J Antimicrob Chemother, 2003, 51(2): 397-400.
[3]TZOUVELEKIS LS, MARKOGIANNAKIS A, PSICHOGIOU M, et al. Carbapenemases in Klebsiella pneumoniae and other Enterobacteriaceae: an evolving crisis of global dimensions [J]. Clin Microbiol Rev, 2012, 25(4): 682-707.
[4]CORNAGLIA G, GIAMARELLOU H, ROSSOLINI GM. Metallo-β-lactamases: a last frontier for β-lactams [J]. Lancet Infect Dis, 2011, 11(5): 381-393.
[5]SHET V, GOULIOURIS T, BROWN NM, et al. IMP metalloβ-lactamase-producing clinical isolates of Enterobacter cloacae in the UK [J]. J Antimicrob Chemother, 2011, 66(6): 1408-1409.
[6]Clinical and Laboratory Standards Institute. Performance standards for antimicrobial susceptibility testing[S]. Twenty-first informational supplement, 2011, M100-S20.
[7]SHAHCHERAGHI F, NOBARI S, RAHMATI GHEZELGEH F, et al. First report of New Delhi metallo-beta-lactamase-1-producing Klebsiella pneumoniae in Iran [J]. Microbial Drug Resist, 2013, 19(1): 30-36.
[8]XIONG J, HYNES MF, YE H, et al. bla(IMP-9) and its association with large plasmids carried by Pseudomonas aeruginosa isolates from the People's Republic of China [J]. Antimicrob Agents Chemother, 2006, 50(1): 355-358.
[9]TSAKRIS A , POURNARAS S , WOODFORD N , et al. Outbreak of infections caused by Pseudomonas aeruginosa producing VIM-1 carbapenemase in Greece [J]. J Clin Microbiol,2000, 38(3):1290-1292.
[10]SIMONA B, POOJA T, USHA K, et al. Carbapenemaseproducing Klebsiella pneumoniae in Brooklyn, NY: molecular epidemiology and in vitro activity of polymyxin B and other agents [J]. J Antimicrob Chemother, 2005, 56(1):128-132.
[11]TONKIC M, MOHAR B, SISKO-KRALJEVIC K, et al. High prevalence and molecular characterization of extended-spectrum beta-lactamase-producing Proteus mirabilis strains in southern Croatia [J]. J Med Microbiol, 2010, 59(Pt 10): 1185-1190.
[12]BHATTACHARJEE A, SEN MR, PRAKASH P, et al. Role of beta-lactamase inhibitors in Enterobacterial isolates producing extended-spectrum beta-lactamases [J]. J Antimicrob Chemother,2008, 61(2): 309-314.
[13]PARK YJ, LEE S, KIM YR, et al. Occurrence of extendedspectrum( beta)-lactamases and plasmid-mediated AmpC (beta)-lactamases among Korean isolates of Proteus mirabilis[J]. J Antimicrobial Chemother, 2006, 57(1): 156-158.
[14]CELENZA G, PELLEGRINI C, CACCAMO M,et al. Spread of bla(CTX-M-type) and bla(PER-2) beta-lactamase genes in clinical isolates from Bolivian hospitals [J]. J Antimicrob Chemother, 2006, 57(5):975-978.
[15]NAVON-VENEZIA S, CHMELNITSKY I, LEAVITT A, et al. Dissemination of the CTX-M-25 family beta-lactamases among Klebsiella pneumoniae, Escherichia coli and Enterobacter cloacae and identification of the novel enzyme CTX-M-41 in Proteus mirabilis in Israel [J]. J Antimicrobial Chemother, 2008,62(2): 289-295.
[16]VERSALOVIC J, KOEUTH T, LUPSKI JR. Distribution of repetitive DNA sequences in eubacteria and application to fingerprinting of bacterial genomes [J]. Nucleic Acids Res,1991, 19(24): 6823-6831.
[17]王凯. 123 株阴沟肠杆菌的临床分布和耐药性分析[J]. 中华医院感染学杂志, 2013, 23(1): 187-189.
[18]李丰田, 杨继勇, 叶丽艳, 等. 2007-2012 年肠杆菌科细菌分布及耐药性分析[J]. 中华医院感染学杂志, 2014,24( 24):6004-6006.
[19]徐英春, 张小江, 陈民钧, 等. 肠杆菌属的耐药调查及抗感染用药探讨[J]. 中华医院感染学杂志, 2001, 11(3): 230-232.
[20]蒋琰. 肠杆菌科细菌质粒介导喹诺酮耐药机制研究[D]. 浙江大学, 2009.
[21]SUNAGAWA M, MATSUMURA H, INOUE T, et al. A novel carbapenem antibiotic, SM-7338 structure-activity relationship [J]. J Antibiot, 1990, 43(5): 519-532.
[22]BEHERA B, MATHUR P, DAS A, et al. Ertapenem susceptibility of extended spectrum beta-lactamase producing Enterobacteriaceae at a tertiary care centre in India[J]. Singapore Med J, 2009, 50(6): 628-632.
[23]CARVALHAES CG, PICÃO RC, NICOLETTI AG,et al. Cloverleaf test( modified Hodge test) for detecting carbapenemase production in Klebsiella pneumoniae: be aware of false positive results[J]. J Antimicrob Chemother, 2010, 65(2):249-251.
[24]FERNANDO P,TANIA M,MELINA R,et al. Controlling false-positive results obtained with the Hodge and Masuda assays for detection of class A curpene mase in species of Enterobacteriacease by incorpotatiry boronic acid [J]. J Clin Micobiol,2010,48(4):1323-1332.
[25]DOYLE D, PEIRANO G, LASCOLS C, et al. Laboratory detection of Enterobacteriaceae that produce carbapenemases [J]. J Clin Microbiol, 2012, 50(12): 3877-3380.
[26]庞峰, 李艳华, 贾秀芹, 等. 改良 Hodge 试验检测肠杆菌科IMP 型碳青霉烯酶的性能评价[J]. 中国实验诊断学, 2013,17(11): 1981-1984.
[27]宋景秋, 戴蕾,陶月. 耐亚胺培南的阴沟肠杆菌碳青霉烯酶基因检测及同源性分析[J]. 国际检验医学杂志, 2014, 35(1):75-76.
[28]胡雪, 林迪, 陈坚, 等. 碳青霉烯类药物非敏感肠杆菌科细菌基因型研究[J]. 临床检验杂志, 2013, 31(10): 736-739.
[29]宁长秀, 汪红, 钟桥石, 等. 耐碳青霉烯类抗菌药物肠杆菌科细菌耐药特性的分析[J]. 中国抗生素杂志, 2013,38(10):788-790.
Study on the resistance mechanisms of carbapenem-resistant Enterobacter cloacae
LIN Boxi, LI Bin, LIU Xiuqin, XU Xiaohong, CAO Yingping. (Department of Laboratory Medicine, Fujian Medical University Union Hospital, Fuzhou 350001, China)
Objective To investigate the antibiotic resistance mechanisms of carbapenem-resistant Enterobacter cloacae. Methods The modified Hodge test was used for detection of carbapenemase production. The minimum inhibitory concentrations (MICs) were determined using agar dilution method. Carbapenem-resistant genes (KPC, IMP, VIM, NDM) and other β-lactamase genes (SHV, TEM, CTX-M-1 group, CTX-M-2 group and CTX-M-9 group) were analyzed by PCR and sequencing. Enterobacterial repetitive intergenic consensus-polymerase chain reaction (ERIC-PCR) was used to evaluate the genetic similarity between the isolates. A conjugation experiment was performed using broth mating technique. Results A total of 29 isolates were included in this study. Antimicrobial susceptibility testing showed that more than 90% of the strains were resistant to ceftazidime, cefoxitin and aztreonam. The modified Hodge test was positive for 79.3% (23/29) of the isolates. PCR demonstrated a high prevalence (62.1%, 18/29) of carbapenemases in Enterobacter cloacae. IMP-4, IMP-8, and KPC-2 were identified in 11 (37.9%), 6 (20.7%), 1 (3.4%) isolates,respectively. Overall, 28 of the 29 isolates belonged to 23 different types. The remaining one strain was nontypeable. Conjugation experiment was successful for 48.3% (14/29) of the isolates. Conclusions IMPs are the dominant genotypes in the carbapenem-resistant Enterobacter cloacae in our hospital.
Enterobacter cloacae; carbapenemase; IMP metallo-beta-lactamase; mechanism of antibiotic resistance
R378.2
A
1009-7708(2016)02-0194-06
10.16718/j.1009-7708.2016.02.0012
2015-04-17
2015-11-11
国家自然科学基金(81201328、81171656);福建省高校杰青项目(JA13134);福建省卫计委中青年骨干人才培养项目(2015-ZQN-ZD-15)。
1. 福建医科大学附属协和医院检验科,福州 350001;2. 福建医科大学协和临床医学院。
林伯熹(1989—),男,硕士研究生,主要从事细菌耐药机制研究。
曹颖平,E-mail: caoyingping@aliyun.com。
