2014年上海市细菌耐药性监测
2016-09-26朱德妹胡付品蒋晓飞王传清王爱敏应春妹庞立峰袁轶群胡必杰黄声雷王金铎陈险峰0杏0刘庆中孙康德虞中敏瞿跃红周华敏傅启华黄卫春汪雅萍杨海慧卫颖珏倪语星孙景勇瑛0峰0徐伟红钱敏健朱学源吴唯一唐群力沈思娣汪瑞忠范惠清严育忠朱祖怀康向东0戴俊华0唐之俭彭敬红尧荣凤沈菊英陶建敏袁应华张雯雁叶杨芹侯伟伟娜0臧先林0
郭 燕, 杨 洋, 朱德妹, 胡付品, 汪 复, 蒋晓飞, 吉 强, 周 军, 王传清,王爱敏, 应春妹, 高 晶, 方 毅, 庞立峰, 袁轶群, 叶 琴, 胡必杰, 黄声雷,魏 丽, 王金铎, 王 靖, 李 虎, 陈险峰0, 殷 杏0, 汤 瑾, 刘庆中, 汤 荣,张 泓, 王 春, 孙康德, 虞中敏, 瞿跃红, 周华敏, 吴 琼, 傅启华, 黄卫春,李 敏, 汪雅萍, 杨海慧, 卫颖珏, 倪语星, 孙景勇, 刘 瑛0, 陈 峰0, 孙 晴,徐伟红, 秦 云, 钱敏健, 朱学源, 龚 炜, 王 蓉, 吴唯一, 唐群力, 冯 景,孙 杰, 沈思娣, 汪瑞忠, 房 华, 范惠清, 严育忠, 朱祖怀, 陈 超, 康向东0,戴俊华0, 唐之俭, 曲 浩, 彭敬红, 刘 军, 尧荣凤, 沈菊英, 胡 骏, 王 蕾,张 珏, 乔 昀, 陶建敏, 陶 钧, 袁应华, 刘 妍, 张雯雁, 叶杨芹, 侯伟伟,江 涟, 李 娜0, 臧先林0
·论著·
2014年上海市细菌耐药性监测
郭 燕1, 杨 洋1, 朱德妹1, 胡付品1, 汪 复1, 蒋晓飞1, 吉 强2, 周 军2, 王传清3,王爱敏3, 应春妹4, 高 晶4, 方 毅5, 庞立峰5, 袁轶群6, 叶 琴6, 胡必杰7, 黄声雷7,魏 丽8, 王金铎8, 王 靖9, 李 虎9, 陈险峰10, 殷 杏10, 汤 瑾11, 刘庆中12, 汤 荣12,张 泓13, 王 春13, 孙康德14, 虞中敏14, 瞿跃红15, 周华敏15, 吴 琼16, 傅启华16, 黄卫春16,李 敏17, 汪雅萍17, 杨海慧18, 卫颖珏18, 倪语星19, 孙景勇19, 刘 瑛20, 陈 峰20, 孙 晴21,徐伟红21, 秦 云22, 钱敏健22, 朱学源23, 龚 炜23, 王 蓉24, 吴唯一24, 唐群力25, 冯 景25,孙 杰26, 沈思娣26, 汪瑞忠27, 房 华27, 范惠清28, 严育忠28, 朱祖怀29, 陈 超29, 康向东30,戴俊华30, 唐之俭31, 曲 浩31, 彭敬红32, 刘 军32, 尧荣凤33, 沈菊英33, 胡 骏34, 王 蕾34,张 珏35, 乔 昀35, 陶建敏36, 陶 钧36, 袁应华37, 刘 妍37, 张雯雁38, 叶杨芹38, 侯伟伟39,江 涟39, 李 娜40, 臧先林40
目的 了解2014年上海市细菌耐药性监测情况。方法 采用纸片扩散法(K-B法)或自动化仪器法对上海市40所医院的临床分离菌进行药敏试验。包括28所三级医院和12所二级医院,其中含3所儿童医院。采用CLSI 2014年版标准判断结果。结果 总计102 113株临床分离菌,革兰阳性菌27 482株,占26.9%;革兰阴性菌74 631株,占73.1%。MRSA和MRCNS的检出率分别为47.4%和79.8%。MRSA、MRCNS在二级医院和三级医院的平均检出率分别为51.1%、79.9% 和46.6% 、79.8%。葡萄球菌属中未发现万古霉素和替考拉宁耐药株。845株儿童非脑膜炎分离株中青霉素敏感 (PSSP)、中介(PISP)和耐药(PRSP)株的检出率分别为70.1%、14.6%和15.4%;167株成人分离株的PSSP、PISP和PRSP分别为97.6%、1.2%和1.2%。发现67株屎肠球菌和14株粪肠球菌耐万古霉素。根据PCR测序,多数万古霉素耐药肠球菌为vanA和vanM基因型。大肠埃希菌、克雷伯菌属(肺炎克雷伯菌和产酸克雷伯菌)和奇异变形杆菌中ESBL的检出率分别为59.4%、35.9%和30.1%。上述ESBL菌株在二级医院和三级医院的检出率分别为61.6%、31.6% 、35.0%和58.9% 、36.9%、29.5%。肠杆菌科细菌对碳青霉烯类抗生素仍高度敏感,对亚胺培南和美罗培南的总耐药率均为7.0%。鲍曼不动杆菌、肺炎克雷伯菌、铜绿假单胞菌和大肠埃希菌中有少数对所有测试药物耐药的广泛耐药株。分离自尿液标本中的肠球菌属和大肠埃希菌对磷霉素的耐药率低。结论 细菌耐药性仍对临床构成严重威胁,临床需合理规范应用抗菌药物,避免耐药株的广泛传播。
细菌耐药性监测; 药敏试验; 广泛耐药
现报道2014年上海市细菌耐药性监测网(40所单位)按统一方案进行的细菌耐药性监测的结果。
1 材料与方法
1.1 材料
1.1.1 细菌 收集 2014年1月1日-12月31日,上海市40所医院临床分离的102 113株细菌,剔除同一患者相同部位的重复菌株;凝固酶阴性葡萄球菌和草绿色链球菌只收集分离自血液、脑脊液和无菌体液标本的菌株。按统一方案进行药物敏感性试验。
1.1.2 抗菌药物 抗菌药物纸片为英国OXOID公司或美国BBL公司商品;部分医院采用自动化仪器测定临床分离株对抗菌药物的敏感性。β内酰胺酶测定用的头孢硝噻吩纸片、ESBL确认试验用的头孢噻肟-克拉维酸和头孢他啶-克拉维酸纸片均为BBL公司商品。用于鉴定肺炎链球菌耐药性的青霉素E试验条为法国生物梅里埃公司商品。
1.1.3 培养基 药敏试验培养基为MH琼脂。肺炎链球菌及各组链球菌用含5%脱纤维羊血MH琼脂。流感嗜血杆菌和卡他莫拉菌用嗜血杆菌属培养基(HTM)加SR0158营养补充剂。上述培养基和试剂均为英国OXOID公司商品。
1.2 方法
1.2.1 药敏试验 采用CLSI 2014年版[1]推荐的纸片扩散法或自动化仪器法进行药物敏感性试验并判断结果。磷霉素纸片法仅用于测定分离自尿标本的大肠埃希菌和粪肠球菌。质控菌株为金黄色葡萄球菌(金葡菌)ATCC 25923、ATCC 29213,大肠埃希菌ATCC 25922,铜绿假单胞菌ATCC 27853,肺炎链球菌ATCC 49619,流感嗜血杆菌ATCC 49247、ATCC 49766。
1.2.2 β内酰胺酶的检测 采用头孢硝噻吩纸片测定流感嗜血杆菌和卡他莫拉菌的β内酰胺酶。按CLSI 2012年版[2]推荐的酶抑制剂增强试验筛选和确证大肠埃希菌、克雷伯菌属(肺炎克雷伯菌和产酸克雷伯菌)和奇异变形杆菌中产ESBL菌株。
1.2.3 青霉素不敏感肺炎链球菌的检测 经苯唑西林纸片法测定其抑菌圈直径≤19 mm的肺炎链球菌菌株,采用青霉素E试验条测定其对肺炎链球菌的MIC。脑膜炎株和非脑膜炎株分别按CLSI 2014年标准判定为青霉素敏感(PSSP)、中介(PISP)和耐药株(PRSP)。
1.2.4 万古霉素、替考拉宁或利奈唑胺不敏感革兰阳性菌的检测 纸片法或仪器法检测到对上述抗菌药物不敏感的革兰阳性菌经菌种复核无误后,采用相应E试验条测定其MIC值,必要时采用PCR方法检测和分析耐药基因型。
1.2.5 广泛耐药(XDR)菌株的检测 由于本次监测中不是所有医院均做了黏菌素和替加环素的药敏,故本文只统计XDR。XDR定义:除黏菌素和替加环素外,对其他测试的抗菌药物全耐药者[3]。
1.2.6 碳青霉烯类耐药肠杆菌科细菌(CRE)的检测 对任何一种碳青霉烯类耐药的肠杆菌科细菌为CRE[4]。本次肠杆菌科细菌受试的碳青霉烯类抗菌药物为亚胺培南、美罗培南和厄他培南。对这三者中任一种碳青霉烯类耐药者即为CRE。
1.2.7 监测资料的统计分析 用WHONET 5.6软件对纸片法的抑菌圈直径药敏结果和仪器法MIC值药敏结果进行数据处理和分析。
2 结果
2.1 细菌分布
从国内目前的支付现状来看,消费者无现金支付使用频率高,使用人数多,发展迅速,从全球消费市场来看,北欧一些国家的支付方式革命早已走在中国前列。2014年的丹麦,由于银行卡就可以完成国内大部分的交易,于是中央银行决定不再印刷纸币,用电子支付来代替纸币,率先进入无现金社会。无论是国内还是国际,无现金支付发展都是迅速的,但面对无现金支付,有红火有隐忧,有人乐观对待,有人持观望态度,也有人悲观认为觉得其不会实现长远发展,因此开展对无现金支付用户使用意愿的研究非常重要。本研究基于感知价值理论,建立消费者无现金支付的使用意愿模型,通过实证研究影响无现金支付使用者使用意愿的因素。
2014年共检测102 113株临床分离株。具体临床分离株见表1。其中81 841株(80.1%)分离自28所三级医院,20 272株(19.8%)分离自12 所二级医院。革兰阳性菌占26.9%( 27 482/ 102 113),革兰阴性菌占73.1%(74 631/102 113)。革兰阴性菌中肠杆菌科细菌占65.6%(48 924/ 74 631),不发酵糖革兰阴性杆菌占32.4%(24 156/74 631),其他革兰阴性菌(巴斯德菌属、弧菌属等)占2.1% (1 551/74 631)。革兰阳性菌中金葡菌占35.9% (9 873/ 27 482),凝固酶阴性葡萄球菌占15.7% (4 317/27 482),肠球菌属占36.0%(9 906/27 482),链球菌属占12.1%(3 319/27 482)。住院患者分离株占88.5%(90 398/102 113), 门、急诊患者分离株占11.5%(11 715/102 113)。住院患者和门急诊患者的分离株在三级医院、二级医院中分 别 占87.2%(71 411/81 841)、12.7 %(10 430/ 81 841)和93.7 %(18 987/20 272)、6.3 %(1 285/ 20 272)。
细菌在各类标本中的分布为呼吸道分泌物41.5 % (42 363/102 113)、尿液27.1%(27 675/102 113)、血液10.0%、伤口脓液6.2%、各种无菌体液(胆汁、胸腹水、脑脊液等)4.7%、生殖道分泌液和粪便2.0%、其他标本8.5%。呼吸道标本中最常见的分离菌为克雷伯菌属、不动杆菌属、铜绿假单胞菌和金葡菌等,大肠埃希菌和肠球菌属是尿液和脑脊液等无菌体液标本中的主要分离菌,凝固酶阴性葡萄球菌是血培养标本中的主要分离菌,粪便中沙门菌属占81.2%。
门急诊患者中主要分布的细菌为大肠埃希菌耐药菌的检出率
2.2.1 甲氧西林耐药葡萄球菌 9 873株金葡菌中MRSA的检出率为47.4%;3所儿童医院中的检出率为29.8%~35.5%,总体低于成人医院中的检出率(16.7%~91.5%);三级医院和二级医院金葡菌中 MRSA检出率分别为46.6%和51.1%。4 317株凝固酶阴性葡萄球菌中,MRCNS检出率为79.8%;儿童和成人菌株中MRCNS的检出率分别为78.6%~88.1%和46.2%~100%;三级医院和二级医院菌株中MRCNS的检出率分别为79.8%和79.9%。
2.2.2 青霉素耐药肺炎链球菌 1 140株肺炎链球菌中儿童组870株,成人组270株。其中1 134株为非脑膜炎肺炎链球菌,6株为脑膜炎分离株。6株中5株为儿童脑膜炎肺炎链球菌,其中3株PSSP和2株PRSP;1株为成人脑膜炎肺炎链球菌。1 134株非脑膜炎肺炎链球菌中1 012株经青霉素E试验检测,其中儿童组845株 ,成人组167株;儿童株中PSSP、PISP和PRSP分别为70.1%、14.6%和15.4%,成人株中分别为97.6%、1.2%和1.2%。
2.2.3 万古霉素耐药肠球菌(VRE) 9 906株肠球菌属细菌中粪肠球菌5 738株(57.9%)、屎肠球菌3 640株(36.7%),其他肠球菌属528株(5.3%)。3 640株屎肠球菌中有67株VRE(1.8%),其中6株分离自二级医院,其余分离自三级医院。5 738株粪肠球菌中14株为VRE(0.2%),均分离自三级医院。44株万古霉素耐药屎肠球菌经PCR检测为vanA 和vanM基因型的菌株分别为21株和23株。
2.2.4 产ESBL肠杆菌科细菌的检出率 40所医院中有34所医院(含2所儿童医院)对大肠埃希菌、克雷伯菌属(肺炎克雷伯菌+产酸克雷伯菌)和奇异变形杆菌进行了ESBL的检测。检出率分别为59.4% (32.0%~89.2%)、35.9% (11.1%~86.9%)和30.1 %(2.0%~70.6%)。二级医院中上述3种细菌ESBL分离株的检出率分别为61.6%、31.6% 和35.0%;三级医院的检出率分别为58.9%、36.9%和29.5%。
2.2.5 CRE菌株的检出率 48 924株肠杆菌科细41.7%(4 885/11 715)、肠球菌属9.1%、克雷伯菌属8.7%和金葡菌7.8%。住院患者中则为大肠埃希菌19.9%(17 989/90 398)、克雷伯菌属15.5%、不动杆菌属10.6%和铜绿假单胞菌10.4%。
2.2菌中共检出4 030株(8.2%)CRE菌株,其中三级医院检出率为8.5%(3 275/38 486),二级医院则为7.2%(755/10 438)。
2.2.6 革兰阴性杆菌中XDR菌株的检出率 对所测试抗菌药物(多黏菌素和替加环素除外)均耐药的XDR菌株在鲍曼不动杆菌、肺炎克雷伯菌、铜绿假单胞菌和大肠埃希菌中分别为478株(15.4%)、198株(5.4%)、81株(2.9%)和12株(0.4%)。其中二级医院分别为34株(8.4%)、22株(2.0%)、7株(1.1%)和1株(0.2%),三级医院中分别为444株(16.5%)、176株(6.7%)、74株(3.4%)和11株(0.4%)。
2.3 革兰阳性菌对各类抗菌药物的耐药率
2.3.1 葡萄球菌属 金葡菌中MRSA对各类受试抗菌药物的耐药率均明显较 MSSA为高,但其对利福平和甲氧苄啶-磺胺甲唑的耐药率较低(≤11.0%)。MSSA除对青霉素(87.9%)和红霉素(37.7%)的耐药率较高外,对庆大霉素、利福平以及左氧氟沙星和甲氧苄啶-磺胺甲唑的耐药率均<10%;MRCNS对上述抗菌药物的耐药率亦均较MSCNS明显为高。相比较而言,MRCNS对抗菌药物的耐药率较MRSA为低,但MRCNS对甲氧苄啶-磺胺甲唑的耐药率(49.2%)较MRSA (10.4%)为高。金葡菌和凝固酶阴性葡萄球菌中均未发现对万古霉素和替考拉宁耐药的菌株,见表2。二级医院的MRSA菌株对庆大霉素、左氧氟沙星和克林霉素的耐药率(62.3%、83.6%和76.0%)高于三级医院 (47.2%、67.7%和 61.6%)。三级医院MSCNS对红霉素的耐药率(55.0%)高于二级医院(40.4%)。

表2 金葡菌对抗菌药物的耐药率和敏感率Table 2 Susceptibility of Staphylococcus aureus to antimicrobial agents
2.3.2 肠球菌属 粪肠球菌对氨苄西林(11.5%)和呋喃妥因(4.2%)等大多受试抗菌药物的耐药率较屎肠球菌为低(35.6%对88.8%)。两者对高浓度庆大霉素的耐药率为40%左右,对左氧氟沙星的耐药率分别为38.9%和84.5%。分离自尿标本中的粪肠球菌和屎肠球菌对磷霉素的耐药率分别为8.6%和23.3%。两者均已出现对万古霉素耐药菌株,耐药率分别为0.2%和1.9%;同时也发现个别的菌株对利奈唑胺耐药,见表3。二级医院的粪肠球菌对所有受试抗菌药物包括呋喃妥因、氨苄西林、高浓度庆大霉素、左氧氟沙星以及磷霉素的耐药率几乎均高于三级医院。
2.3.3 肺炎链球菌 肺炎链球菌非脑膜炎株无论是儿童还是成人患者的分离株,无论是PSSP还是PISP和PRSP菌株对红霉素和克林霉素耐药率均很高,接近或超过80%。该类菌株对左氧氟沙星的耐药率,成人株为4.5%,较儿童株的耐药率为高(1.6%);但两者均未发现莫西沙星耐药株,也均未发现对万古霉素和利奈唑胺耐药株,见表4。

表3 肠球菌属对抗菌药物的耐药率和敏感率Table 3 Susceptibility of Enterococcus spp. to antimicrobial agents (%)
2.3.4 溶血链球菌 1 862株β溶血链球菌中主要是A组(422)和B组(1 294)β溶血链球菌,少数为C组(139)和G组(2)。各组β溶血链球菌对青霉素和头孢曲松均很敏感,未见耐药株;但对红霉素和克林霉素耐药率均很高,其中A组的耐药率≥83.4%为最高。除B组溶血链球菌对左氧氟沙星的耐药率为29.6%外,其他各组链球菌对左氧氟沙星的耐药率为 0~7.8%。自血液、脑脊液等无菌体液分离的草绿色链球菌对青霉素的耐药率高于β溶血链球菌,为6.6%。该属细菌中未发现万古霉素和利奈唑胺耐药株,见表5。

表4 非脑膜炎肺炎链球菌对抗菌药物的耐药率和敏感率Table 4 Susceptibility of nonmeningitis S. pneumoniae to antimicrobial agents (%)
2.4 革兰阴性杆菌对抗菌药物的耐药率
2.4.1 肠杆菌科细菌 48 924株肠杆菌科细菌中多数菌株对3种受试的碳青霉烯类仍呈现敏感,但不同菌种的耐药率有差异。其中大肠埃希菌对碳青霉烯类的耐药率为1.2%~2.0%,克雷伯菌属的耐药率为14.7%~17.8%。其他肠杆菌科细菌对3种碳青霉烯类的耐药率大多<10%;但其中变形杆菌属、摩根菌属和普罗威登菌属细菌对亚胺培南的耐药率(7.7%、27.2%和16.1%)显著高于美罗培南(1.7%、6.7%和7.5%)。见表6-1和表6-2。大肠埃希菌、克雷伯菌属(肺炎克雷伯菌和产酸克雷伯菌)以及奇异变形杆菌中产ESBL菌株对受试抗菌药物的耐药率均显著高于非产ESBL株。分离自尿标本中的大肠埃希菌,包括产和非产ESBL株对磷霉素的耐药率较低(≤11.1%),见表7。肠炎沙门菌和鼠伤寒沙门菌对氨苄西林的耐药率均在68.4%以上,两者对头孢曲松的耐药率<10%,见表8。肠杆菌科细菌对临床常用抗菌药物的耐药率见表9。

表5 溶血链球菌对抗菌药物的耐药率和敏感率Table 5 Susceptibility of hemolytic Streptococcus to antimicrobial agents (%)
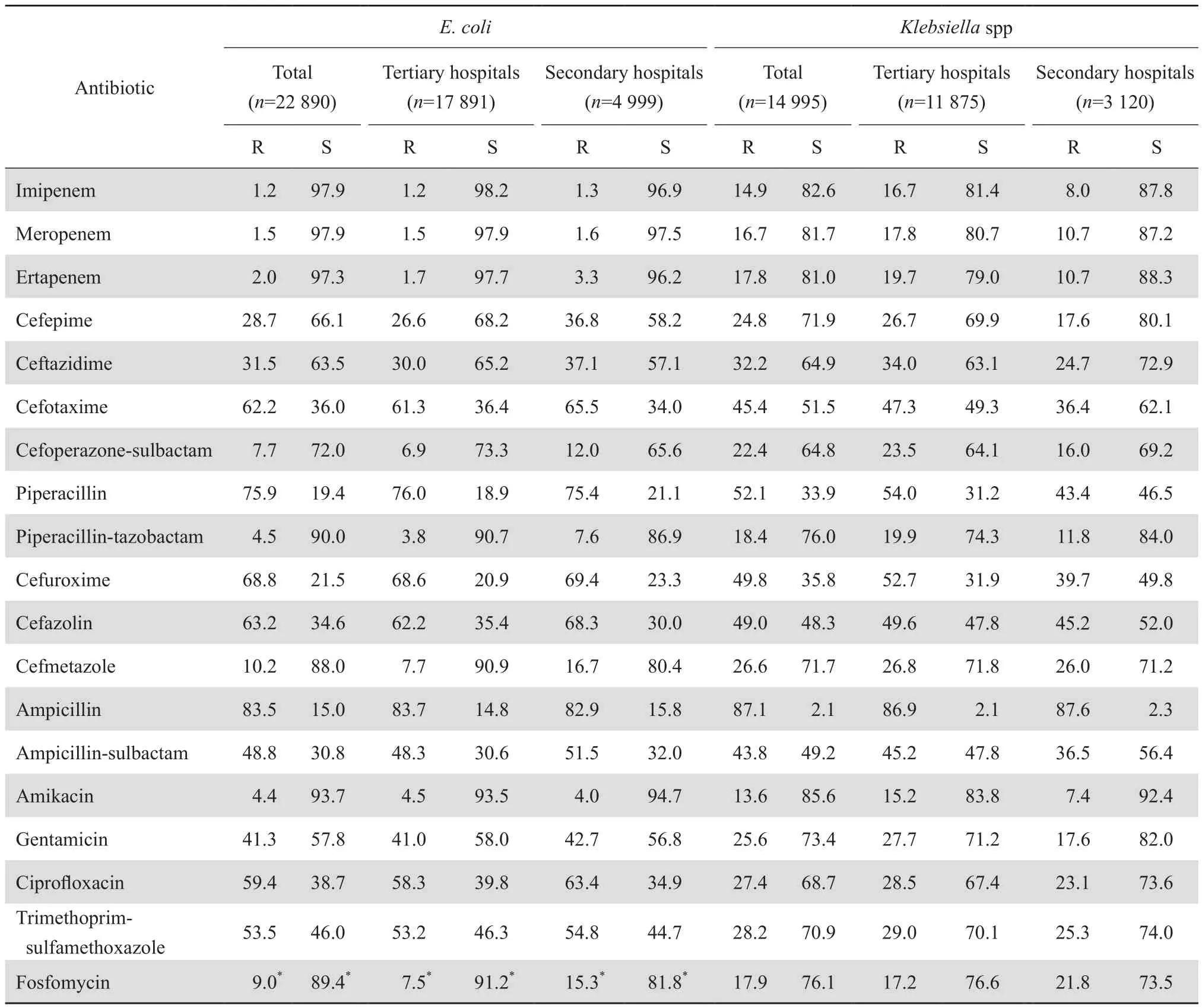
表6-1 肠杆菌科细菌对抗菌药物的耐药率和敏感率Table 6-1 Susceptibility of Enterobacteriaceae to antimicrobial agents (%)

表6-2 肠杆菌科细菌对抗菌药物的耐药率和敏感率Table 6-2 Susceptibility of Enterobacteriaceae to antimicrobial agents (%)
2.4.2 不发酵糖革兰阴性杆菌 10 048株铜绿假单胞菌对亚胺培南和美罗培南的耐药率分别为26.6%和25.4%,对其他测试药物的耐药率多数在10.4%~29.7%。9 930株不动杆菌属中主要是鲍曼不动杆菌(91.9%)。不动杆菌属对亚胺培南和美罗培南的耐药率分别高达53.2%和55.7%。该菌除对头孢哌酮-舒巴坦和米诺环素的耐药率为34.3% 和33.2%外,对其他测试抗菌药物的耐药率均近50%或以上,见表10-1。洋葱伯克霍尔德菌对CLSI推荐的4种抗菌药物的耐药率低于22.9%。嗜麦芽窄食单胞菌对CLSI推荐的3种抗菌药物高度敏感,耐药率<10%,见表10-2。
2.4.3 其他革兰阴性菌
2.4.3.1 流感嗜血杆菌 927株流感嗜血杆菌中成人分离株235株,儿童分离株692株;其中β内酰胺酶的检出率分别为28.8%和36.3%,总体检出率34.9%。儿童株和成人株中均未发现对头孢曲松、美罗培南、左氧氟沙星和阿奇霉素耐药株;成人株对氨苄西林、氨苄西林-舒巴坦、头孢呋辛和甲氧苄啶-磺胺甲唑的耐药率均高于儿童株,见表11。
2.4.3.2 卡他莫拉菌 168株卡他莫拉菌中主要为儿童分离株(151株),其β内酰胺酶的检出率为96.4%。对甲氧苄啶-磺胺甲唑的敏感率高达88.4%,但是对红霉素和阿奇霉素的耐药率在30%左右。

表7 产和非产ESBL大肠埃希菌、克雷伯菌属和奇异变形杆菌对抗菌药物的耐药率和敏感率Table 7 Susceptibility of ESBLs-producing and ESBLs- nonproducing E. coli, Klebsiella spp. and Proteus mirabilis strains to antimicrobial agents (%)

表8 沙门菌属对抗菌药物的耐药率和敏感率Table 8 Susceptibility of Salmonella spp. to antimicrobial agents (%)
3 讨论
参加2014年上海市细菌耐药性监测网的医院组成与2013年相仿。与2013年[5]的资料相比,2014年的资料有以下特点:①102 113株细菌中,革兰阴性菌占73.1%,较2013年的72.9%略有增加、革兰阳性菌26.9%较2013年的27.1%略有下降。肠杆菌科细菌中大肠埃希菌、克雷伯菌属和沙雷菌属有所增多,但沙门菌属和志贺菌属有所减少;不发酵糖革兰阴性杆菌有所下降;革兰阳性菌中葡萄球菌属、肠球菌属和肺炎链球菌有所减少。②门急诊患者分离菌(11.5%)较2013年(12.6%)有所减少,但住院患者分离菌(88.5%)较2013年(87.4%)有所增加。③呼吸道分泌物分离菌(41.5%)较2013年(42.2%)有所减少;尿液(27.1%)较2013年(25.9%)有所增加。④葡萄球菌中甲氧西林耐药株的检出率MRSA为47.4%,较2013年的50.8%有所减少,MRCNS 为79.8%,较2013年(77.6%)有所增加 ;万古霉素耐药屎肠球菌的检出率(1.9%)高于2013年(1.0%);儿童非脑膜炎分离株中PSSP的检出率(70.1%)较2013年(56.7%)有显著增高(P<0.01),PRSP的检出率(15.4%)较2013年(27.7%)有显著下降(P<0.01);大肠埃希菌、克雷伯菌属(肺炎克雷伯菌、产酸克雷伯菌)和奇异变形杆菌中ESBL的检出率均较2013年有所下降;鲍曼不动杆菌、肺炎克雷伯菌、铜绿假单胞菌和大肠埃希菌中仍有少量XDR菌株的检出,其中XDR鲍曼不动杆菌的检出率(15.4%)较2013年(5.1%)有显著升高(P<0.01)。

表9 肠杆菌科细菌对抗菌药物的耐药率和敏感率Table 9 Susceptibility of Enterobacteriaceae to antimicrobial agents (%)

表10-1 不发酵糖革兰阴性杆菌对抗菌药物的耐药率和敏感率Table 10-1 Susceptibility of non-fermentative gram-negative bacilli to antimicrobial agents (%)

表10-2 不发酵糖革兰阴性杆菌对抗菌药物的耐药率和敏感率Table 10-2 Susceptibility of non-fermentative gram-negative bacilli to antimicrobial agents (%)
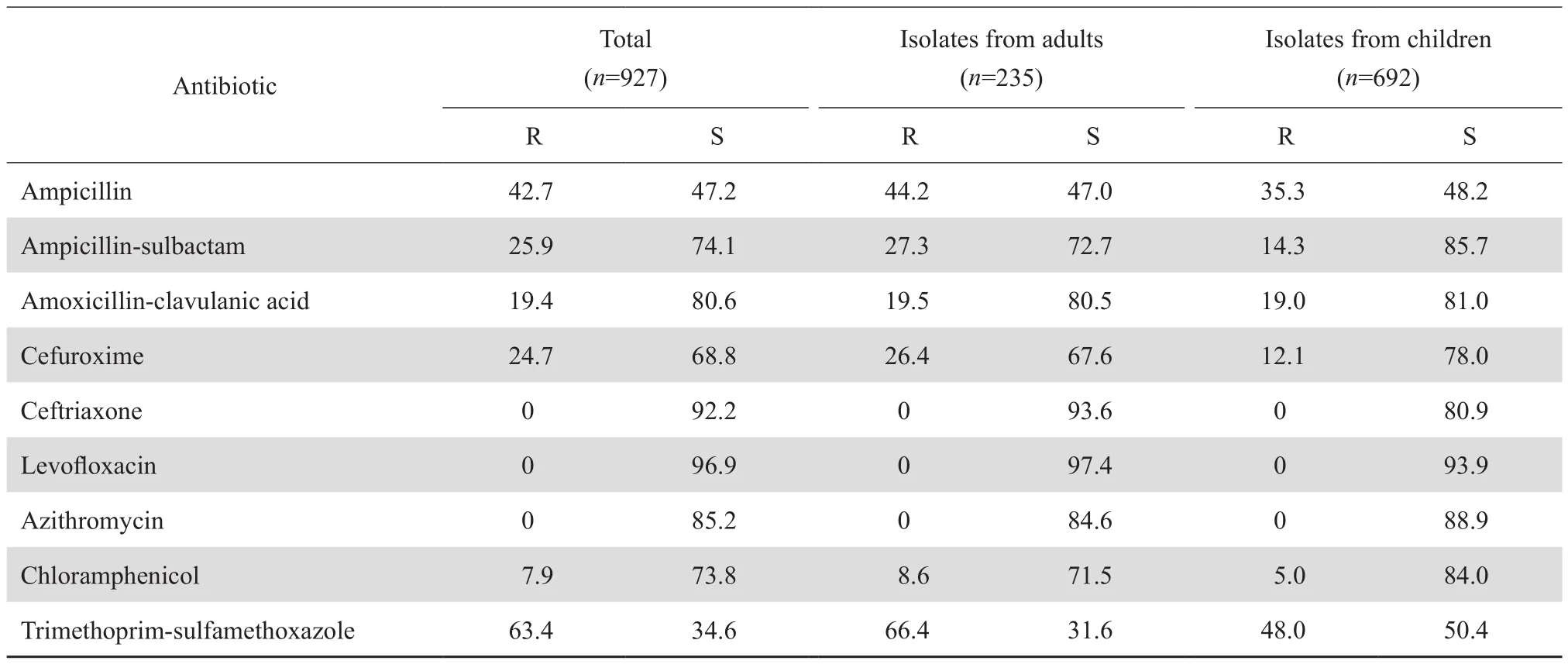
表11 流感嗜血杆菌对抗菌药物的耐药率和敏感率Table 11 Susceptibility of Haemophilus influenzae to antimicrobial agents (%)
二级医院和三级医院在菌种的分布、标本的分布、耐药菌株的检测以及细菌对受试抗菌药物的耐药率与以往资料相比仍存在明显的差异。在菌种分布上:①三级医院分离的革兰阳性菌比例(28.1%)高于二级医院(22.1%),革兰阴性菌比例(71.9%)少于二级医院(77.9%);二级医院住院患者分离菌(93.7%)高于三级医院(87.3% ),门急诊患者分离菌 (6.3% )低于三级医院(12.7%)。②二级医院中,常见的临床分离革兰阴性菌如大肠埃希菌、克雷伯菌属、铜绿假单胞菌、不动杆菌属、肠杆菌属、变形杆菌属和气单胞菌属等细菌较三级医院多见;而嗜血杆菌属、卡他莫拉菌、各种β溶血链球菌和肺炎链球菌等苛养菌在二级医院中少见。在标本分布上,二级医院分离自呼吸道分泌物和尿液标本的菌株数分别约占42.7% 和30.5%,高于三级医院(41.2%和26.2%)。耐药细菌的检出率显示:①二级医院的MRSA检出率(51.1%)高于三级医院(46.6%)。②二级医院中VRE显著较三级医院少见。③二级医院的大肠埃希菌和奇异变形杆菌中ESBL检出率(61.6%和35.0%)高于三级医院(58.9%和29.5%),但克雷伯菌属ESBL检出率三级医院(36.9%)高于二级医院(31.6%)。④CRE菌株三级医院检出率(8.5%)高于二级医院(7.2%)。⑤XDR革兰阴性杆菌二级医院较为少见。二级医院中大多细菌对受试抗菌药物的耐药率高于三级医院,如MRSA株对庆大霉素、利福平、左氧氟沙星、克林霉素以及甲氧苄啶-磺胺甲唑的耐药率;MRCNS株对庆大霉素和左氧氟沙星的耐药率;肠球菌属细菌对呋喃妥因、氨苄西林、左氧氟沙星和磷霉素的耐药率;肠杆菌科细菌对头孢哌酮-舒巴坦、头孢吡肟、头孢他啶以及环丙沙星的耐药率;铜绿假单胞菌对氨曲南、头孢哌酮、哌拉西林和环丙沙星的耐药率。三级医院分离的不动杆菌属细菌对抗菌药物的耐药率除对米诺环素(31.7%对43.6%)外,大多较二级医院高。
2010年美国感染性疾病协会(IDSA)[6]指南中将磷霉素列为治疗女性非复杂性尿路感染的推荐用药,CLSI 2015年版[7]亦将磷霉素增加为U组的补充药物,从本组资料结果显示分离自尿液标本的粪肠球菌和大肠埃希菌对磷霉素的敏感率分别为85.3%和89.4%,可见磷霉素对这两种细菌具有很好的抗菌活性。磷霉素是一种磷酸衍生物[8],主要是通过抑制目标细菌合成磷酸烯醇式丙酮酸转移酶,阻止肽聚糖合成导致目标菌死亡而发挥抗菌活性[9]。本组资料13 264株尿液分离大肠埃希菌对磷霉素的敏感率近90%。其中,5 427株为产ESBL菌株,260株为CRE菌株。目前,CLSI[7]中除尿液分离大肠埃希菌和粪肠球菌外,对所有肠杆菌科细菌和其他革兰阳性球菌均没有磷霉素的折点。如采用对尿液分离大肠埃希菌和粪肠球菌的磷霉素折点,结果显示本组资料中枸橼酸杆菌对该药的敏感率为90.4%,肠杆菌属、克雷伯菌属和沙雷菌属对该药的敏感率分别为82.6%、76.1%和70.3%。革兰阳性菌中MRSA 和VRE对该药的敏感率分别为56.2%和62.2%。提示磷霉素不但对目前临床上较棘手的多重耐药株(MDR)和XDR细菌具有很好的抗菌活性,而且对VRE、MRSA等亦有很好的抗菌活性,此与国外报道的研究资料相一致[10-11]。在全球细菌耐药日益严重的严峻形势下,具有优异疗效的老药新用也是当下临床感染治疗的一大策略。
在肠杆菌科细菌中出现2个较为引人注目的现象。其一,引起大肠埃希菌和克雷伯菌属对第三、第四代头孢菌素耐药的ESBL菌株的检出率有逐年下降的趋势;其二,肠杆菌科细菌对碳青霉烯类的耐药率在逐年上升,包括不产酶的菌株;其中以克雷伯菌属的耐药率增加尤为显著。文献报道[12],导致CRE菌株对碳青霉烯类耐药的主要机制为细菌产KPC类碳青霉烯酶。此类耐药机制可导致细菌几乎对所有β内酰胺类包括第三、第四代头孢菌素和酶抑制剂复方制剂耐药。因此,导致采用酶抑制剂增强试验对大肠埃希菌、克雷伯菌属和奇异变形杆菌中产ESBL菌株检测结果呈现为假阴性菌株。本组资料显示6 409株不产ESBL大肠埃希菌、6 302株不产ESBL克雷伯菌属和482株不产ESBL奇异变形杆菌中对碳青霉烯类(亚胺培南、美罗培南和厄他培南)的耐药率分别为1.4%、1.7% 和2.5%;12.4%、13.5%和14.0%;2.2%、 0.6%和1.1%。这就很好地解释了近年来这些肠杆菌科细菌中ESBL检出率较2010年前后有所降低的原因。
[1]Clinical and Laboratory Standards Institute. Performance Standards for Antimicrobial Susceptibility Testing: twenty-Fourth Informational Supplement[S]. 2014, M100-S24.
[2]Clinical and Laboratory Standards Institute. Performance Standards for Antimicrobial Susceptibility Testing. twenty-Second Informational Supplement[S]. 2012, M100-S22.
[3]FALAGAS ME, KARAGEORGOPOULOS DE. Pandrug resistance( PDR), extensive drug resistance( XDR), and multidrug resistance( MDR) among Gram-negative bacilli:need for international harmonization in terminology[J]. Clin Infect Dis, 2008,46(7): 1121-1122.
[4]CDC. FAQs abntt choosing and implementing a CRE Definition[EB/OL].[2015-9-10]. http://www.cdc.gov/hai/ organisms/cre/definition.html.
[5]胡付品,朱德妹,汪复,等. 2013年上海地区细菌耐药性监测[J].中国感染与化疗杂志,2014,14(6):461-473.
[6]GUPTA K, HOOTON TM, NABER KG, et al. International clinical practice guidelines for the treatment of acute uncomplicated cystitis and pyelonephritis in women: A 2010 update by the infectious Diseases Society of America and the European Society for Microbiology and Infectious Diseases[J]. Clin Infect Dis,2011, 52( 5): e103-e120.
[7]Clinical and Laboratory Standards Institute. Performance Standards for Antimicrobial Susceptibility Testing: twenty-Fifth Informational Supplement[S]. 2015, M100-S25.
[8]HENDLIN D, STAPLEY EO, JACKSON M, et al. Phosphonomycin,a new antibiotic produced by strains of streptomyces[J]. Science,1969,166(3901):122-123.
[9]RAZ R. Fosfomycin: an old--new antibiotic[J]. Clin Microbiol Infect,2012,18(1):4-7.
[10]FALAGAS ME, MARAKI S, KARAGEORGOPOULOS DE,et al. Antimicrobial susceptibility of multidrug-resistant( MDR)and extensively drug-resistant( XDR) Enterobacteriaceae isolates to fosfomycin[J]. Int J Antimicrob Agents,2010,35(3):240-243.
[11]FALAGAS ME, MARAKI S, KARAGEORGOPOULOS DE,et al. Antimicrobial susceptibility of Gram-positive non-urinary isolates to fosfomycin[J]. Int J Antimicrob Agents, 2010,35(5):497-499.
[12]HU FP, CHEN SD, XU XG, et al. Emergence of carbapenemresistant clinical Enterobacteriaceae isolates from a teaching hospital in Shanghai, China[J]. J Med Microbiol,2012,61(1):132-136.
Surveillance of antibiotic resistance in the bacterial strains isolated from hospitals in Shanghai during 2014
GUO Yan, YANG Yang, ZHU Demei, HU Fupin, WANG Fu, JIANG Xiaofei, JI Qiang, ZHOU Jun, WANG Chuanqing, WANG Aimin, YING Chunmei, GAO Jing, FANG Yi, PANG Lifeng, YUAN Yiqun, YE Qin, HU Bijie, HUANG Shenglei, WEI Li, WANG Jinduo, WANG Jing, LI Hu, CHEN Xianfeng, YIN Xing, TANG Jin,LIU Qingzhong, TANG Rong, ZHANG Hong, WANG Chun, SUN Kangde, YU Zhongmin, QU Yuehong, ZHOU Huamin, WU Qiong, FU Qihua, HUANG Weichun, LI Min, WANG Yaping, YANG Haihui, WEI Yingjue, NI Yuxing,SUN Jingyong, LIU Ying, CHEN Feng, SUN Qing, XU Weihong, QIN Yun, QIAN Minjian, ZHU Xueyuan, GONG Wei, WANG Rong, WU Weiyi, TANG Qunli, FENG Jing, SUN Jie, SHEN Sidi, WANG Ruizhong, FANG Hua, FAN Huiqing, YAN Yuzhong, ZHU Zuhuai, CHEN Chao, KANG Xiangdong, DAI Junhua, TANG Zhijian, QU Hao,PENG Jinghong, LIU Jun, YAO Rongfeng, SHEN Juying, HU Jun, WANG Lei, ZHANG Jue, QIAO Yun, TAO Jianmin, TAO Jun, YUAN Yinghua, LIU Yan, ZHANG Wenyan, YE Yangqin, HOU Weiwei, JIANG Lian, LI Na,ZANG Xianlin. (Institute of Antibiotics, Huashan Hospital, Fudan University, Shanghai 200040, China)
Objective To investigate the resistance of clinical bacterial isolates to antibiotics in Shanghai hospitals during 2014. Methods Antimicobial susceptibility testing was carried out for the clinical isolates collected from 40 hospitals ( including 28 tertiary hospitals and 12 secondary hospitals) according to a unified protocol using Kirby-Bauer ( K-B ) method or automated systems. Results were analyzed according to CLSI 2014 breakpoints. Results Of the 102 113 clinical isolates, gram positive cocci and gram negative bacilli accounted for 26.9% and 73.1%, respectively. The overall prevalence of MRSA in Staphylococcus aureus was 47.4% and 79.8% for MRCNS in coagulase-negative Staphylococcus. The average prevalence of MRSA and MRCNS was 51.1% and 79.9% in secondary hospitals, 46.6% and 79.8% in tertiary hospitals. No strains were found resistant to vancomycin or teicoplanin. About 70.1% of the 845 strains of non-meningitis S. pneumoniae isolated from children were penicillin-susceptible (PSSP), 30.0% were penicillin-nonsusceptible, including penicillin-intermediate (PISP, 14.6%) and penicillin-resistant (PRSP,15.4%) strains. Of the 167 strains isolated from adults, 97.6%, 1.2% and 1.2% were PSSP, PISP and PRSP, respectively. Overall, 67 strains of vacomycin-resistant E. feacium and 14 strains of vacomycin-resistant E. feacalis were identified. According to PCR results,most of these resistant strains were vanA and vanM type based on their phenotype. The overall prevalence of ESBLs-producing strains was 59.4% in E. coli, 35.9% in Klebsiella spp. (K. pneumoniae and K. oxytoca) and 30.1% in P. mirabilis. Specifically, the prevalence of such strains was 61.6%, 31.6% and 35.0% in secondary hospitals, 58.9%, 36.9% and 29.5% in tertiary hospitals, respectively. Enterobacteriaceae strains were still highly susceptible to carbapenem antibiotics. Overall, both 7.0% of the Enterobacteriaceae strains were resistant to imipenem and meropenem, respectively. A few extensively drug- resistant strains were identified in A. baumannii,K. pneumoniae, P. aeruginosa, and E. coli. The strains of Enterococcus spp. and E. coli isolated from urine showed relatively lower resistance to fosfomycin. Conclusions It seems that antibicotic resistance is increasing in the clinical isolates, which poses a serious threat to the clinical practice. Rational use of antibiotics should be required to prevent the spread of drug resistant strains.
bacterial resistance; antimicrobial susceptibility testing; extensively drug-resistant microorganism
R378
A
1009-7708(2016)02-0105-12
10.16718/j.1009-7708.2016.02.001
2015-09-25
2015-11-09
(除组长单位外,其他医院按拼音字母顺序排列)
1. 复旦大学附属华山医院;
2. 东方肝胆外科医院;
3. 复旦大学附属儿科医院 ;
4. 复旦大学附属妇产科医院;
5. 复旦大学附属华东医院;
6. 复旦大学附属金山医院;
7. 复旦大学附属中山医院;
8. 复旦大学附属上海市第五人民医院;
9. 长海医院;
10. 上海长征医院 ;
11. 上海交通大学附属第六人民医院;
12. 上海交通大学附属第一人民医院;
13. 上海交通大学附属儿童医院;
14. 上海交通大学医学院附属第九人民医院;
15. 上海交通大学医学院附属第三人民医院;
16. 上海交通大学医学院附属儿童医学中心;
17. 上海交通大学医学院附属仁济医院(浦东);
18. 上海交通大学医学院附属仁济医院(浦西);
19. 上海交通大学医学院附属瑞金医院;
20. 上海交通大学医学院附属新华医院;
21. 上海市长宁区中心医院;
22. 上海市崇明县中心医院;
23. 上海市第八人民医院;
24. 上海市第二人民医院;
25. 上海市奉贤区中心医院;
26. 上海市嘉定区中心医院;
27. 上海市浦东新区人民医院;
28. 上海市浦东医院;
29. 上海市普陀区人民医院;
30. 上海市普陀区中心医院;
31. 上海市青浦区中心医院;
32. 上海市松江区中心医院;
33. 上海市杨浦区中心医院;
34. 上海中医药大学附属龙华医院;
35. 上海中医药大学附属曙光医院;
36. 上海中医药大学附属岳阳中西医结合医院;
37. 同济大学附属第十人民医院;
38. 同济大学附属东方医院;
39. 同济大学附属同济医院;
40. 中国人民解放军第四五五医院。
郭燕(1982—)女,硕士,主管技师,主要从事新抗菌药物药效学评价和细菌耐药性监测。
朱德妹,E-mail :zhu_dm@fudan.edu.cn。
