栽培甘松药材质量标准研究△
2016-09-25张宇霞马世震冯海生李彩霞郑植元刘永玲
张宇霞,马世震,冯海生,李彩霞,郑植元,刘永玲
(1.中国科学院 西北高原生物研究所/藏药研究重点实验室,青海 西宁 810001;2.中国科学院大学,北京 100049)
栽培甘松药材质量标准研究△
张宇霞1,2,马世震1*,冯海生1,李彩霞1,郑植元1,2,刘永玲1
(1.中国科学院 西北高原生物研究所/藏药研究重点实验室,青海 西宁 810001;2.中国科学院大学,北京 100049)
目的:制定栽培甘松药材的质量标准。方法:按中国药典规定的方法对栽培甘松进行粉末显微观察及薄层(TLC)鉴别,对其挥发油、水分、浸出物、总灰分、酸不溶性灰分、重金属、有害元素、有机氯类农药残留进行测定;采用高效液相色谱法(HPLC)测定甘松新酮的含量。结果:栽培甘松的显微鉴别及TLC结果与中国药典甘松一致;确定了水分、浸出物、总灰分、酸不溶性灰分、重金属、有害元素、有机氯类农药残留、挥发油、甘松新酮的限度。结论:所测指标可以为完善甘松的质量标准提供依据。
甘松;高效液相色谱法;甘松新酮;挥发油;质量标准
甘松为败酱科植物甘松NardostachyschinensisBatal.或匙叶甘松N.jatamansiDC.的干燥根及根茎,药用历史悠久,具有理气止痛,开郁醒脾的功能,可治胃痛、胸腹胀满、头痛、癔病、脚气等病症[1]。现代研究表明,甘松具有抗抑郁、抗心律失常、促进PC12D细胞中神经因子诱导的神经突生长[2-4]等药理作用。
甘松被《中华人民共和国药典》自第二版起开始收载至今,且藏药标准也有其收载。成都中医药大学及北京中医药大学对甘松的质量标准进行了研究[5-6],《中华人民共和国药典》2010版甘松规定项目仅包括显微鉴别、性状、TLC、水分及挥发油含量限定[7],本研究拟在前人研究工作的基础上,以野生甘松和市售甘松为对照药材,对甘松质量标准进行研究,从而增加甘松标准规定项目,制定人工规范化栽培的甘松药材质量标准,增加其质量可控性。同时本方法尚可为其他药材质量标准的研究方法提供借鉴,对规范性评价药材质量有重大的意义。
1 仪器与材料
1.1 仪器与试剂
美国Waters 515型高效液相色谱仪,包括溶剂管理系统,二极管阵列检测器,Emprower色谱工作站(美国Waters公司);MARS 6微波消解仪(美国CEM公司);AA240Z石墨炉原子吸收光谱仪(美国Aligent公司);725型ICP-AES(美国Aligent公司);AFS-8230原子荧光光度计(北京吉天仪器有限公司);挥发油提取器(上海玻璃仪器厂);7890B GC气相色谱仪(美国Agilent公司);ESJ182-4型电子天平(沈阳龙腾电子有限公司)。
HPLC色谱柱:Dikma Diamonsil C18(250 mm×4.6 mm,5 μm),Phenomenex Synergi 4μHydro-R P80A(250 mm×4.6 mm,4 μm),HPLC-PCartridge LIChrosp-1her 100 RP-180(5 μm)试剂:甲醇(色谱纯,山东禹王实业有限公司化工分公司),超纯水为实验室自制,其它试剂均为分析纯(天津市百世化工有限公司)。
对照品:甘松新酮(成都曼斯特生物科技有限公司,批次MUST-13090901)。
1.2 材料
第1~10批为栽培甘松,地点为青海省大通宝库药材种植基地,海拔为2890 m,引种种源为青海省玉树藏族自治州巴塘乡野生种源,栽培种源为第二代自繁种源,采集时间依次为2013-07-01、2013-07-31、2013-08-28、2013-09-18、2013-10-30、2014-05-17、2014-06-15、2014-07-16、2014-08-15、2014-09-13;第11批为野生甘松,2013年9月采于青海省玉树藏族自治州巴塘乡,海拔为3800m;第12批为市售甘松,2013年9月购自西宁市八一路药材市场。以上样品均经中国科学院西北高原生物研究所卢学峰教授鉴定为甘松(NardostachyschinensisBatal.)的根茎。采回的甘松经除去泥沙等杂质后,室温下阴干,经植物粉碎机粉碎,过标准药筛,待用。
2 方法与结果
2.1 显微鉴别
显微观察结果与《中华人民共和国药典》描述基本一致(图1)。

注:A.石细胞(10×40);B.导管1(10×40);C.导管2(10×40);D.木栓细胞(10×40);E.基生叶残基碎片1(10×40);F.基生叶残基碎片2(10×40)图1 栽培甘松显微结构图
显微结构观察结果表明:甘松石细胞类圆形或不规则多角形,偶见长方形,单个或成群,直径33~64 μm,长可至200 μm或更长,壁甚厚,无色,胞腔狭小。梯纹导管或网纹导管,直径7~40 μm,小型梯纹导管成束,其旁有时可见细长的木纤维。木栓细胞多为不规则多角形,略暗棕色,较薄,内含黄色至棕黄色挥发油。基生叶残基碎片较多,细胞呈长方形或长多角形,深黄色至棕色,直径20~31 μm,长50~90 μm,壁呈念珠状增厚。另一种碎片细胞呈长条形,长可达200 μm,壁有时呈念珠状增厚。
2.2 薄层鉴别
参考《中华人民共和国药典》2010版方法,以野生甘松药材作为对照药材,对栽培甘松进行薄层鉴别(图2及图3)。从图2及图3中可看出,在与野生药材及对照品一致的位置上,10批栽培药材均出现相同颜色的斑点。

注:1~5及8~12为10批栽培甘松;6为野生甘松;7为甘松新酮对照品(下同)。图2 甘松254nm紫外灯下TLC图

图3 甘松0.5%香草醛硫酸溶液显色TLC图
2.3 检查
水分按照《中华人民共和国药典》甲苯法测定;浸出物按照《中华人民共和国药典》稀乙醇、热浸法测定[8];总灰分、酸不溶性灰分、重金属及有害元素、有机氯类农药残留均按照《中华人民共和国药典》测定。结果见表1~3、图4。
由表1及表2数据得出,建议甘松中水分不得超过5.0%;浸出物不得少于27.0%;总灰分不得超过13.0%;酸不溶性灰分不得超过7.0%;铅不得过百万分之五,镉不得过千万分之三,砷不得过百万分之二,汞不得过千万分之二,铜不得过百万分之二十;由图4知,9种有机氯类农药残留均未检出,所以计算其检出限,结果见表3。

表1 甘松水分、浸出物、总灰分、酸不溶性灰分测定 (%)

表2 甘松重金属及有害元素测定 /mg·kg-1
2.4 含量测定
2.4.1 挥发油测定 称取甘松样品粉末约10g,按照《中华人民共和国药典》2010版第一部附录Ⅹ D甲法测定挥发油含量,结果见表4。《中华人民共和国药典》规定甘松挥发油不得少于2.0%(mL·g-1),本实验结果均符合该规定,且栽培甘松与野生、市售甘松含量差异不大。但除第6批样品外,挥发油含量均大于3.0%(mL·g-1),所以建议甘松药材质量标准中挥发油含量不得少于3.0%(mL·g-1)。
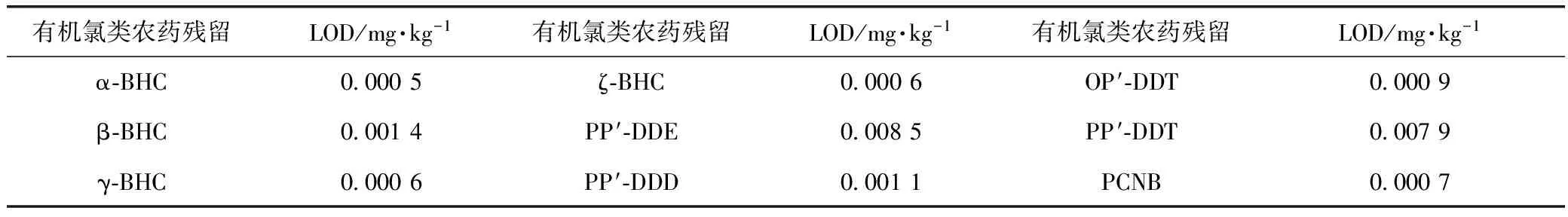
表3 有机氯类农药残留检出限
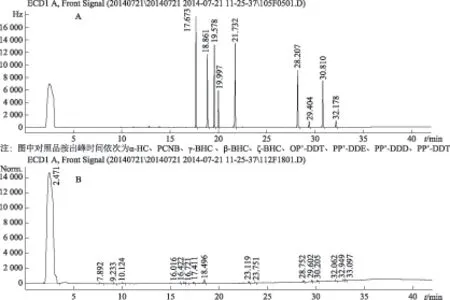
注:A.混合对照品;B.栽培甘松样品图4 有机氯类农药残留GC图
2.4.2 甘松新酮测定 色谱条件:采用HPLC法,色谱柱为Dikma Diamonsil C18(250 mm×4.6 mm,5 μm),流动相为甲醇-水(65∶35),柱温为30 ℃,流速为1.0 mL·min-1,检测波长为254 nm。对照品和供试品色谱图见图5。

注:A.甘松新酮对照品;B.栽培甘松供试品图5 对照品和供试品色谱图
对照品溶液制备:取甘松新酮对照品适量,精密称定,加甲醇制成每1mL含1.45 mg的溶液,即得。置于冰箱中4 ℃保存备用。
供试品溶液制备:取本品粉末(过四号筛)约0.25 g,精密称定,置具塞锥形瓶中,精密加入甲醇25 mL,密塞,称定重量,超声处理30 min(100W,40kHz),放冷,再称定重量,用甲醇补足减失的重量,摇匀,滤过,取续滤液,用微孔滤膜(0.45 μm)过滤,得供试品溶液。
所建立的方法已进行方法学考察,包括线性关系、精密度、重现性、稳定性、加样回收率,均符合方法学验证要求[9]。样品测定结果见表4。表中数据显示,除第3、4批药材的甘松新酮低于10.0 mg·g-1,其他批次均高于10.0 mg·g-1,所以建议甘松药材质量标准中甘松新酮含量不得少于10.0 mg·g-1。
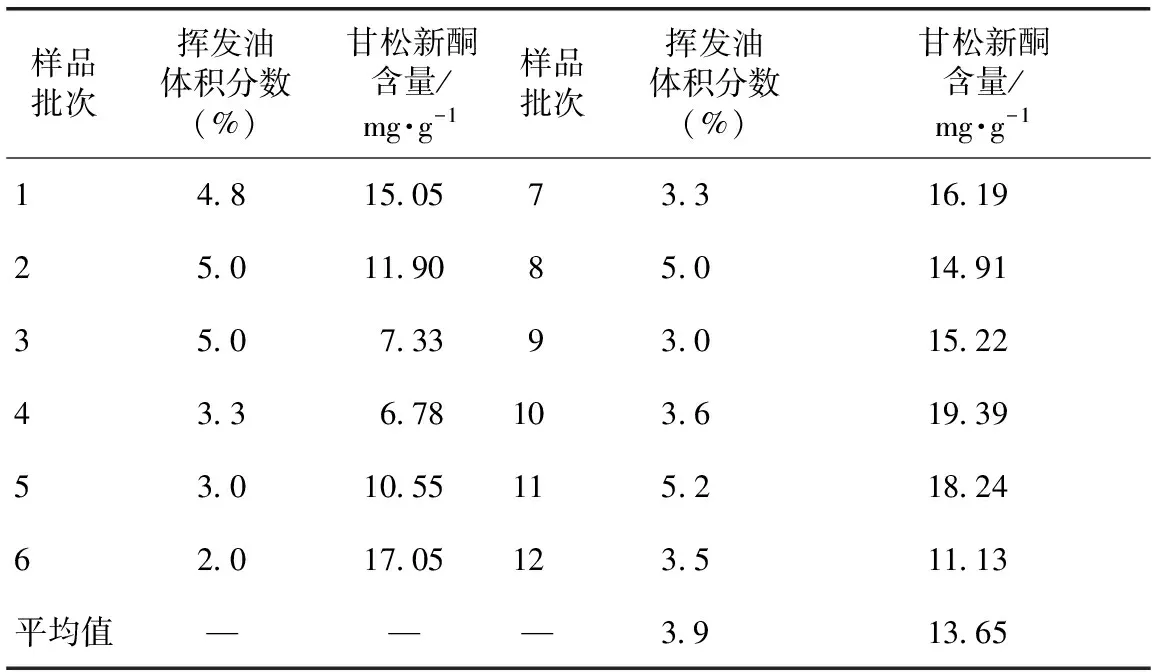
表4 甘松挥发油及甘松新酮含量测定结果(n=3)
3 小结和讨论
本文通过以野生及市售药材作对照,对10批栽培甘松药材质量进行分析,初步制定了甘松浸出物、总灰分、酸不溶性灰分、重金属及有害元素、有机氯类农药残留及甘松新酮的含量限度,同时提高了对甘松药材挥发油及水分的含量限度要求,可以为中国药典甘松质量标准的提高提供借鉴。建议甘松药材质量标准中规定:水分不得超过5.0%;浸出物不得少于27.0%;总灰分不得超过13.0%;酸不溶性灰分不得超过7.0%;铅不得过百万分之五,镉不得过千万分之三,砷不得过百万分之二,汞不得过千万分之二,铜不得过百万分之二十;有机氯类农药残留由于未检出所以暂不作规定;挥发油含量不得少于3.0% mL·g-1;甘松新酮含量不得少于10.0 mg·g-1。
[1] 江苏新医学院.中药大辞典:上册 [M].上海:上海科学技术出版社,1985.
[2] 武姣姣,石晋丽,唐民科,等.甘松对动物行为绝望模型的影响[J].中国实验方剂学杂志,2012,18(7):205-207.
[3] 李翔宇,罗骏,葛郁芝,等.甘松挥发油对大鼠心室肌细胞 Ik 和 Ik1 的影响[J].时珍国医国药,2013,24(8):1814-1817.
[4] Li P,Yamakuni T,Matsunaga K,et al.Nardosinone enhances nerve growth factor-induced neurite outgrowth in a mitogen-activated protein kinase-and protein kinase C-dependent manner in PC12D cells.J Pharmacol Sci,2003,93(1):122-125.
[5] 李莹.甘松药效物质基础及质量标准的初步研究[D].成都:成都中医药大学,2009.
[6] 耿晓萍.甘松化学成分及质量标准研究[D].北京中医药大学,2010.
[7] 中华人民共和国国家药典委员会.中华人民共和国药典:一部.[S].北京:中国医药科技出版社,2010:78-79.
[8] 张宇霞,马世震,冯海生.不同产地甘松挥发油及浸出物的含量测定[J].时珍国医国药,2015,26(2):318-319.
[9] 张宇霞,马世震,董琦,等.不同生长期甘松中甘松新酮的HPLC测定[J].分析试验室,2014,33(增刊):141-143.
StudyonQualityStandardsofCultivatedNardostachyschinensisBatal.
ZHANGYuxia1,2,MAShizhen1*,FENGHaisheng1,LICaixia1,ZHENGZhiyuan1,2,LIUYongling1
(1.NorthwestInstituteofPlateauBiology,ChineseAcademyofSciences/KeyLaboratoryofTibetanMedicineResearch,Xining810001,China;2.UniversityofChineseAcademyofSciences,Beijing100049,China)
Objective:To establish the quality standards for cultivatedNardostachyschinensisBatal.Methods:According to the standards of Chinese Pharmacopoeia,the cultivatedN.chinensiswas identified by powder microscopic observation and TLC,essential oil,water content,extract,total ash,acid-insoluble ash,heavy metals,harmful elements and organochlorine pesticides residue were measured,nardosinone was determined by HPLC.Results:Powder microscopic observation and TLC were consistent to the description of Chinese Pharmacopoeia.The limits of water content,extract,the total ash,acid-insoluble ash,heavy metals,harmful elements,organochlorine pesticides residue,essential oil and nardosinone were set up.Conclusion:The determined indicators can provide scientific basis for improvingN.Chinensis.quality standards.
NardostachyschinensisBatal.;HPLC;nardosinone;essential oil;quality standards
2015-07-10)
中国科学院藏药研究重点实验室项目(No.Y34291OZ1)
*
马世震,研究员,研究方向:药材质量标准研究及产品开发;E-mail:szma@nwipb.cas.cn
10.13313/j.issn.1673-4890.2016.5.018
