CRISPR/Cas9在烟草遗传育种中的应用
2016-09-23张之矾周红江冯厚平刘明竞芶剑渝
张之矾,周红江,冯厚平, 刘明竞,侯 军,芶剑渝
(1.贵州省烟草公司遵义市公司正安县分公司,贵州正安 563400;2.贵州省烟草公司遵义市公司,贵州遵义 563000)
CRISPR/Cas9在烟草遗传育种中的应用
张之矾1,周红江1,冯厚平2, 刘明竞1,侯 军1,芶剑渝2
(1.贵州省烟草公司遵义市公司正安县分公司,贵州正安 563400;2.贵州省烟草公司遵义市公司,贵州遵义 563000)
主要从CRISPR/Cas9系统的基本原理、应用及其存在的问题等方面进行了综述,并对该技术如何应用于烟草遗传育种以及分子改良研究进行了展望。
CRISPR/Cas9;基因组;定点编辑;烟草
随着分子生物学的进步及大量生物基因组测序工作的完成,人类对生物特定基因的DNA序列进行定点编辑得以实现。从最初应用于酵母细胞DNA改造的同源重组技术,基因编辑经历了锌指核酸酶(Zinc-finger nucleases, ZFNs)和TALE核酸酶(Transcription activator like effector nucleases, TALENs)2个重要的发展时期,直到CRISPR/Cas9技术被大量报道,基因编辑技术迎来了新的发展契机。CRISPR(clustered regularly interspaced short palindromic repeats)/Cas9是一种新型的基因组定点编辑工具,该技术已发展成为继锌指核酸酶(Zinc Finger Nucleases,ZFNs)及TALE核酸酶(Transcription Activator-like Effector Nucleases,TALENs)后对基因定点高效编辑的首选技术。
CRISPR/Cas系统最早被发现于细菌中,属于细菌在进化过程中演化出的一种天然免疫方式。研究者已成功利用Type II型CRISPR/Cas9对多种生物的基因组进行了定点编辑。CRISPR/Cas9系统是一种高效、快速、简单的基因组定点编辑新技术,该技术利用细菌人工核酸酶在DNA靶位点产生DNA双链断裂,从而实现对基因组的定点编辑。CRISPR/Cas9技术目前已在多种模式生物(干细胞、斑马鱼、爪哇蟾、酵母、大肠杆菌、水稻及烟草等)中被成功应用,相信未来该技术会成为每个生物学实验室必备的基因定点编辑工具。对于农业研究,该技术应用于动植物新品种的培育会极大地提高创制动植物优异新种质的效率[1]。烟草育种是综合运用植物遗传学、育种学以及其他相关学科的理论和技术,对不同烟草栽培类型的遗传组成进行有效改良和创新,培育和创造烟草优良新品种,不断满足烟草生产发展的需求[2]。烟草是我国最重要的经济作物,现行品种的抗病、产量、烘烤品质等性状均存在诸多问题。因此,培育新型烟草品种及创制烟草种质资源对国民经济增长具有重要意义[3]。笔者CRISPR/Cas9系统的基本原理应用及存在的问题进行了综述,并对该技术如何应用于烟草遗传育种以及分子改良研究进行了展望。
1 CRISPR/Cas9系统基本原理
1.1CRISPR/Cas9 作用原理CRISPR/Cas9来自细菌TypeⅡ型免疫系统,该蛋白为多结构复合体,主要包含RuvC-like 结构域及位于中间的HNH结构域,HNH与sgRNA(single-strand guide RNA)结合形成Cas9-sgRNA复合体[4-5]。复合体中的sgRNA与靶向DNA特异性配对,配对完成后Cas9会对靶向DNA原型间隔序列毗邻基序(Protospacer adjacent motif, PAM)上游3 nt处的碱基进行剪切。Cas9蛋白中RuvC与HNH结构域都具有核酸内切酶活性,HNH识别PAM序列后对与sgRNA互补配对的DNA单链进行切割并产生缺口(nick),RuvC则剪切另一条单链[6]。Sternberg等[7]研究发现,Cas9携带sgRNA的复合体会在全基因组上快速地搜寻PAM序列,PAM序列作为触发器催化Cas9行使剪切功能,即便sgRNA是与非目标区段完全配对,若无PAM的存在Cas9蛋白直接忽略配对。如果基因组PAM序列呈现高密度串联重复,Cas9蛋白可能会错误识别靶位点。由于Cas9剪切DNA双链产生缺口(nick),造成基因组碱基序列缺失、替换、插入等多种损伤,真核生物会通过非同源性末端重组(Non-homologous End Joining,NHEJ)修复机制,将缺口两端的DNA序列直接相连,补平缺口。该修复机制完成后,靶向DNA的序列会发生改变,即通过sgRNA引导Cas9蛋白实现对基因组序列的定点编辑(图1)。化脓性链球菌StreptococcuspyogenesCas9蛋白是目前使用最多的CRISPR核酸酶,Jinek等[8]利用单粒子显微镜重塑技术,结果发现,SpCas9晶体中的核酸酶部分(RuvC与HNH结构域)在剪切DNA双链时,与螺旋蜷曲结构域之间产生一定的缝隙,该缝隙使Cas9蛋白能够适应不同sgRNA的引导。其他类型的Cas蛋白同样具有较高的应用价值,Luo等[9]用大肠杆菌TypeI-E型CRISPR/Cas系统抑制基因表达,通过删除cas3基因,该免疫系统转变为可编程的基因调节器。该系统靶向启动子与编码序列都会导致转录抑制,由此可见,CRISPR家族不同类型的蛋白具有许多特殊的研究用途。

图1 Cas9蛋白剪切基因组序列机制Fig.1 The mechanism of Cas9 protein splices the genome sequence
2 CRISPR/Cas9的特点、问题及应用
2.1CRISPR/Cas9特点CRISPR/Cas9系统构建相对简单,以常规转基因过表达质粒为骨架,克隆插入Cas9编码基因,Cas9蛋白能够在多种模式生物中稳定表达,通常不会产生氨基酸突变。同时,设计扩增sgRNA表达盒序列,sgRNA前导序列为编码核内小RNA的U3、U6a-c等基因的启动子,sgRNA的查找只需要针对靶基因内PAM序列前19~20碱基进行选择,将两者连接后导入到受体细胞,sgRNA表达后即可引导Cas9蛋白剪切靶基因(图2)。不同于RNA干涉,Cas9打靶成功后目标基因的信使RNA及氨基酸序列会被同时改变,但RNA干涉有时不能够将目标基因完全沉默,转基因表型不明显。
锌指核酸酶(Zinc Finger Nucleases,ZFNs)由锌指蛋白(Zinc Finger Protein,ZFP)和FokI核酸内切酶人工融合而成ZFN识别结合并剪切特定的 DNA 序列。ZFN 中的 ZFP 结构域通常由 3~6 个C2H2类型的锌指重复单位串联而成。其中,每个锌指模块可直接特异识别 DNA 双螺旋中某一条单链上 3 个连续的核苷酸(称为一个三联子,Triplet),由多个锌指串联形成的 ZFP 结构可识别更长的靶序列, 同时也增加了DNA靶向修饰的特异性[10]。植物致病菌黄单胞杆菌属(Xanthomonas)中发现的转录激活类似效应物(Transcription Activator Like Effector, TALE)能够识别特定的DNA序列。根据该特性,可将TALEN单元重复串联起来(14~20个重复单元)与FokI核酸内切酶融合形成TALE核酸酶,TALEN可识别剪切特定的DNA序列[11]。但ZFN与TALEN的共同特点是模块化组装非常繁琐,耗时长,资金投入大,且受技术专利的限制,一般的小型实验室无法独立开展模块的构建。但Cas9组装过程即为简单的载体构建,构建好的质粒可直接用于转化受体细胞。因此,相对于其他技术,Cas9高效、省时及成本低的特点尤为突出。

图2 Cas9表达质粒构建过程Fig.2 Schematic diagram of Cas9 expression vector construction
2.2CRISPR/Cas9的主要问题ZFN 与TALEN 由于是模块化组装,每个模块仅识别特定的碱基序列,重复串联的模块提高了其打靶的准确性,但CRISPR/Cas9 技术最大的缺点即为容易脱靶。基因组序列非常庞大,sgRNA只与PAM序列前20个碱基进行配对,在基因组中出现错误配对的概率就会很高,Cas9蛋白有时不能正确剪切与sgRNA配对的目标DNA序列,而是错误地将一些相似序列进行剪切。 Xie等[12]利用Cas9技术对水稻基因MAPK5进行打靶,结果估算打靶效率在3%~8%;同时分析了水稻全基因组中约有3.89 × 107个PAM基序,只有2.09 × 107个能够作为有效的sgRNA序列,其中,6.4 × 106个序列具有错配性。为有效解决脱靶问题,Ran等[13]利用双Cas9系统对小鼠卵细胞的Mecp2基因进行打靶,设计常规的sgRNA基于基因组正链,同时在互补链上间隔的50 bp内再次设计新的sgRNA,该系统对单基因的不同位点进行双打靶,有效提高了Cas9的打靶效率。
2.3CRISPR/Cas9的应用Jinek等[14]构建了含有Protospacer2的质粒,设计配对的tracrRNA:crRNA作为外源sgRNA引导Cas9蛋白用2个不同的结构域剪切双链DNA,并证明Cas9剪切的识别位点即PAM序列存在2个保守的碱基GG,该研究首次人工模拟CRISPR免疫系统剪切DNA,为Cas9蛋白的后续成功运用奠定基础。Mali等[15]利用Cas9敲除人体细胞内源基因AAVS1,在293T细胞中Cas9打靶效率为10%~25%,但在多能干细胞中相对较低为2%~4%。同时Cong等[16]将Cas9密码子人源优化,能够精确剪切人体及小鼠细胞内的EMX1,并认为Cas9可作为缺口酶应用于哺乳动物DNA同源重组修复,还可构建CRISPR芯片同时进行多重位点打靶。成功剪切哺乳动物的基因组序列表明,Cas9蛋白具有高效的通用性,该技术有望广泛应用于合成生物学、直接和多通路干扰基因网络、体内外靶向性基因治疗等。Hwang等[17]利用Cas9系统与前期ZFN及TALEN敲除斑马鱼胚胎细胞基因tia11和gsk3b相比,Cas9将突变率从2%提高到6%~36%,但Cas9易产生瞬时的非嵌合敲除体,该研究结果显示,除哺乳动物外,脊椎动物也可运用Cas9系统。随后在多种模式生物中,Cas9系统成功敲除了不同物种的多个基因。Ren等[18]创建了果蝇Cas9敲除系统:Drosophila germline specific Cas9(CGSC)system ,该系统发现sgRNA与基因组序列,如果存在3个碱基内的错配不会增加脱靶效应,通过优化sgRNA内的碱基以及改变GC含量,新的果蝇敲除系统大大提高打靶效率,且产生的突变数远高于未优化系统。
植物由于特殊的组织结构,难以离体培养的特性,导致许多生物技术的应用受到限制,但经过密码子优化的Cas9同样能够在植物中发挥作用。Li等[19]利用该系统成功敲除模式植物拟南芥及本生烟中的AtPDS3、AtFLS2、NbPDS3基因。多倍体植物由于染色体组的加倍导致许多性状发生了明显变化,二倍体的研究策略此时并不适用于多倍体植物。Wang等[20]利用Cas9技术将大麦抵御白粉病的3个同源等位基因MLO同时敲除,结果表明,Cas9系统不仅具有同时打靶的能力,而且适用于多倍体植物研究。Cas9 系统的高效利用为植物育种、遗传改良、基础研究带来了巨大的改变,该技术使科学家更易于在基因组水平改良植物性状。
CRISPR/Cas9基因组定点编辑技术能够为研究植物的生长、发育和衰老提供新的方式。Cas9剪切基因组DNA依赖RuvC和HNH,这2个结构域的同时作用使DNA产生双链断裂,若具有单个结构域的Cas9蛋白剪切DNA产生单链缺口,此时如果继续导入一段外源DNA,有可能植物会利用同源重组酶将外源DNA整合插入到单链缺口处,若该方法成功将产生一种新的植物转基因模式。另外,Cas9蛋白受sgRNA引导,到达目标DNA处进行剪切,如果将Cas9蛋白进行改造,使其仅受sgRNA引导而不剪切DNA,则改造后的Cas9蛋白可应用于转录激活研究。转录因子与Cas9蛋白相融合,在sgRNA的引导下Cas9蛋白携带转录因子进入到特定区域,激活下游基因表达。转录因子与Cas9蛋白的结合能够为蛋白质-DNA互作鉴定提供新的方法,还可对染色质免疫共沉淀(Chromatin immunoprecipitation assay,Chip)数据进行核内有效验证。Cheng等[21]建立CRISPR-on系统,将Cas9蛋白与转录因子的转录激活结构域融合,sgRNA特异靶向启动子区,结果表明,该系统能够激活小鼠卵细胞内源基因IL1RN、SOX2及OCT4的表达。再者,可利用Cas9蛋白同时敲除对多个基因进行敲除。研究蛋白质相互作用时,很难获得互作蛋白的双突变体,若将针对单个基因产生双缺口的sgRNA替换成同时引导2个基因打靶的sgRNA,在理论上完全能够获得双突变体以及多突变体。
3 CRISPR/Cas9应用于烟草遗传育种的展望
3.1CRISPR/Cas9 技术应用于烟草DH群体构建Cas9能够将控制作物不良性状的基因进行有效敲除,敲除后的作物虽携带有Cas9基因,但通过回交及分子检测的方法可逐步除去子代体内的Cas9基因(图3),利用Cas9将烟草中的负调控基因进行定点诱变即可产生新的转基因烟草株系。F1代与优良性状的烟草轮回亲本杂交后的F2代,分子检测若不含Cas9基因,可利用花药及组织培养技术快速获得纯合株系,并能够有效节约育种时间。
植物育种中纯合株系的获得需要经过很多年,单倍体加倍可有效解决该问题,烟草花药培养法已成为作物中应用最成熟的生物技术, 从 DH 群体选育而来的烟草品种有 F211、NC744、TanYuh1、Yuh2、Yuh3 及 LMAFC34等[22]。正常烟草植株诱导出的愈伤组织经过Cas9技术修饰后会出现大量的嵌合体,即DNA的一条单链被剪切,而另一条链处于正常状态,转基因后代会出现分离现象。若使用烟草花药培养诱导出的单倍体愈伤组织经Cas9修饰去除负向调控基因,随后再加倍形成的DH群体即为纯合株系。该群体可直接应用于培育新品种、构建遗传图谱、基因定位等多项工作。
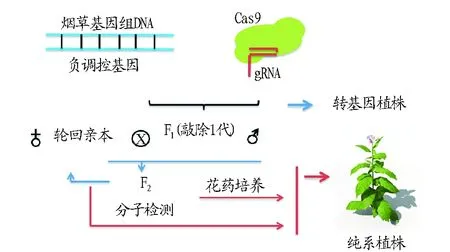
图3 Cas9应用于烟草育种Fig.3 Schematic diagram of Cas9 application in tobacco breeding research
3.2CRISPR/Cas9 技术应用于烟草抗病育种烟草是研究植物与病原菌相互作用的模式植物,生产中主要使用化学药剂防治烟草黑胫病、赤星病、花叶病等病害,但培育烟草抗病新品种才是最经济安全的策略。烟草基因组中包含400多个NBS-LRR类抗病基因,该家族基因在植物抗病反应中发挥重要作用[23]。其中,抗烟草花叶病单基因N属于典型的TIR-NBS-LRR抗病基因[24],该基因具有2种转录产物NS与NL,2种产物在抗病时间上具有不同的功能。若使用Cas9技术对N基因的外显子序列进行修饰,那么N基因只会转录产生一个可变剪切,具有单一转录剪切本的基因NL具有更持久的抗病性。但目前针对黑胫病与青枯病的抗性基因发掘相对缓慢,多数为已报道的QTL位点,随着烟草基因组测序的完成及功能基因组的开展,将加快对抗性QTL的精细定位[25]。陈帅等[26]利用EMS诱变获得了eIF4E的抗马铃薯Y病毒的突变体,若用Cas9创制一批eIF4E敲除的突变体材料能够为抗马铃薯Y病毒病提供许多中间型抗病株系。
3.3CRISPR/Cas9 技术应用于烟草不育系选育育种中杂种优势的利用是培育新品种的重要手段,杂交种在生物产量、抗性方面都具有超亲优势。但烟草中不育系的品种非常稀少,这限制了烟草杂交选育的进度,生产上应用较多的为 MS白肋21×Ky10 的后代[27]。烟草为叶用作物,其杂交种可为不育,只需雄性不育系和保持系即可。若将Cas9蛋白融合烟草线粒体蛋白定位信号,那么Cas9蛋白作用于线粒体蛋白敲除线粒体编码基因Nad7则可获得与林烟草细胞质雄性不育CMSI功能相同的材料[28],而敲除材料的遗传背景多样化,再与亲缘关系较远的父本杂交,F1的超亲优势会更加显著。针对细胞核雄性不育系材料的创制则更为简单,但目前对控制烟草育性的核基因很少,NtCOI1的RNAi干涉植株表现为育性降低,该基因可作为一个潜在的细胞核不育基因使用[29]。
3.4CRISPR/Cas9技术应用于烟草突变体库构建烟草突变体库的建立对烟草功能基因组研究具有重要意义。物理、化学、生物等多种方法已被应用于创制烟草突变体材料,如化学诱变剂EMS与Tiling(Targeting induced local lesions in genomes)技术的结合,但该技术后续大规模测序花费巨大[30]。随着生物技术T-DNA插入的运用,不同类型的材料易于获得,但后期鉴定过程非常复杂。根据烟草基因组信息比对,首先合成Cas9-single guide RNA文库,随后构建Cas9-sgRNA的质粒文库,利用土壤农杆菌携带Cas9文库质粒转入烟草愈伤细胞,可产生具有不同表型以及基因型的突变体,后续可用Tiling平台及高通量测序筛选Cas9突变体。虽然构建的sgRNA文库不能覆盖基因组全部的编码基因,但通过人为定向选择可快速获得目标突变体(图4)。宗鹏等[31]利用定向诱导基因组局部突变技术(Targeting Induced Local Lesions In Genomes,TILLING)从经EMS诱变的烟草突变体库中筛选出13株NtPhyB突变体材料,NtPhyB 编码光敏色素受体蛋白调控植株相应光周期及光形态建成。若Cas9的突变体库中筛选出单一基因的突变体材料,只需设计特异性引物对靶点DNA序列扩增,通过测序的方法鉴定可节约大量时间。
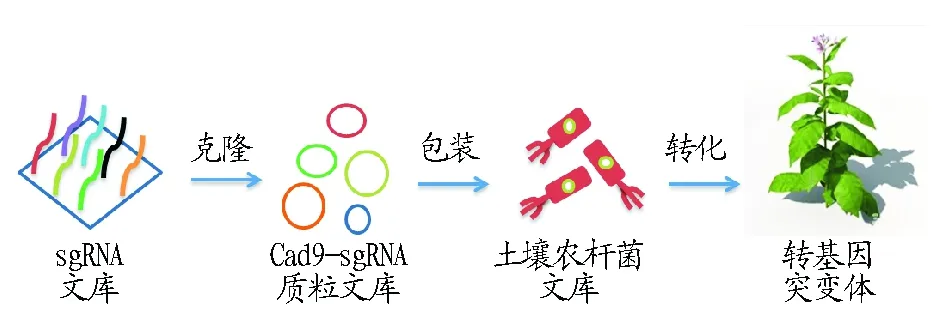
图4 Cas9烟草突变体库构建Fig.4 Construct the tobacco mutants library depend on Cas9 system
3.5CRISPR/Cas9技术应用于烟草特殊性状改良烟草为叶用植物,又可作为良好的生物反应器,烟草具有许多异于其他作物的特殊性状,如烟草叶色是反映其生长发育、生理状态的参考标志。白肋烟是重要的混合型卷烟原料,相对于正常植株白肋烟属于叶色突变体,其叶绿素含量为正常绿色型的1/3,由2对连锁的隐性核基因控制[32]。若利用Cas9技术将正常高产烟草品种中控制叶绿素合成的基因进行敲除,便可获得与白肋烟具有相类似表型的突变体。目前,烟草原料的生产需符合降焦减害的指导思想。烟草中的尼古丁、烟碱、焦油等有害物质的合成途径已逐渐清晰,如果利用Cas9对烟草中调控焦油合成关键酶的基因进行突变,焦油含量下降。可不需要在工艺或栽培过程中完成降焦工作。
烟草育种中尚有许多亟待解决的问题,许多调控烟草重要性状的基因尚未被克隆,这极大地限制了CRISPR/Cas9 技术在烟草育种研究中的应用。伴随着烟草基因组测序的完成以及功能基因研究的开展,将加快烟草重要基因在烟草分子育种中的应用,也期待传统的烟草育种与新的生物技术CRISPR/Cas9 的结晶成果。
[1] LIU D,HU R,PALLA K J,et al.Advances and perspectives on the use of CRISPR/Cas9 systems in plant genomics research[J].Curr Opin Plant Biol,2016,30:70-77.
[2] 王彦亭.我国烟草育种工作发展思路[J].中国烟草科学,2001(4):1-5.
[3] 王献生,张忠锋,肖炳光.中国烟草育种研究进展[J].烟草科技,2007(5):53-57.
[4] SAMANTA M K,DEY A,GAYEN S.CRISPR/Cas9:An advanced tool for editing plant genomes[J/OL].Transgenic res,2016[2016-05-09].http://www.researchgate.net/publication/299419009_CRISPRCas 9_an_advanced_tool_for_editing_plant_genomes.DOI:10.1007/S11248-016-9953-5.
[5] BELHAJ K,CHAPARRO-GARCIA A,KAMOUN S,et al.Editing plant ge-
nomes with CRISPR/Cas9[J].Curr Opin Biotechnol,2015,32:76-84.
[6] BARRANGOU R.RNA events.Cas9 targeting and the CRISPR revolution[J].Science,2014,344(6185):707-708.
[7] STERNBERG S H,REDDING S,JINEK M,et al.DNA interrogation by the CRISPR RNA-guided endonuclease Cas9[J].Nature,2014,507(7490):62-67.
[8] JINEK M,JIANG F,TAYLOR D W,et al.Structures of Cas9 endonucleases reveal RNA-mediated conformational activation[J].Science,2014,343(6176):1247997.
[9] LUO M L,MULLIS A S,LEENAY R T,et al.Repurposing endogenous type I CRISPR-Cas systems for programmable gene repression[J].Nucleic Acids Res,2015,43(1):674-681.
[10] OAKES B L,XIA D F,ROWLAND E F,et al.Multi-reporter selection for the design of active and more specific zinc-finger nucleases for genome editing[J].Nat Commun,2016,7:10194.
[11] UL AIN Q,CHUNG J Y,KIM Y H.Current and future delivery systems for engineered nucleases:ZFN,TALEN and RGEN[J].J Control Release,2015,205:120-127.
[12] XIE K,YANG Y.RNA-guided genome editing in plants using a CRISPR-Cas system[J].Mol Plant,2013,6(6):1975-1983.
[13] RAN F A,HSU P D,LIN C Y,et al.Double nicking by RNA-guided CRISPR Cas9 for enhanced genome editing specificity[J].Cell,2013,154(6):1380-1389.
[14] JINEK M,CHYLINSKI K,FONFARA I,et al.A programmable dual-RNA-guided DNA endonuclease in adaptive bacterial immunity[J].Science,2012,337(6096):816-821.
[15] MALI P,YANG L,ESVELT K M,et al.RNA-guided human genome engineering via Cas9[J].Science,2013,339(6121):823-826.
[16] CONG L,RAN F A,COX D,et al.Multiplex genome engineering using CRISPR/Cas systems[J].Science,2013,339(6121):819-823.
[17] HWANG W Y,FU Y,REYON D,et al.Efficient genome editing in zebrafish using a CRISPR-Cas system[J].Nat Biotechnol,2013,31(3):227-229.
[18] REN X,YANG Z,XU J,et al.Enhanced specificity and efficiency of the CRISPR/Cas9 system with optimized sgRNA parameters in Drosophila[J].Cell Rep,2014,9(3):1151-1162.
[19] LI J F,NORVILLE J E,AACH J,et al.Multiplex and homologous recombination-mediated genome editing inArabidopsisand Nicotiana benthamiana using guide RNA and Cas9[J].Nat Biotechnol,2013,31(8):688-691.
[20] WANG Y,CHENG X,SHAN Q,et al.Simultaneous editing of three homoeoalleles in hexaploid bread wheat confers heritable resistance to powdery mildew[J].Nat Biotechnol,2014,32(9):947-951.
[21] CHENG A W,WANG H,YANG H,et al.Multiplexed activation of endogenous genes by CRISPR-on,an RNA-guided transcriptional activator system[J].Cell Res,2013,23(10):1163-1171.
[22] 朱惠琴,戴文新.烟草加倍单倍体群体的构建及其在遗传育种中的应用[J].青海大学学报(自然科学版),2003(6):20-23.
[23] 王元英.烟草抗病基因筛选及其高通量RNAi载体库的构建[D].北京:中国农业科学院,2011:78.
[24] WHITHAM S,DINESH-KUMAR S P,CHOI D,et al.The product of the tobacco mosaic virus resistance gene N:Similarity to toll and the interleukin-1 receptor[J].Cell,1994,78(6):1101-1115.
[25] 龚达平.烟草重要基因篇:1.烟草抗病相关基因[J].中国烟草科学,2014(1):133-135.
[26] 陈帅,刘贯山,杨爱国,等.受PVY诱导的烟草NtERD1的基因分离与表达分析[J].中国烟草科学,2010(5):62-67.
[27] 李凤霞.烟草重要基因篇:9.烟草雄性不育和育性恢复基因[J].中国烟草科学,2015(3):106-108.
[28] SABAR M,DE PAEPE R,DE KOUCHKOVSKY Y.Complex I impairment,respiratory compensations,and photosynthetic decrease in nuclear and mitochondrial male sterile mutants of Nicotiana sylvestris[J].Plant Physiol,2000,124(3):1239-1250.
[29] WANG W,LIU G,NIU H,et al.The F-box protein COI1 functions upstream of MYB305 to regulate primary carbohydrate metabolism in tobacco(NicotianatabacumL.cv.TN90)[J].J Exp Bot,2014,65(8):2147-2160.[30] MCCALLUM C M,COMAI L,GREENE E A,et al.Targeting induced local lesions IN genomes(TILLING)for plant functional genomics[J].Plant Physiol,2000,123(2):439-442.
[31]宗鹏,李凤霞,王倩,等.烟草TILLING技术体系的建立及NtPhyB基因的筛选[J].中国烟草科学,2014(2):32-36.
[32] 陈明丽,龚达平.烟草重要基因篇:12.烟草叶色相关基因[J].中国烟草科学,2015(6):112-114.
Application of CRISPR/Cas9 in Tobacco Genetic Breeding
ZHANG Zhi-fan1, ZHOU Hong-jiang1, FENG Hou-ping2et al
(1.Zhengan Branch of Zunyi Company, Guizhou Tobacco Company, Zhengan, Guizhou 563400;2.Zunyi Tobacco company of Guizhou Province,Zunyi Guizhou,563000)
We reviewed the fundamental principle, application and existing problems of CRISPR/Cas9. And the application of CRISPR/Cas9 in tobacco genetic breeding and molecular modified research were forecasted.
CRISPR/Cas9; Genome; Target editing; Tobacco
贵州中烟工业有限责任公司资助项目(2013-3)。
张之矾(1988- ),男,山东聊城人,助理农艺师,硕士,从事烟草生产技术推广工作。
2016-05-31
S 503.2
A
0517-6611(2016)22-118-04
