高血糖通过HBP途径增加SD大鼠子宫内膜细胞内β-catenin稳定性
2016-09-23周福兴刘高伟刘海霞陈必良
周福兴, 陈 颖, 刘高伟, 刘海霞 ,李 娜 ,马 芮,陈必良
(1.第四军医大学西京医院妇产科,陕西 西安710032;2.第四军医大学药学院天然药物学教研室,陕西 西安 710032)
高血糖通过HBP途径增加SD大鼠子宫内膜细胞内β-catenin稳定性
周福兴1, 陈颖2, 刘高伟1, 刘海霞1,李娜1,马芮1,陈必良1
(1.第四军医大学西京医院妇产科,陕西 西安710032;2.第四军医大学药学院天然药物学教研室,陕西 西安 710032)
目的探讨高血糖通过HBP途径增加子宫内膜细胞内β-catenin稳定性的相关机制。方法50只SD雌性大鼠随机分为正常对照组、禁食组、高糖高脂组、葡萄糖胺组和葡萄糖组。高糖高脂组给予高糖高脂饲料喂养,其他组普通饲料喂养。8周后将高糖高脂组和正常对照组大鼠处死;禁食组禁食24h后处死;葡萄糖胺组禁食24h后给予葡萄糖胺 2.50g/kg灌胃,3h后处死;葡萄糖组禁食24h后给予葡萄糖5g/kg灌胃,3h后处死。分别取各组大鼠子宫内膜组织,检测相关蛋白和基因表达水平。结果HSHF组和NC组相比,各饲养周空腹血糖水平均明显升高(t值2.34~2.78,均P<0.05)。GLU组和FASTING组相比,血糖水平明显升高(t=3.46,P<0.05),而GLN组和FASTING组相比血糖水平无统计学差异(t=0.84,P>0.05)。Westernblot检测结果相对表达量分析显示,GLN组和GLU组子宫内膜组织内β-catenin、O-GlcNAc表达量均明显高于FASTING组(t值3.44~5.08,均P<0.05),而GLN组和GLU组之间β-catenin、O-GlcNAc表达量均无统计学差异(t值分别为0.75、0.66,均P>0.05)。RT-PCR检测HSHF组Ctnnb1表达水平与NC组相比无统计学差异(t=0.43,P>0.05),而β-catenin特异性靶基因CyclinD1和Axin2表达水平HSHF组明显高于NC组(t值分别为4.48、5.26,均P<0.05)。结论高血糖能够通过HBP途径,使β-catenin的O-GlcNAc化增加,从而增加其稳定性,使进入细胞核内的β-catenin增多,持续作用于下游靶基因引起细胞异常增殖分化。
高血糖;内膜癌;WNT/β-catenin;O-GlcNAc
[Keywords]hyperglycemia;endometrialcancer;WNT/β-catenin;O-GlcNAc
子宫内膜癌是女性三大恶性肿瘤之一。2014年美国女性内膜癌的新增病例为52 630例,死亡病例为8 590例[1],在女性常见的恶性肿瘤中占第4位,生殖系统肿瘤中占第1位。中国女性子宫内膜癌的患病率仅次于宫颈癌,位于生殖系统肿瘤第2位。随着人们生活水平的提高,饮食结构的西方化改变,国内子宫内膜癌的发病率逐年上升,并呈现年轻化,高侵袭性,低分化等特点,严重危害女性生命健康[2]。 肥胖[3]和糖尿病[4-5]是子宫内膜癌的两大危险因素。而高血糖作为二者共同特征,已发现与多种肿瘤的发生发展相关[6-7],但是血糖升高是否与子宫内膜癌的发生相关目前尚不清楚。因此,本研究重点探索高血糖对子宫内膜细胞通路的影响及可能的分子机制。实验以高糖高脂喂养的SD大鼠为切入点,研究高血糖状态下子宫内膜分子通路变化的情况。通过建立高糖高脂喂养的SD大鼠模型,模拟人类高血糖状态下内膜组织WNT/β-catenin通路异常状态,探讨高血糖状态下氧连接的氮乙酰葡萄糖胺(Nacetylglucosamine,O-GlcNAc)化对β-catenin异常升高的作用。
1材料与方法
1.1动物
8~10周龄雌性SD大鼠(第四军医大学动物中心)50只,体重180~200g。
1.2主要试剂
O-GlcNAc抗体(RL2,Abcam公司),β-catenin抗体(Abcam公司),葡萄糖胺(Sigma公司),RNA提取试剂盒(TaKaRa公司)。
1.3动物分组及模型的建立
将所有实验大鼠适应性喂养1周后,随机分为5组:正常对照组(normalcontrolgroup,NC组)、禁食组(fastinggrop,FASTING组)、高糖高脂组(highsugarandhighfatgroup,HSHF组)、葡萄糖胺组(glucosaminegroup,GLN组)和葡萄糖组(glucosegroup,GLU组)。HSHF组喂养高糖高脂饲料(普通饲料中加入10%的猪油、20%的蔗糖、2.5%的胆固醇、1%的胆酸钠,特洛菲公司),其他组喂养普通饲料喂养(65%碳水化合物,11% 脂肪,24%蛋白),自由饮水。NC组和HSHF组连续喂养8周后处死。FASTING组禁食24h后处死;GLN组禁食24h后给予葡萄糖胺 2.50g/kg灌胃,3h后处死;GLU组禁食24h后给予葡萄糖5g/kg灌胃,3h后处死。
1.4观察指标及检测方法
观察大鼠一般状态包括精神活动状态,皮毛色泽,净饮食量,二便等状况。每周称量并记录体重。检测空腹血糖:夜间禁食12h,尾部取血检测空腹血糖。内膜组织取材前阴道涂片确定大鼠生理周期,在动情期处死大鼠,取子宫角,迅速刮取子宫内膜置于液氮中冻存,用于蛋白免疫印迹(westernblot,WB)和实时定量PCR(real-timepolymerasechainreaction,RT-PCR)检测。
1.5 蛋白免疫印迹法检测相关蛋白的表达水平
提取内膜组织蛋白,测定蛋白含量后,按每孔30ug总蛋白量上样进行电泳分离,0.30A横流电转2h,5%脱脂奶粉室温摇床封闭抗体2h,分别加入一抗孵育液中(β-catenin1:4 000稀释,RL2 1:1 000稀释)4℃孵育过夜。0.25%PBST洗膜10min×3次,用含辣根过氧化物酶标记的相应二抗室温孵育2h,洗膜10min×3次,滴加化学发光底物进行检测,ImageJ软件分析图像。
1.6 RT-PCR检测相关基因表达水平
TaKaRaRNA提取试剂盒(TaKaRaMiniBESTUniversalRNAExtractionKit)提取内膜组织RNA,测浓度,逆转录后进行RealTimePCR检测,以甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphatedehydrogenase,GAPDH)作为内参,进行相对表达量分析。引物设计与合成如下:Ctnnb1,正义:5′-GTGCAATTCCTGAGCTGACC-3′,反义:5′-CGGGCTG ̄TTTCTACGTCATT-3′;CyclinD1,正义:5′-TCAAGTGTG ̄ACCCGGACTG-3′,反义:5′-GACCAGCTTCTTCCTCCACTT-3′;Axin2,正义:5′-TCCTTACCGCATGGGGAGTA-3′,反义:5′-GTGGGTTCTCGGGAAGTGAG-3′。
1.7统计学方法
2结果
2.1各组血糖值比较
HSHF组和NC组相比,各饲养周空腹血糖水平均明显升高(t值2.34~2.78,均P<0.05)。GLU组和FASTING组相比,血糖水平明显升高(t=3.46,P<0.05),而GLN组和FASTING组相比血糖水平无统计学差异(t=0.84,P>0.05)(图1)。

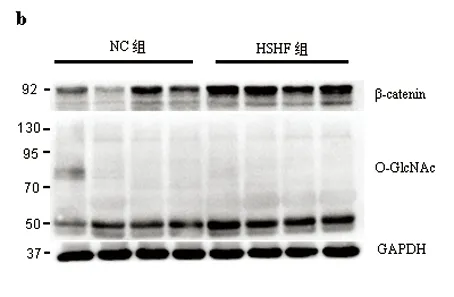
图1各组血糖值比较(a为NC组和HSHF组饲养周空腹血糖水平对比;b为FASTING组、GLU组和GLN组大鼠血糖水平的比较)
Fig.1Comparisonofbloodglucoselevelsamongdeffrentgroups(a:fastingbloodglucoselevelsinNCgroupandHSHFgroup;b:BloodglucoselevelsinFASTING,GLUandGLNgroups)
2.2子宫内膜组织内β-catenin和O-GlcNAc表达比较
Westernblot检测结果显示,HSHF组子宫内膜组织内β-catenin表达量明显高于NC组,O-GlcNAc化水平也增高。相对表达量分析显示,GLN组和GLU组子宫内膜组织内β-catenin、O-GlcNAc表达量均明显高于FASTING组(t值3.44~5.08,均P<0.05),而GLN组和GLU组之间β-catenin、O-GlcNAc表达量均无统计学差异(t值分别为0.75、0.66,均P>0.05)(图2)。
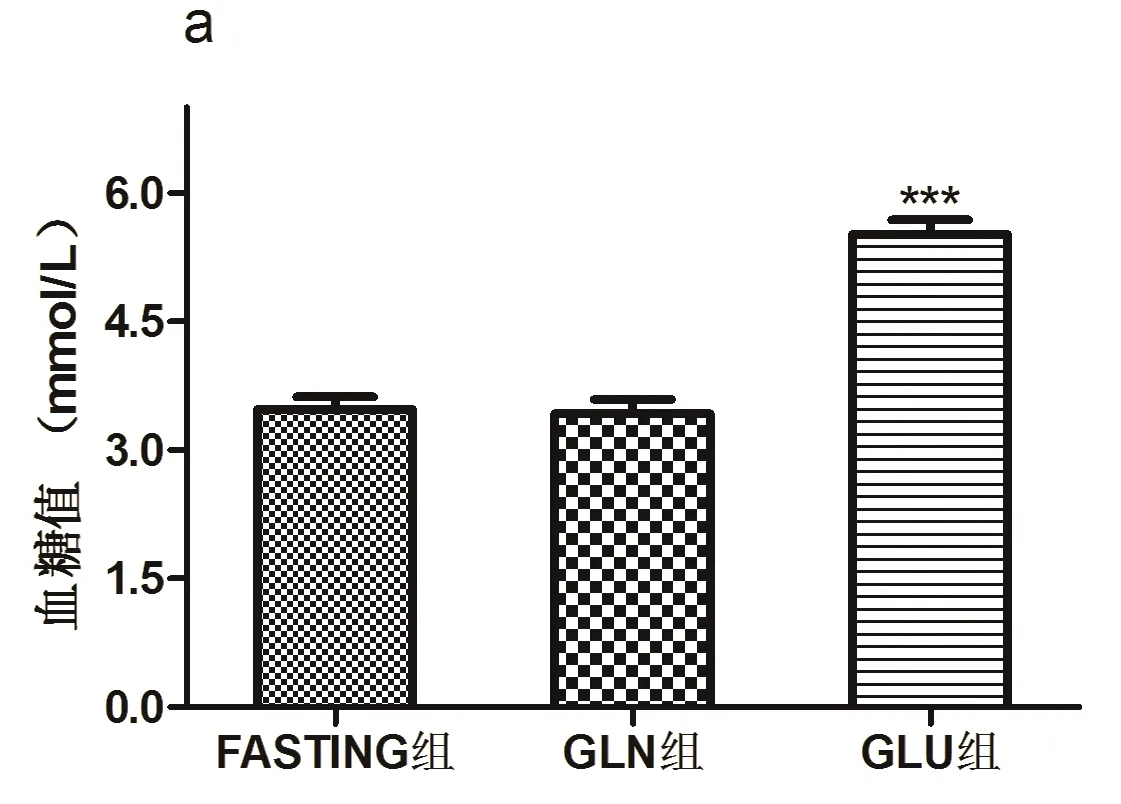
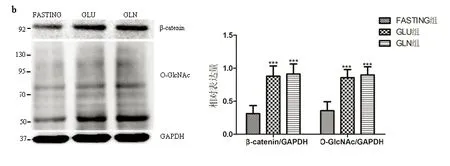
图2Westernblot检测子宫内膜组织内β-catenin、O-GlcNAc表达结果
Fig.2Expressionsofβ-cateninandO-GlcNAcinendometriumtissuesdetectedbyWesternblot
2.3正常对照组高糖高脂组RT-PCR检测结果比较
RT-PCR检测HSHF组Ctnnb1表达水平与NC组相比无统计学差异(t=0.43,P>0.05),而β-catenin特异性靶基因CyclinD1和Axin2表达水平HSHF组明显高于NC组(t值分别为4.48、5.26,均P<0.05(图3)。

图3RT-PCR检测NC组和HSHF组中Ctnnb1,CyclinD1和Axin2的表达水平。
Fig.3ExpressionsofCtnnb1,CyclinD1andAxin2detectedbyRT-PCR
3讨论
3.1WNT/β-catenin通路正常和异常状态下对细胞生长发育的作用
WNT/β-catenin通路是真核生物一条保守的分子通路,能够调节多种细胞进程如细胞生存、凋亡、转移等[8-9]。β-catenin是这条通路中的核心蛋白,正常代谢过程中合成的β-catenin蛋白在胞质中会被酶解复合体降解,只有少部分β-catenin能进入细胞核内,与靶基因结合来调控细胞生理活动[10]。因此当细胞胞质内的β-catenin异常增加,会使进入细胞核内的β-catenin增多,持续作用于核内的靶基因,诱导细胞异常增殖分化发生癌变[11]。β-catenin编码基因的突变、酶解复合体突变和β-catenin本身结构改变都可以造成β-catenin的异常增加[11]。近些年,越来越多的研究表明WNT/β-catenin通路异常与内膜癌的发生发展有密切的关系,之前对子宫内膜癌的研究多集中于β-catenin编码基因突变和酶解复合体突变如APC的突变[12-13],对于β-catenin本身结构改变所致的突变研究较少,所以本实验着重于β-catenin本身结构改变导致通路突变的研究。
3.2氮乙酰葡萄糖胺化对于WNT/β-catenin通路的作用
O-GlcNAcylation是一种翻译后修饰,与磷酸化类似,能够使β-catenin蛋白O-GlcNAc化,使其结构改变而不被酶解复合体识别[14]。O-GlcNAc化所需的GlcNAc基团是由己糖胺合成途径(hexosaminebiosynthesispathway,HBP)途径的终产物UDP-GlcNAc提供的,HBP途径是糖代谢的一个小分支,正常情况下细胞内有大约5%的葡萄糖用于HPB途径产生UDP-GlcNAc[14]。目前已有研究表明血糖升高可导致HBP途径活跃,进而通过O-GlcNACylation影响包括WNT/β-catenin在内的一系列通路[15-17]。那么高血糖会不会通过HBP使β-catenin升高而诱导内膜癌的发生呢?本研究主要通过检测高糖高脂喂养的SD大鼠子宫内膜β-catenin表达变化探究其与高血糖之间的可能的相关关系。
3.3血糖通过HBP途径影响β-catenin的氮乙酰葡萄糖胺化水平
实验结果显示,HSHF组大鼠子宫内膜组织β-catenin的表达量和O-GlcNAc化水平明显高于NC组。HSHF组血糖升高,相应的HBP途径增强,使UDP-GlcNAc合成增多,进而蛋白的O-GlcNAc化也增多。β-catenin也随着血糖的升高而表达增加,提示我们β-catenin可能与HBP途径相关,这与之前的文献报道相符[14]。葡萄糖胺是HBP途径的中间产物,能够直接进入HBP途径参与下一步反应[15],本实验发现给饥饿24h的SD大鼠灌胃葡萄糖胺后,子宫内膜的β-catenin和O-GlcNAc的表达量明显高于FASTING组,同样的结果在出现在GLU组;但是相应的血糖浓度GLN组和FASTING组比并没有升高,而GLU组明显升高,这支持了我们之前的假设即升高的血糖可以通过HBP途径作用于β-catenin的使其表达量增高。结合文献报道的β-catenin的O-GlcNAc化能改变其结构[14,15-16],提示血糖通过HBP途径产生UDP-GlcNAc,作用于β-catenin使其结构改变,稳定性增加使其在细胞内含量增加。
3.4高血糖引起的β-catenin的增加能够进一步激活下游的靶基因
为了验证β-catenin高表达是由于稳定性增加导致的,而非β-catenin编码基因Ctnnb1表达量增加导致的,本实验对HSHF组和NC组的Ctnnb1的表达量进行了比较,HSHF组的Ctnnb1转录水平未发现明显的增加,提示β-catenin细胞内异常增高可能是由于其降解减少引起的。同时β-catenin的特异性靶基因Axin2和Cyclin1的表达量在HSHF组中明显增高,说明高血糖引起的β-catenin的变化能够进一步激活下游的靶基因,调节细胞的生长增殖。
综上所述,本研究发现高血糖能够通过HBP途径使β-catenin的O-GlcNAc化水平增加,导致稳定性增加使进入细胞核内的β-catenin增多,激活下游靶基因。而β-catenin激活的下游靶基因是否能进一步引起细胞的异常增殖分化还需要进一步研究,同时高血糖对于β-catenin的影响是否也对人类的子宫内膜产生类似的影响还需要进一步研究。
[1]SiegelR,MaJ,ZouZ, et al.Cancerstatistics, 2014 [J].CA:CancerJClin, 2014, 64(1):9-29.
[2]TorreLA,BrayF,SiegelRL, et al.Globalcancerstatistics, 2012 [J].CA:acancerjournalforclinicians, 2015,65(2):87-108.
[3]NevadunskyNS,VanArsdaleA,StricklerHD, et al.Obesityandageatdiagnosisofendometrialcancer[J].Obstetgynecol, 2014,124(3):300-6.
[4]PeteraJ,SmahelovaA.Diabetesmellitusandmalignancies[J].VnitrniLekarstvi, 2014, 60(2): 69-74.
[5]黄春琴,詹美色. 1608例妊娠期妇女葡萄糖耐量筛查分析 [J].中国妇幼健康研究, 2008, 19(6): 635-6
[6]LambeM,WigertzA,GarmoH, et al.Impairedglucosemetabolismanddiabetesandtheriskofbreast,endometrial,andovariancancer[J].CancerCauses&Control:CCC, 2011, 22(8): 1163-1171.
[7]ShikataK,NinomiyaT,KiyoharaY.Diabetesmellitusandcancerrisk:reviewoftheepidemiologicalevidence[J].CancerSci, 2013,104(1):9-14.
[8]VoronkovA,KraussS.Wnt/beta-cateninsignalingandsmallmoleculeinhibitors[J].CurrPharmDes, 2013,19(4):634-64.
[9]CleversH,NusseR.Wnt/beta-cateninsignalinganddisease[J].Cell, 2012,149(6):1192-1205.
[10]GordonMD,NusseR.Wntsignaling:multiplepathways,multiplereceptors,andmultipletranscriptionfactors[J].JBioChem, 2006,281(32):22429-33.
[11]CleversH.Wnt/β-CateninSignalinginDevelopmentandDisease[J].Cell, 2006, 127(3): 469-480.
[12]MarkowskaA,PawalowskaM,LubinJ, et al.Signallingpathwaysinendometrialcancer[J].ContempoOncol, 2014,18(3):143-148.
[13]DellingerTH,PlanutisK,TewariKS, et al.RoleofcanonicalWntsignalinginendometrialcarcinogenesis[J].ExpRevAnticancerTherapy,2012,12(1):51-62.
[14]Olivier-VanStichelenS,DehennautV,BuzyA, et al.O-GlcNAcylationstabilizesbeta-cateninthroughdirectcompetitionwithphosphorylationatthreonine41 [J].FASEBJ, 2014, 28(8): 3325-3338.
[15]Olivier-VanStichelenS,GuinezC,MirAM, et al.ThehexosaminebiosyntheticpathwayandO-GlcNAcylationdrivetheexpressionofbeta-cateninandcellproliferation[J].AmJphyEndocrimetab, 2012,302(4):E417-E424.
[16]AnagnostouSH,ShepherdPR.GlucoseinducesanautocrineactivationoftheWnt/beta-cateninpathwayinmacrophagecelllines[J].BiochemJ, 2008,416(2):211-218.
[17]HaJR,HaoL,VenkateswaranG, et al.beta-cateninisO-GlcNAcglycosylatedatSerine23:implicationsforbeta-catenin'ssubcellularlocalizationandtransactivatorfunction[J].ExperCellRes, 2014,321(2):153-66.
[专业责任编辑:张忠明]
Glucose enhances the stability of β-catenin via hexosamine biosynthetic pathway in endometrium of SD rats
ZHOU Fu-xing1, CHEN Ying2, LIU Gao-wei1, LIU Hai-xia1, LI Na1, MA Rui1, CHEN Bi-liang1
(1.DepartmentofGynecologyandObstetrics,XijingHospital,FourthMilitaryMedicalUniversity,ShaanxiXi’an710032,China;2.DepartmentofNaturalMedicine,SchoolofPharmacy,FourthMilitaryMedicalUniversity,ShaanxiXi’an710032,China)
ObjectiveToinvestigatethemechanismofhyperglycemiaenhancingthestabilityofβ-catenininendometrialcellsviahexosaminbiosyntheticpathyway(HBP).MethodsFemaleSDratswererandomlydividedinto5groups:normalcontrol(NC)group,fasting(FASTING)group,highsugarandhighfat(HSHF)group,glucosamine(GLN)groupandglucose(GLU)group.RatsintheHSHFgroupweregivenhighglucoseandhighfatdiet,whiletheothergroupsweregivennormaldiet.After8weeks’feedingratsinHSHFgroupandNCgroupwereexecutedandendometriumofthemwerecollected.RatsinFASTINGgroupwereexecutedafter24h.GLNgroupandGLUgroupwaslavagedwithglucosamine(2.50g/kg)andglucose(5g/kg)afterfastingfor24hours.Threehourslatertheratswereexecuted.Thenendometriumofratsineachgorupwascollectedtodetectexpressionsofproteinandgenes.ResultsComparedwithNCgroup,fastingbloodglucoselevelincreasedremarkablyinHSHFgroup(tvalueranged2.34-2.78,bothP<0.05).ComparedwithFASTINGgroup,glucoselevelofGLUgroupenhancedsignificantly(t=3.46,P<0.05),butGLNgroupwasnotsignificantlydifferent(t=0.84,P>0.05).Westernblotdetectionresultsshowedthattheexpressionsofβ-cateninandO-GlcNAcinGLNgroupandGLUgroupwereremarkablyhigherthanthoseinFASTINGgroup(tvalueranged3.44-5.08,respectively,allP<0.05),butthedifferencesinGLNgroupandGLUgroupwerenotsignificant(tvaluewas0.75and0.66,respectively,bothP>0.05).RT-PCRdetetionrevealedthatthedifferenceinCtnnb1expressionwasnotsignificantbetweenHSHFgroupandNCgroup(t=0.43, P>0.05),buttheexpressionsofCyclinD1andAxin2wereremarkablyhigherinHSHFgroupthaninNCgroup(tvaluewas4.48and5.26,respectively,bothP<0.05).ConclusionHyperglycemiacanenhanceO-GlcNAclevelofβ-cateninviaHBP,andthuselevateitsstabilitytohelptheaccululationofβ-catenin,whichcausesabnormalproliferationbyconsitentactionondownstreamtargetgenes.
2015-06-29
周福兴(1989-),男,硕士研究生,主要从事妇科肿瘤的研究。
陈必良,教授。
10.3969/j.issn.1673-5293.2016.01.005
R711.7
A
1673-5293(2016)01-0014-04
