ALDH1在宫颈癌组织中的表达及临床意义
2016-09-23杨文婷郑鹏生
张 丽,杨文婷,郑鹏生,3
(1.西安交通大学第一附属医院生殖医学科,陕西 西安 710061;2.西安交通大学医学院附属3201医院妇科,陕西 汉中 723000;3.西安交通大学教育部环境与基因重点实验室,陕西 西安 710061)
ALDH1在宫颈癌组织中的表达及临床意义
张丽1,2,杨文婷1,郑鹏生1,3
(1.西安交通大学第一附属医院生殖医学科,陕西 西安 710061;2.西安交通大学医学院附属3201医院妇科,陕西 汉中 723000;3.西安交通大学教育部环境与基因重点实验室,陕西 西安 710061)
目的探讨乙醛脱氢酶1(ALDH1)在正常宫颈组织、宫颈上皮内瘤样病变组织及宫颈浸润癌组织中的表达及临床意义。方法采用免疫细胞化学的方法检测ALDH1蛋白在宫颈癌细胞系HeLa、SiHa、C33A、CaSki和HT-3中的表达,采用免疫组织化学法检测ALDH1蛋白在100例正常宫颈组织、100例宫颈上皮内瘤样病变组织及100例浸润性宫颈癌组织中的表达,同时分析ALDH1的表达与100例宫颈浸润癌患者临床病理特征的关系。结果免疫细胞化学结果显示,ALDH1蛋白在宫颈癌细胞系C33A中的阳性率为42.24%,在HT-3细胞系中表达的阳性率为12.39%,而在宫颈癌细胞系SiHa、HeLa和CaSki中均未检测到ALDH1蛋白的表达。随着正常宫颈、宫颈上皮内瘤样病变到宫颈浸润癌的进展,ALDH1蛋白在正常宫颈组织、宫颈上皮内瘤样病变组织及宫颈癌组织中表达的阳性率分别为28.00%、38.00%和65.00%,ALDH1蛋白的阳性率和评分均逐渐增加(χ2=29.785,P=0.000);Spearman相关性分析结果显示,ALDH1的表达与宫颈癌患者的病理分级、临床分期、盆腔淋巴结转移、肿瘤大小及患者年龄均无显著性差异(均P>0.05)。结论ALDH1蛋白随着宫颈癌的进展表达逐渐增加,提示其可能作为癌基因参与宫颈癌的发生发展。
宫颈浸润癌;宫颈上皮内瘤样病变;乙醛脱氢酶1;肿瘤干细胞
[Abstract]ObjectiveToinvestigatetheexpressionsofALDH1innormalcervixtissues,cervicalintraepithelialneoplasiatissuesandinvasivecervicalcancertissuesanditssignificance.MethodsTheexpressionsofALDH1proteininHeLa,SiHa,C33A,CaSkiandHT-3cancercelllinesweredetectedbyimmunocytochemistryanalysis,andthosein100normalcervixtissues, 100cervicalintraepithelialneoplasiatissues(CIN)and100invasivecervicalcancertissuesweredetectedbyimmunocytochemistryanalysis.Meanwhile,thecorrelationbetweenALDH1expressionandclinicalpathologiccharacteristicsin100cervicalinvasivecancerpatientswasanalyzed.ResultsTheimmunocytochemistryresultsshowedthatthepositiverateofALDH1proteinwas42.24%incervicalcancercelllineC33Aand12.39%inHT-3cells,butnoALDH1proteinwasdetectedinSiHa,HeLaorCaSkicells.ALDH1wasexpressedin28% (28/100)ofthenormalcervicaltissues, 38% (38/100)ofthecervicalintraepithelialneoplasiatissues(CIN)and65% (65/100)oftheinvasivecarcinomatissues.ThepositiverateandIHCscoreofALDH1decreasedgradually(χ2=29.785,P<0.0001).SpearmananalysisshowedthattherelationshipwasofnosignificancebetweenALDH1expressionandclinicalcharacteristics,includingpathologicgrade,clinicalTNMstage,multiplepelviclymphnodemetastasis,tumorsizeandageofcervicalcancerpatients(allP>0.05).ConclusionTheexpressionofALDH1proteinincreasesgraduallywiththeprogressionofcervicalcancer,whichsuggeststhatALDH1mayplayanoncogeneinthedevelopmentandprogressionofcervicalcarcinoma.
[Keywords]cervicalinvasivecancer;cervicalintraepithelialneoplasia(CIN);ALDH1;tumorstemcell
宫颈癌是常见的妇科恶性肿瘤之一,是全球妇女中仅次于乳腺癌和结肠癌的第3种常见恶性肿瘤。在发展中国家,宫颈癌是仅次于乳腺癌第2常见的女性恶性肿瘤,占女性癌症死因的第2位[1]。全球每年大约有529 000妇女被诊断为浸润性宫颈癌,并且有大约250 000死于该病[2]。我国每年约有13.2万宫颈癌新发病例,占世界宫颈癌新发病例总数的28%,位居世界第2(宫颈癌发病率最高的国家是智利),并且有年轻化的趋势。研究证实,宫颈癌的发生与持续性高危型人乳头瘤状病毒(HPV)的感染密切相关,然而有近90%的感染者在2年内自然消退,仅有约10%左右的患者会存在持续性感染,最终仅有不到2%的感染者发展成为浸润性宫颈癌[3]。有少量浸润性宫颈癌患者中未检测到HPV的感染,由此可见除HPV感染之外,其他因素也参与了宫颈癌的发生发展,其中肿瘤相关基因的表达异常在宫颈癌发生发展中的作用备受关注。
乙醛脱氢酶1(ALDH1)是一种负责细胞内乙醛氧化的细胞溶质酶,参与多种组织的分化及基因表达,同时在干细胞早期的分化中具有重要作用。ALDH1在多种肿瘤中的表达上调,包括乳腺癌[4]、胰腺癌[5]、卵巢癌[6-7]和结肠癌[8]等。作为调节干细胞分化的关键蛋白,ALDH1常作为正常干细胞和癌症干细胞的标记,近年来关于ALDH1作为肿瘤干细胞标记的研究在多种肿瘤中一致性的表明,ALDH1阳性的细胞亚群具有致瘤、分化和自我更新等肿瘤干细胞特有的特性,并且通过增加肿瘤细胞耐药、复发与转移等方式[9-10],影响患者的预后[11-12]。在宫颈癌中,ALDH1作为干细胞标志物表达于正常宫颈组织、宫颈癌细胞系及宫颈癌组织中;另外,Yao等[13]的研究显示阳性ALDH1的表达与宫颈癌患者的预后呈正相关。本研究团队以ALDH1为标记,通过流式分选技术从SiHa、C33A及HT-3等宫颈癌细胞系中筛选获得了具有肿瘤干细胞特性的ALDH1阳性细胞群[14];但是,目前ALDH1在宫颈上皮内瘤样病变(cervicalintra-epithelialneoplasia,CIN)组织中的表达及ALDH1在宫颈癌发生发展中的作用尚不清楚。本研究采用免疫组织化学技术结合系统的评分方法,检测分析ALDH1在正常宫颈组织、CIN组织和宫颈癌组织、宫颈癌细胞系中的表达情况及临床意义。
1资料与方法
1.1临床样本的收集
标本选自2012年7月至2014年7月西安交通大学医学院附属3201医院妇科住院的患者,包括正常宫颈组织(normalcervix,NC)、CIN组织、宫颈癌组织(cervicalcancer,CC)各100例;其中,100例宫颈癌患者术前经活检确诊,术前均未经放化疗,手术行全子宫及双侧附件切除+盆腔淋巴结清扫术,术中癌灶切除后于中心部位取病变组织;100例CIN组织来源于行宫颈锥切术患者门诊活检病理资料;100例正常宫颈组织来源于接受因各种良性病变行全子宫切除术或宫颈活检术的患者。本研究中标本的获取均得到患者的知情同意。将300例新鲜标本组织经甲醛固定石蜡包埋,连续切片,厚度为4μm。
1.2主要试剂
鼠抗人ALDH1单克隆抗体购于SantaCruz,USA公司,羊抗鼠SP免疫组织化学试剂盒购于北京中杉生物技术有限公司,DAB显色试剂盒购于北京中杉金桥公司,DMEM(高糖)培养基、RPMI-1640培养基及McCoy's5A培养基均购自GIBCO,USA公司,胎牛血清购自美国GIBCO公司。
1.3宫颈癌细胞的培养
宫颈癌细胞系HeLa、SiHa、C33A、CaSki及HT-3均购自美国模式培养物集存库(AmericanTypeCultureCollection,ATCC)。HeLa、SiHa、C33A采用含10%胎牛血清(fetalbovineserum,FBS)的DMEM高糖培养基,CaSki采用含10%FBS的RPMI-1640培养基,HT-3采用含10%FBS的McCoy’s5A培养基培养。分别将SiHa、C33A、HT-3、HeLa、CaSki细胞置于37℃、5%CO2条件的细胞培养箱中静置培养。待细胞增殖至细胞培养皿底约80%时,弃去培养基,经2.5%胰酶消化用于实验或者传代。
1.4免疫细胞化学和免疫组织化学法
生长状态良好的宫颈癌细胞经常规培养,消化成细胞悬液后,接种于放有无菌载玻片的培养皿中生长2~3天,待细胞长至爬片约80%左右,经4%多聚甲醛固定,0.1%的Triton-X室温孵育15min,PBS洗涤5min×2次,滤纸吸干残余液体,PBS稀释抗体(ALDH1,1:100),加适量一抗至盖过组织,切片置于湿盒中4℃过夜,复温后PBS冲洗5min冲洗×2次后,切片上滴加生物素标记二抗,室温孵育30min,PBS冲洗,DAB显色,梯度酒精脱水,二甲苯透明,设立PBS溶液代替一抗作为阴性对照组。
免疫组织化学采用包埋好的组织块,并将其切成厚度约4μm,严格按试剂盒说明进行操作:组织切片在65℃的烤箱中过夜,经二甲苯脱蜡,梯度酒精脱水后,放入pH6.0的柠檬酸钠修复液,在高压锅中加热至沸腾。把组织切片插在耐高温塑料切片架上,放置在高压锅中,盖上锅盖及压力阀,待压力上升开始喷气时,计时2min,将压力锅移开热源,自然冷却至室温;冷却后取出切片,PBS冲洗5min×2次后,3%的H2O2封闭10min(用纯水配,现用现配),PBS冲洗5min×2次后,滤纸吸干残余液体,PBS稀释抗体(1:100),加适量一抗至盖过组织,切片置于湿盒中4℃过夜,复温后PBS冲洗5min×2次后,切片上滴加生物素标记二抗,室温孵育30min,PBS冲洗,DAB显色,梯度酒精脱水,二甲苯透明,设立PBS溶液代替一抗作为阴性对照组。
1.5结果判断
ALDH1蛋白染色阳性为细胞浆呈棕黄色染色,组织标本的染色结果按ALDH1蛋白在肿瘤组织中有≥1个细胞的表达计为阳性。评分过程由2位经验丰富的病理医师进行双盲阅片,显微镜下计数每个组织10个高倍视野下(1 000倍油镜)的肿瘤细胞数。
1.6统计学方法
采用统计软件SPSS18.0进行数据的录入和分析,计数资料采用χ2检验或方差分析(ANOVA)检验,ALDH1蛋白表达的阳性率与宫颈癌病理参数的相关性采用Spearman线性相关分析,以P<0.05为差异有统计学意义。
2结果
2.1乙醛脱氢酶1蛋白在宫颈癌细胞系中的表达
采用免疫细胞化学的方法检测ALDH1蛋白在宫颈癌细胞系HeLa、SiHa、C33A、CaSki和HT-3中的表达,高背景下随机观察10个视野的阳性百分比,取平均值,结果显示,ALDH1蛋白的表达主要定位宫颈癌细胞的细胞浆中;ALDH1蛋白在C33A中的阳性率约为42.24%,在HT-3细胞中表达的阳性率约为12.39%;而在宫颈癌细胞系Caski、SiHa和HeLa中均未检测到ALDH1蛋白的表达,见图1。
2.2乙醛脱氢酶1蛋白在正常宫颈组织、宫颈上皮内瘤样病变组织及宫颈癌组织中的表达
按照免疫组织化学评分,ALDH1蛋白在正常宫颈组织、CIN组织及宫颈癌组织中表达的阳性率分别为28.00%、38.00%和65.00%;ALDH1蛋白在这3组中的表达差异有统计学意义(χ2=29.785,P=0.000),在宫颈癌组织中的表达均显著高于CIN组织和正常宫颈组织,(χ2=14.593,P=0.000;χ2=27.515,P=0.000);ALDH1蛋白在CIN组织中的表达率高于正常宫颈组织,但两者差异无统计学意义(χ2=2.261,P=0.088)。
进一步分析ALDH1蛋白在各种组织中阳性表达的模式,大致可分为3种类型:点状表达、节段性表达和弥漫性表达,见图2。ALDH1蛋白在正常宫颈组织和CIN组织中的点状表达均显著高于节段性表达和弥漫性表达(χ2=4.421,P=0.028;χ2=14.222,P=0.000),在CIN组织中的点状表达均显著高于节段性表达和弥漫性表达(χ2=8.165,P=0.003;χ2=14.559,P=0.000),提示其可能作为正常宫颈上皮干细胞及CIN进一步发展成为癌细胞的标记蛋白;而在宫颈癌组织中的表达主要为点状表达和弥漫性表达,见表1,这一点与ALDH1作为宫颈癌干细胞的标记具有肿瘤使动和促进增殖的作用是相一致的。
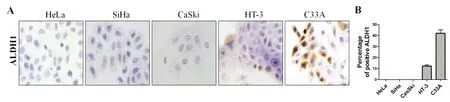
注:A图为ALDH1蛋白在宫颈癌细胞系HeLa、SiHa、CaSki、HT-3和C33A中的表达;B图为ALDH1蛋白阳性表达细胞在5个宫颈癌细胞系中所占的百分率。
图1ALDH1在宫颈癌细胞系中的表达
Fig.1TheexpressionofALDH1incervicalcancercelllines

注:NC为正常宫颈组织;CIN为宫颈上皮样内瘤变;CC为宫颈癌(放大倍数10×100)。ALDH1的阳性表达方式可分为3种类型:点状表达Dot-scatteredexpression;节段性表达Segmentalexpression;弥漫性表达Diffuseexpression。
图2ALDH1蛋白在正常宫颈组织,宫颈上皮内瘤变组织和宫颈癌组织中的表达及模式
Fig.2TheexpressionsandpatternsofALDH1innormalcervix,cervicalintraepithelialneoplasiaandcervicalcancertissues
2.3乙醛脱氢酶1在宫颈癌患者中的表达与临床病理特征的关系
根据100例宫颈癌患者的年龄、临床TNM分期、组织病理分级、盆腔淋巴结转移情况及肿瘤大小的不同,分析ALDH1蛋白表达的临床意义,结果显示,ALDH1在组织病理分级高分化、中分化和低分化组织中的表达阳性率分别为58.33%、67.09%和55.56%(P=0.572);ALDH1蛋白在不同年龄组、TNM临床分期、肿瘤大小及盆腔淋巴结转移中表达中差异均无统计学意义(P>0.05),见表2。

表1 ALDH1在正常宫颈、CIN及宫颈癌组织中的表达[n(%)]
表2ALDH1表达与100例宫颈癌患者的临床病理
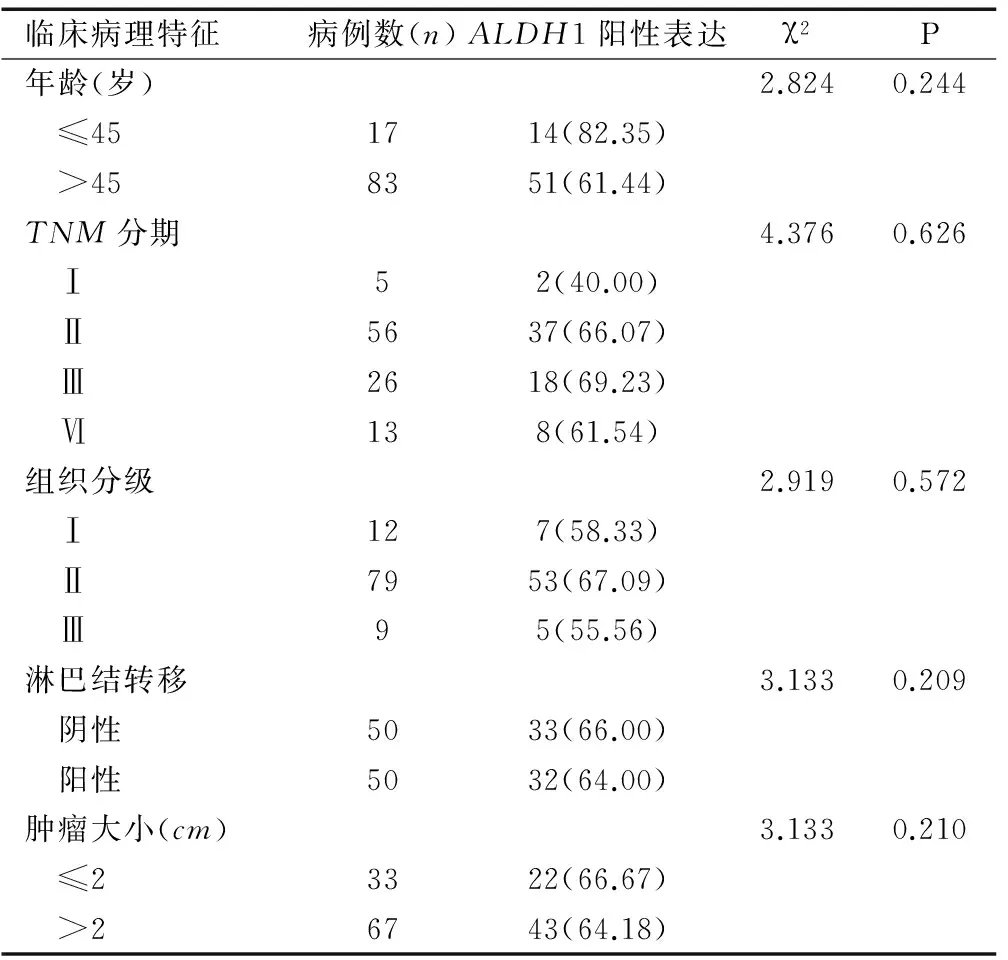
特征关联性[n(%)]Table 2 The correlation between ALDH1 expression and pathologicalcharacteristics of 100 cervical cancer patients[n(%)]
3讨论
醛脱氢酶(aldehydedehydrogenase,ALDH)是近年来新发现的正常干细胞及肿瘤干细胞的功能标记蛋白。ALDH是醛类代谢过程中的酶,能将醛类氧化为相应的羧酸,发挥解毒功能。视黄醛是ALDH1的主要底物,在ALDH的催化下氧化为维甲酸,进而调控细胞分化。目前以ALDH为标记蛋白已从多种实体瘤中分离鉴定出肿瘤干细胞,包括乳腺癌[15]、前列腺癌[16]、宫颈癌[14]、胰腺癌[17]、结肠癌[18-19]、膀胱癌[20]等。以ALDH1为标记筛选获得的宫颈癌细胞亚群具有促进肿瘤细胞增殖、分化及自我更新的肿瘤干细胞特性,因此推测ALDH1在宫颈癌发生发展中可能发挥癌基因的作用。
在SiHa、C33A、HT-3、HeLa、CaSki5个宫颈癌细胞系中,ALDH1表现出不同水平的表达程度,在C33A和HT-3中检测到了ALDH1的表达,而在SiHa、HeLa和CaSki中未检测到ALDH1的表达。本课题组在前期采用ALDEFLUOR试剂盒结合流式技术在SiHa、C33A、CaSki和HT-3中筛选获得了ALDH1阳性的具有肿瘤干细胞特性的宫颈癌细胞群,这与该实验中ALDH1在宫颈癌细胞系中表达水平似乎不太一致,这一点可能是由于免疫细胞化学检测的灵敏度较流式细胞抗体检测稍差的原因。在宫颈癌临床标本中采用免疫组化方法,检测ALDH1蛋白表达的差异及临床意义,结果显示,ALDH1蛋白的表达主要定位于细胞浆,ALDH1蛋白在正常宫颈组织,宫颈CIN组织及宫颈癌这3组的表达差异有统计学意义(P=0.000),在宫颈癌组织中的表达均显著高于CIN组织和正常宫颈组织(均P=0.000),ALDH1蛋白在CIN组织中的表达率高于正常宫颈组织,但两者差异无统计学意义(P=0.088)。
进一步分析发现ALDH1蛋白在正常宫颈上皮基底细胞高表达,在宫颈癌组织中呈散在点状表达或弥漫性表达。基底细胞是公认的正常宫颈干细胞,ALDH1可能作为正常宫颈干细胞及宫颈癌干细胞的标记,而宫颈癌组织中散在点状表达符合肿瘤干细胞的特点,这一点与ALDH1作为宫颈癌干细胞的标记具有肿瘤使动和促进增殖的作用是相一致的。以上结果表明,ALDH1蛋白在宫颈癌组织中呈点状或弥漫性高表达,提示其作为癌基因或肿瘤干细胞标记参与宫颈癌的发生与发展。因此猜测ALDH1可能加速了正常宫颈组织向宫颈癌组织的转化,ALDH1阳性的宫颈癌细胞可能由ALDH1阳性的储备细胞突变而来。
研究表明ALDH1作为乳腺癌干细胞的标记,与乳腺癌患者治疗的耐药性与预后相关[21],另外,其高表达被认为与多种肿瘤包括膀胱癌[11]、肺癌[22]、卵巢癌[23]及宫颈癌[13]的预后有显著性关系。其机制可能为通过维持肿瘤中癌干细胞亚群,促进肿瘤转移及抵抗放化疗作用有关。本研究中比较了不同临床病理参数分类下ALDH1蛋白的表达,结果均未发现有显著性差异。这一点提示ALDH1蛋白在宫颈癌中的作用可能主要体现在其发生过程中。
综上,本研究显示ALDH1蛋白在宫颈癌组织中的表达显著高于正常宫颈组织和CIN组织,ALDH1在宫颈癌组织中的表达与宫颈癌患者的年龄、组织病理分级、临床TNM分期、盆腔淋巴结转移情况及肿瘤大小均无关联。本研究为ALDH1在宫颈癌发生发展中的分子病因学提供了理论基础及靶向治疗的方向,而其是否通过影响宫颈癌中癌干细胞的增殖转化发挥作用及其与宫颈癌患者预后的关系仍需进一步探讨。
[1]JemalA,BrayF,CenterMM, et al.Globalcancerstatistics[J].CACancerJClin, 2011, 61(2): 69-90.
[2]TaylorK,GordonN,LangleyG, et al.Estimatesforworldwidelaboratoryanimalusein2005[J].AlternLabAnim, 2008,36(3):327-342.
[3]CarterJR,DingZ,RoseBR.HPVinfectionandcervicaldisease:areview[J].AustNZJObstetGynaecol, 2011,51(2):103-108.
[4]MadjdZ,RamezaniB,MolanaeS, et al.HighexpressionofstemcellmarkerALDH1isassociatedwithreducedBRCA1ininvasivebreastcarcinomas[J].AsianPacJCancerPrev, 2012, 13(6): 2973-2978.
[5]VoglerT,KrieglL,HorstD, et al.Theexpressionpatternofaldehydedehydrogenase1(ALDH1)isanindependentprognosticmarkerforlowsurvivalincolorectaltumors[J].ExpMolPathol, 2012, 92(1): 111-117.
[6]AyubTH,Keyver-PaikMD,DebaldM, et al.AccumulationofALDH1-positivecellsafterneoadjuvantchemotherapypredictstreatmentresistanceandprognosticatespooroutcomeinovariancancer[J].Oncotarget, 2015, 6(18): 16437-16448.
[7]SunY,JiaX,WuX.HighExpressionsofLgr5andALDH1inPrimaryEpithelialOvarianCancerCorrelatewithAdvancedTumorStageandGradeaswellasPoorPrognosisofthePatients[J].GynecolObstetInvest, 2015, 4(1): 6437-6448.
[8]ZhouF,MuYD,LiangJ, et al.ExpressionandprognosticvalueoftumorstemcellmarkersALDH1andCD133incolorectalcarcinoma[J].OncolLett, 2014, 7(2): 507-512.
[9]YouQ,GuoH,XuD.DistinctprognosticvaluesandpotentialdrugtargetsofALDH1isoenzymesinnon-small-celllungcancer[J].DrugDesDevelTher, 2015, 9(2): 5087-5097.
[10]YaoT,LuR,LiY, et al.ALDH1mightinfluencethemetastaticcapabilityofHeLacells[J].TumourBiol,2015,36(9):7045-7051.
[11]XuN,ShaoMM,ZhangHT,et al.Aldehydedehydrogenase1(ALDH1)expressionisassociatedwithapoorprognosisofbladdercancer[J].CancerEpidemiol,2015,39(3):375-381.
[12]WuS,XueW,HuangX, et al.DistinctprognosticvaluesofALDH1isoenzymesinbreastcancer[J].TumourBiol, 2015, 36(4): 2421-2426.
[13]YaoT,WuZ,LiuY, et al.Aldehydedehydrogenase1(ALDH1)positivitycorrelateswithpoorprognosisincervicalcancer[J].IntMedRes,2014,42(4):1038-1042.
[14]LiuSY,ZhengPS.Highaldehydedehydrogenaseactivityidentifiescancerstemcellsinhumancervicalcancer[J].Oncotarget,2013,4(12):2462-2475.
[15]GinestierC,HurMH,Charafe-JauffretE, et al.ALDH1isamarkerofnormalandmalignanthumanmammarystemcellsandapredictorofpoorclinicaloutcome[J].CellStemCell,2007,1(5):555-567.
[16]VandenHoogenC,VanderHorstG,CheungH, et al.Highaldehydedehydrogenaseactivityidentifiestumor-initiatingandmetastasis-initiatingcellsinhumanprostatecancer[J].CancerRes, 2010, 70(12):5163-5173.
[17]KimMP,FlemingJB,WangH, et al.ALDHactivityselectivelydefinesanenhancedtumor-initiatingcellpopulationrelativetoCD133expressioninhumanpancreaticadenocarcinoma[J].PLoSOne, 2011, 6(6):206-216.
[18]HuangEH,HynesMJ,ZhangT, et al.Aldehydedehydrogenase1isamarkerfornormalandmalignanthumancolonicstemcells(SC)andtracksSCoverpopulationduringcolontumorigenesis[J].CancerRes, 2009, 69(8):3382-3389.
[19]CarpentinoJE,HynesMJ,AppelmanHD, et al.Aldehydedehydrogenase-expressingcolonstemcellscontributetotumorigenesisinthetransitionfromcolitistocancer[J].CancerRes, 2009, 69(20):8208-8215.
[20]SuY,QiuQ,ZhangX, et al.Aldehydedehydrogenase1A1-positivecellpopulationisenrichedintumor-initiatingcellsandassociatedwithprogressionofbladdercancer[J].CancerEpidemiolBiomarkersPrev, 2010,19(2): 327-337.
[21]GoudarziPK,MehrabiF,KhoshnoodRJ, et al.Expressionandprognosticvalueofthealdehydedehydrogenase1(ALDH1)andN-mycdownstreamregulatedgene2(NDRG2)aspotentialmarkersinhumanastrocytomas[J].TumourBiol, 2015, 16(2): 307-315.
[22]HuoW,DuM,PanX, et al.PrognosticvalueofALDH1expressioninlungcancer:ameta-analysis[J].IntJClinExpMed, 2015, 8(2):2045-2051.
[23]HuangR,LiX,HolmR, et al.Theexpressionofaldehydedehydrogenase1(ALDH1)inovariancarcinomasanditsclinicopathologicalassociations:aretrospectivestudy[J].BMCCancer, 2015, 15(2): 502-505.
[专业责任编辑:安瑞芳]
Expression of ALDH1 in cervical carcinoma and its significance
ZHANG Li1,2, YANG Wen-ting1, ZHENG Peng-sheng1,3
(1.DepartmentofReproductiveMedicine,FirstAffiliatedHospitalofXi’anJiaotongUniversity,ShaanxiXi’an710061,China;2.DepartmentofGenecology, 3201AffiliatedHospital,MedicalSchoolofXi’anJiaotongUniversity,ShaanxiHanzhong723000,China;3.KeyLaboratoryofEnvironmentandGenesRelatedtoDiseasesofMinistryofEducation,MedicalSchoolofXi’anJiaotongUniversity,ShaanxiXi’an710061,China)
2015-12-21
张丽(1979-),女,副主任医师,在读硕士研究生,在西安交通大学医学院附属3201医院妇科工作,主要从事妇科肿瘤的研究。
郑鹏生,教授。
10.3969/j.issn.1673-5293.2016.01.016
R737.33
A
1673-5293(2016)01-0045-04
