软骨组织工程软骨细胞分离方式的优化
2016-09-22龚忠诚宁晓婷高芸竹林兆全
邵 博, 占 琼, 龚忠诚, 宁晓婷, 杨 萌, 王 玥, 胡 鑫, 高芸竹, 林兆全
(新疆医科大学第一附属医院1颌面肿瘤外科·新疆医科大学口腔医院·新疆维吾尔自治区口腔医学研究所, 2科研教育中心研究生管理科,
·基础医学研究·
软骨组织工程软骨细胞分离方式的优化
邵博1, 占琼2, 龚忠诚1, 宁晓婷1, 杨萌1, 王玥1, 胡鑫1, 高芸竹3, 林兆全1
(新疆医科大学第一附属医院1颌面肿瘤外科·新疆医科大学口腔医院·新疆维吾尔自治区口腔医学研究所,2科研教育中心研究生管理科,
3中心手术室, 乌鲁木齐830054)
目的探讨不同软骨分离方法获得软骨细胞的细胞存活率及细胞数量,优化软骨细胞获取方法。方法采用SD大鼠20只,获取关节软骨,机械剪碎后称重,每组使用相同重量的软骨组织(1 g),4组采用不同方法获取软骨细胞:实验1组: 0.25%胰蛋白酶消化3 h, 0.2%Ⅱ型胶原酶消化10 h。实验2组:4℃下0.25%胰蛋白酶消化12 h, 0.25%胰蛋白酶消化72 h。实验3组: 0.2%Ⅱ型胶原酶消化16 h。实验4组:0.08%Ⅱ型胶原酶消化12 h。加入原代细胞培养液进行体外培养增殖。使用化学特殊染色法鉴定获取细胞是否为软骨细胞。计算每组软骨细胞存活率及细胞数。结果经过4种方法消化细胞,所获得细胞在外形上无明显差异,细胞均呈四方形,甲苯胺蓝染色鉴定所获取细胞为软骨细胞。细胞存活率:实验1组:原代(P0)为(79.6±2.1) %,一代(P1)为(78.6±8.4) %,三代(P3)为(82.7±2.1) %。实验2组:P0为(81.0±6.9) %,P1为 (80.7±3.5) %,P3为(85.0±3.0) %。实验3组:P0为(84.7±4.0) %,P1为(85.3±1.2) %,P3为(89.7±2.5) %。实验4组:P0为(82.0±2.6) %,P1为(79.0±7.8) %,P3为(86.3±2.5) %,实验3组的细胞存活率明显高于其他3组,差异具有统计学意义(P<0.05)。活细胞数:实验1组(364 776±81 743) 个,实验2组(306 111±49 768) 个,实验3组(472 580±42 644) 个,实验4组(361 906±78 405) 个,实验3组的活细胞数明显高于其他3组,差异具有统计学意义(P均<0.05)。结论4种实验方法均能获取一定数量的软骨细胞,0.2%Ⅱ型胶原酶消化16 h的方法在细胞存活率及细胞数量均高于其他方法,适合用于软骨组织工程中软骨细胞的获取。
组织工程; 关节软骨; 软骨细胞; 消化法; 细胞外基质
骨关节炎是一种进行性的退行性病变,其特点是造成软骨退化、软骨下骨改建、滑膜炎和慢性疼痛[1]。软骨细胞是疾病过程中的靶细胞。通常小的软骨缺损可以通过手术进行软骨修复,如自体软骨移植等[2-3],但该方法的缺点诸多,如可能有术后瘢痕、疼痛、感染、术区愈合不良等风险。此法获取的软骨数量太少或太坚硬,无法达到修复和功能重建[4-5]。随着软骨组织工程的兴起,通过体外构建,软骨植入缺损区域可以达到较好的修复的效果[6]。软骨细胞是软骨组织工程中一个重要的种子细胞,但在软骨组织中,软骨细胞包绕在致密的细胞外基质当中,且软骨细胞较少,必须在体外扩增至一定数量才能满足用量。但是软骨细胞随着增殖和传代时间的延长,细胞会逐渐出现老化的迹象,如原本呈四方形的细胞会成圆形扁平状。同时软骨细胞特异地表达Ⅱ型胶原也会逐渐地表达Ⅰ型胶原,此现象为去分化,使用这种软骨细胞无法达到生物力学的要求[7]。获取良好的软骨细胞成为重中之重,本研究采用4种不同的酶消化法获取软骨细胞,旨在探讨能获取较多数量的细胞及较高的成活率的方法。
1 材料与方法
1.1主要仪器与试剂恒温细胞培养箱(Heal Froce,香港),细胞培养无菌台(AIRTECH,中国),电子天平(赛多利斯,中国),倒置显微镜(Leica,德国),离心机(Eppendorf,德国),-80℃超低温冰箱(Thermo,美国),-20℃冰箱(海尔,中国),全波长酶标仪(Thermo,美国),H-DMEM培养基、胎牛血清、PBS(Hyclone,美国)。甲苯胺蓝染色试剂(上海生工,中国)。
1.2实验动物健康雄性SD大鼠20只,体质量180~220 g,由新疆医科大学实验动物中心提供,SPF级,生产许可证号:SCXK(新) 2003-001。
1.3实验方法
1.3.1软骨细胞培养取雄性大SD鼠20只,脱臼处死后用75% 乙醇严格消毒术区,于双侧膝关节获取关节软骨,浸泡于含双抗DMEM中,机械剪碎后称重,每组使用相同重量的软骨组织(1 g)。实验分为4组:实验1组:0.25%胰蛋白酶消化3 h,0.2%Ⅱ型胶原酶消化8~12 h。实验2组:4℃下0.25%胰蛋白酶消化12 h, 0.25%胰蛋白酶消化72 h。实验3组: 0.2%Ⅱ型胶原酶消化16 h。实验4组:0.08%Ⅱ型胶原酶消化12 h[8-11]。原代获得细胞用含15%胎牛血清的DMEM置37℃,体积分数为5% CO2培养箱中培养。每3 天换液1次。待细胞达80%~90%融合时,胰酶消化以1传3 进行传代培养。
1.3.2形态学观察大鼠软骨细胞原代与传代培养后,每2 天用倒置显微镜观察后拍照。待细胞贴壁爬片后用40 g/L多聚甲醛固定20 min,行甲苯胺蓝染色,显微镜下观察细胞形态并拍照。


2 结果
2.1细胞形态及甲苯胺蓝染色P0软骨细胞在未贴壁之前呈圆球形,悬浮于培养液中,4~7 h基本贴壁,部分细胞开始伸展,细胞体积较小,单核,24 h后基本全部贴壁生长,散在生长。随着培养时间的延长,部分细胞出现分裂相(图1a)。当细胞传至P1后,细胞呈长梭形,多角,呈明显的“铺路石”,部分细胞集落已形成复层(图1b)。传至P3可见形态均一,呈多角形细胞(图1c)。P0、P1、P3细胞进行甲苯胺蓝染色,倒置显微镜下见:细胞外基质均匀,细胞外基质及细胞核均被染成深蓝色,证实所获细胞为软骨细胞(图1d)。
2.2细胞存活率及细胞数实验1组细胞存活率:P0为(79.6±2.1) %,P1为(78.6±8.4) %,P3为(82.7±2.1) %。实验2组:P0为(81.0±6.9) %,P1为(80.7±3.5) %、P3为(85.0±3.0) %。实验3组:P0为(84.7±4) %,P1为(85.3±1.2) %,P3为(89.7±2.5) %。实验4组:P0为(82.0±2.6) %,P1为(79.0±7.8) %,P3为(86.3±2.5) %,实验3组的细胞存活率明显高于其他3组,差异有统计学意义(P均<0.05),见图2。4组活细胞数分别为(364 776±81 743)、(306 111±49 768)、 (472 580±42 644)、 (361 906±78 405)个。实验3组的细胞数高于其他3组,差异有统计学意义(P均<0.05),见图3。

a: P0细胞(50×)

b: P1细胞(50×)
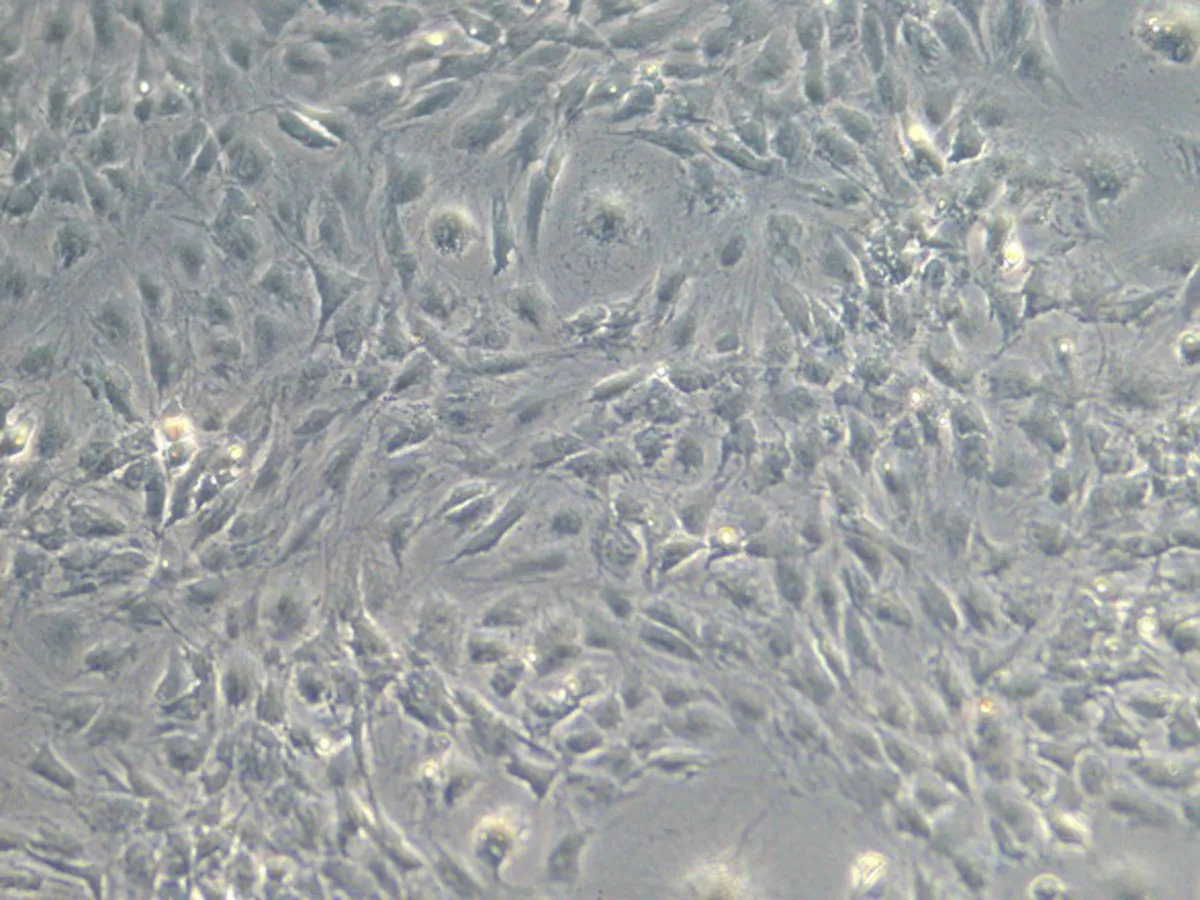
c: P3细胞(100×)
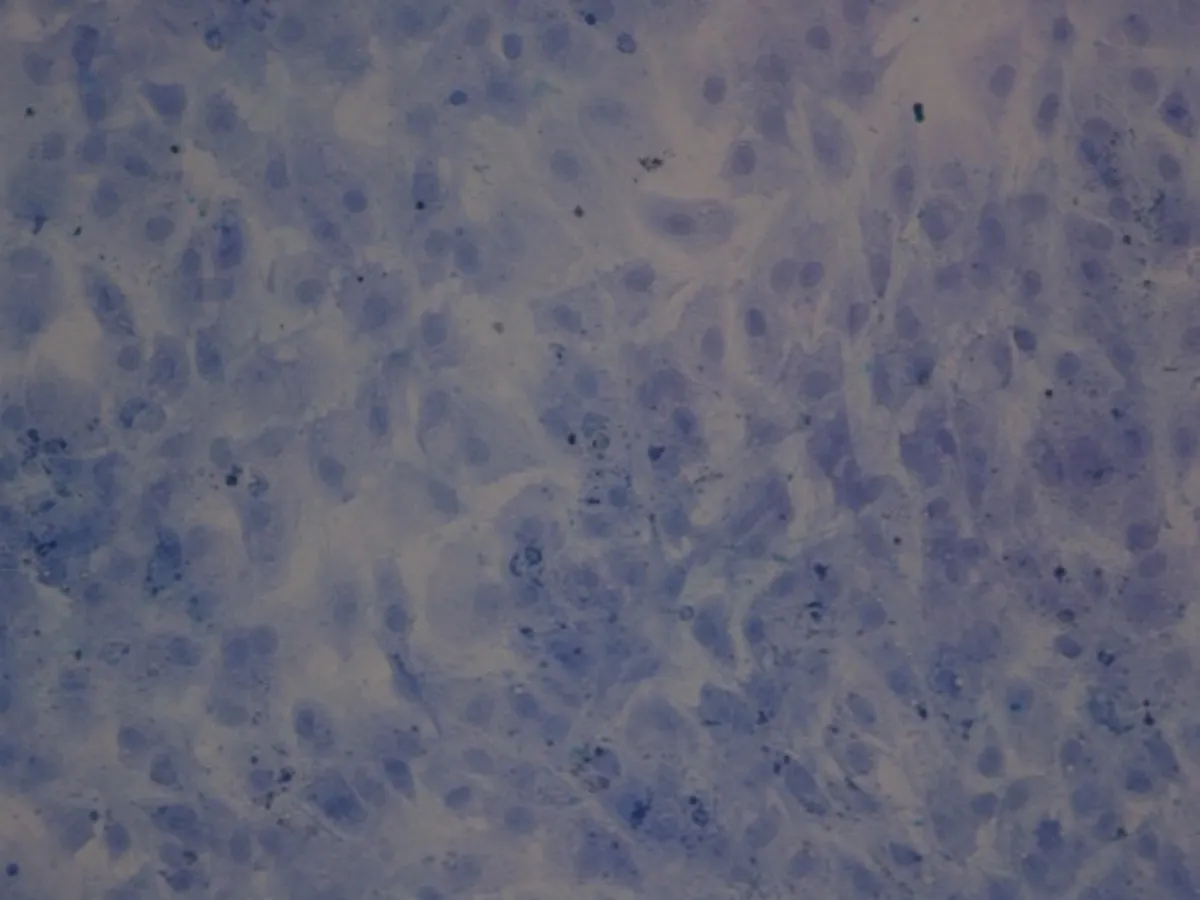
d: P3细胞甲苯胺蓝染色(100×)
图1细胞形态及甲苯胺蓝染色
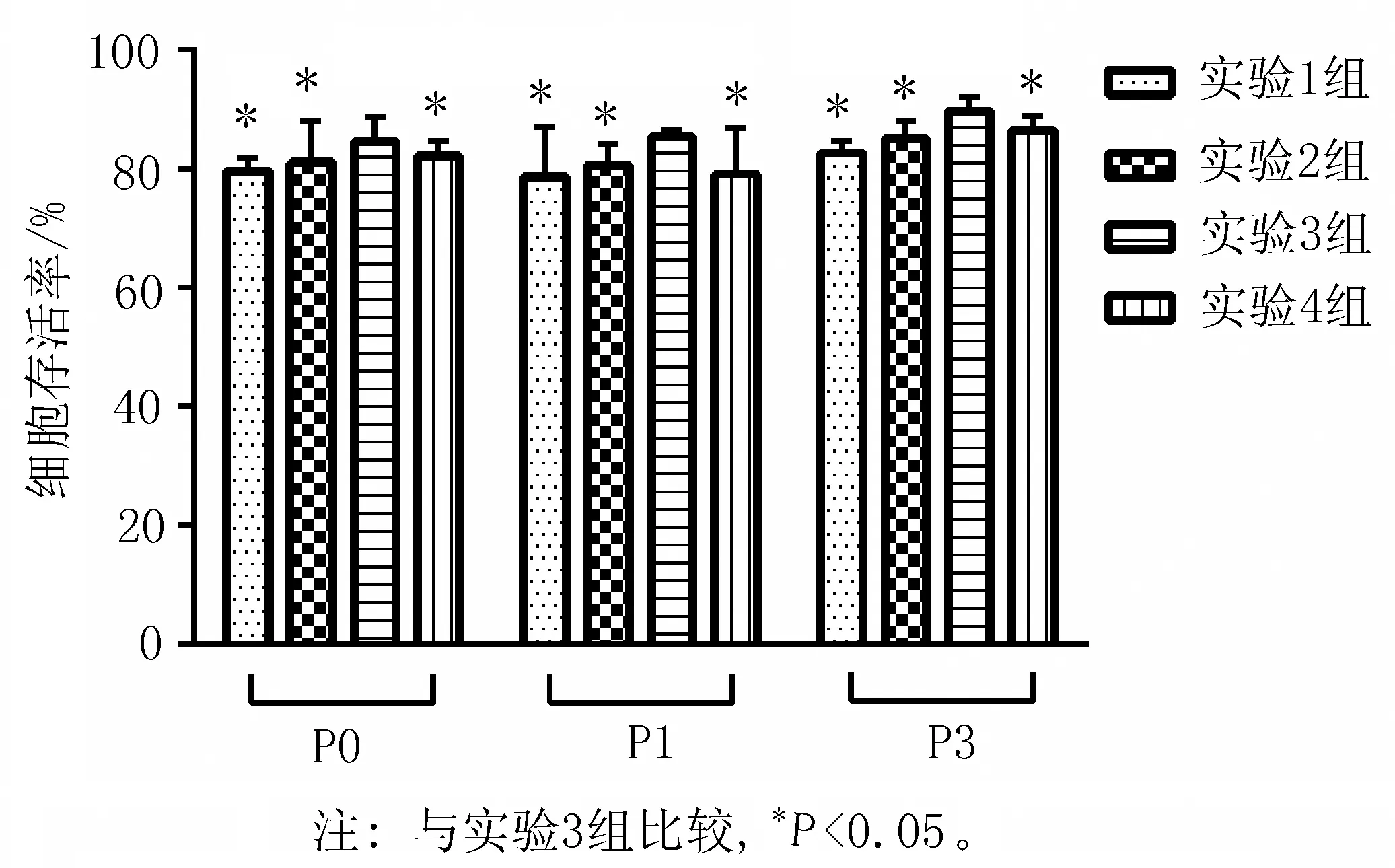
图2 实验组细胞存活率

图3 实验组原代细胞数
3 讨论
软骨细胞的分离是软骨组织工程研究和治疗的一个具有争议的问题,每个实验室都有自己独特的分离培养方法,其中包括使用不同的酶、消化时间以及温度[12]。软骨细胞离体后开始了去分化过程,表现为软骨特异性基因表达降低,成纤维细胞特异性基因表达增多,因此在培养至P3之后软骨细胞就失去其特性,在形态学观察中,软骨细胞由原来的四方形变成成纤维的细胞外形[13-14]。有研究证实正常人的软骨细胞在体外培养 5代以后出现去分化现象,骨关节炎软骨细胞增殖慢,生物学特征改变[15]。
软骨细胞及细胞外基质共同构成了关节软骨的主要成分。软骨不含血管,软骨细胞主要靠关节腔内滑膜分泌的滑液获取营养,且成熟的软骨细胞被完全包裹在大量的细胞外基质中而无法迁移或增殖。因此,获得软骨细胞相对其他组织的细胞较难[16]。在软骨组织中,软骨细胞是重要的种子细胞。为了扩大种子细胞的数量,改进培养方法能在较短的时间内简单地培养出大量纯化的软骨细胞成为研究者重点关注的问题。因此本研究对比4种不同获取细胞的方法,参考文献[8-11]中的消化方法,使用相同的物种、相同质量的软骨组织对其进行后续研究。实验操作上,实验1组、实验2组较为复杂,需要通过2种不同的消化酶消化细胞,增加了实验的操作难度,并且细胞容易受到污染。结果表明实验1组和实验2组相对其他方法获得P0细胞成活率和活细胞数相对较少,原因可能在于使用消化酶的种类过多和消化时间较长,二者同时作用于细胞后,导致活细胞死亡。大量的胶原酶分解细胞外基质后也对细胞造成了一定的损害,因此在细胞成活率及细胞数上较其他组少。考虑到临床及科研应用方面,简单、时效的方法是首先推荐的。本研究实验结果证实,增加了消化步骤并没有得到较多数量的细胞,因此没有必要增加消化步骤。实验3组细胞存活率及细胞数都明显多于其他3组,且使用方法较为简单,用时较少,相对于其他3组较为有效。实验结果表明如果软骨细胞游离于消化液中超过24 h,便开始加速死亡时间。软骨细胞离开其原本特异的生存环境后,尽管能在体外通过使用营养液获得了大量的细胞,但是细胞的性质也在发生相对应的改变。
综上所述,4种实验方法均能获取一定数量的软骨细胞,0.2%Ⅱ型胶原酶消化16 h的方法在细胞存活率及细胞数量均高于其他方法,适用于软骨组织工程中获取软骨细胞。
[1]Wang XD, Zhang JN, Gan YH, et al. Current understanding of pathogenesis and treatment of TMJ osteoarthritis[J]. J Dent Res,2015,94(5):666-673.
[2]Kalladka M, Quek S, Heir G, et al. Temporomandibular joint osteoarthritis: diagnosis and long-term conservative management: a topic review[J]. J Indian Prosthodont Soc,2014,14(1):6-15.
[3]Li Y, Zhang F, Zeng C, et al. Autophagy in osteoarthritis[J]. Joint Bone Spine,2016,83(2):143-148.
[4]Schultz-Coulon HJ, Stange T, Neumann A. The risks of autogenous cartilage grafting in laryngotracheal reconstruction in adults[J]. HNO,2011,59(1):45-54.
[5]Chang JS, Becker SS, Park SS. Nasal reconstruction: the state of the art[J]. Curr Opin Otolaryngol Head Neck Surg,2004,12(4):336-343.
[6]Zhu W, Ma X, Gou M, et al. 3D printing of functional biomaterials for tissue engineering[J]. Curr Opin Biotechnol,2016,40:103-112.
[7]Chung C, Mesa J, Miller GJ, et al. Effects of auricular chondrocyte expansion on neocartilage formation in photocrosslinked hyaluronic acid networks[J]. Tissue Eng,2006,12(9):2665-2673.
[8]刘明东,盛天金,王万宗. 胰蛋白酶及Ⅱ型胶原酶消化获取关节软骨细胞[J]. 中国组织工程研究与临床康复,2010,(46):8551-8554.
[9]崔小平,张永红,薛军. 胰蛋白酶法和Triton X-100法脱猪软骨细胞的比较[J]. 中国组织工程研究与临床康复,2009,13(46):9080-9083.
[10]Tallheden T, van der Lee J, Brantsing C, et al. Human serum for culture of articular chondrocytes[J]. Cell Transplant,2005,14(7):469-479.
[11]Rotter N, Bonassar LJ, Tobias G, et al. Age dependence of cellular properties of human septal cartilage: implications for tissue engineering[J]. Arch Otolaryngol Head Neck Surg,2001,127(10):1248-1252.
[12]Hidvegi NC, Sales KM, Izadi D, et al. A low temperature method of isolating normal human articular chondrocytes[J]. Osteoarthritis Cartilage,2006,14(1):89-93.
[13]Darling EM, Athanasiou KA. Rapid phenotypic changes in passaged articular chondrocyte subpopulations[J]. J Orthop Res,2005,23(2):425-432.
[14]Schulze-Tanzil G, de Souza P, Villegas CH, et al. Redifferentiation of dedifferentiated human chondrocytes in high-density cultures[J]. Cell Tissue Res,2002,308(3):371-379.
[15]Chung C, Mesa J, Miller GJ, et al. Effects of auricular chondrocyte expansion on neocartilage formation in photocrosslinked hyaluronic acid networks[J]. Tissue Eng,2006,12(9):2665-2673.
[16]Hubka KM, Dahlin RL, Meretoja VV, et al. Enhancing chondrogenic phenotype for cartilage tissue engineering: monoculture and coculture of articular chondrocytes and mesenchymal stem cells[J]. Tissue Eng Part B Rev,2014,20(6):641-654.
(本文编辑杨晨晨)
Optimization of chondrocyte isolation for cartilage tissue engineering
SHAO Bo1, ZHAN Qiong2, GONG Zhongcheng1, NING Xiaoting1, YANG Meng1, WANG Yue1,HU Xin1, GAO Yunzhu3, LIN Zhaoquan1
(1DepartmentofOralandMaxillofacialSurgery·TheXinjiangUygurAutonomousRegionInstituteofOralMedicine·StomatologicalHospitalofXinjiangMedicalUniversity,2DepartmentofGraduateManagement,3DepartmentofCentralOperatingRoom,TheFirstAffiliatedHospitalofXinjiangMedicalUniversity,Urumqi830054,China)
OojectiveTo investigate the optimized chondrocyte isolation method. MethodsThe chondrocytes were obtained from the same quality of rat knee jointscartilage and cut into pieces, then adopted the differet enzyme digestion method from reference. Toluidine bluestaining were used to identify the articular cartilage and thenassess cell viability and the number of cells in each group. ResultsArticular cartilage were successfully isolated from different digestion methods. No significant differences in cell morphology which represented a square-like appearance. Four groups were expressed in cartilage-specific staining. Cell viability were P0 (79.6±2.1)%, P1(78.6±8.4)%, P3(82.7±2.1)% in group 1; P0(81.0±6.9)%, P1(80.7±3.5)%, P3(85.0±3.0)% in group 2; P0(84.7±4.0)%, P1(85.3±1.2)%, P3(89.7±2.5)% in group 3; P0(82.0±2.6)%, P1(79.0±7.8)%, P3(86.3±2.5)%(P<0.05) in group 4. Number of viable cells were:(364 776±81 743) in group 1,(306 111±49 768) in group 2,(472 580±42 644) in group 3,(361 906±78 405)(P<0.05)in group 4, respectively. The third group were the highest of cell viability and cell number and which had statistically significant in all groups. ConclusionThough all groups can harvest chondrocytes, group 3 were higher than other groups in cell survival rate and cell number, so it is suitable for use in cartilage tissue engineering.
tissue engineering; articular cartilage; chondrocytes; extracellular matrix ;digestion method
国家自然科学基金(31260229); 新疆维吾尔自治区青年科技创新人才培养工程项目(2014721046)
邵博(1986-),男,硕士,住院医师,研究方向:颞下颌关节疾病及软骨组织工程。
龚忠诚,男,博士,副主任医师,教授,博士生导师,研究方向:口腔颌面部良恶性肿瘤及颞下颌关节的临床与基础,E-mail:565249755@qq.com。
R782.6
A
1009-5551(2016)09-1139-04
10.3969/j.issn.1009-5551.2016.09.015
2015-11-16]
