两株少孢节丛孢菌在不同培养基中的形态学差异及生长特性
2016-09-21黎晓珊陈明月彭建伟陈春蓉蔡葵蒸马忠仁
刘 伟,许 强,黎晓珊,李 清,陈明月,韩 元,彭建伟,陈春蓉,王 帆,蔡葵蒸,马忠仁
(西北民族大学生命科学与工程学院,甘肃兰州 730030)
两株少孢节丛孢菌在不同培养基中的形态学差异及生长特性
刘伟,许强,黎晓珊,李清,陈明月,韩元,彭建伟,陈春蓉,王帆,蔡葵蒸*,马忠仁*
(西北民族大学生命科学与工程学院,甘肃兰州 730030)
为了观察捕食线虫性真菌少孢节丛孢菌不同分离株在不同培养基中的形态学特性及生长情况,将少孢节丛孢菌分离株DH 066和F 107接种于10 g/L麸皮琼脂(WBA)培养基、10 g/L玉米粉琼脂(CMA)培养基、20 g/L葡萄糖离子琼脂(DIA)培养基和20 g/L葡萄糖琼脂(DA)培养基中,置于25 ℃恒温箱培养,观察不同分离株在不同培养基中的形态学特性并测定其产孢量。对2个分离株在6种不同培养基中菌丝生长长度每天进行定时测量。结果表明,该菌在4种培养基中的特征为分生孢子梨形至倒卵形,1个分隔,偶见2个分隔,分生孢子梗无色,直立,分隔,偶见分枝,分生孢子在10 g/L WBA产量最大。此外,对2个分离株在不同培养基中生长速度研究表明,该菌在10 g/L麸皮自来水琼脂(WBWA)培养基和10 g/L玉米粉自来水琼脂(CMWA)培养基中生长最快。
捕食线虫性真菌;少孢节丛孢菌;形态学特性
节丛孢属(Arthrobotrys)最早是由Corda于1839根据模式种多孢节丛孢菌(A.superba)而建立,少孢节丛孢菌(A.oligospora)是Fresenius于1852年首次发现,但当时并没有发现其具有捕食能力,直到1888年,Zopf才观察到该菌捕食线虫,并对黏性网进行了描述。A.oligospora是广泛分布于自然界的一种捕食线虫性真菌,从土壤、牛羊粪便、粪堆、烂菜叶、垃圾和水中[1-5]都曾分离到,并且是大部分栖息地中的优势种,说明该菌具较强的抵抗外界环境变化的能力及对环境适应能力强。
国内外对捕食线虫性真菌A.oligospora已进行了大量的研究,如用传统分类法对A.oligospora进行鉴定[6-9], Jansson H B等[10]、满达等[11]通过扫描电镜对A.oligospora的形态和分生孢子直接产生捕食结构及捕食全过程的动态学进行了观察,Murray D S等[12]用微分干涉差显微镜对其捕食过程中刺入阶段形成的感染球(初级感染球和二级感染球)进行详细观察和描述,但没有记载A.oligospora能产生2个隔的分生孢子及分生孢子梗分枝的现象。杨玉琴等[13]、Singh R K等[14]对在不同温度、不同pH及不同培养基生长的理化特性进行研究,但未记载A.oligospora在麸皮培养基中菌丝生长状况及分生孢子产量的研究。
虽然国内对该菌有不少研究,但由于每株菌来源不同、分离地地理环境、气候不同,对该菌的形态学及生物学特性也存在差异,DH 066和F 107来源于粪堆和新鲜粪便,说明已经通过1次消化道。鉴于此,本试验对生长于4种不同培养基的DH 066和F 107进行详细的形态学观察和在6种培养基中生长状况进行研究,以便为今后利用捕食线虫性真菌进行家畜体内寄生虫的生物防治提供候选菌种。
1 材料与方法
1.1材料
1.1.1菌种捕食线虫性真菌——少孢节丛孢菌(A.oligospora)分离株DH 066是从浙江省温州市平阳县地区粪堆中分离纯化获得,分离株F 107是从吉林省长春市绿园区城地区新鲜绵羊粪便中分离纯化获得。菌种于20 g/L麸皮琼脂斜面培养基4℃保存。
1.1.2培养基20 g/L葡萄糖琼脂(dextrose agar,DA)培养基:称取琼脂粉20 g,加900 mL蒸馏水,121℃高压灭菌20 min后,加入100 mL已用115 ℃高压蒸汽灭菌15 min的含量为200 g/L的葡萄糖,然后倾注于灭菌培养皿中,备用。
20 g/L葡萄糖离子琼脂(dextrose ionized agar,DIA)培养基:称取琼脂粉20 g,MgSO40.5 g,K2HPO41 g,加900 mL蒸馏水,121 ℃高压灭菌20 min后,加入100 mL已用115 ℃高压灭菌15 min的含量为200 g/L的葡萄糖,倒置平皿,备用。
10 g/L麸皮琼脂(wheat bran agar,WBA)培养基:称取新鲜麸皮40 g,加入1 000 mL蒸馏水,微火煮沸1 h后,4层~6层纱布过滤,补蒸馏水至1 000 mL,滤液置于4 ℃冰箱沉淀过夜,虹吸上清液,制成原液。取原液250 mL加蒸馏水至1 000 mL,加入琼脂粉20 g,121 ℃高压灭菌20 min后,倾注于灭菌培养皿中,备用。
10 g/L麸皮自来水琼脂(wheat bran water agar,WBWA)培养基:方法同上,仅将蒸馏水换成自来水。
10 g/L玉米粉琼脂(corn meal agar,CMA)培养基:方法同上,用蒸馏水,麸皮换成玉米粉。
10 g/L玉米粉自来水琼脂(corn meal water agar,CMWA)培养基:方法同上,用自来水。
4 g/L玉米粉琼脂(corn meal agar,CMA)培养基:方法同上,用蒸馏水将40 g/L的玉米粉琼脂原液稀释10倍。
1.2方法1.2.1形态学特征观察将DH 066和F 107接种于10 g/L CMA,25 ℃培养。培养过程中,对该菌菌落特征,分生孢子形态及大小、产孢方式、分生孢子梗大小、捕食结构等进行观察,并按照张克勤等[15],Zhang K Q等[16]的描述进行形态学鉴定。
将保存于20 g/L麸皮斜面培养基的DH 066和F 107先接种在4 g/L CMA平皿上,25℃培养7 d后,再接种于10 g/L WBA,10 g/L CMA,20 g/L DIA,20 g/L DA平皿中央,置于25 ℃培养,3 d后在菌落边缘以30°~50°角倾斜插入灭菌的盖玻片,继续培养,3 d~6 d后待菌丝完全覆盖盖玻片,取出盖玻片用乳酸酚棉蓝染色液制片,在光学显微镜(OLYMPUS,CX21,日本)下观察每株菌在不同培养基中分生孢子和分生孢子梗的形态,并拍照。测量分生孢子的大小(各测50个)。在盖玻片上画0.3 cm×0.3 cm的方格,计分生孢子数,从而推算出每株菌在不同培养基中分生孢子量/cm2,同时计有分枝的分生孢子梗数及分生孢子梗总数,计算分生孢子梗的分枝率。
1.2.2对生长在不同培养基中的两株少孢节丛孢菌进行观察及测量将保存于20 g/L麸皮斜面培养基的DH 066和F 107接种于4 g/L CMA平皿上。25 ℃培养7 d后,用直径为5 mm的打孔器取出同等大小的带有菌丝的琼脂块,接种于10 g/L WBWA,10 g/L WBA,10 g/L CMWA,10 g/L CMA,20 g/L DIA,20 g/L DA平皿中央,每组3个培养皿。将接种后的培养皿置于25 ℃下培养,从接种后第3天(即接种后48 h)开始,每天定时观察并用游标卡尺定点测量1次,最后用如下公式计算菌丝生长长度:
菌丝生长长度(mm)=各组中菌丝当天的菌落直径平均值-5
将统计的数据用GraphPad Prism 6.0作图。
2 结果
2.1在不同培养基中DH 066和F 107的形态
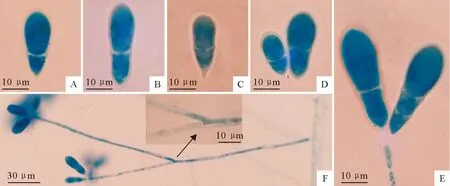
通过对培养于10 g/L CMA的DH 066和F 107进行形态学观察,鉴定这2株菌均为少孢节丛孢菌。培养在不同培养基的DH 066和F 107,其分生孢子大小不同(表1),DH 066在4种培养基中产生的分生孢子大小依次排列为20 g/L DA>20 g/L DIA>10 g/L WBA≈10 g/L CMA,F 107分生孢子大小依次排列为10 g/L CMA>10 g/L WBA≈20 g/L DIA>20 g/L DA(图1和图2)。在4种培养基中的DH 066和F 107的分生孢子均为梨形至倒卵形,1个分隔,偶见2个分隔,具2个分隔的分生孢子约占总体的0.01%(图1E和图2E)。分生孢子梗无色,直立,分隔,偶见分枝,分枝率约为0.4%(图1F和图2F),分生孢子梗顶端具瘤节,分生孢子着生在瘤状突起的小齿梗上。
2.2在不同培养基中DH 066和F 107的分生孢子产量
如图3所示,DH 066和F 107的分生孢子均在10 g/L WBA培养基中产量最大,在20 g/L DA培养基中产量最低,其中F 107在10 g/L WBA中分生孢子产量和在其他3种培养基的产量有显著差异(P<0.05),而DH 066在4种培养基中分生孢子产量差异不显著(P>0.05)。
2.3不同培养基对DH 066和F 107菌丝生长的影响
不同培养基对DH 066和F 107生长速度的影响分别见图4和图5。从图4可知,DH 066在相同的培养温度(25 ℃)下,其生长速度快慢依次排列为10 g/L WBWA≈10 g/L CMWA>10 g/L WBA>20 g/L DIA>10 g/L CMA>20 g/L DA。于10 g/L WBWA和10 g/L CMWA培养基中生长最佳,5 d就已长满整个平皿;20 g/L DA生长最差,10 d才能覆盖整个平皿。从图5可知,F 107在相同的培养温度(25 ℃)下,其生长速度快慢依次排列为10 g/L WBWA>10 g/L CMWA>10 g/L WBA>20 g/L DIA≈10 g/L CMA>20 g/L DA。于10 g/L WBWA培养基中生长最佳,6 d长满整个平皿;20 g/L DA生长最差,10 d还未覆盖整个平皿。往往菌丝在最后1 d生长速度减慢(斜率小),这是由于菌丝长满整个平皿所致。

表1 捕食线虫性真菌少孢节丛孢菌DH 066和F 107在不同培养基中分生孢子的大小

A,B,C,D分别是在10 g/L WBA、10 g/L CMA、20 g/L DA、20 g/L DIA培养基中的分生孢子;E.具2个隔的分生孢子;F.分生孢子梗分枝A,B,C,D are the conidia produced on 10 g/L WBA,10 g/L CMA,20 g/L DA,20 g/L DIA,respectively; E.2-septate conidia; F.branched conidiophores
图1不同培养基中捕食线虫性真菌少孢节丛孢菌DH 066分生孢子形态及分生孢子梗分枝
Fig.1Conidial morphology and branched conidiophores of nematode-trapping fungusArthrobotryoligosporastrain DH 066 in different media
A,B,C,D分别是在10 g/L WBA、10 g/L CMA、20 g/L DA、20 g/L DIA培养基中的分生孢子;E.具2个隔的分生孢子;F.分生孢子梗分枝A,B,C,D are the conidia produced on 10 g/L WBA,10 g/L CMA,20 g/L DA,20 g/L DIA,respectively; E.2-septate conidia; F.branched conidiophores
图2不同培养基中捕食线虫性真菌少孢节丛孢菌F 107分生孢子形态及分生孢子梗分枝
Fig.2Conidial morphology and branched conidiophores of nematode-trapping fungusArthrobotryoligosporastrain F 107 in different media
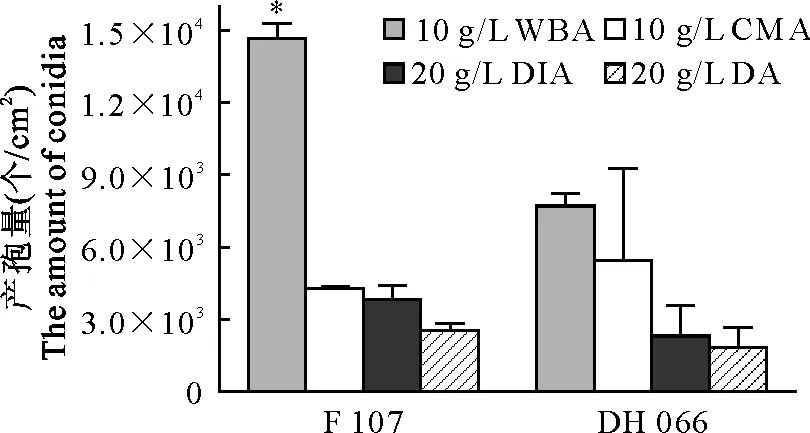
图3 捕食线虫性真菌少孢节丛孢菌DH 066和F 107在不同培养基中分生孢子量/cm2
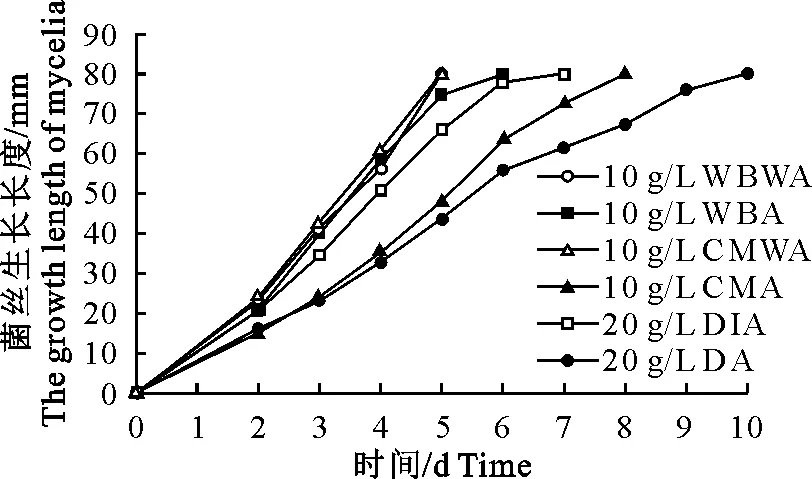
图4 捕食线虫性真菌少孢节丛孢菌DH 066于6种不同培养基中的生长情况
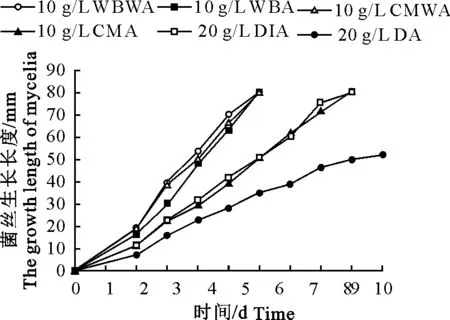
图5 捕食线虫性真菌少孢节丛孢菌F 107于6种不同培养基中的生长情况
3 讨论
本研究表明DH 066在20 g/L DA培养基中的分生孢子明显要比其他培养基中的大,而F 107在10 g/L CMA中的分生孢子要比其他培养基的大,Singh R K等[14]研究发现,在牛肉膏琼脂培养基中培养的A.oligospora,其分生孢子长度最长可达51.0 μm,在营养琼脂培养基中最长可达40 μm,而在Richard’s,YPSS,Sabouraud’s,PDA和CMA培养基中,分生孢子最长为30.50 μm,在含有线虫的CMA培养基中产生的分生孢子要比不加线虫的CMA培养基中的大。Haaed K[7]研究表明在含有线虫的培养基中的分生孢子比不加线虫的培养基中要小,这与Singh R K的研究结果相反,这种结果可能由于同种不同株导致的。这说明同一株少孢节丛孢菌在不同培养基中分生孢子大小不同,并且也说明同种不同株的分生孢子在同种培养基中分生孢子大小也不同。因此,鉴于在不同培养基中分生孢子的大小和形态有所差异,因此在鉴定种时,应统一在CMA培养基中测量孢子大小,并进行鉴定。
Cooke R C等[6]描述A.oligospora分生孢子倒卵形,分生孢子1个分隔并在分隔处溢缩,分生孢子梗不分枝。Haaed K[7]研究表明,A.oligospora在CMA培养基中产生的分生孢子倒卵形至梨形,分生孢子1个分隔,末端细胞是顶端细胞的2倍,分生孢子梗不分枝,以及国内对该种不同分离株也有不少描述,但没有报道过该种偶尔产生2个分隔的分生孢子以及分生孢子梗偶尔分枝的现象。
在10 g/L WBWA和10 g/L CMWA 培养基中,DH 066和F 107菌丝生长速度最快,在10 g/L WBA培养基两株菌的生长速度略比10 g/L WBWA和10 g/L CMWA慢,但要远远快于10 g/L CMA。这表明WBA培养基要比CMA培养基更适合培养A.oligospora,也表明自来水比蒸馏水更适合培养该菌。但并不是营养越高菌丝生长速度越快,我们研究资料表明,在20 g/L CMA以及PDA培养基中,菌丝生长速度较慢,明显要比4 g/L和10 g/L CMA慢,这与杨晓野等[8]的试验结论一致。在相同培养基中DH 066生长速度明显要比F 107快,这说明不同分离株的确存在差异。
在10 g/L WBA培养基中所产生的分生孢子的量比在10 g/L CMA及20 g/L DIA明显要多,这说明麸皮培养基不仅适合于A.oligospora的生长,也适合于大量生产分生孢子。麸皮价格相比玉米和其他粮食更低,从实用性的角度来说,更适合于今后的大规模生产。
早在20世纪20年代,Nathan Cobb就提出用线虫的天敌来防治线虫,直到1978年Coyrol J C等[17]才成功地用强力节丛孢(A.robusta,商品名:Royale 300)防治蘑菇生产上线虫的危害;于1983年,Coyrol J C将A.irregularis(商品名:Royale 350)用于番茄生产中对根结线虫的防治。目前,国内也有用于植物线虫的产品,如淡紫拟青霉(Paecilomyceslilacinus,商品名:灭线宁),厚孢轮枝菌(Pochoniachlamydosporia,商品名:线虫必克)。但用于家畜寄生线虫的生防治剂还没有商品化,因为用于动物寄生线虫防治的菌种需添加到家畜饲料中让其采食,这样既节约成本,又方便实施[18]。因此,要求菌种必须能够通过家畜的消化道,与植物生防菌种相比,对菌种要求更高。由于本次研究的2株A.oligospora来源于粪堆和新鲜粪便,已通过家畜的消化道,说明其可能对家畜胃肠道的pH、酶等具有一定的耐受性,但还需进一步进行体内试验以验证其通过家畜胃肠道的生存活力。
[1]Cai K Z,Liu J L,Liu W,et al.Screening of different sample types associated with sheep and cattle for the presence of nematophagous fungi in China[J].J Basic Microb,2015,DOI:10.1002/jobm.201500281.
[2]Swe A,Jeewon R,Pointing S B,et al.Diversity and abundance of nematode-trapping fungi from decaying litter in terrestrial,freshwater and mangrove habitats[J].Biodivers Conserv,2009,18(6):1695-1714.
[3]Saxena G.Observations on the occurrence of nematophagous fungi in Scotland[J].Appl Soil Ecol,2008,39(3):352-357.
[4]Su H Y,Mo M H,Zhang K Q.The ecology of nematode-trapping hyphomycetes in cattle dung from three plateau pastures[J].Vet Parasitol,2007,144(3):293-298.
[5]董世娟,黄维义.食线虫真菌防治寄生线虫的研究概况[J].动物医学进展,2003, 24(5):58-61.
[6]Cooke R C,Godfrey B E S.A key to the nematode-destroying fungi[J].Trans Br Mycol Soc,1964,47(1):61-74.
[7]Haard K.Taxonomic studies on the genusArthrobotrysCorda[J].Mycologia,1968,60:1140-1159.
[8]杨晓野,杨莲茹,刘珍莲,等.捕食线虫性真菌的分离培养技术与形态学[J].中国兽医学报,2002,22(2):175-177.
[9]朱海.中国五省(区)食线虫真菌的分离鉴定和分子分类研究[D].黑龙江哈尔滨:东北农业大学,2013.
[10]Jansson H B,Persson C,Odeslius R.Growth and capture activities of nematophagous fungi in soil visualized by low temperature scanning electron microscopy[J].Mycologia,2000,92(1):10-15.
[11]满达,杨晓野,杨莲茹,等.少孢节丛孢菌菌超微结构的观察研究[J].中国兽医科学,2006,36(1):18-24.
[12]Murray D S,Wharton D A.Capture and penetration processes of the free-living juveniles ofTrichostrongyluscolubriformis(Nematoda) by the nematophagous fungus,Arthrobotrysoligospora[J].Parasitology,1990,101(1):93-100.
[13]杨玉琴,杨晓野,杨莲茹,等.少孢节丛孢菌菌的生长特性研究[J].中国兽医科技,1998,28(10):24-25.
[14]Singh R K,Kumar N,Singh K P.Morphological variations in conidia ofArthrobotrysoligosporaon different media[J].Mycobiology,2005,33(2):118-120.
[15]张克勤,莫明和,刘雪峰.中国真菌志.节丛孢及相关属[M].北京:科学出版社,2006:26-62.
[16]Zhang K Q,Hyde K D.Nematode-trapping Fungi[M].Netherlands:Springer Science & Business,2014:92-94.
[17]Cayrol J C,Frankowski J P,Laniece A,et al.Arthrobotrys robusta souche Antipolis[J].Rev Hortie,1978,184:23-30.
[18]徐春兰,刘伟,秦鸽鸽,等.食线虫真菌防治家畜胃肠道线虫研究进展[J].动物医学进展,2014,35(12):127-131.
Morphological Differences and Growth Characteristics of TwoArthrobotryoligosporaStrains in Different Media
LIU Wei,XU Qiang,LI Xiao-shan,LI Qing,CHEN Ming-yue,HAN Yuan,PENG Jian-wei,CHEN Chun-rong,WANG Fan,CAI Kui-zheng,MA Zhong-ren
(College of Life Science and Engineering,Northwest University for Nationalities,Lanzhou,Gansu, 730030,China)
The influence of different cultures on nematode-trapping fungusArthrobotryoligosporastrains DH 066 and F 107 was studied for understanding its biological characteristics.The isolated strains DH 066 and F 107 were inoculated in 10 g/L wheat bran agar (WBA),10 g/L corn meal agar (CMA),20 g/L dextrose ionized agar (DIA) and 20 g/L dextrose agar (DA),cultured in incubator with 25 ℃,the morphological characteristics and the amount of conidia were carefully observed and counted.The growth status and growth length of DH 066 and F 107 mycelia,cultured in 6 different culture media,were monitored at the fixed time.The results showed that isolated strains DH 066 and F 107 were characterized by hyaline,erect,septate,occasionally branched conidiophores,which bear pyriform or obovoid,1-septate,occasionally 2-septate conidia.The amount of conidia in 10 g/L WBA is top producer in 4 different culture media.The hyphal growth rate was the best when strains DH 066 and F 107 were cultured in 10 g/L wheat bran water agar (WBWA) and 10 g/L corn meal water agar (CMWA).
nematode-trapping fungus;Arthrobotryoligospora; morphological characteristics
2016-01-17
甘肃省科技支撑计划项目(1304NKCA157);教育部“长江学者和创新团队发展计划”(IRT13091)资助;西北民族大学研究生科研创新项目(Yxm2014184)
刘伟(1990-),男,内蒙古乌兰察布人,硕士研究生,主要从事家畜寄生线虫病的生物防治研究。*通讯作者
S855.4
A
1007-5038(2016)08-0060-05
