国产派格宾治疗慢性乙型肝炎Ⅲ期临床试验严重不良事件观察*
2016-09-21刘振宇袁劲松彭雁忠北京大学深圳医院广东深圳58036汕头大学医学院广东汕头5504
刘振宇,袁劲松,彭雁忠△(.北京大学深圳医院,广东深圳58036;.汕头大学医学院,广东汕头5504)
国产派格宾治疗慢性乙型肝炎Ⅲ期临床试验严重不良事件观察*
刘振宇1,袁劲松2,彭雁忠1△(1.北京大学深圳医院,广东深圳518036;2.汕头大学医学院,广东汕头515041)
目的分析国产派格宾(Y型聚乙二醇化重组人干扰素α2b注射液)在临床试验过程中发生的严重不良事件(SAE),为今后临床安全用药提供参考。方法于2013年12月至2015年6月进行多中心、前瞻性、中央随机、阳性药物对照[研究组应用国产派格宾、对照组应用派罗欣(聚乙二醇干扰素α2a注射液)]Ⅲ期临床试验,通过分析临床试验中SAE发生情况,探讨应用国产派格宾的安全性。结果该Ⅲ期临床试验共筛选患者47例,入组33例,发生SAE 5例(6例次),SAE发生率为15.15%(5/33)。发生SAE均与应用国产派格宾和派罗欣无关。结论临床试验中应用国产派格宾和派罗欣均未出现严重安全事件。临床应用国产派格宾时应密切关注患者出现的症状,降低SAE发生率。
肝炎,乙型,慢性/药物疗法;干扰素类/治疗应用;聚西托醇/治疗应用;严重不良事件
乙型肝炎病毒(hepatitis B virus,HBV)的存在是慢性乙型肝炎反复发作的重要原因,α-干扰素具有抗病毒作用,是目前公认的治疗慢性乙型肝炎的药物之一,但随着临床应用的增加,干扰素不良反应也受到医学工作者的重视[1];其不良反应主要包括血细胞减少、流行性感冒样症状、皮肤症状、精神症状等。国产派格宾(Y型聚乙二醇化重组人干扰素α2b注射液)经Y型40 KD聚乙二醇修饰得到,是一种长效干扰素。作者进行了多中心、前瞻性、中央随机、阳性药物对照[研究组应用国产派格宾、对照组应用派罗欣(聚乙二醇干扰素α2a注射液)]Ⅲ期临床试验,分析了该临床试验中严重不良事件(serious adverse event,SAE)发生情况,旨在为临床安全应用国产派格宾提供依据。
1 资料与方法
1.1资料
1.1.1一般资料选取2013年12月至2015年6月进行的多中心、前瞻性、中央随机、阳性药物对照Ⅲ期临床试验筛选受试者47例,入组33例,其中男28例,女5例;年龄19~39岁,平均(27.3±4.2)岁。SAE定义为临床试验过程中发生的需住院治疗、延长住院时间、伤残、影响工作能力、危及生命安全或死亡、导致先天性畸形等事件。将SAE与研究药物的关联性分为肯定有关、很可能有关、可能有关、可能无关和肯定无关,前三者被认为与研究药物相关,后二者被认为与研究药物无关。SAE发生率=发生SAE例数/可评价病例数×100%。
1.1.2入选标准(1)自愿入组,能理解和签署知情同
*基金项目:广东省深圳市科技项目(201213)。
作者简介:刘振宇(1989-),在读硕士研究生,主要从事中药药理学研究。△通讯作者,E-mail:pyz988@163.com。
意书,尽量保证用药依从性;(2)年龄18~65岁;(3)体质量指数为17~28 kg/m
2
;(4)HBV血清学要求为HBV表面抗原(hepatitis B virus surface antigen,HBsAg)阳性病史至少6个月,筛选时HBsAg和HBV e抗原(hepatitis B virus e antigen,HBeAg)均为阳性,且HBV DNA≥24× 10
5
U/mL(或相当于该病毒载量);(5)筛选时(停用护肝降酶药至少2周)丙氨酸氨基转移酶(alanine amiotransferase,ALT)为正常参考值的2~10倍;(6)育龄妇女尿妊娠试验阴性,且受试者(包括男性受试者)愿意未来18个月内无妊娠计划且采取有效避孕措施。
1.1.3排除标准(1)既往接受过干扰素治疗者;(2)筛选前6个月内接受过核苷(酸)类似物治疗或曾有核苷(酸)类似物治疗耐药史,曾用过强力免疫调节剂(如肾上腺皮质激素、胸腺肽α1、胸腺五肽)、肝毒性药物(如氨苯砜、红霉素、氟康唑、酮康唑、利福平)超过2周或参与了其他药物的临床试验;(3)神经、精神疾病患者(包括抑郁、焦虑、躁狂、精神分裂症)或有精神疾病家族史者(尤其是抑郁症疾病史或抑郁倾向者);(4)自身免疫性疾病患者(包括银屑病、系统性红斑狼疮)、未控制的轻度心血管疾病或中度以上心血管疾病患者、内分泌系统疾病患者(包括甲状腺疾病、糖尿病)、肺部疾病患者(如浸润性肺疾病、支气管炎)、眼底疾病患者(如视网膜病变)、肾脏疾病患者(如急、慢性肾炎,肾功能不全,肾病综合征)等;(5)实验室检查异常者,中性粒细胞小于1.5×109L-1;血小板计数小于90×109L-1,总胆红素大于正常参考值的2倍,血清蛋白小于35 g/L,凝血酶原较正常参考值延长3 s以上,筛选时肝功能Child-Pugh分级大于或等于B级,血肌酐大于正常参考值,其他实验室检查异常等;(6)HBsAg和抗HBV表面抗体同时阳性或HBeAg与抗HBV e抗体同时阳性者;(7)计划接受器官移植或已进行过器官移植者。
1.2方法
1.2.1研究设计研究设计为多中心、前瞻性、中央随机、阳性药对照Ⅲ期临床试验,入组受试者年龄大于或等于18岁,HBsAg阳性病史至少6个月,筛选时HBsAg和HBeAg均为阳性。试验启动前通过医院伦理委员会同意。
1.2.2药物选择及治疗方法试验药物选择国产派格宾,由厦门特宝生物工程股份有限公司提供(批号不详)。受试者筛选合格后随机化按2∶1比例分配至研究组或对照组,分别应用国产派格宾和派罗欣(上海罗氏制药有限公司,批号不详),每周1次,皮下注射,治疗48周。停药后随访观察24周,记录SAE发生情况,并上报相关职能部门。
2 结 果
2.1SAE发生情况33例患者中发生SAE5例(6例次),SAE发生率为15.15%(5/33),5例患者均为男性,发生SAE均与应用国产派格宾和派罗欣无关,见表1。
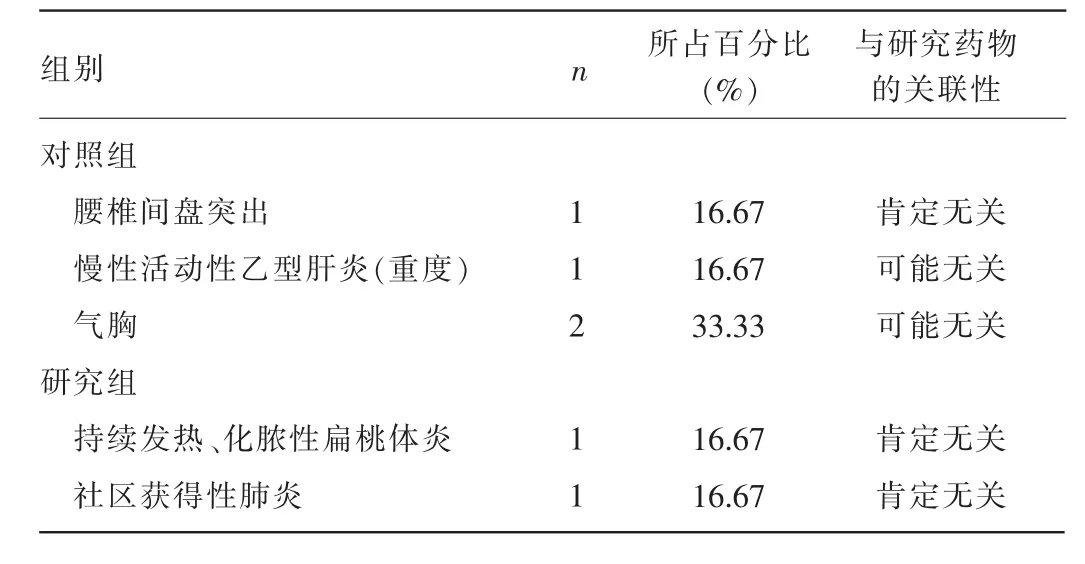
表1 SAE发生情况(n=6)
2.25例患者SAE发生情况及处理
2.2.1病例1电话通知回访患者时自述因脚痛住院,诊断为“腰椎间盘突出”。术前口服地塞米松片1.50 g,每天2次,3 d后行腰5骶1椎间管扩大减压神经根粘连松懈术,术后给予还原性谷胱甘肽针2.40 g治疗3 d,手术顺利,未影响本临床试验用药及随访。
2.2.2病例2患者自述因吹空调受凉引起持续发热、化脓性扁桃体炎住院治疗,给予氯化钾注射液、门冬氨酸钾镁注射液、头孢西丁钠等药物对症治疗后体温恢复正常,咽部不适较前有所减轻,电话随访已无大碍。发生SAE期间未影响本临床试验用药及随访。
2.2.3病例3患者因发热、咽痛2 d本研究者判断病情予以住院,但患者未办理住院手续;而后电话随访患者自述口服左氧氟沙星0.50 g,每天1次,2 d后症状缓解未给予特殊处理;之后患者因发热、咽痛加重前往医院就诊,以“社区获得性肺炎”收入院,给予静脉滴注左氧氟沙星0.40g,好转后出院。发生SAE期间未影响本临床试验用药。
2.2.4病例4患者因肝功能异常计划外随访,本研究者判定病情予以住院,诊断为“慢性活动性乙型肝炎(中度)”;给予谷胱甘肽、多稀磷脂酰胆碱等护肝降酶、退黄治疗,最后结合临床病史、辅助检查判断为“慢性活动性乙型肝炎(重度)”,但与本临床试验无关,患者未退出本临床试验,出院后完成最后随访。
2.2.5病例5患者告知本研究者因气胸在外住院,予以胸腔引流术治疗,口服头孢哌酮/舒巴坦针2.00 g,每天1次,复方甘草酸酐针200 mL,每天1次,头孢克洛0.25g,每天3次,氨溴索30 mg,每天2次静脉滴注治疗,术后好转出院,住院期间未影响本临床试验用药。患者打电话告知本研究者因“气胸”再次入院,行左侧胸腔闭式引流术,4d后行胸腔镜下左肺大泡切除术,术中给予苯巴比妥、地塞米松磷酸钠、肝素钠等药物治疗。手术顺利,术后给予头孢菌素类、氨溴索等药物对症治疗,1个月后顺利出院。住院期间未影响本临床试验用药。
3 讨 论
世界卫生组织报道,全球约20亿人曾感染过HBV,其中3.5亿人为慢性HBV感染者,每年约有60万人死于急性肝功能衰竭、HBV感染所致肝硬化和原发性肝细胞癌[2-3]。HBV感染呈世界性流行趋势,但不同地区流行强度差异较大。在亚洲、撒哈拉以南的非洲地区、欧洲东南地区及美洲中部及南部地区HBV流行率较高[4]。
慢性乙型肝炎的治疗主要包括抗病毒治疗、免疫调节治疗及其他治疗等。目前,国内出台的慢性乙型肝炎治疗指南中对乙型肝炎治疗的总体目标:(1)尽可能最大限度地长时间抑制或清除HBV;(2)减轻肝细胞坏死程度及肝脏纤维化;(3)延缓和阻止疾病进展,降低和防止肝脏失代偿、肝硬化、原发性肝细胞癌及其他并发症的风险,从而改善患者生活质量,尽可能延长存活时间[5]。
国内外公认有效的抗HBV药物主要包括干扰素类和核苷(酸)类似物[6],其中一线抗病毒药物为(聚乙二醇)干扰素、恩替卡韦和替诺福韦[7]。长效干扰素(聚乙二醇干扰素)在干扰素基础上疗效增强,药物耐受性好,不良反应相似[8],现广泛应用于治疗乙型肝炎。
作者进行了国家Ⅰ类新药——国产派格宾的上市注册研究的Ⅲ期临床试验,为国家重大新药创制专项。本研究分析了国产派格宾在上市过程中开展Ⅲ期临床试验中的SAE发生情况,探讨了应用国产派格宾的安全性,旨在为上市注册及后续研究提供依据。结果显示,33例患者中发生SAE5例(6例次),SAE发生率为15.15% (5/33),5例患者均为男性;患者均由于SAE住院,给予相应治疗后均未影响本临床试验用药。
本研究中病例2由于吹空调导致全身乏力,高热不退,在外院医生的建议下住院观察治疗。据文献报道,α-干扰素的不良反应有长期发热[9],因此,临床应用该类药物时应时刻关注患者病情,务必注意及时处理发热,尽快给予对症退热治疗,减轻患者痛苦,如发生更严重的情况应酌情进行减量或停药处理。病例3自述有持续咳嗽、咽痛症状,本研究者告知其住院,患者本人未给予重视,之后仍出现间断性咳嗽,导致病情加重,最后住院治疗。因此,即使这种情况不可避免,研究者也应尽量与患者沟通,建议患者选择最合适的治疗方案,延缓病情进展。病例4因肝功能异常计划外随访,本研究者判断病情后予以住院治疗,结合住院期间患者临床病史、辅助检查,诊断为“慢性活动性乙型肝炎”,住院期间根据病情予以护肝、降酶、退黄治疗,出院后检测指征恢复正常,经本研究者判定此次SAE为重度,但与本临床试验用药可能无关。据文献报道,在应用普通干扰素时出现肝功能恶化,ALT、天门冬氨酸氨基转移酶水平大幅升高,甚至出现黄疸、出血倾向[10];故临床应用聚乙二醇干扰素类药物治疗慢性乙型肝炎时一定要定期检查患者肝功能,一旦出现肝损伤应立即减药或停药,定期随访,加大对患者肝功能的监测频率及对症治疗,保证患者安全。病例5因胸闷、咳痰中带血丝,入院诊断为“气胸”,经治疗症状消失后出院,住院期间未影响本临床试验用药;因“气胸”第二次住院可能由于病情反复,未完全治愈所致。另外,流行病学研究表明,HBV主要经血制品、母婴传播,围生(产)期传播是母婴传播的主要传播方式[11-12],同时,孕妇用药应非常谨慎;因此,为下一代的健康,防止疾病交叉传播,患者应尽量避免服药期间怀孕,将危险性降至最低。
抗病毒治疗可有效抑制HBV活性,但未能清除病毒,治疗一旦停止,由于共价闭合环状DNA的形成,会使病毒复活[13]。其存在也是病毒逃避抗病毒药物治疗和机体自身免疫的原因之一,因此,大部分感染者均需终身治疗。有研究表明,患者需长期服药,加上进口干扰素价格昂贵,每年均会产生上万元的医疗费用,相对于大多数家庭,负担沉重。而国产派格宾上市后价格低廉,安全性不低于已上市药物——派罗欣,待其推上市场必能惠及国人。
综上所述,国产派格宾不良反应与普通干扰素相似,但其安全性的评估尚需纳入更多的临床样本,临床应用该药时要注意该药物不良反应的发生,降低SAE发生率。
[1]郑雯,马慧群.干扰素的不良反应及处理[J].中国医学文摘:皮肤科学,2014,31(4):217-220.
[2]Ott JJ,Stevens GA,Groeger J,et al.Global epidemiology of hepatitis B virus infection:new estimates of age-specific HBsAg seroprevalence and endemicity[J].Vaccine,2012,30(12):2212-2219.
[3]Coppola N,Alessio L,Pisaturo M,et al.Hepatitis B virus infection in immigrant populations[J].World J Hepatol,2015,7(30):2955-2961.
[4]Sunbul M.Hepatitis B virus genotypes:global distribution and clinical importance[J].World J Gastroenterol,2014,20(18):5427-5434.
[5]中华医学会肝病学分会,中华医学会感染病学分会.慢性乙型肝炎防治指南(2015年版)[J/CD].中华实验和临床感染病杂志:电子版,2015,9(5):570-589.
[6]Martin P,Lau DT,Nguyen MH,et al.A treatment algorithm for the management of chronic hepatitis B virus infection in the United States:2015 update[J].Clin Gastroenterol Hepatol,2015,13(12):2071-2087.
[7]Wang YJ,Yang L,Zuo JP.Recent developments in antivirals against hepatitis B virus[J].Virus Res,2016,213:205-213.
[8]Kao JH.HBeAg-positive chronic hepatitis B:why do I treat my patients with pegylated interferon?[J].Liver Int,2014,34 Suppl 1:S112-119.
[9]Yang JF,Kao YH,Dai CY,et al.Comparison of adverse effects related to pegylated interferon-based therapy for patients with chronic hepatitis B and chronic hepatitis C in Taiwan[J].Hepatol Int,2010,4(4):732-740.
[10]王全楚,张燕.慢性肝炎合并脂肪肝患者应用干扰素后肝功能恶化2例[J].肝脏,2010,15(5):400.
[11]Thio CL,Guo N,Xie C,et al.Global elimination of mother-to-child transmission of hepatitis B:revisiting the current strategy[J].Lancet Infect Dis,2015,15(8):981-985.
[12]Liu Y,Lu Y,Li J.Occult hepatitis B virus infection:a new challenge for hepatitis B vaccine to block mother-to-child transmission[J].Zhonghua Gan Zang Bing Za Zhi,2016,24(2):157-160.
[13]Kumar R,Pérez-Del-Pulgar S,Testoni B,et al.Clinical relevance of the study of hepatitis B virus covalently closed circular DNA[J].Liver Int,2016,36 Suppl 1:S72-77.
Observation on serious adverse events of phase 3 clinical trial in domestic Paigebin treatment of chronic hepatitis B*
Liu Zhenyul,Yuan Jinsong2,Peng Yanzhongl△(l.Shenzhen Hospital of Beijing University,Shenzhen,Guangdong 5l8036,China;2.Medical College,Shantou University,Shantou,Guangdong 5l504l,China)
ObjectiveTo analyze the serious adverse events(SAE)occurred in the clinical trial of domestic polyethylene glycol human recombinant interferon α-2b(Paigebin)to provide a reference for the safe medication in the future.MethodsThe phaseⅢclinical trial of multicenter,prospective,central randomization and positive drug control was performed from December 2013 to June 2015,the study group used the domestic Paigebin and the control group used polyethylene glycol interferon α-2a injection(Pegsys).The safety of domestic Paigebin use was investigated by analyzing the SAE occurrence situation during the clinical trial process.ResultsA total of 47 cases were screened in the phaseⅢclinical trial,33 cases were included,5 cases (6 case-times)of SAE occurred,the SAE occurrence rate was 15.15%(5/33).The SAE occurrence had no relation with domestic Paigebin and Pegsys.ConclusionUsing domestic Paigebin and Pegsys had no SAE occurrence during the clinical trial.Using the domestic Paigebin in clinic should pay close attention to the symptom occurrence of patients for reducing the SAE occurrence.
Hepatitis B,chronic/drug therapy;Interferons/therapeutic use;Cetomacrogol/therapeutic use;Serious adverse events
10.3969/j.issn.1009-5519.2016.17.008
A
1009-5519(2016)17-2644-03
2016-05-27)
