听觉事件相关电位对新生儿大脑皮质认知功能研究进展
2016-09-21孙国玉侯新琳周丛乐
孙国玉 侯新琳 周丛乐
·综述·
听觉事件相关电位对新生儿大脑皮质认知功能研究进展
孙国玉侯新琳周丛乐
大脑的皮质功能从胎儿期至生后处于不断发育、完善的过程,由于多种宫内外高危因素会干扰这一发育过程,影响儿童认知、学习、记忆和社会活动能力,因此人们不断探讨有效的检查方法以评价发育中脑的皮质功能。近年来,事件相关电位(ERP)技术已经逐渐成为探索大脑功能的有力手段,广泛应用于脑皮质功能的研究。目前已有研究将ERP用于学龄前期及学龄期儿童脑认知功能的评价,然而新生儿由于无法配合测试者完成测试任务,应用受到限制。听觉认知记忆是人类发育过程中最早发育完善的脑功能,研究认为人类的听觉神经传导通路在胎儿后期已经开始发育[1],出生时已经发育成熟[2~4]。有文献[5]报道胎龄27周的早产儿即可被动听取并分辨不同频率的纯音,反映了极早早产儿的大脑皮质即存在了一定的认知功能。自1990年始,Alho等[6]应用听觉ERP(AERP)技术对小婴儿的认知功能进行评价,目前国内外应用AERP对小婴儿脑发育的研究逐渐增多,但对新生儿的研究仍较少。本文就应用AERP对新生儿大脑皮质认知功能的研究进行综述。
1 AERP的概念及研究指标
1.1AERP是指给予受试者被动听取不同声音后,由大脑皮质特定区域产生的、与声音刺激有相对固定时间间隔和特定位相的生物电反应。经典的ERP主要成分包括:受刺激本身物理特性影响的外源性成分P1、N1和P2波,与人心理活动相关的内源性成分N2、P3波(图1A)。这5种成分不仅仅是大脑单纯生理活动的体现,而且一定程度上能反映认知心理活动。与诱发电位不同的是,ERP中应用的声音刺激往往带有情感或情绪因素,如母亲的声音、快乐与悲伤的声音等,故而当受试者的某种心理因素出现变化时,脑区也会产生相应的电反应,即认知反应电位。失匹配负波(MMN)是ERP的1个内源性成分,相当于P3波。MMN指的是一种新的刺激出现时,大脑产生的不同于先前刺激的差异反应波,代表了大脑对不同刺激产生反应的差异,与注意、记忆、智能和心理等加工过程密切相关。MMN可用以判断不同频率的声音刺激,或者母语与非母语的声音刺激后大脑皮质反应的差异,是在大脑对不同刺激的物理特性本身产生反应后,由于认知功能不同而产生的差异。
1.2Oddball模式为AERP的经典试验模式。即以较大的频率(出现频率≥80%)播放一种声音刺激的同时,以较小的频率(出现频率<20%)随机播放另一种有细微差别的声音刺激(偏离刺激),从而研究大脑是否能将这2种刺激区分开来。通过电生理技术,对2种不同声音刺激下产生的脑电信号分别进行叠加,将获得2种不同的脑电反应波,即ERP波。其中较小频率出现的声音刺激诱导出的ERP波减去较大频率出现的声音刺激诱出的ERP波,所得差异波即失匹配反应波(MMR,图1B),代表了大脑对这2种不同声音刺激的辨别能力。新生儿、小婴儿的MMR一般为正向极性波[4,7,8],少见负向极性波,而成人的MMR是负向极性波,故称为MMN[9]。
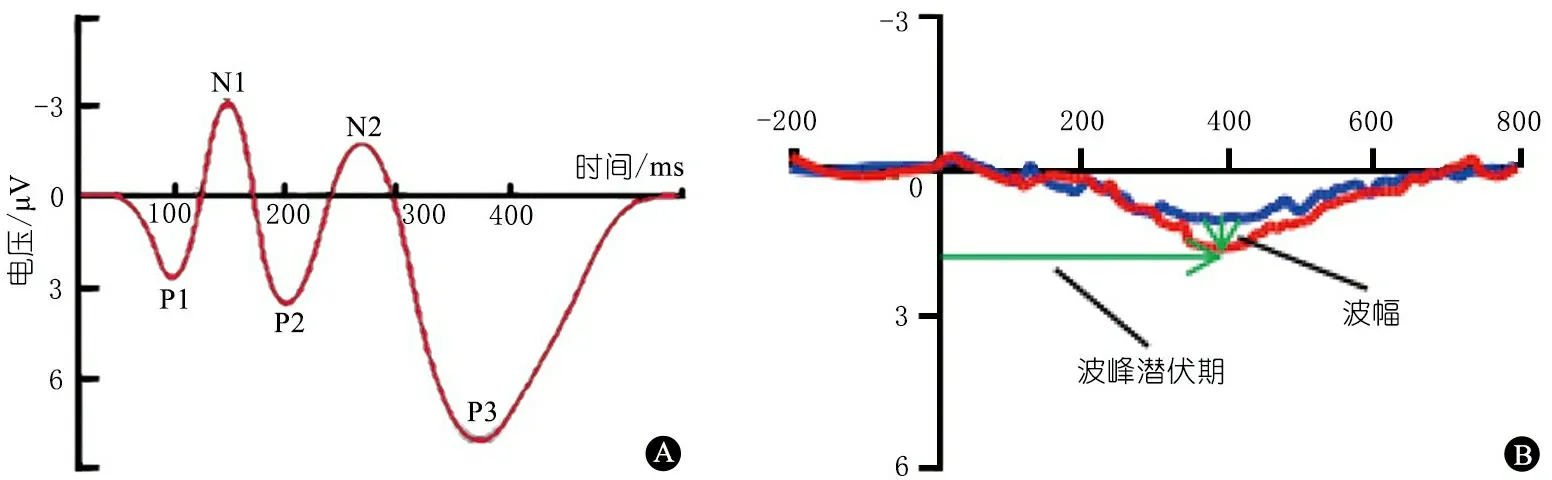
图1事件相关电位波型
注A:事件相关定位示意图;B:失匹配反应波波峰潜伏期、波幅示意图,红线和蓝线为不同刺激下事件相关电位波形
1.3临床常用的AERP观察指标
1.3.1MMR波峰潜伏期是指刺激结束后至产生差异波波峰的时间(图1B),代表大脑皮质对偏离刺激注意的能力,即分辨不同刺激的敏感性。潜伏期越短,说明对信号刺激越敏感,即越易分辨2种不同的声音刺激。
1.3.2MMR波幅是指基线至差异波波峰的垂直距离(图1B)。波幅越大,说明在信号刺激后反应的强度越大,反映大脑对不同刺激的分辨能力越强[10]。
2 AERP对新生儿认知功能的评价
2.1新生儿AERP的声音刺激常用的声音刺激主要为不同音频的纯音或单音节语音[11]。Suppiej等[12]应用1 000 Hz的纯音作为标准刺激,以2 000 Hz的纯音作为偏离刺激,发现新生儿能够辨识这2种不同频率的声音。也有研究者[13~15]给新生儿听“bi、gi”或“y、i、yi”语音或人与机器合成的“ba”的声音,发现新生儿能够分辨出不同的声音刺激。还有研究[13,15]给新生儿听不同的单词,如匈牙利语“banán”及“panán”或者母亲和陌生人分别发出的单词“baby”,发现新生儿大脑能够对不同单词及陌生人的声音进行分辨。
2.2新生儿AERP的特点
2.2.1MMR极性Winkler等[16]对11例生后2~5 d的足月新生儿和8例18~23岁青年进行AERP研究,播放出现频率分别为90%和10%正弦声波,结果显示新生儿在刺激后的200~300 ms处产生了与成人极性不同的正向MMR。Cheng等[17]给98例足月新生儿听“害怕”和“快乐”的语音,也发现在不同情绪语音条件下产生了正向MMR。Novitski等[4]给11例足月新生儿听250~4 000 Hz的纯音,发现在20%的偏离刺激下可以产生正向的MMR波。但也有研究[2,3,18,19]诱发出类似成人或者较大年龄儿童的负向MMR。
2.2.2MMR波峰潜伏期青少年及成人MMR波峰潜伏期为100~300 ms[20]。新生儿至3岁儿童大脑仍处于发育状态,目前研究[12,21]表明婴儿MMR波峰平均潜伏期100~450 ms。
2.3睡眠周期及不同脑区MMR的特点
2.3.1睡眠周期不同睡眠状态的神经机制[22]和生理学基础不同[15]。活动睡眠(AS)期与脑桥被盖产生的兴奋性神经递质有关,此时脑电波呈现不同步的低波幅快波,脑耗氧量增加,脑血流量增多,脑内蛋白质合成加快,有利于建立新的突触联系,促进学习记忆。而在安静睡眠(QS)期,由于脑内中缝核所释放的5-HT抑制了网状结构上行激动系统,脑电图呈现同步化的慢波,此时机体的耗氧量下降,脑的耗氧量无明显变化,主要为了体力的恢复。成人AERP研究[23,24]显示,随着大脑睡眠的加深,MMR波峰的潜伏期会延长,而波幅会下降,觉醒状态会对大脑的认知反应产生影响。新生儿每天20余小时均在睡眠中度过,对听觉信息的处理往往在睡眠中完成,不同睡眠周期在脑功能成熟方面扮演的角色是否也存在差别,目前也引起研究者的关注。
目前研究普遍认为新生儿在AS期能够产生MMR。Winkler等[16]给14例生后2~5 d的足月新生儿听不同频率的声音,发现在AS期声音刺激后的180~400 ms产生了MMR。Ceponiene等[25]研究发现,81%的足月新生儿在AS期不同频率声音刺激后的100~350 ms产生了MMR。Suppiei等[12]对26例出生胎龄25~35周的早产儿在矫正胎龄35周时予1 000 Hz与2 000 Hz的声音刺激,发现仅在AS期时,刺激后的200~300 ms产生了明显的MMR,而QS期并未产生MMR。部分研究发现MMR在QS期也可以出现。Martynova等[26]对20例出生7 d内的健康新生儿研究显示,除了AS期,在QS期均在“o”和“e”这2个元音刺激后的100~300 ms产生了MMR。Leppänen等[9]对21例处于QS期的足月新生儿进行AERP研究显示,在不同频率的声音刺激后的150~375 ms产生了MMR。Cheour-Luhtanen等[19]在12例足月新生儿QS期以不同的出现频率播放“y”和“i”的声音刺激后200~250 ms出现了MMR。
2.3.2不同脑区大脑皮质不同区域的神经支配不同。成人研究[27~30]显示, AERP的起源可能较广,如颞叶、额叶、顶叶、丘脑、海马、网状系统等皮质和皮质下结构。Opitz等[31]将ERP与功能MRI结合研究发现,成人右侧额下回的岛盖部分为MMR的发生源,颞区听觉皮质主要对偏差刺激进行检测、分析和加工,最终在额区产生MMR。婴幼儿AERP研究也显示,对不同听觉刺激产生的差异波主要在额区、中央区,甚至顶区也可以引出相应的MMR,而非颞区。Suppiei等[12]研究发现,对偏离刺激的反应,只有在额中线区,新生儿处于AS期时才能监测到,而中央中线区、顶中线区及颞区等处未能出现MMR。Ceponiene等[25]给26例足月新生儿听不同频率的声音,发现在额区及中央区,新生儿对偏离刺激产生了比“标准刺激”更明显的MMR,而在颞区及顶区未发现差异。Cheng等[17]给30例生后0~5 d的足月新生儿听代表“快乐”和“生气”的“dada”语音,也发现在额区及中央区产生了MMR,而在颞区及顶区未产生MMR。Cheour等[14]的研究发现,除了额中央区,在顶区也发现了MMR。还有其他相关研究[4,10,19,26,32],也在额区或者中央区诱发出MMR。
3 影响新生儿AERP的因素
3.1脑的成熟度胎龄不同,脑的发育水平处于不同阶段。根据脑神经元、神经胶质细胞及突触联系的发育规律,不同胎龄的早产儿脑的成熟度亦不相同。胎龄越小的早产儿,脑发育处于更加不成熟的阶段。当受到外界不良影响时,更容易造成神经系统损伤,可以累及皮质和脑白质。这是造成学龄期甚至成年后认知功能障碍,特别是语言理解能力下降的高危因素。Bisiacchi等[11]应用1 000 Hz和2 000 Hz的声音刺激对20例胎龄23~29周的早产儿及19例胎龄30~34周的早产儿在矫正胎龄35周时进行测试,在声音刺激150~400 ms后,这2组早产儿均对不同频率的刺激产生了MMR,而胎龄较大的早产儿MMR波幅较高,反映胎龄较大的早产儿大脑皮质对不同刺激的分辨能力更强。Ragó等[33]选取21例胎龄28~36周的无脑损伤证据的早产儿及25例正常足月儿,在6、10月龄时给予“banana”和“panana”声音刺激后的250~350 ms,大脑皮质均产生了MMR,当刺激信号1个仍为“banana”,另1个信号将“banana”的重音稍作调整再刺激时,只有正常足月儿对这2种不同的声音刺激产生了MMR,而早产儿未能分辨。提示早产儿生后早期在语言能力方面仍落后于足月儿,说明良好的宫内生活环境有益于大脑语言区的发育。Cheour等[14]给矫正胎龄30~35周的早产儿、足月儿及生后3月龄的小婴儿听“y”及“i”音节,发现3组均能分辨这2个音节,且MMR波幅无明显差异,但MMR波峰潜伏期平均值随着年龄的增加而逐渐缩短(380 msvs273 msvs229 ms),反映了早产儿大脑皮质已经存在了一定的认知功能,但仍落后于足月儿及小婴儿。
3.2疾病新生儿期严重脑损伤及全身疾病往往也会造成脑发育的成熟延迟[34,35]。Leipälä等[36]以9例颅内出血的早产儿和9例脑损伤足月儿(5例颅内出血,4例缺氧性脑损伤)作为研究对象,并选取16例健康早产儿和22例健康足月儿作为对照。当早产儿矫正胎龄至足月、6月龄、12月龄时,足月儿生后17 d内、6月龄、12月龄时,以不同出现频率播放500 Hz和750 Hz的纯音。研究结果显示,健康足月儿较脑损伤足月儿在生后17 d内、6月龄、12月龄时的MMR波幅明显升高,且6月龄与12月龄时波幅差异更加明显,表明围生期脑损伤的足月儿早期脑功能较健康足月儿落后。而颅内出血的早产儿矫正胎龄足月、6月龄、12月龄时,均产生了明显的MMR,波幅与健康早产儿相似。这一现象,一方面可能与研究对象数量偏少有关,另一方面与纳入的早产儿颅内出血均为脑室内出血(Ⅱ度颅内出血6/9例),脑损伤程度不严重相关;而足月儿颅内出血往往为脑实质或累及皮质的出血,大脑皮质功能更容易受损。Leppänen等[37]对有阅读障碍家族史的22例新生儿进行了队列研究,给这些新生儿听1 000 Hz(出现频率88%)及1 100 Hz(出现频率12%)的声音,并与无此家族史的25例足月儿进行对比,发现后期发展为语言认知障碍的新生儿早期对这2种声音并不能进行分辨,在学龄前期及学龄期,对音节与单词的理解也存在问题,这最终会导致阅读障碍;而无家族史的新生儿生后早期能够分辨2种不同频率的声音。Deregnier等[38]给32例健康足月儿和25例糖尿病母亲婴儿听母亲的声音和陌生人的声音,发现2组新生儿均能够分辨出母亲的声音,但是健康足月儿对母亲的声音产生的MMR更加强烈。
4 总结与展望
由于MMR来源于大脑皮质,可以客观准确评估中枢听觉皮质加工、听觉知觉综合能力,并且不受注意力影响,不需要受试者对声音做出反应,在睡眠中的儿童也能记录到;且MMR是人类可记录到的最早存在的ERP成分,在出生后即可诱出;尤其适合应用于新生儿及婴幼儿,是一项早期评价听觉认知功能的非常有价值的方法[39]。首先,作为无创、方便的脑功能监测方法,从大脑认知功能层面来对新生儿、特别是早产儿脑发育进行评价,在探索人类脑的认知机制的起源及发展方面具有重大意义。其次,在疾病方面,MMR可以尽早发现正常言语感知的听皮质发育障碍所致的言语发育迟缓患儿,从而进行必要的干预。Friedrich等[40]发现,有特殊言语障碍家族史的2月龄婴儿,听到不同持续时间的元音音节时,诱发出的MMR波峰潜伏期比正常婴儿延长。但由于新生儿脑仍处于发育中,会受不同出生胎龄、睡眠周期、不同脑区及疾病的影响,因此新生儿MMR的极性、潜伏期、波幅尚无统一标准,仍处于研究的开始阶段,有明显的发育性变化。但AERP这种电生理学技术无疑为临床评价新生儿大脑皮质的认知功能开启了新的方向。
[1]Schleussner E, Schneider U, Arnscheidt C, et al. Prenatal evidence of left-right asymmetries in auditory evoked responses using fetal magnetoencephalography. Early Hum Dev, 2004, 78(2):133-136
[2]Hirasawa K, Kurihara M, Konishi Y. The relationship between mismatch negativity and arousal level. Can mismatch negativity be an index for evaluating the arousal level in infants? Sleep Med, 2002, 3(S2):45-48
[3]高延, 洪琦, 罗小杏, 等. 健康新生儿的失匹配负波研究. 中国儿童保健杂志, 2011,19(5):415-418
[4]Novitski N, Huotilainen M, Tervaniemi M, et al. Neonatal frequency discrimination in 250-4000Hz range: electrophysiological evidence.Clin Neurophysiol, 2007, 118(2):412-419
[5]Holst M, Eswaran H, Lowery C, et al. Development of auditory evoked fields in human fetuses and newborns: a longitudinal MEG study. Clin Neurophysiol, 2005, 116(8):1949-1955
[6]Alho K, Sainio K, Sajaniemi N, et al. Event-related brain potential of human newborns to pitch change of an acoustic stimulus. Electroencephalogr Clin Neurophysiol, 1990, 77(2):151-155
[7]Partanen E, Pakarinen S, Kujala T, et al. Infants′ brain responses for speech sound changes in fast multifeature MMN paradigm. Clin Neurophysiol, 2013, 124(8):1578-1585
[8]Leppänen PH, Guttorm TK, Pihko E,et al. Maturational effects on newborn ERPs measured in the mismatch negativity paradigm. Exp Neurol, 2004, 190(S1):91-101
[9]Cheour-Luhtanen M, Alho K, Sainio K, et al. The ontogenetically earliest discriminative response of the human brain. Psychophysiology, 1996, 33(4):478-481
[10]Cheour M, Leppänen PH, Kraus N. Mismatch negativity (MMN) as a tool for investigating auditory discrimination and sensory memory in infants and children. Clin Neurophysiol, 2000, 111(1):4-16
[11]Bisiacchi PS, Mento G, Suppiej A. Cortical auditory processing in preterm newborns: an ERP study. Biol Psychol, 2009, 82(2):176-185
[12]Suppiej A, Mento G, Zanardo V, et al. Auditory processing during sleep in preterm infants: An event related potential study. Early Hum Dev, 2010, 86(12):807-812
[13]Therien JM, Worwa CT, Mattia FR, et al. Altered pathways for auditory discrimination and recognition memory in preterm infants. Dev Med Child Neurol, 2004, 46(12):816-824
[14]Cheour M, Alho K, Ceponiené R, et al. Maturation of mismatch negativity in infants. Int J Psychophysiol, 1998, 29(2):217-226
[15]deRegnier RA, Wewerka S, Georgieff MK, et al. Influences of postconceptional age and postnatal experience on the development of auditoryrecognition memory in the newborn infant. Dev Psychobiol, 2002, 41(3):216-225
[16]Winkler I, Kushnerenko E, Horváth J, et al. Newborn infants can organize the auditory world. Proc Natl Acad Sci U S A, 2003, 100(20):11812-11815
[17]Cheng Y, Lee SY, Chen HY, et al. Voice and emotion processing in the human neonatal brain. J Cogn Neurosci, 2012, 24(6):1411-1419
[18]Cheour M, Ceponiené R, Leppänen P, et al. The auditory sensory memory trace decays rapidly in newborns. Scand J Psychol, 2002, 43(1):33-39
[19]Cheour-Luhtanen M, Alho K, Kujala T, et al. Mismatch negativity indicates vowel discrimination in newborns. Hear Res, 1995, 82(1):53-58
[20]李宝环, 李富德, 林鹏. 失匹配负波发生原理及临床应用. 听力学及言语疾病杂志, 2012, 20(5):499-503
[21]Stefanics G,Háden GP, Sziller I, et al. Newborn infants process pitch intervals. Clin Neurophysiol, 2009, 120(2):304-308
[22]刘军, 刘鑫, 易庆华. 睡眠机制研究进展. 亚太传统医药, 2007, 11.3(11):34-36
[23]Atienza M, Cantero JL. Complex sound processing during human REM sleep by recovering information from long-term memory asrevealed by the mismatch negativity (MMN). Brain Res, 2001, 901(1-2):151-160
[24]Winter O, Kok A, Kenemans JL, et al. Auditory event-related potentials to deviant stimuli during drowsiness and stage 2 sleep. Electroencephalogr Clin Neurophysiol, 1995, 96(5):398-412
[25]Ceponiene R, Kushnerenko E, Fellman V, et al. Event-related potential features indexing central auditory discrimination by newborns. Brain Res Cogn Brain Res, 2002, 13(1):101-113
[26]Martynova O, Kirjavainen J, Cheour M. Mismatch negativity and late discriminative negativity in sleeping human newborns. Neurosci Lett, 2003, 340(2):75-78
[27]Näätänen R, Alho K. Mismatch negativity--the measure for central sound representation accuracy. Audiol Neurootol, 1997, 2(5):341-353
[28]Csépe V. On the origin and development of the mismatch negativity. Ear Hear, 1995, 16(1):91-104
[29]Polich J. P300 clinical utility and control of variability. J Clin Neurophysiol, 1998, 15(1):14-33
[30]Polich J, Kok A. Cognitive and biological determinants of P300: an integrative review. Biol Psychol, 1995, 41(2):103-146
[31]Opitz B, Rinne T, Mecklinger A, et al. Differential contribution of frontal and temporal cortices to auditory change detection: fMRI and ERP results. Neuroimage, 2002, 15(1):167-174
[32]孙国玉, 侯新琳, 周丛乐. 在生气和害怕声音情绪暴露下新生儿事件相关电位的初步研究. 中国循证儿科杂志, 2015, 10(2):90-94
[33]Ragó A, Honbolygó F, Róna Z, et al. Effect of maturation on suprasegmental speech processing in full- and preterm infants: a mismatch negativity study. Res Dev Disabil, 2014, 35(1):192-202
[34]Natalucci G, Rousson V, Bucher HU, et al. Delayed cyclic activity development on early amplitude-integrated EEG in the preterm infant with brain lesions. Neonatology, 2013, 103(2):134-140
[35]Romagnoli C, Zecca E, Vento G. Effect on growth of two different dexamethasone courses for preterm infants at risk of chronic lung disease. A randomized trial. Pharmacology, 1999, 59(5):266-274
[36]Leipälä JA, Partanen E, Kushnerenko E, et al. Perinatal cerebral insults alter auditory event-related potentials. Early Hum Dev, 2011, 87(2):89-95
[37]Leppänen PH, Hämäläinen JA, Salminen HK, et al. Newborn brain event-related potentials revealing atypical processing of sound frequency and the subsequent association with later literacy skills in children with familial dyslexia. Cortex, 2010, 46(10):1362-1376
[38]Deregnier RA, Nelson CA, Thomas KM, et al. Neurophysiologic evaluation of auditory recognition memory in healthy newborn infants and infants of diabeticmothers. J Pediatr, 2000, 137(6):777-784
[39]Kraus N, Cheour M. Speech sound representation in the brain. Audiol Neurootol, 2000, 5(3-4):140-150
[40]Friedrich M, Weber C, Friederici AD. Electrophysiological evidence for delayedmismatch response in infants at-risk for specific language impairment. Psychophysiology, 2004, 41(5):772-782
(本文编辑:张崇凡)
10.3969/j.issn.1673-5501.2016.03.016
北京大学第一医院北京,100034
侯新琳,E-mail:houxinlin66@sina.com
2015-12-15
2016-06-07)
