基于单中心儿童样本库人群全外显子组数据的致病突变携带者分析
2016-09-21林伊凤王慧君吴冰冰卢宇蓝周文浩
林伊凤 王慧君 吴冰冰 杨 琳 董 辰 卢宇蓝 周文浩
·论著·
基于单中心儿童样本库人群全外显子组数据的致病突变携带者分析
林伊凤1王慧君2吴冰冰2杨琳2董辰2卢宇蓝2周文浩3
目的通过对比公共数据库和复旦大学附属儿科医院分子诊断中心(复旦儿科)样本库全外显子组测序(WES)数据中已知儿童致病突变频率差异,推测中国人群隐性遗传致病基因携带者频率分布。方法整理公共数据库(OMIM、ClinVar、HGMD)中常染色体隐性遗传病的致病基因和突变位点,计算复旦儿科样本库中的WES数据,基于公共数据库的致病基因的携带者频率。结果从公共数据库分析中共得到1 368个常染色体隐性致病基因上的60 209个位点。在复旦儿科1 147例临床WES样本中,共筛出408个基因上的1 016个突变位点。比较复旦儿科、人类外显子组整合数据库(ExAC)东亚(4 312例)和欧洲人群(33 301例)突变位点的出现频率,3个人群中均发现了人群特有的突变位点,相比ExAC欧洲人群,复旦儿科人群中的突变位点出现频率与ExAC东亚人群更为相近。在携带者频率>1%的基因中,复旦儿科和ExAC东亚人群相同的基因分别为70/81个(86.4%)和70/102个(68.6%);复旦儿科和ExAC欧洲人群相同的基因分别为37/81个(45.7%)和37/136个(27.2%)。结论通过与ExAC东亚和欧洲人群数据进行对比,中国人群中隐性致病基因及致病突变位点的携带者频率与ExAC东亚人群较为相似,与欧洲人群差异较大,建立针对中国人群特异性的常见遗传携带者突变位点筛查项目十分必要。
全外显子组测序;遗传病;携带者;突变筛查
AbstractObjectiveBy comparing genotype frequencies among public population databases and single pediatric center, the carrier frequency of autosomal recessive disease-causing genes was acquired in Translational Medicine Center of Children′s Hospital of Fudan University (TMCCHFU). These carrier frequencies could be used as a reference to estimate the Chinese population carrier frequency, and would provide essential information for the design of Chinese-specific disease-causing gene carrier screen panel.MethodsThe disease-causing autosomal recessive genes from OMIM, and known pathogenic disease-causing mutations from ClinVar and HGMD were summarized. The carrier frequency of disease-causing genes was calculated using local population data and public population databases seperately, and then compared with each other in further studies.ResultsThe public database were filtered and 60 209 pathogenic mutations on 1 368 autosomal recessive disease-causing genes were found, and 1 016 of mutations on 408 genes were identified in 1 147 WES datasets from TMCCHFU. Compared with ExAC East Asian population (4 312 samples) and ExAC European population (33 301 samples), population-specific mutations were identified in each of the populations. Carrier frequencies in TMCCHFU showed more similarity with ExAC East Asian population than European population. Among genes with carrier frequency higher than 1%, 70 out of 81 genes (86.4%) from TMCCHFU overlapped with 70 out of 102 genes (68.6%) from ExAC East Asian population, while 37 out of 81 genes (45.7%) overlapped with 37 out of 136 genes (27.2%) from ExAC European population.ConclusionThrough comparison with ExAC East Asian and European population, carrier frequency of disease-causing genes identified in TMCCHFU is much more similar with East Asian population than European population. The difference of carrier frequency among populations should not be ignored and makes it necessary to establish a Chinese-specific panel for genetic disease screen.
虽然单个常染色体隐性遗传病的发病率不高,但各种遗传病的群体加和依然数量惊人,其比例可占婴儿死亡的20%和儿童住院的10%[1]。携带者筛查是针对这类高危人群(如已育患儿的双亲)进行的检测,目的是帮助双亲了解其携带的患某种遗传病的有害隐性致病基因情况。据估计,健康人群中平均每人携带2.8个先天性隐性遗传病的致病基因[2]。针对发生频率较高、具有人群特异性的遗传突变,建立有特异性的筛查基因谱,可对携带者人群进行疾病预警和早期诊断。目前,中国携带者筛查仅局限于特定基因的单一筛查,如耳聋[3]和脊髓性肌萎缩症(SMA)[4,5]等。尚无基于大规模中国人群的常染色体隐性遗传病人群携带频率的数据,更未见采用高通量测序进行携带者人群筛查的报道。对于无疾病家族史和生育记录人群的携带者筛查,只能参考国外现有的临床筛查项目。图1显示,对比人类外显子组整合数据库(ExAC)中东亚和欧洲人群,目前已知的常染色体隐性致病突变频率在东亚和欧洲人群间具有较强的特异性,中国人群在上述目前已知的常染色体隐性致病突变频率是否也具有特异性?
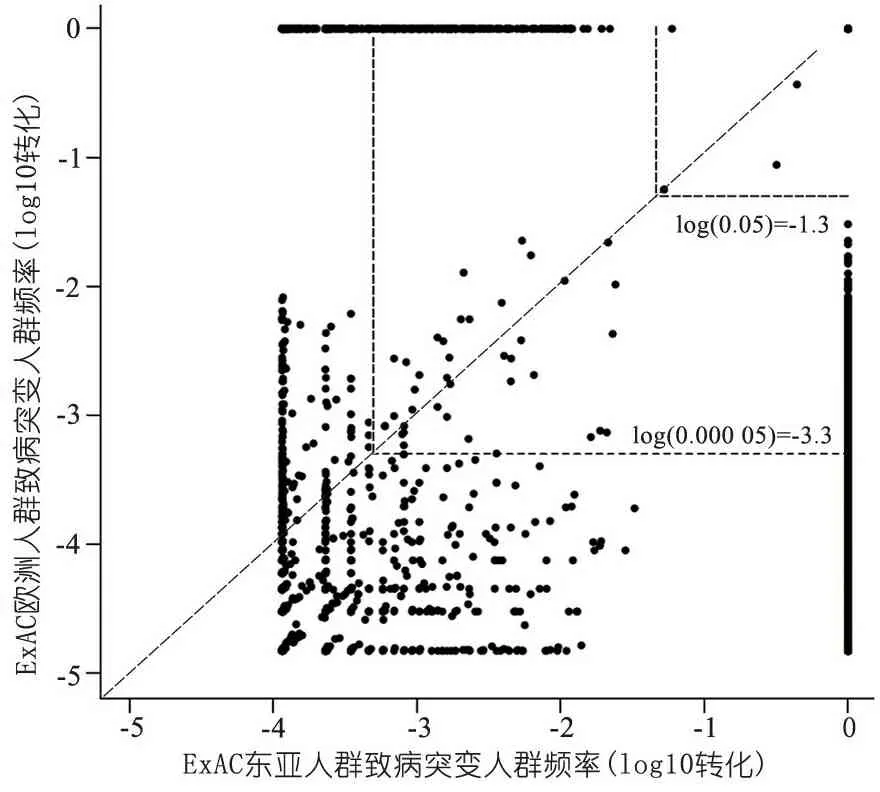
图1已知致病突变的人群频率在ExAC东亚和欧洲人群中差别
注横坐标轴上的点(纵坐标频率为0)表示该基因中的致病突变在欧洲人群中未检测到;纵坐标轴上的点(横坐标频率为0)表示该基因中的致病突变在东亚人群中未检测到
1 方法
1.1研究设计整理公共数据库[人类基因和遗传病的知识库(OMIM)、ClinVar、人类基因突变数据库(HGMD)]中常染色体隐性遗传病的致病基因和致病突变位点,计算复旦大学附属儿科医院分子诊断中心(复旦儿科)样本库中的全外显子组测序(WES)数据,基于公共数据库的致病基因的携带者频率,与公共数据库进行对比,分析中国人群隐性遗传病致病基因携带者频率分布。
1.2已知常染色体隐性突变位点数据来源常染色体隐性遗传病的致病基因注释来源于OMIM。已知的致病突变位点来源于英国的HGMD(http://www.hgmd.cf.ac.uk/ac/index.php)和美国ClinVar数据库(http//:www.nlm.nih.gov/clinvar)。HGMD数据库仅选取分类为致病突变的位点,作为致病置信度等级最高的突变位点;ClinVar数据库挑选注释为致病性的位点,作为致病置信度等级中等的突变位点。过滤数据库中报道的可能性较高的假阳性位点(如ExAC总体数据中≥2次纯合变异报道的位点、复杂疾病的相关位点等)。正常参照人群数据采用ExAC(http://biorxiv.org/content/early/2015/10/30/030338)。
1.3复旦儿科隐性突变位点数据来源复旦儿科样本库中国汉族人群行WES检测到得的数据,所有送检行WES的病例为临床送检病例,送检时均获得家属知情同意。
1.4WES基因组DNA用NanoDrop紫外光分光度仪(美国Thermofisher公司)测定样本的浓度及定量。参照SureSelct Human All Exon试剂盒说明书,基因组DNA经超声打断、末端修复、接头连接和杂交捕获。捕获文库采用Illumina HiSeq2000平台,行WES检测。
1.5测序数据初步分析原始图像文件经Illumina base calling 软件1.7进行图像识别,去除污染及接头序列处理后,Clean reads采用Burrows-Wheeler Aligner(BWA)软件v.0.5.9-r16,以人类基因组hg19(GRCh37)为参考序列进行比对。采用SAMtools软件v.0.1.16,对生成的BAM文件进行排序、合并和去除重复。生成初步分析数据,包括:reads长度分析、数量及总产量、reads比对到参考序列的总序列在基因组中的覆盖度与测序深度等。采用GATK软件 v.3.2.2进行SNV分析。排除低可信度SNPs:①测序深度<4,②一致性质量评分<20,③邻近区域平均拷贝数>2,④与前1个SNV距离<5 bp。
1.6复旦儿科WES样本中突变位点的筛选在保证HGMD已报道位点的前提下,先筛除位于外显子捕获区域外的内含子突变,其次筛除公共数据库中具有较高纯合频率的位点。余下的位点用于后续的对比分析。
1.7携带者频率算法设基因G上存在n个可能发生的已知致病突变位点,其突变发生的频率相互独立,分别为p1,p2...pn。
同时假设,这些突变中的任何一个都能使基因G失活,而基因G的2个等位基因同时失活导致疾病的发生,则:

2 结果

2.2复旦儿科WES数据中致病突变位点的携带者频率评估复旦儿科样本建库以来对1 147例临床样本行WES,共检出1 016个上述公共数据库中筛选后的致病突变位点。在复旦儿科、ExAC东亚人群(4 312例)和欧洲人群(33 301例)之间比较突变位点的出现频率,图2中的每个点代表1个突变,横坐标轴上点(纵坐标频率为0)分别为东亚和欧洲人群特有的致病突变位点,纵坐标轴上点(横坐标频率为0)为复旦儿科人群检测到的特有致病突变位点,未处于坐标轴上的点越接近对角线,则表示突变频率在ExAC相应人群和复旦儿科人群间越相似。对比图2可见,复旦儿科人群致病突变位点的出现频率与ExAC东亚和欧洲人群均存在差异,3个人群中均发现了人群特有的突变位点。相比于ExAC欧洲人群,复旦儿科人群中的致病突变位点出现频率与ExAC东亚人群更为相近,符合本文对于突变位点人群特异性的假设。

图2已知致病突变的人群频率在复旦儿科人群和ExAC东亚和欧洲人群中的差别
注坐标轴上的点表示该基因中的致病突变在相应人群数据库中未检测到;由于3个人群的样本量存在差异(复旦儿科1 147例,ExAC东亚人群4 312例,欧洲人群33 301例),故突变频率的最小值存在差异
2.3致病基因的携带者频率评估图3A为复旦儿科人群中携带者频率>1%的基因(81个)做降序排列,图3B截取了ExAC东亚人群携带者频率>1%的102个基因中的前81个基因做降序排列,图3C截取了ExAC欧洲人群携带者频率>1%的136个基因中的前81个基因做降序排列。
按照携带者频率计算公式计算致病基因的携带者频率,复旦儿科人群1 016个致病突变位点,涉及413个基因,携带者频率最高的是USH2A基因,该基因在复旦儿科人群中共检测到24个致病突变,据此估算出的基因携带者频率为16.8%;9个基因的携带者频率>5%,包括USH2A、PCDH15、CFTR、DYSF、NPHS1、TG、WNT10A、ABCA4和PAH,分别为Usher综合征、囊性纤维化(CF)、肌萎缩、肾病综合征、甲状腺功能减低症、外胚层发育不良、斯特格氏病和苯丙酮尿症的致病基因。②东亚人群中携带者频率>5%的有12个基因(图3B),依次为USH2A、CFTR、PCDH15、DYSF、SLC25A13、MYO7A、CEP290、NPHS1、ITGB3、TG、CD36和WFS1;③欧洲人群中携带者频率>5%有7个基因(图3C),依次为CFTR、ABCA4、MYO7A、CYP21A2、RYR1、VWF和CEP290。
在携带者频率>1%的基因中,复旦儿科和ExAC东亚人群相同的基因分别为70/81个(86.4%)和70/102个(68.6%);在携带者频率>1%的基因中,复旦儿科和ExAC欧洲人群相同的基因分别为37/81个(45.7%)和37/136个(27.2%)。
在携带者频率>5%的基因中,复旦儿科和ExAC东亚人群相同的基因分别为6/9个(66.7%)和6/12个(50.0%),且前4位基因(USH2A、PCDH15、CFTR、DYSF)相同,排序略有不同;在携带者频率>5%的基因中,复旦儿科和ExAC欧洲人群相同的基因分别为2/9个(22.2%)和

图3按不同人群携带者频率排序的隐性遗传致病基因(部分)
注基因分别按复旦儿科(A)、ExAC东亚人群(B)及欧洲人群(C)中的携带者频率降序排列,纵坐标为基因携带者频率的自然对数值
2/7个(28.6%)。复旦儿科和ExAC欧洲人群不相同的7个基因中有5 个基因(USH2A、PCDH15、DXSF、NPHS、TG)出现在东亚人群。
3 讨论
本研究对公共数据库ExAC东亚、欧洲及复旦儿科的WES数据进行携带者频率分析,在复旦儿科人群发现了413个基因上的1 016个文献报道致病突变位点,其中81个致病基因的人群携带者频率>1%。人群间对比发现,携带者频率存在明显的人群差异,但复旦儿科与东亚人群的一致性远高于欧洲人群。对于频率较高(以5%或1%为界)、具有人群筛查价值的基因而言,复旦儿科和东亚人群的基因携带者频率一致性更好。以携带者频率>1%的基因为例,在欧洲人群中携带者频率>1%的基因仅有45.7%在复旦儿科人群中也>1%,而东亚人群中携带者频率>1%的基因有86.4%在复旦儿科人群也>1%,这一特异性也与致病突变在人群间的差异一致。
根据本文结果可以发现,USH2A、CFTR、PCDH15、DYSF等基因在ExAC东亚和复旦儿科人群都有着较高的携带者频率。但也有一些基因在东亚人群表现的携带者频率比复旦儿科人群高,比如MYO7A、CD36、SLC25A13、CEP290和ITGB3。频率差别的主要原因有2种,MYO7A和CD36在ExAC东亚人群中检出了更多的致病突变数量;SLC25A13和ITGB3在致病热点上有显著的差异;CEP290则2种原因皆有。
CFTR基因在复旦儿科、ExAC东亚或欧洲人群中都有很高的携带者频率,且在东亚和欧洲人群中的携带率较复旦儿科人群高。该基因突变会导致CF,被认为是欧美常见,亚洲及中国罕见的遗传病。刘亭威等[6]复习文献检索到26例中国CF患者,临床表现与欧美人群相似,但CFTR基因突变位点可能与白种人不同。有研究发现[7],中国CF患者的CFTR基因突变类型与西方有很大差异。本研究中,CFTR基因在ExAC东亚和复旦儿科人群携带率高,但发病率低,可能是由于在欧洲人群中发现的致病突变在亚洲人群中表现出的症状较轻或无症状。因此,单纯使用欧美CFTR常见突变进行筛查不能反映中国人群的CFTR基因突变携带情况,应结合中国实际人群的突变携带位点设计筛查项目。
Usher综合征以不同程度的视网膜色素变性和感音神经性耳聋为主要表现,致病基因为USH2A、PCDH15、MYO7A等。美国的Usher综合征发病率为(1~4)/25 000[8,9],国内尚无发病率数据。本研究复旦儿科人群Usher综合征致病基因的携带者频率较高,但依然与东亚人群的携带者频率相一致。推测,HGMD中报道的欧洲人群的致病位点有可能在亚洲人群中表现为不致病的热点突变。进一步分析,在USH2A基因中,如c.5953G>A, c.10246T>G, c.4758+3A>G等多个突变位点在ExAC东亚人群(约4 000人)中出现10~140次,而在欧洲人群(约30 000人)中出现均<10次,同时这些位点在千人基因组计划数据库中的亚洲人群的频率在1%左右,而欧洲人群的频率却为0,说明存在具有很强人群特异性的致病突变位点。参考以往研究发现中国人群与欧美人群USH2A基因致病的突变谱有着很大的差异[10],证明Usher综合征相关基因突变位点的致病性可能存在人群特异性,说明现有文献报道的致病突变在应用于其他人群时,突变位点的致病性还有待商榷。这也可以解释Usher综合征在ExAC东亚和复旦儿科人群均出现的致病基因携带者频率高,但发病率低的情况。
除此之外,本研究呈现的大部分内容能够很好的反映临床情况。如TG基因突变导致的先天性甲状腺功能减低症在中国的发病率为49.2/100 000[11],而该病在欧美人群的发病率为28/100 000[12],本研究结果也同样显示复旦儿科人群的TG突变频率高于欧洲人群。亚洲人高发的Citrin缺乏病的致病基因SLC25A13,在东亚和复旦儿科人群的携带者频率远高于欧洲人群。这与该病主要在东亚地区分布[13],在中国遗传代谢疾病谱中排第2位的情况也相符合[14]。而与线粒体DNA质量相关的POLG基因突变,会导致Alpers-Huttenlocher综合征、遗传性进行性眼外肌麻痹等一系列疾病,则表现为欧美人群发病率高于亚洲人群,这与本研究的欧洲人群携带者频率高于东亚及复旦儿科人群也是相一致的。再如PCCA基因突变会导致丙酸血症,本研究结果中该基因的携带者频率在复旦儿科和东亚人群中约为3%,而欧洲人群中则<1%。既往并未报道丙酸血症的发病率有明显的人群差异,但丙酸血症的致病基因除了PCCA外还有PCCB,结果发现PCCB基因的携带者频率在欧洲人群中约为2%,而东亚和复旦儿科人群中则<1%。该数据体现了丙酸血症在人群致病基因的特异性。
虽然复旦儿科人群携带者频率与ExAC东亚人群较为吻合,但是由于本研究的研究对象是临床送检的样本,并非健康的人群,仍存在样本选择的偏倚,可能导致与中国人群实际频率存在偏差。如IL10-RA基因在复旦儿科的携带者频率较东亚人群及欧洲人群均高出许多,原因在于复旦儿科的样本中有1例先天性免疫缺陷的患儿,由于IL10-RA基因隐性突变所致,而该患儿的2个隐性突变分别来自其双亲,所以该家系使得在本研究中IL10-RA基因的携带者频率显著增高。除此之外,本研究仅针对常染色体隐性遗传疾病致病基因中点突变的形式进行携带者频率计算,并不包括基因的大片段缺失的携带者频率。所以本研究中的携带者频率较高的基因并没有包含某些发病率高、因大片段缺失或者拷贝数变异导致的疾病,如地中海贫血[15]和SMA[5]。
携带者筛查能有效降低常染色体隐性疾病的发病率。在以色列针对CF的人群携带者筛查已经取得成效,一项回顾性研究显示,CF发病率已经从1990年的14.5/10万降至2011年的6/10万[16]。中国仅对于严重的常染色体隐性遗传病,如地中海贫血、X连锁肾上腺脑白质营养不良、SMA等开展了单个疾病的携带者筛查,对于其他常见遗传携带者突变位点,仍需建立新的携带者筛查项目,以明确中国人群致病突变的携带率。当然,不是所有的隐性遗传性疾病都适合进行筛查和产前诊断,对于一些外显不全的致病基因,或临床危害不严重的疾病如色盲,则并不建议进行遗传筛查和家庭遗传咨询[17]。目前,高通量测序成本的降低,使大规模的遗传筛查成为可能[18,19]。而随着生殖技术的发展,基因测序在临床的应用,除了熟知的无创产前检测外,还有胚胎植入前遗传学检测技术。这些技术的应用,真正使基因检测的结果服务于临床,使患者家庭受益,也推动了基因筛查的普及和应用。
本研究通过大规模对比文献报道的致病突变位点在不同人群间的频率差异,明确了致病突变位点在不同人群中具有很大的差异性。在此基础上计算的致病基因携带者频率,也表现出人群特征。因此,若要建立中国人群常见遗传携带者突变位点筛查项目,有必要针对致病突变的人群差异对筛选内容做出调整,通过参考中国人群的致病突变频率设计高通量的基因筛查方案,为包括有生育需求的成年人、已计划怀孕的夫妇,尤其是对已生育患儿的家庭再计划怀孕的高危人群提供携带者筛查,或是为家庭遗传咨询提供依据。
[1]Kumar P, Radhakrishnan J, Chowdhary MA, et al. Prevalence and patterns of presentation of genetic disorders in a pediatric emergency department. Mayo Clin Proc, 2001,76(8):777-783
[2]Bell CJ, Dinwiddie DL, Miller NA, et al. Carrier testing for severe childhood recessive diseases by next-generation sequencing. Sci Transl Med, 2011,3(65):65ra4
[3]吕康模, 熊业华, 俞皓, 等. 17000名新生儿遗传性耳聋基因突变筛查. 中华医学遗传学杂志, 2014,31(5):547-552
[4]曲晓星, 肖冰, 季星, 等. 应用荧光定量PCR对上海地区人群进行脊肌萎缩症携带者筛查. 中华医学遗传学杂志, 2013,30(1):1-4
[5]龚波, 章莉, 侯雅萍, 等. 中国上海地区4719名孕妇脊髓性肌萎缩症携带者筛查. 中华医学遗传学杂志, 2013,30(6):670-672
[6]刘亭威, 康健. 中国人囊性纤维化临床特点分析. 中国全科医学, 2012,15(24):2807-2810
[7]Liu Y, Wang L, Tian X, et al. Characterization of gene mutations and phenotypes of cystic fibrosis in Chinese patients. Respirology, 2015,20(2):312-318
[8]Boughman JA, Vernon M, Shaver KA. Usher syndrome: definition and estimate of prevalence from two high-risk populations. J Chronic Dis, 1983,36(8):595-603
[9]Kimberling WJ, Hildebrand MS, Shearer AE, et al. Frequency of Usher syndrome in two pediatric populations: Implications for genetic screening of deaf and hard of hearing children. Genet Med, 2010,12(8):512-516
[10]李杨. 中国人与欧美人USH2A基因突变谱不同. 中华实验眼科杂志, 2011,29(11):961-963
[11]徐艳华, 秦玉峰, 赵正言. 中国新生儿先天性甲状腺功能低下症与苯丙酮尿症筛查22年回顾. 中华儿科杂志, 2009,47(1):18-22
[12]Barry Y, Bonaldi C, Goulet V, et al. Increased incidence of congenital hypothyroidism in France from 1982 to 2012: a nationwide multicenter analysis. Ann Epidemiol, 2016,26(2):100-5 e4
[13]Lu YB, Kobayashi K, Ushikai M, et al. Frequency and distribution in East Asia of 12 mutations identified in the SLC25A13 gene of Japanese patients with citrin deficiency. J Hum Genet, 2005,50(7):338-346
[14]Song YZ, Li BX, Hao H, et al. Selective screening for inborn errors of metabolism and secondary methylmalonic aciduria in pregnancy at high risk district of neural tube defects: a human metabolome study by GC-MS in China. Clin Biochem, 2008,41(7-8):616-620
[15]蔡稔, 李莉艳, 梁昕, 等. 柳州市城镇人群α和β地中海贫血的发生率调查和基因型鉴定. 中华流行病学杂志, 2002,23(4):281-285
[16]Stafler P, Mei-Zahav M, Wilschanski M, et al. The impact of a national population carrier screening program on cystic fibrosis birth rate and age at diagnosis: Implications for newborn screening. J Cyst Fibros, 2015, pii:S1569-1993(15)00203-9
[17]Wienke S, Brown K, Farmer M, et al. Expanded carrier screening panels-does bigger mean better? J Community Genet, 2014,5(2):191-198
[18]Tanner AK, Valencia CA, Rhodenizer D, et al. Development and performance of a comprehensive targeted sequencing assay for pan-ethnic screening of carrier status. J Mol Diagn, 2014,16(3):350-360
[19]Umbarger MA, Kennedy CJ, Saunders P, et al. Next-generation carrier screening. Genet Med, 2014,16(2):132-140
(本文编辑:张崇凡)
Carrier analysis of known disease-causing genes based on WES data from single Shanghai pediatric center
LINYi-feng1,WANGHui-jun2,WUBing-bing2,YANGLin2,DONGChen2,LUYu-lan2,ZHOUWen-hao3
(1InstituteofPediatrics, 2MolecularDiagnosticCenter, 3DepartmentofNeonatology,Children′sHospitalofFudanUniversity,Shanghai201102,China)
LU Yu-lan,E-mail:yulanlu@fudan.edu.cn
Whole exome sequencing;Genetic disease;Carrier;Mutation screening
2016上海市青年科技英才扬帆计划:16YF1401000; 2016上海自然科学基金探索类项目:16ZR1446500
复旦大学附属儿科医院1 儿科研究所,2 分子诊断中心,3 新生儿科上海,201102
卢宇蓝,E-mail:yulanlu@fudan.edu.cn
10.3969/j.issn.1673-5501.2016.03.009
2016-02-23
2016-06-08)
