淫羊藿素药物在终板软骨细胞退变中的保护作用研究
2016-09-20徐永明徐宏光张晓玲
徐永明,徐宏光,张晓玲,王 弘,高 智,肖 良
(1.皖南医学院第一附属医院弋矶山医院脊柱外科,芜湖 安徽 241001;2.中国科学院上海生命科学院骨科细胞与分子生物学实验室,上海 200025)
淫羊藿素药物在终板软骨细胞退变中的保护作用研究
徐永明1,徐宏光1,张晓玲2,王弘1,高智1,肖良1
(1.皖南医学院第一附属医院弋矶山医院脊柱外科,芜湖安徽241001;2.中国科学院上海生命科学院骨科细胞与分子生物学实验室,上海200025)
目的:探讨淫羊藿素药物对张力诱导下终板软骨细胞退变的保护作用.方法:分离获取大鼠终板软骨细胞,体外培养建立终板软骨细胞加力退变模型.设对照组(未加力的终板软骨细胞,NC组)、加力组(10%间歇性循环牵张力,10%ICMT,0.5Hz,8h/d,加力3天,ICMT组)及加力加药物组(加力组中加入不同浓度中药淫羊藿素,加药+ICMT组).倒置相差显微镜观察细胞形态学变化,甲苯胺蓝染色鉴定细胞表型. MTT法检测大鼠终板软骨细胞的增殖.实时聚合酶链反应及Westernblotting检测Ⅱ型胶原(COL2A1)、蛋白多糖(ACAN)及SOX-9基因变化.结果:淫羊藿素在低浓度(<2umol/L)药物范围内对大鼠终板软骨细胞生长无明显毒性作用,较高浓度对细胞生长与增殖有明显的抑制作用.终板软骨细胞体外加力后细胞表型改变,甲苯胺蓝染色可见细胞外基质减少,加药+ICMT组细胞外基质未见明显减少.淫羊藿素药物在一定药物范围内对大鼠终板软骨细胞具有保护作用,抑制细胞软骨细胞退变发生.结论:淫羊藿素通过抑制椎间盘终板软骨细胞退变的发生,进而起到保护终板软骨的作用.
淫羊藿素;终板软骨细胞;间歇性循环牵张力(ICMT);软骨细胞退变
颈腰痛是临床上常见的慢性疾病,发病趋势渐年轻化,严重影响患者的正常生活和工作.椎间盘退变被认为是引起颈腰痛的重要病因[1],而目前临床对于该疾病治疗上主要为对症治疗,虽可暂时缓解患者的临床症状,但无法从根本上预防或阻止椎间盘进一步退变.因此针对椎间盘退变的病理生理过程采取相应干预措施对预防椎间盘退变意义尤为重要.作为人体中最大的无血管组织,椎间盘营养供给主要通过终板途径实现[2].保护终板软骨能够延缓椎间盘退变的发生.我们前期研究发现,体外实验中对终板软骨细胞给与间歇性循环牵张力会引起终板软骨细胞外基质改变[3],进而出现终板软骨细胞退变.淫羊藿为我国传统中药,范曾丽等[4]研究表明该药具有治疗肾阳虚衰、风湿麻痹等疾病,同时还具有抗衰老、促进骨细胞生长,抗肿瘤等多方面疗效.淫羊藿素(icaritin)为淫羊藿苷衍生物,具有促进成骨细胞增殖[5]、抗氧化和预防骨质疏松[6]、保护神经损伤[7]、治疗心血管方面疾病[8].淫羊藿素在促进成骨细胞生长与增殖方面研究逐渐受到人们的重视,然而其对终板软骨细胞影响研究报道甚少.因此,本研究建立在前期细胞加力退变模型的基础上,观察淫羊藿素药物在软骨细胞退变过程中所起到的相关作用,为临床上椎间盘退行性疾病提供新的治疗手段.
1 材料与方法
1.1材料:
1.1.1实验动物:清洁级SD(SpragueDawley)大鼠8只(6-8周龄),雌雄不限,体重(160±15)g,上海斯莱克实验动物有限公司提供[SCXK(沪)2012-0002].
1.1.2试剂及仪器:二型胶原酶(Sigma.Aldrich,美国);胰蛋白酶;胎牛血清(Gibico,美国);DMEM/F12(Hyclone,美国);MTT试剂(美国Sigma公司产品);纯度为98%的淫羊藿素购自上海源叶生物科技有限公司;细胞计数仪和Trizol(Invitrogen,美国);RealtimePCR试剂盒(TOYOBO,中国);Nano-Drop2000(Thermo& Scientific,美国);凝胶成像系统(Tanon;中国);实时逆转录聚合酶链反应(realtimeRT-PCR)仪(RocheLightCycler480,德国);FX-5000细胞应变加载系统、BioFlexTM六孔多向加力板(美国Flexcellint国际公司);Ⅱ型胶原抗体(BioworldTechnology,美国);SOX-9、Ⅱ型胶原、蛋白聚糖、GAPDH引物合成(生工生物公司,上海).
1.2方法
1.2.1分离培养大鼠原代终板软骨细胞:取8只清洁级SD大鼠,颈椎脱臼法处死后常规消毒,超净台内完整取出腰椎,剥离肌肉组织后用手术刀片分别刮取各个腰椎的终板软骨,用含1%双抗(青霉素-链霉素混合液)的磷酸盐缓冲液(PBS)中洗2-3次,再将终板软骨组织剪碎成约1mm3大小,0.25%胰酶消化30min后,加入0.2%的II型胶原酶消化6h,悬液过滤两次,滤过液以1000r/min离心5min,吸除消化液,加入含10%胎牛血清的DMEM/F12培养液吹打混匀,种植于10cm培养皿后放入培养箱内培养(37℃含5%CO2),2-3天换液一次,细胞融合至80-90%时按1:2或1:3传代. 取P2代细胞进行实验,实验分为未加力组(NC组)、加力组(ICMT,10%ICMT,0.5Hz,8h/d)及加力加药组(细胞加力前24h给与含不同浓度的淫羊藿素药物的培养液预处理)细胞进行检测,各组细胞培养均在相同条件下进行.
1.2.2MTT比色法检测细胞增殖率:将对数期细胞按1×104/孔接种至96孔细胞培养板中,待细胞贴壁后分别加入终浓度为0,0.01,0.1,0.5,1,2,4,8,16μmol/L的淫羊藿素.分别于加药处理24h、48h、72h时时弃去培养液,加入 MTT使用液(100ul/孔),培养箱孵育4h;弃去MTT使用液,PBS洗涤一次,加入DMSO并摇荡15min(室温).待颗粒完全溶解后,用酶标仪在测定波长545nm/570nm,参考波长630nm处测定吸光度值.
1.2.3甲苯胺蓝染色:PBS洗涤2次,用4%多聚甲醛固定15min,PBS洗涤2次,甲苯胺蓝染色30min,吸除染液PBS洗涤,自然晾干后,倒置显微镜下观察拍照.
1.2.4RNA提取及RT-PCR:吸除六孔板的培养液,用PBS洗涤2次,各孔加入1mlTrizol冰上裂解提取RNA,用Nano-Drop2000测定RNA浓度并鉴定RNA纯度,所提取RNA的OD260/OD280值在1.8-2.0之间则达到实验要求,根据获得的RNA浓度,按20μl反转体系一步法反转成cDNA,产物cDNA稀释10倍后进行RT-PCR,每个样品设置三个复孔.反应条件:95℃预变性30s;95℃变性5s;60℃退火延伸25s,扩增50个循环.GAPDH为内参.用RocheLightCycler480软件自动分析结果,计算2-△△Ct值[9],PCR引物序列如表1.

表1 RealTimePCR引物序列表
1.2.5Westernblotting检测:吸除六孔板中的培养液,PBS洗涤2次,各孔加入含1%PMSF100μl蛋白提取缓冲液(RIPA),于冰上裂解30min后用细胞刮除器刮净六孔板中的细胞,移入1.5mlEP管中,12000r/min离心15min,挑除细胞碎片,吸取上清,取10μl蛋白用BCA定量法测定蛋白浓度,剩余蛋白加入蛋白上样缓冲液于高温混匀仪中99℃煮5min使蛋白变性,-20℃长期保存.根据测定的蛋白浓度上样,十二烷基酸钠聚丙烯酸铵(SDS-PAGE)凝胶电泳,分离胶跑30min,浓缩胶跑60min,300Ma电流转膜120min.5%牛血清白蛋白(BSA)封闭1h,一抗(封闭液稀释1:800),4℃冷库摇床上孵育过夜,洗膜缓冲液(TBST)冲洗三次,每次8min.二抗(封闭液稀释1:5000)室温摇床孵育1h,TBST洗膜三次,每次15min,凝胶成像系统显影成像.
1.2.7统计学处理:实验所得数据均由SPSS18.0统计软件处理,以±s表示,各组比较采用两独立样本间t检验,设检验水准为α=0.05,P<0.05即为差异有统计学意义.
2 结果
2.1大鼠终板软骨细胞表型的鉴定:倒置相差显微镜下观察,大鼠终板软骨细胞在间歇性循环牵张力刺激后,细胞形态由偏圆颗粒状形逐渐变为长梭形,正常细胞铺路石样排布消失,甲苯胺蓝染色可见细胞外基质淡染,随着加力的进行软骨细胞逐渐发生退变,用淫羊藿素药物预处理的加力组细胞形态清晰,未成多角形,细胞仍呈铺路石样排布(见图2).
2.2MTT法检测淫羊藿素药物对细胞增殖率影响:低浓度(<2umol/L)淫羊藿素药物对细胞生长无明显毒性影响,较高浓度淫羊藿素药物对细胞增殖具有明显抑制作用(见图3).
2.3RT-PCR检测:(1)软骨细胞表型基因:10% ICMT,0.5Hz,8h/d,加力3天细胞组(ICMT组)较未加力细胞(NC组)COL2A1、ACAN、SOX-9表达明显降低(P<0.05)(见图4);(2)加入0.5、1、2umol/L浓度淫羊藿素药物加力组(加药+ICMT组)与ICMT组比较COL2A1、ACAN、SOX-9表达增高,与药物浓度梯度呈正相关性(见图5).
2.4Westernblotting检测:ICMT组较未加力组相比,COL2A1表达含量明显减低(见图6-1),加药+ICMT组与ICMT组比较COL2A1表达含量渐增高(见图6-2).
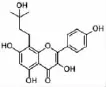
图1 淫羊藿素化学结构式

图2 终板软骨细胞形态及表型鉴定(甲苯胺蓝染色)

图3 MTT法检测淫羊藿素药物不同浓度对细胞增殖影响

图4 力学刺激后终板软骨细胞相关基因表达变化(NC组与ICMT组比较*代表P<0.05,**代表P<0.01)
3 讨论
终板软骨是介于椎间盘与椎体之间的薄层透明软骨,主要由软骨细胞和细胞外基质组成,对运动过程中产生的力学刺激具有重要调节作用[10],力学刺激在椎间盘退变过程中伴有重要角色[11].过度不当的力学刺激会引起椎间盘退变,进而出现腰腿痛和神经功能障碍[12].前期研究表明,体外给予终板软骨细胞施加10%、0.5Hz的间歇性循环牵张力,随着加力时间的延长细胞外基质ACAN、COL2A1逐渐降低,软骨基质合成中起到关键基因SOX-9表达含量下调,软骨细胞出现退变,同时我们发现在该条件下间歇性循环牵张力不会引起细胞凋亡[13].

图5 淫羊藿素药物处理后力学刺激终板软骨细胞相关基因表达变化(加药+ICMT组与ICMT组比较,*代表P<0.05,**代表P<0.01)

图6-1 NC组与ICMT组细胞中COL2A1蛋白表达检测图6-2ICMT组与加药+ICMT组细胞中COL2A1表达检测
淫羊藿素为黄酮醇类化合物,是通过淫羊藿多步萃取制得,相关研究表明淫羊藿素具有预防骨质疏松、预防癌症、保护神经等疗效,因此越来越受到人们的重视.目前针对该药物在软骨细胞方面研究甚少,尤其对终板软骨细胞方面研究鲜有报道.本实验在建立的大鼠终板软骨体外加力退变模型基础上,通过不同浓度药物处理因力学刺激引起终板软骨细胞退变,发现该药物对加力引起终板软骨细胞退变具有保护作用.软骨外基质相关COL2A1、ACAN、SOX-9表达含量较ICMT组均明显增高,在药物浓度2umol/L时作用最为明显.LeiZhang等[14]报道淫羊藿素药物浓度在1×10-5M浓度对细胞毒性较小,能够起到促进细胞外基质合成作用,我们实验结果与其基本一致,但是药物浓度高于2umol/L时会导致细胞凋亡,出现该结果可能与不同细胞对药物敏感程度以及不同厂家生产药物纯度等因素有关.因此,我们有理由认为淫羊藿素药物对力学刺激引起的终板软骨细胞退变起到良好的保护作用,为今后治疗椎间盘退变性疾病提供了新的思路.
〔1〕MANEKNJ,MACGREGORAJ.Epidemiologyofbackdisorders:prevalence,riskfactors,andprognosis[J].Currentopinionin rheumatology,2005,17(2):134-40.
〔2〕RODRIGUEZAG,RODRIGUEZ-SOTO AE,BURGHARDTAJ,etal.Morphology ofthehumanvertebralendplate[J].Journalof orthopaedicresearch:officialpublicationof theOrthopaedicResearchSociety,2012,30(2):280-7.
〔3〕XUHG,YUYF,ZHENGQ,etal.Autophagyprotectsendplatechondrocytesfrom intermittentcyclicmechanicaltensioninduced calcification[J].Bone,2014,66(23):2-9.
〔4〕范曾丽,权秋梅.淫羊藿的药理研究进展[J].安徽农业科学,2012(17):92-96.
〔5〕MAXN,ZHOUJ,GEBF,etal.Icariin inducesosteoblastdifferentiationandmineralizationwithoutdexamethasoneinvitro[J]. Plantamedica,2013,79(16).
〔6〕JIANGJ,LIJ,JIAX.Theantiosteoporotic activityofcentral-icaritin(CIT)onbone metabolismofovariectomizedrats[J].Molecules (Basel,Switzerland),2014,19(11).
〔7〕张如意,张丽,艾厚喜.淫羊藿苷对线粒体损伤模型大鼠脑内β-淀粉样蛋白和神经营养因子的影响[J].中国中药杂志,2013(09).
〔8〕ZHOUH,YUANY,LIUY,etal.Icariin attenuatesangiotensinII-inducedhypertrophy andapoptosisinH9c2cardiomyocytesbyinhibitingreactiveoxygenspecies-dependent JNKandp38pathways[J].Experimentaland therapeuticmedicine,2014,7(5).
〔9〕LIVAKKJ,SCHMITTGENTD.Analysisof relativegeneexpressiondatausingreal-time quantitativePCRandthe2(-DeltaDeltaC (T)Method[J].Methods(SanDiego,Calif),2001,25(4).
〔10〕FERGUSONSJ,STEFFENT.Biomechanicsoftheagingspine[J].Europeanspine journal:officialpublicationoftheEuropean SpineSociety,theEuropeanSpinalDeformity Society,andtheEuropeanSectionofthe CervicalSpineResearchSociety,2003,12.
〔11〕LOTZJC,ULRICHJA.Innervation,inflammation,andhypermobilitymaycharacterizepathologicdiscdegeneration:reviewof animalmodeldata[J].TheJournalofbone andjointsurgeryAmericanvolume,2006,88.
〔12〕ALKHATIBB,ROSENZWEIGDH,KROCKE,etal.Acutemechanicalinjuryof thehumanintervertebraldisc:linktodegenerationandpain[J].Europeancells&materials,2014,28.
〔13〕XUHG,ZHENGQ,SONGJX,etal. Intermittentcyclicmechanicaltensionpromotesendplatecartilagedegenerationvia canonicalWntsignalingpathwayandE-cadherin/beta-catenincomplexcross-talk[J].Osteoarthritisandcartilage/OARS,OsteoarthritisResearchSociety,2016,24(1):158-165.
〔14〕ZHANGL,ZHANGX,LIKF,etal.I-cariinpromotesextracellularmatrixsynthesis andgeneexpressionofchondrocytesinvitro [J].Phytotherapyresearch:PTR,2012,26(9):85-92.
R681
A
1673-260X(2016)08-0054-04
2016-06-15
国家自然科学基金(ProjectsupportedbytheNationalNaturalScienceFoundationofChina)(81272048、30973025、81311130314);卫生部公益性行业专项基金(Ministryofhealthpublicwelfareindustryspecialfund)(201002018)
