国内应用TACE联合核苷类抗病毒药物治疗中晚期肝癌疗效的系统评价
2016-09-20李子林翁高龙王洪波张新华
李 宏, 李子林, 朱 能, 翁高龙, 王洪波, 张新华
湖北省肿瘤医院肝胆胰外科,武汉 430079
国内应用TACE联合核苷类抗病毒药物治疗中晚期肝癌疗效的系统评价
李宏,李子林,朱能,翁高龙,王洪波,张新华△
湖北省肿瘤医院肝胆胰外科,武汉430079
目的通过Meta分析的方法对国内应用TACE联合核苷类抗病毒药物治疗中晚期肝癌的疗效进行系统评价。方法计算机检索维普科技期刊数据库(1989~2015)、万方数据库(1999~2015)、中国知网数据库(1994~2015)、学术期刊网络出版总库等数据库中关于TACE联合核苷类抗病毒药物治疗中晚期肝癌疗效的临床随机对照试验(RCT),对符合要求的RCT进行Meta分析。结果最终纳入24篇RCT,共有2 085例患者符合纳入标准。Meta分析结果显示:较TACE治疗组,TACE联合抗病毒治疗组的临床有效率高[总效应Z=4.95,OR=1.83,95%CI(1.44,2.32),P<0.01],1年生存率高[总效应Z=8.54,OR=2.86,95%CI(2.25,3.64),P<0.01],Child-Pugh评分低[总效应Z=8.64,MD=-0.84,95%CI(-1.03,-0.65),P<0.01],ALT水平低[总效应Z=5.99,MD=-23.27,95%CI(-30.88,-15.65),P<0.01],并发症及不良反应并没有增加[总效应Z=0.31,OR=1.30,95%CI(0.25,6.71),P=0.76]。结论较TACE治疗,TACE联合核苷类药物抗病毒治疗中晚期肝癌能提高临床有效率及患者生存率,改善肝功能,而并发症及不良反应并没有增加。
肝癌;TACE;疗效;抗病毒治疗;Meta分析
原发性肝癌(primary hepatic carcinoma,PHC)是我国常见的消化道肿瘤之一,绝大多数患者伴有乙型肝炎病毒感染。由于起病隐匿,大多数患者出现临床症状时已进展到了中、晚期,丧失了手术切除机会,预后很差。目前,经肝动脉栓塞化疗术(transhepatic arterial chemotherapy and embolization,TACE)是治疗中晚期肝癌的首选方案。有文献报道,TACE治疗时动脉内灌注的化疗药物不仅损伤正常的肝组织,而且抑制机体免疫功能,进一步导致乙型肝炎病毒(HBV)的激活,加重肝损伤,甚至引起肝衰竭[1]。也有较多的文献报道,应用TACE联合核苷类抗病毒药物治疗中晚期PHC取得了满意的疗效,减轻了TACE术后肝损伤,提高了患者的生存率[2-3]。但这些文献样本量均较小,文献质量不高,影响了研究结论的可靠性和真实性。本研究拟采用Meta分析的方法,总结国内多篇随机对照试验(randomized controlled trails,RCT)系统评价TACE联合核苷类抗病毒药物治疗中晚期PHC的疗效,以期提供循证医学依据,指导临床应用。
1 资料与方法
1.1检索策略
计算机以“肝癌and TACE and病毒”or“肝癌and介入治疗and病毒”or“肝癌and TACE and拉米夫定”or“肝癌and TACE and恩替卡韦”or“肝癌and TACE and阿德福韦酯”or“肝癌and TACE and替比夫定”为检索词,检索万方数据库(1999~2015年)、学术期刊网络出版总库、维普科技期刊数据库(1989~2015年)、中国知网数据库(1994~2015年)。
1.2文献纳入和排除标准
1.2.1纳入文献的特征检阅文献全文,收集所有应用TACE联合核苷类抗病毒药物治疗中晚期PHC的RCT,去掉试验性研究及非RCT后,共纳入24篇文献,2 085例患者符合纳入标准。24篇文献都为RCT,其质量均为中等,13篇RCT比较了临床有效率;18篇RCT比较了1年生存率,9篇RCT比较了Child-Pugh评分,8篇RCT比较了血清谷丙转氨酶(ALT),4篇RCT比较了并发症及不良反应。
1.2.2纳入及排除标准①符合2001年《原发性肝癌的临床诊断与分期标准》及《病毒性肝炎防治方案》诊断为乙型肝炎相关原发性肝癌,且无手术治疗指征[4];②未经任何放化疗及手术等治疗,无其他重要器官疾病;③无TACE治疗禁忌证[5];④HBV-DNA检测大于1×103copies/mL;⑤预计生存期>3个月;⑥患者及家属同意治疗方案。
1.2.3疗效评价标准①临床疗效参照WHO实体肿瘤疗效评价标准(RECIST)分为完全缓解(CR)、部分缓解(PR)、稳定(SD)及进展(PD),临床有效率=(CR+PR)例数/总例数×100%;②肝脏储备能力以Child-Pugh评分为评定标准;③肝脏功能以ALT水平变化为评定标准;④生存状况以1年生存率为评定标准;⑤并发症及不良反应。
1.2.4干预措施实验组患者接受常规药物保肝+TACE+核苷类药物(拉米夫定、替比夫定、恩替卡韦、阿德福韦酯)抗病毒治疗;对照组患者接受常规药物保肝+TACE治疗。
1.3疗效指标
临床有效率,1年生存率,肝功能(ALT),Child-Pugh评分,并发症及不良反应。
1.4文献质量评价
将所有纳入的文献根据Cochrane Handbook for Systematic Reviews of Intervention的质量评价标准进行质量评价[6]:①随机方法是否正确;②是否做到分配隐藏;③是否采用盲法;④报道失访及退出的人数和原因;⑤是否采用意向治疗分析;⑥基线可比性。文献质量分为A、B、C三级:A级完全符合以上标准(偏倚较小);B级部分符合以上标准(偏倚中等);C级完全不符合以上标准(偏倚较大)。
1.5资料分析
采用Review Manager 5.1软件对数据进行Meta分析。通过χ2检验分析各项RCT的异质性。文献异质性的来源不清楚(P<0.1),则进行描述性分析。各项RCT具有同质性(I2<50%,P>0.1),则选择固定效应模型分析;各项RCT具有异质性(I2≥50%,P<0.1),则选择随机效应模型分析;对二分类资料计算比值比(odds ratio,OR)值,分析均计算95%可信区间(confidence interval,CI),以α=0.05为检验水准。
2 结果
2.1纳入文献概况
首次检索到文献68篇,仔细阅读全文,符合标准的RCT 26篇,去掉2篇重复发表RCT,最终纳入24项研究。5篇RCT描述了随机方法,其余未对具体随机方法作出说明,所有RCT均对随机方案是否隐藏等信息作出说明;1篇RCT报道失访者按死亡计数,其余23篇RCT均未作出文字说明,所以研究质量均为中等质量研究(表1)。
2.2临床有效率
采用固定效应模型分析(P=0.47,I2=0%),取α=0.05为检验水准。森林图(图1)结果显示:TACE联合抗病毒治疗组共624例患者,有374例有效;TACE治疗组共602例患者,有282例有效。总效应Z=4.95,P<0.01,OR=1.83,95%CI:1.44~2.32,提示TACE联合抗病毒治疗晚期PHC临床有效率高于TACE治疗。漏斗图观察到各项研究分布尚对称,提示纳入的13篇RCT偏倚较小,纳入得当(图2)。
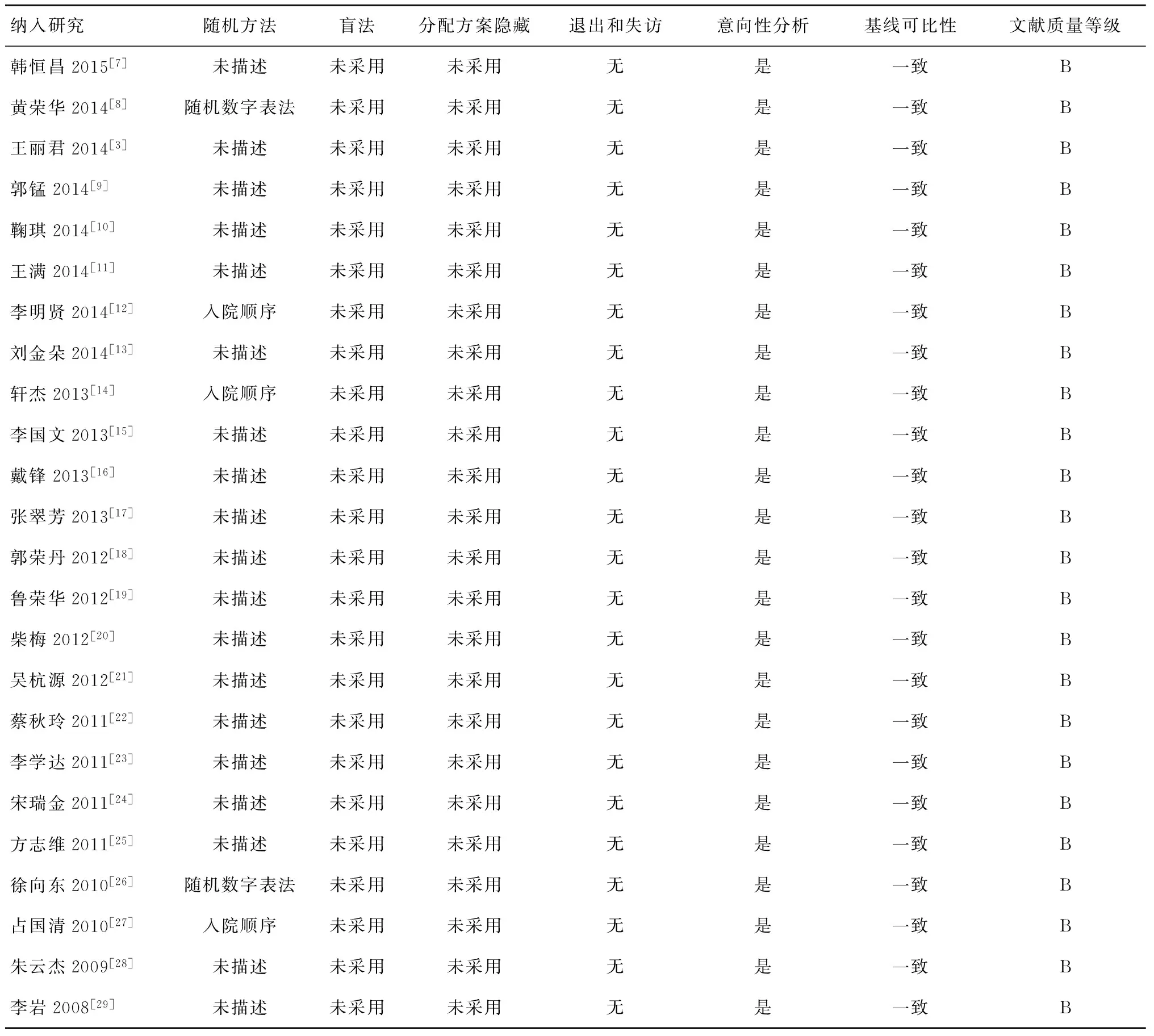
表1 纳入RCT的质量评价
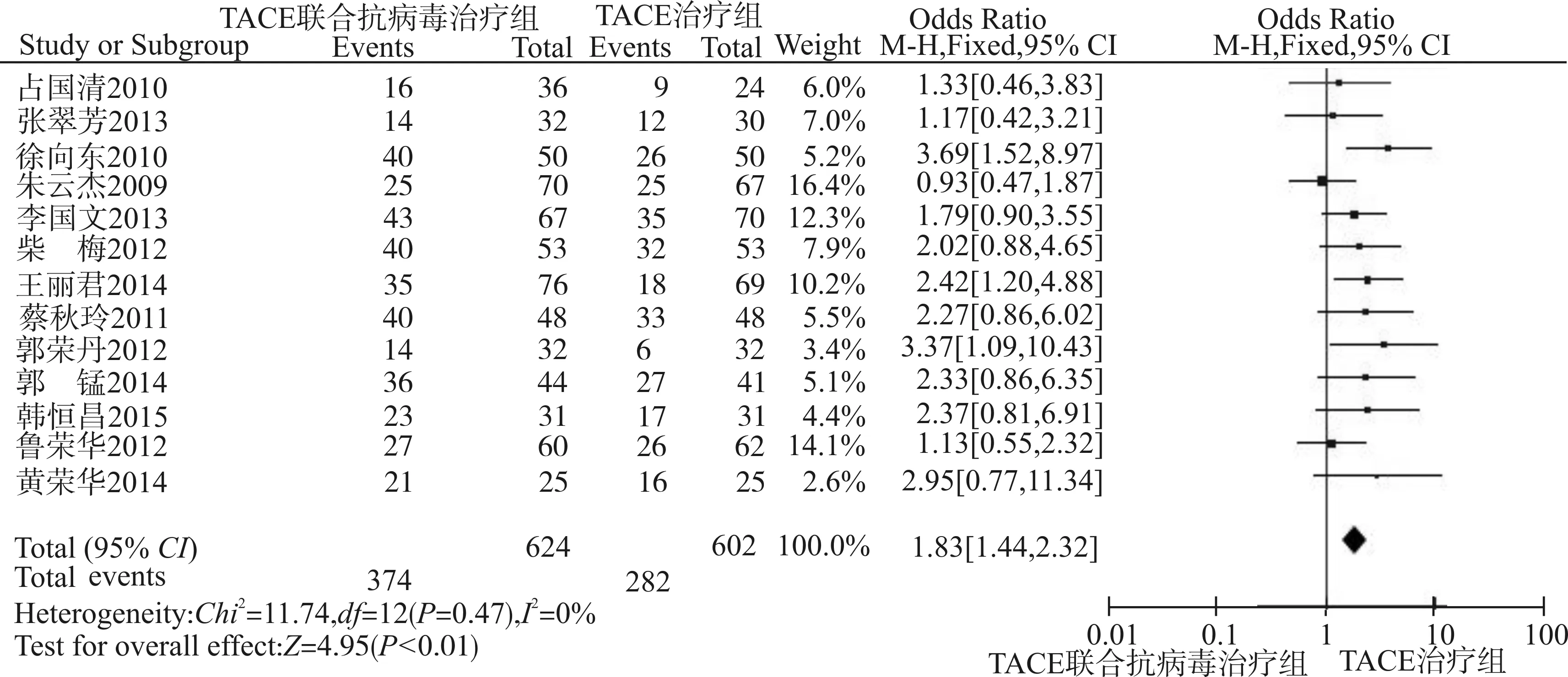
图1 13项RCT比较临床有效率的Meta分析森林图Fig.1 Forest plot of the clinical efficacy in 13 RCTs
图2 13项RCT比较临床有效率的Meta分析漏斗图Fig.2 Funnel plot of the clinical efficacy in 13 RCTs
2.31年生存率
采用固定效应模型分析(P=0.56,I2=0%),取α=0.05为检验水准。森林图(图3)结果显示:TACE联合抗病毒治疗组共762例患者,有618例有效;TACE治疗组共715例患者,有433例有效。总效应Z=8.54,P<0.01,OR=2.86,95%CI:2.25~3.64,提示TACE联合抗病毒治疗晚期PHC 1年生存率高于TACE治疗。漏斗图观察到各项研究分布尚对称,提示纳入的18篇RCT偏倚较小,纳入得当(图4)。
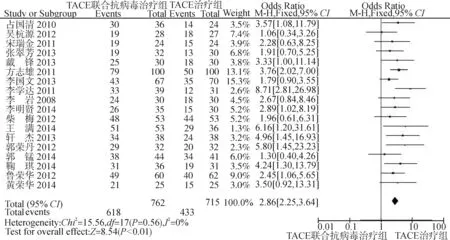
图3 18项RCT比较1年生存率的Meta分析森林图Fig.3 Forest plot of the 1-year survival rate in 18 RCTs
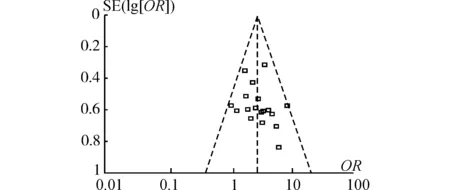
图4 18项RCT比较1年生存率的Meta分析漏斗图Fig.4 Funnel plot of 1-year survival rate in 18 RCTs
2.4Child-Pugh评分
采用固定效应模型分析(P=0.32,I2=14%),取α=0.05为检验水准。森林图(图5)结果显示:总效应Z=8.64,P<0.01,MD=-0.84,95%CI:-1.03~-0.65,提示TACE联合抗病毒治疗中晚期肝癌,患者Child-Pugh评分显著低于TACE治疗。因纳入研究少于10项,漏斗图意义不大,故不做漏斗图分析。
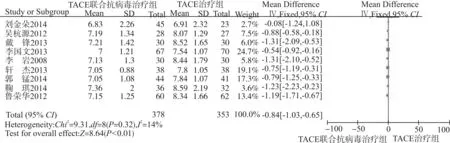
图5 9项RCT比较Child-Pugh评分的Meta分析森林图Fig.5 Forest plot of Child-Pugh scores in 9 RCTs
2.5肝功能ALT水平
采用随机效应模型分析(P<0.01,I2=91%),取α=0.05为检验水准。森林图(图6)结果显示:总效应Z=5.99,P<0.01,MD=-23.27,95%CI:-30.88~-15.65,提示TACE联合抗病毒治疗中晚期肝癌,患者血清ALT水平显著低于TACE治疗。因纳入研究少于10项,漏斗图意义不大,故不做漏斗图分析。
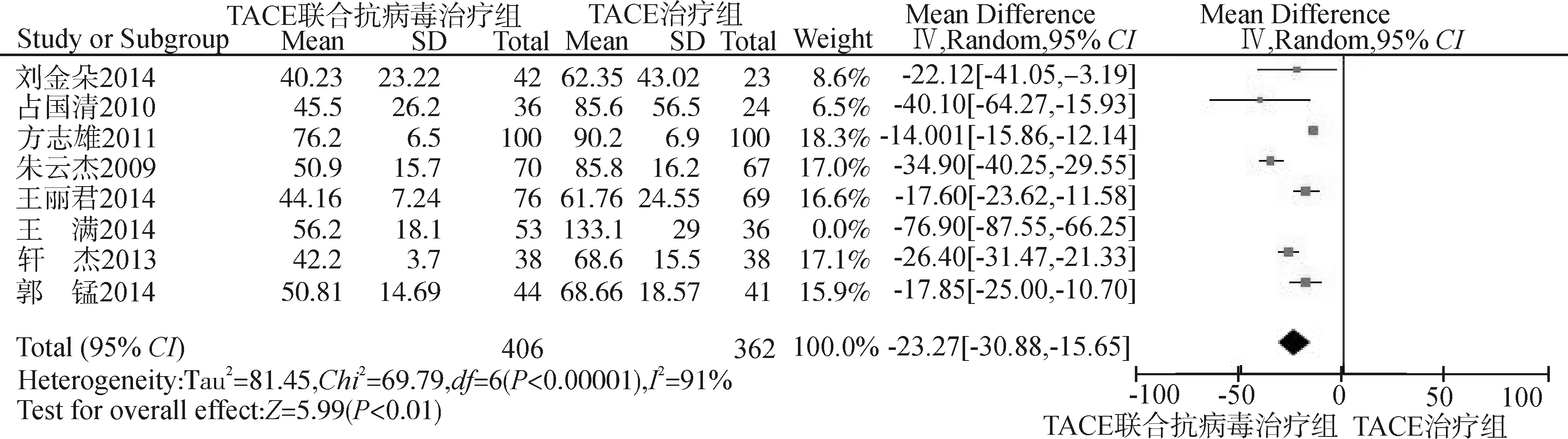
图6 8项RCT比较ALT水平的Meta分析森林图Fig.6 Forest plot of the ALT Levels in 8 RCTs
2.6并发症及不良反应
采用随机效应模型分析(P=0.001,I2=81%),取α=0.05为检验水准。森林图(图7)结果显示:总效应Z=0.31,P=0.76,OR=1.30,95%CI:0.25~6.71,提示较TACE治疗,TACE联合抗病毒药治疗中晚期肝癌,患者并发症及不良反应并没有增加。因纳入研究少于10项,漏斗图意义不大,故不做漏斗图分析。
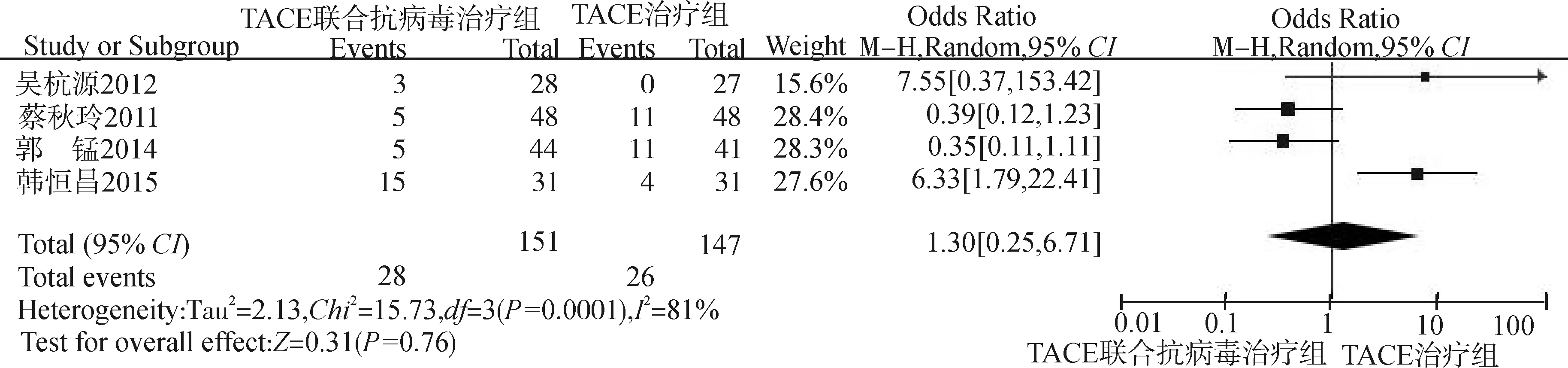
图7 4项RCT比较并发症及不良反应的Meta分析森林图Fig.7 Forest plot of the complications and adverse reactions in 4 RCTs
3 讨论
HBV是原发性肝癌最为重要的病因之一。有研究报道,90%以上肝癌患者合并HBV感染,HBV在机体内大量复制,可加重肝细胞的破坏,引起肝性脑病、肝功能衰竭等并发症,最终导致死亡[30]。由于肝癌起病隐匿,早期缺乏典型的临床症状,明确诊断时仅10%~30%的患者能够手术根治[31]。有循证医学证据表明TACE能有效地阻断肝癌的血供并有局部化疗作用,有效控制了肝癌生长,延长患者生存期,为中晚期肝癌的首选治疗方案[11]。但TACE治疗肝癌可致HBsAg阳性患者病毒的再激活,激活的HBV导致的肝损伤与TACE治疗相关性肝损伤形成叠加效应,严重者可发展为肝衰竭死亡[28]。因此,中晚期肝癌患者TACE后给予抗病毒治疗十分必要。
核苷酸类似物为常用的抗HBV药物,临床上主要有拉米夫定、替比夫定、恩替卡韦、阿德福韦酯等,其机制为环腺磷酸嵌入到病毒DNA中,使DNA链合成中止。此外,其可减少HBV基因与癌基因及抑癌基因整合,降低癌基因的过表达及抑癌基因的失活[11]。大多中晚期肝癌患者需要多次TACE治疗,对肝功能要求较高。因此,抗病毒稳定肝功能和针对肿瘤治疗同等重要。大多文献报道,TACE联合抗病毒治疗肝癌能改善患者的肝功能,提高患者生存率[19-20]。但也有少数文献报道,在生存率方面,抗病毒联合TACE治疗仅能提高患者的2年生存率并延长生存期,对1年生存率并没有提高,这与我们的循证医学结果不一致。我们的研究系统地总结了国内多篇RCT,Meta分析结果显示,较TACE治疗,TACE联合核苷类抗病毒药物治疗中晚期肝癌能显著提高临床有效率及1年生存率,改善肝功能,降低Child-Pugh评分,且并发症及不良反应并没有增加。
本研究所纳入的RCT经Cochrane系统评价员手册的标准评价后,文献质量均为中等。由于药物治疗具有一定的特殊性,较难接纳意向治疗分析,因此所纳入RCT发生偏倚的可能性不大,在临床研究中,我们仍可视其为较高质量的文献。在不良反应方面,仅4篇RCT给出了两组研究的数据,因此,TACE联合核苷类抗病毒药物治疗中晚期肝癌并发症及不良反应方面的评价还需更加严格的多中心联合临床试验观察。总之,该研究虽存在不足,但研究结果显示,较TACE治疗,TACE联合核苷类抗病毒药物治疗肝癌能显著提高患者的临床有效率及1年生存率,降低Child-Pugh评分及改善肝功能,这些疗效是确切的。该研究可指导临床治疗,让更多的中晚期肝癌患者受益。
[1]Zhong J H,Xiang B D,Gong W F,et al.Comparison of long-term survival of patients with BCLC stage B hepatocellular carcinoma after liver resection or transarterial chemoembolization[J].PLoS One,2013,8(7):e68193.
[2]倪俊,袁文斌,岑峰,等.抗病毒治疗在乙肝相关性肝癌术后肝内复发中的作用[J].中华肝胆外科杂志,2015,21(2):91-95.
[3]王丽君,卜文哲,陈华,等.TACE联合恩替卡韦治疗乙型肝炎相关原发性肝癌回顾性分析[J].中华肿瘤防治杂志,2014,21(20):1617-1622.
[4]孙恒,韩文杰.TACE联合索拉非尼对不能手术切除肝细胞肝癌的疗效分析[J].胃肠病学和肝病学杂志,2014,23(5):486-488.
[6]Jadad A R,Moore R A,Carroll D,et al.Assessing the quality of reports of randomized clinical trails:is blinding necessary[J].Control Clin Trials,1996,17(1):1-12.
[7]韩恒昌,乔现伟.阿德福韦酯联合TACE介入治疗原发性肝癌临床疗效观察[J].中国实用医药,2015,10(15),150-151.
[8]黄荣华.TACE联合阿德福韦酯或拉米夫定对原发性肝癌患者肝功能的改善作用[J].肝脏,2014,19(2):123-125.
[9]郭锰.恩替卡韦联合介入治疗乙型肝炎相关原发性肝癌的临床研究[J].中国普通外科杂志,2014,23(7):898-903.
[10]鞠琪,夏月根,陆小玲,等.核苷(酸)类似物联合TACE治疗中晚期原发性肝癌的效果[J].实用临床医药杂志,2014,18(21),187-189.
[11]王满,赵立群,徐峰,等.抗病毒治疗对经肝动脉化疗栓塞乙肝相关原发性肝癌的作用[J].实用医学杂志,2014,30(22),3620-3621.
[12]李明贤,刘尚忠,李少明.拉米夫定联合TACE治疗对乙型肝炎相关肝癌患者生存质量和预后的影响[J].实用肝脏病杂志,2014,17(5),539-540.
[13]刘金朵.乙型肝炎病毒相关性肝癌TACE术后抗病毒治疗的近期疗效[D].郑州:郑州大学,2014.
[14]轩杰,马生录,唐江燕,等.恩替卡韦联合肝动脉化疗栓塞术治疗乙型肝炎相关中晚期肝癌患者的疗效观察[J].宁夏医学杂志,2013,35(10),947-948.
[15]李国文.肝动脉化疗栓塞联合抗病毒治疗原发性肝癌疗效观察[D].南昌:南昌大学,2013.
[16]戴锋,付守忠,王斌,等.核苷类药物联合肝动脉栓塞化疗在肝癌中应用观察[J].交通医学,2013,27(3),272-274.
[17]张翠芳,罗鹏程,吴勇波.拉米夫定抗病毒治疗对TACE治疗原发性肝癌疗效的影响[J].实用肝脏病杂志,2013,16(6):554-555.
[18]郭荣丹.恩替卡韦联合TACE治疗原发性肝癌的效果分析[J].吉林医学,2012,33(26):5660-5881.
[19]鲁荣华.恩替卡韦联合TACE治疗原发性肝癌的效果分析[J].肝脏,2012,17(4):254-255.
[20]柴梅.肝动脉化疗栓塞术联合阿德福韦酯治疗原发性肝癌的疗效观察[J].山东医药,2012,52(45):63-64.
[21]吴杭源,尤德宏.替比夫定联合TACE治疗合并肝硬化的中晚期原发性肝癌的临床研究[J].现代中西医结合杂志,2012,21(9):919-923.
[22]蔡秋玲.阿德福韦酯联合TACE介入治疗原发性肝癌48例临床分析[J].齐齐哈尔医学院学报,2011,32(18):2959-2960.
[23]李学达,曹贵文,崔新江,等.肝癌TACE治疗与术后保肝抗病毒治疗临床意义[J].当代医学,2011,17(5):41-43.
[24]宋瑞金,纪民,侯鹏.肝动脉化疗栓塞术联合拉米夫定抗病毒治疗在肝癌治疗中的应用[J].中国冶金工业医学杂志,2011,28(5):504-505.
[25]方志雄,程丹,宋琳.乙肝并肝癌患者的TACE治疗及抗病毒治疗的临床疗效观察[J].中国卫生产业,2011,34:142.
[26]徐向东.TACE联合阿德福韦酯治疗原发性肝癌的临床观察[J].中国实用医药,2010,5(35):111-112.
[27]占国清,谭华炳,朱琳,等.抗病毒对肝动脉化疗栓塞治疗乙肝后中晚期肝癌的作用[J].临床肝胆病杂志,2010,26(4):423-424.
[28]朱云杰,蔡文辉,张春英,等.拉米夫定在原发性肝癌综合性介入治疗中的应用[J].肝脏,2009,14(4):346-347.
[29]李岩.拉米夫定联合TACE治疗原发性肝癌合并肝硬化30例[J].世界华人消化杂志,2008,16(15):1700-1703.
[30]Yeo W,Chan P K,Zhong S,et al.Frequency of hepatitis B virus reactivation in cancer patients undergoing cytotoxic chemotherapy:a prospective study of 626 patients with identification of risk factors[J].J Med Virol,2000,62(3):299-307.
[31]Maluccio M,Covey A.Recent progress in understanding,diagnosing,and treating hepatocellular carcinoma[J].CA Cancer J Clin,2012,62(6):394-399.
(2015-12-23收稿)
TACE Combined with Nucleoside Antiviral Drugs for the Treatment of Advanced Hepatic Carcinoma in China:A Systematic Review
Li Hong,Li Zilin,Zhu Nengetal
DepartmentofHepato-pancreato-biliarySurgery,HubeiCancerHospital,Wuhan430079,China
ObjectiveTo examine the efficacy of transhepatic arterial chemotherapy and embolization(TACE)in combination with nucleoside antiviral drugs in the treatment of advanced hepatic carcinoma in China by means of the meta-analysis.MethodsA comprehensive search was performed in VIP(1989-2015),WANFANG(1999-2015),CNKI(1994-2015)and CAJD databases to obtain the randomized controlled trials(RCT)which examined the treatment of advanced hepatic carcinoma with TACE combined with nucleoside antiviral drugs.RTCs that met the inclusion criteria were subjected to a meta-analysis.ResultsA total of 24 RCTs,involving 2 085 patients,were eventually included for the meta-analysis.The results showed that the clinical effective rate was higher in combination group than in TACE group[overall effect:Z=4.95,OR=1.83,95%CI(1.44,2.32),P<0.01].The combination group had higher 1-year survival rate[overall effect:Z=8.54,OR=2.86,95%CI(2.25,3.64),P<0.01],lower Child-Pugh score[overall effect:Z=8.64,MD=-0.84,95%CI(-1.03,-0.65),P<0.01]and lower ALT level [overall effect:Z=5.99,MD=-23.27,95%CI(-30.88,-15.65),P<0.01]than the TACE group did.The complications and adverse reactions didn’t increase in the combination group [overall effect:Z=0.31,OR=1.30,95%CI(0.25,6.71),P=0.76].ConclusionTACE in combination with nucleoside antiviral drugs can increase the clinical effective rate and survival rate,and improve the liver function,without increasing the adverse reactions.
hepatic carcinoma;transhepatic arterial chemotherapy and embolization(TACE);clinical effect;antiviral therapy;Meta analysis
,Corresponding author,E-mail:relaxing2008@163.com
R735.7
10.3870/j.issn.1672-0741.2016.04.023
李宏,男,1980年生,医学博士,主治医师,E-mail:hongli_8008@163.com
