宫颈微小浸润癌IA1期66例诊治分析及文献复习
2016-09-20郑静洁陈慧君
郑静洁 ,陈慧君,朱 华,周 凯
(温州医科大学附属第一医院妇科,浙江 温州 325000)
宫颈微小浸润癌IA1期66例诊治分析及文献复习
郑静洁 ,陈慧君,朱华,周凯
(温州医科大学附属第一医院妇科,浙江 温州 325000)
目的评估锥切术在宫颈微小浸润癌IA1期的诊断及保守治疗中的应用价值,并通过复习文献探讨宫颈微小浸润癌IA1期的诊治规范。方法回顾性分析2009年至2014年于温州医科大学附属第一医院病理诊断为宫颈微小浸润癌IA1期的66例患者的临床诊治经过,比较锥切术与宫颈活检的病理诊断差别以及不同手术方案的优缺点。结果①66例宫颈微小浸润癌IA1期患者中,仅26例(39.4%)经阴道镜活检诊断为不排除早期浸润癌,高达60.6%的宫颈微小浸润癌IA1期患者被阴道镜活检诊断为CIN Ⅲ甚至更低级别;②66例患者中有49例先行宫颈锥切术,其中有2例因切缘阳性接受了第二次手术(1例行再次锥切,另1例行宫颈根治性切除术),其余切缘阴性者中有8例年轻、随访条件好且要求保留子宫或有生育要求者选择严密随访,其余无生育要求的39例患者接受全子宫切除术,除5例患者失访外,其余患者术后复查TCT和(或)HPV分型或阴道镜均无复发证据;③49例宫颈锥切术患者中有8例术中送冰冻病理检查,结果回报确诊或可疑宫颈微小浸润癌IA1期的准确率为87.5%。结论宫颈微小浸润癌IA1期需通过宫颈锥切后病理确诊;年轻、随访条件好、有生育要求或强烈要求保留子宫的宫颈癌IA1期患者若锥切切缘阴性可考虑密切随访,若切缘阳性者可考虑再次锥切或行宫颈根治性切除术,年龄>45岁,已完成生育者建议行全子宫切除是合理的手术选择。另外,锥切术中冰冻病理检查的价值仍需要大样本进一步探究。
宫颈锥切术;宫颈微小浸润癌;宫颈上皮内瘤变;临床价值
宫颈癌仍是女性生殖道最常见的恶性肿瘤之一,我国每年新发病例约13.15万,占全球宫颈癌新发病例总数的四分之一。[1]。近年来随着宫颈癌前三阶梯筛查技术的规范化开展,宫颈上皮内瘤变(cervix intraepithelial neoplasia, CIN)及宫颈微小浸润癌(microinvasive cervical cancer, MICA)的检出率逐渐升高,且宫颈癌发病呈年轻化的趋势[2]。有关宫颈微小浸润癌IA1期的诊治规范,虽有FIGO 2009指南[3],但临床实际诊治情况仍存在偏颇。根据患者个体情况差异选择不同的治疗方案对预后的影响很大。因此,如何及时并准确诊断宫颈微小浸润癌IA1期以及如何合理选择手术方式是妇科医生面临的新挑战。本文通过回顾性分析66例宫颈微小浸润癌IA1期患者的临床资料及病理特点,探讨宫颈锥切术在宫颈微小浸润癌IA1期诊断及治疗中的价值,并提出宫颈癌IA1期的简明处理思路。
1资料与方法
1.1一般资料
本研究收集自2009年1月至2014年4月温州医科大学附属第一医院妇科经手术病理检查确诊为宫颈微小浸润鳞癌IA1期(间质浸润深度≤3mm,水平扩散≤7mm)的66例患者的临床和病理资料,回顾性分析其诊断方式及手术方式。本组资料中患者年龄24~79岁,平均45±11.19岁,妊娠次数0~8次(中位数3次),分娩次数0~8次(中位数2次),未生育2例。
1.2方法
1.2.1诊断标准
参照FIGO 2009宫颈癌临床分期诊断标准。所有66例患者均接受了阴道镜下宫颈活检并将标本送病理检查,其中17例患者活检病理结果出来后直接行子宫切除术,其余49例则先行宫颈锥切术(包括冷刀锥切或LEEP锥切术)。同一病例,若宫颈活检、宫颈锥切或子宫切除标本的病检结果不符,最后诊断以最高级别为准。
1.2.2治疗方式
①宫颈锥切术:切除范围包括宫颈碘不着色区外0.5cm处,锥深2.0~2.5cm,疑有宫颈管病变者同时行宫颈管搔刮。锥切标本统一12点标记后送病检。LEEP锥切术标本分为宫颈组织、宫颈管组织及内口组织送病理;②锥切术后处理方法:锥切术后病理报告为早浸癌或病灶为多灶性或宫颈管累及,或年龄超过45岁结合患者意愿,再行子宫切除术;③子宫切除术:包括筋膜外全子宫切除术、次广泛子宫切除术和广泛子宫切除术±双附件切除术。
1.2.3随访内容及方法
所有患者均接受了自手术后3个月起的定期门诊随访,2年内每半年1次,2年后每1年1次,频率可根据前次随访结果及患者随访条件作适当调整。随访时间截止为2015年6月30日。随访时行常规妇科检查、宫颈液基细胞学检查,部分患者行HPV DNA分型检测,必要时行阴道镜检和(或)宫颈活检以确定是否复发。
2结果
2.1阴道镜下宫颈活检的病理诊断结果
66例患者均在本院妇科门诊行阴道镜下宫颈活检,病理结果包括确诊为IA1期宫颈癌11例,怀疑早期浸润癌15例,CIN Ⅲ 34例, CIN Ⅱ 6例。66例患者中,阴道镜下宫颈活检病理符合率仅39.4%(26/66),高达51.5%(34/66)的IA1期宫颈癌患者被诊断为CINⅢ级,更有9.1%(6/66)的患者被诊断为CIN Ⅱ级(见图1)。
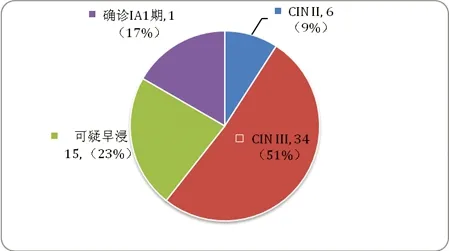
图1阴道镜下宫颈活检的病理学诊断分析图
Fig.1Pathological diagnosis of cervical colposcopic biopsy
2.2阴道镜宫颈活检后直接行子宫切除手术的情况分析
66例患者中17例患者在宫颈活检病理结果得出后直接行子宫切除术。其中行筋膜外子宫全切术共9例,包括1例术前宫颈活检病理诊断为CINⅡ级因绝经多年且患者强烈要求切除子宫者,3例活检结果为CINⅢ级要求切除子宫以及5例确诊或可疑早浸癌患者;8例活检病理结果为确诊或可疑早浸癌患者中有2例接受了次广泛子宫切除术,6例接受了广泛子宫切除+盆腔淋巴结清扫术(其中1例为腹腔镜下广泛子宫切除+盆腔淋巴结清扫术),见表1。17例患者术后最终病理诊断均为宫颈微小浸润鳞癌IA1期,切缘均阴性,行盆腔淋巴结清扫者术后病理回报均阴性。由此可见,4例患者行宫颈活检诊断为CIN Ⅱ~Ⅲ级后直接行子宫切除术后病理升级为宫颈微小浸润癌I A1期。
表117例阴道镜活检后直接行子宫切除的病例(n)Table 1 17 cases of direct hysterectomy after colposcopy biopsy(n)

阴道镜活检例数子宫全切术次广泛子宫切除术广泛子宫切除+盆腔淋巴结清扫术CINⅡ1100CINⅢ3300可疑早浸6411IA17115总数17926
2.3宫颈锥切手术情况及术后处理方式
66例宫颈微小浸润癌IA1期患者中49例首先行宫颈锥切术,其中包括冷刀锥切术41例,行LEEP锥切术8例。有2例患者切缘阳性但有生育要求,故1例行再次宫颈锥切术(术后病检残存CINⅡ,且切缘阴性),另1例于外院行保留生育功能的宫颈根治性切除术(病检未发现残留病灶)。余47例患者锥切切缘均阴性,其中8例年轻、随访条件好且要求保留子宫的患者接受密切随访,39例年龄在45岁以上、无生育要求的患者接受了二次手术治疗,其中行筋膜外全子宫切除±双附件切除术36例(14例为腹腔镜辅助下阴式子宫全切术),行次广泛子宫切除±双附件切除术2例,行广泛子宫切除+双附件切除术1例,见表2。
综合本组病例,我们认为晚期甲状腺癌需尽量保留1~2枚甲状旁腺,以保证术后甲状旁腺功能正常。目前还可以使用纳米碳负显影,或者术中甲状旁腺检测,但是对于累及喉气管和食管的晚期肿瘤,实现的可能性不大,此种情况下以保护对侧远离肿瘤的甲状旁腺为首要任务。
表249例宫颈癌IA1期患者行宫颈锥切术后的再次临床处理方式
Table 2Second clinical treatments after cervical conization for 49 cases of IA1 stage of cervical cancer
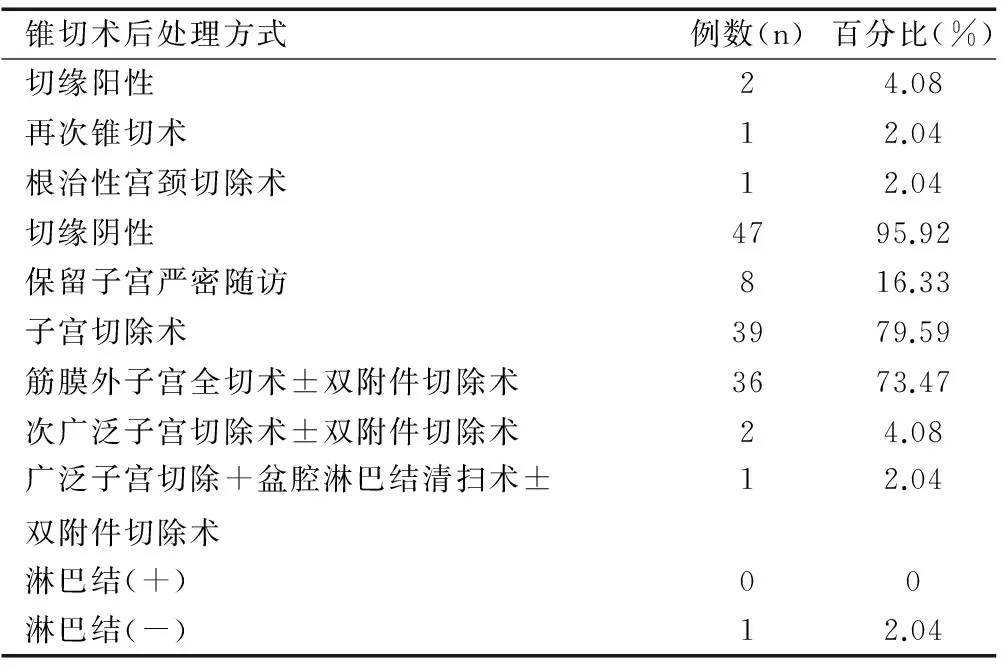
锥切术后处理方式例数(n)百分比(%)切缘阳性24.08再次锥切术12.04根治性宫颈切除术12.04切缘阴性4795.92保留子宫严密随访816.33子宫切除术3979.59筋膜外子宫全切术±双附件切除术3673.47次广泛子宫切除术±双附件切除术24.08广泛子宫切除+盆腔淋巴结清扫术±双附件切除术12.04淋巴结(+)00淋巴结(-)12.04
2.4术中冰冻病理切片与普通石蜡切片的结果比较
49例行宫颈锥切术的患者中,8例患者无生育需求且要求切除子宫,故在行计划性子宫切除术之前先行宫颈锥切术,标本术中送冰冻病理,4例术中回报确诊宫颈微小浸润鳞癌IA1期,3例回报宫颈可疑早浸癌,1例回报CIN Ⅲ,排除进一步浸润癌后遂行全子宫切除术。与术后石蜡病理相比较得出锥切标本术中冰冻病检确诊或可疑早浸癌的准确率为87.5%。余41例经术后普通石蜡病理结果诊断为宫颈微小浸润鳞癌IA1期,其中31例患者在锥切术后1个月后再次入院行子宫切除术,1例行再次锥切术,另有1例行宫颈根治性切除术;其余8例年轻且要求保留子宫的患者接受妇科门诊密切随访。
2.5随访结果
10例保留子宫的患者中,平均随访29个月(15~64个月),复查TCT和(或)HPV分型和(或)阴道镜均阴性,其中1例锥切术后1年自然受孕,足月剖宫产分娩一活婴。
56例切除子宫的宫颈微小浸润鳞癌IA1期患者中,5例术后3个月后失访,其余平均随访时间为21.5个月(3~64个月),复查阴道残端细胞学正常,无复发证据。
3讨论
3.1宫颈锥切术对宫颈微小浸润癌IA1期的确诊价值
随着宫颈癌前筛查的普及,越来越多的年轻女性被诊断出MICA,并得到了及时治疗。因MICA具有发病年龄轻、病变早期、患者有生育要求等特点,使其诊治方案偏向多元化、个体化,已逐渐成为国内外妇科肿瘤医生的关注热点。目前的研究认为对宫颈疾病的诊断仍应遵循“三阶梯”原则,即依次行宫颈细胞学检测、阴道镜检查及组织病理学检查[4]。阴道镜下宫颈组织活检具有取材较方便、损伤较小等优点,对宫颈病变诊断的正确率明显高于宫颈细胞学,曾一度被认为与宫颈锥切结果无明显差异而被广泛推广及应用,甚至认为可以取代锥切手术。然而,近年来越来越多的研究发现二者存在不同之处。由于点状活检取材少而表浅,有时无法判断浸润深度,而且当病灶位于宫颈管时,尽管可行宫颈管搔刮,但深度有限,易遗漏深部病变。本研究结果显示66例最终病理确诊为MICA IA1期患者中,仅26例(39.4%)来源于阴道镜诊断为不排除早期浸润癌,而有34例被阴道镜活检诊断为CIN III甚至更低级别(CIN II,6例),漏诊率高达60.6%。由此可见,仅凭阴道镜下宫颈多点活检的病理结果容易造成部分MICA IA1期被漏诊。而宫颈锥切可切除整个鳞柱交接部,深度可达整个宫颈管,故可提供完整的宫颈标本,其病理检查可对宫颈病变作出全面的诊断,已成为诊断MICA的金标准。尤其针对MICA IA1期,正确诊断其浸润深度,并根据患者个体情况差异选择个体化的治疗方案对患者预后的影响很大。Meirovitz等[5]的研究甚至认为TCT检查结果为HGSIL(高度鳞状上皮内瘤变)相当于活检病理的高级别病变,建议TCT细胞学检查提示为HGSIL时可跳过宫颈活检直接行宫颈锥切,省略活检步骤可缩短治疗时间、减轻患者焦虑及医疗费用支出,且无显著过度治疗或增加副作用之嫌。本研究发现17例患者在宫颈活检病理提示CIN Ⅱ~Ⅲ级、确诊或可疑早浸后直接行子宫切除术,最后子宫病理确诊为宫颈微小浸润癌IA1期,显然此类治疗方案是欠规范的,因为活检难以判断深度及宽度,无法准确把握手术切除范围,贸然行子宫切除,若病理回报仍为CIN Ⅱ~Ⅲ级,有过度治疗之诟病,若病理回报大于IA1期浸润范围,则可能因手术范围不足而需再次手术。综上,当活检病理提示CIN Ⅱ~Ⅲ级、确诊或可疑早浸时,应先行宫颈锥切术进一步确诊后再考虑进一步治疗方案。
MICA的治疗包括手术、放疗、化疗及综合治疗。因MICA IA1期的发病年龄日趋年轻化,广大年轻患者迫切渴望保留生育功能的治疗方案。几十年里,MICA IA1期保留生育功能的手术治疗一直是妇科领域的研究及讨论热点,手术方式包括宫颈冷刀锥切、宫颈根治性切除术+盆腔淋巴结清扫术等。不同手术方式的选择主要取决于病理诊断间质浸润的深度及宽度、脉管浸润与否以及肿瘤大小[6]。有文献报道MICA患者行宫颈根治性切除术后仅63%左右可妊娠至接近足月,且多数需行剖宫产终止妊娠[7]。除此之外,宫颈根治性切除术后易引起宫颈狭窄而需要麻醉下扩张宫颈,还存在深度性交困难、阴道白带异常增多、复发性念珠菌外阴阴道炎等风险。而宫颈锥切术损伤较小、术中出血少,且术后并发症明显少于宫颈根治性切除术,术后妊娠结局优于后者,术后患者可拥有较理想的性生活质量[8]。至于宫颈锥切术在治疗MICA IA1期中的安全性及有效性仍是目前国内外研究的热点。Papakonstantinou等[9]的研究认为宫颈锥切术可应用于MICA IA1期的初始治疗,完整的切除病灶是预后良好的决定性因素,宫颈管内切缘阳性是MICA复发及持续存在的高危因素,如果内切缘阳性(包括残留微小浸润癌、CIN Ⅱ或CIN Ⅲ级),建议行全子宫切除,若患者年轻、有强烈的生育要求并要求保留子宫,可考虑再次行宫颈锥切术,但必须充分告知术后仍有残留、复发CIN甚至浸润癌的可能[9-10]。另外,与初次锥切相比,再次锥切可能增加2~3倍早产风险[11]。而最新的回顾性研究结果显示锥切内切缘阳性与后续全子宫切除标本阳性残留病灶关系密切,提示锥切内切缘阳性者需进一步治疗,而即使在锥切内切缘阴性的患者中,约27.4%的患者在后续全子宫切除标本中仍找到CIN甚至微小浸润癌病灶,故该研究认为MICA IA1期患者行锥切保守治疗时需术前充分评估并获得书面知情同意,锥切术后即使切缘阴性,也需严密随访[12]。本研究中10例行宫颈锥切术后未切除子宫的患者中,有2例因切缘阳性接受了第二次手术治疗(1例再次锥切,1例宫颈根治性切除),至今为止,10例患者均定期复查TCT和(或)HPV分型均阴性,其中1例自然受孕至足月分娩。综上所述,对于年轻(<45岁、有生育要求、随访条件好的MICA IA1期患者,宫颈锥切术可作为保留生育功能的手术选择[13],若宫颈管内切缘阳性,应建议患者再次手术治疗,有生育要求或强烈要求保留子宫者可再次行宫颈锥切术或宫颈根治性切除术,术后严密随访;无生育要求的高龄妇女可考虑行全子宫切除术。
3.3宫颈微小浸润癌IA1期子宫切除手术范围的选择
本研究结果显示子宫全切除术后的子宫切缘均阴性,术后随访均未出现病变复发的证据,提示对于宫颈微小浸润鳞癌IA1期而言,全子宫切除是足够的,没有必要行次广泛或广泛子宫切除术。另外,多数MICA IA1期肿瘤浸润浅,很少累及脉管及盆腔淋巴结,有报道淋巴结转移率约为0.1%到0.8%之间,也有报道为1.5%至4.2%。本研究中66例患者中行淋巴结清扫术共7例,病检结果均无淋巴结转移,提示淋巴结清扫术对于宫颈癌IA1期可能是没有必要的,但也可能与本研究病例及手术例数较少有关。因此,对于无生育要求的育龄妇女(≥45岁)及绝经期患者,全子宫切除术是合适的术式选择。
3.4术中冰冻切片在疑似宫颈早期浸润癌中的指导价值
对于宫颈锥切术后确定为MICA IA1期且要求切除子宫的患者,再次行子宫切除的时机仍存在争议。原则上,宫颈锥切术后普通石蜡病理确诊为MICA IA1期,患者无生育要求,考虑行第二次手术切除全子宫。然而,常规石蜡病理需要较长时间,患者需再次办理入院手续、再次经历麻醉手术,增加了患者的医疗费用,加重了患者的焦虑,也给医生及时制定诊疗计划带来了不便。术中冰冻切片的普及,为医生作出即刻决定提供了依据。 对于无生育要求,计划行全子宫切除者,术中锥切标本送冰冻病理,确诊为MICA IA1期后,可同时行全子宫切除术,一次手术即可完成MICA IA1期患者的诊治,节省了时间和费用,另外避免了患者失访[14]。然而,术中冰冻病理亦存在未能确诊、漏诊、误诊等不足,其临床应用仍受到限制。
近半个世纪以来的研究发现宫颈癌术中冰冻切片病理与常规石蜡病理的符合率约75%~100%[15-16],然而宫颈锥切标本送冰冻切片病理在MICA IA1期中的应用价值仍存在争议。Martinelli 等[17]的观察性研究中,就判断浸润深度而言,锥切标本冰冻病理与石蜡病理的符合率为95.4%-100%,结果提示仍存在部分锥切标本通过冰冻病理无法准确判断浸润深度。本研究中有8例患者的锥切标本送术中冰冻病理(4例回报确诊IA1期,3例回报可疑早浸癌,1例回报CIN III),其准确率为87.5%。
由于术中冰冻病理的漏诊及误诊将直接影响手术范围及患者的预后,且目前术中冰冻切片尚未做到100%的准确性,故妇科及病理科医生仍不断致力于如何进一步评估并提高术中冰冻切片的准确性。有研究认为冰冻切片病理的诊断可靠性主要取决于切片的质量以及快速病检的时间,建议锥切前先行醋白和碘试验,术中避免过分钳夹宫颈溃疡处以提高取材的精确性[18]。最近的研究还发现在肉眼可见的病灶中取材可提高切片的确诊率,降低漏诊及误诊率,另外,横向取材结合纵向取材切片可更准确评估子宫颈管内肿瘤的浸润程度,故提出在肉眼可见的病灶处多点纵向及横向取材是提高准确率的可行方法[19]。最后,经验丰富的病理科医生以及先进的制片仪器[20],与临床医生的充分沟通是提高术中冰冻准确性不可或缺的重要因素。
冰冻切片因其快速、可信、性价比高常被应用于宫颈锥切术中,然而冰冻病理确实存在未能确诊、漏诊、误诊等风险,而这些风险有可能导致不合理的治疗策略。综上,笔者个人认为在积极提高病理医师对锥切冰冻标本的阅片能力及加强病理与临床医师相互沟通的基础上,通过术前充分告知患者及家属冰冻病理的误诊、漏诊等局限性并获得书面知情同意后,可在年龄≥45岁且无生育要求同意切除子宫的患者中开展锥切术后标本送冰冻病理,若术中回报确诊宫颈微小浸润癌IA1期则同时行全子宫切除术。
综上所述,MICA IA1期需通过宫颈锥切后病理确诊;年轻、随访条件好、有生育要求或强烈要求保留子宫的MICA IA1期患者若锥切切缘阴性可考虑密切随访,若切缘阳性者可考虑再次锥切或行宫颈根治性切除。年龄>45岁、已完成生育者在通过术前充分告冰冻病理的误诊、漏诊等局限性并获得书面知情同意后,可先行锥切术后标本送冰冻病理,若术中回报确诊MICA IA1期则同时行全子宫切除术。当然,限于本研究入组样本量偏小,可能存在相应偏移和混杂因素,关于锥切标本术中冰冻病理在MICA IA1期术中的应用仍需进一步大样本研究及探讨。
[1]Wright J D, Chen L, Tergas A I,etal. Population-level trends in relative survival for cervical cancer [J]. Am J Obstet Gynecol,2015,213(5):670.e1-670.e7.
[2]Qian Q, Yang J, Cao D,etal. Analysis of treatment modalities and prognosis on microinvasive cervical cancer: a 10-year cohort study in China [J].J Gynecol Oncol,2014,25(4):293-300.
[3]Zalewski K, Doniec J, Baranowski W,etal. Revised FIGO staging systems for gynecologic malignancies--2009 update [J]. Ginekol Pol,2010,81(10):778-782.
[4]Davis M, Feldman S. Making sense of cervical cancer screening guidelines and recommendations [J]. Curr Treat Options Oncol,2015,16(12):55.
[5]Meirovitz M, Gatt D, Dreiher J,etal.Uterine cervix conization based on Pap smear results: the “see and treat” approach[J]. Isr Med Assoc J,2014,16(5):303-306.
[6]Baalbergen A,Smedts F,Helmerhorst T J.Conservative therapy in microinvasive adenocarcinoma of the uterine cervix is justified: an analysis of 59 cases and a review of the literature [J].Int J Gynecol Cancer,2011,21(9):1640-1645.
[7]Yao Y Y, Wang Y, Wang J L,etal. Outcomes of fertility and pregnancy in patients with early-stage cervical cancer after undergoing neoadjuvant chemotherapy [J]. Eur J Gynaecol Oncol,2016,37(1):109-112.
[8]Kim W Y, Chang S J, Chang K H,etal. Conservative management of stage IA1 squamous cell carcinoma of the cervix with positive resection margins after conization [J].Int J Gynaecol Obstet, 2010,109(2):110-112.
[9]Papakonstantinou K, Kyrgiou M, Lyons D,etal. Management of stage Ia1 squamous cervical cancer and the importance of excision margins: a retrospective study of long-term outcome after 25 years of follow-up [J].Am J Obstet Gynecol,2014,211(6):625.e1-625.e6.
[10]Lee J Y, Kim H S, Kim K,etal. Safety of less aggressive surgery for stage IA1 squamous cell carcinoma of the cervix [J].J Obstet Gynaecol Res,2014,40(5):1382-1388.
[11]Ortoft G, Henriksen T, Hansen E,etal. After conisation of the cervix, the perinatal mortality as a result of preterm delivery increases in subsequent pregnancy [J]. BJOG,2010,117(3):258-267.
[12]Hartman C A, Gurgel M S, Teixeira J C,etal. Avaliation of residual disease in hysterectomy specimens after conization in women treated for squamous microinvasive carcinoma of the uterine cervix: IGCS-0064 cervical cancer [J].Int J Gynecol Cancer, 2015,25(Suppl 1):22.
[13]He Y, Wu Y M, Zhao Q,etal. Clinical value of cold knife conization as conservative management in patients with microinvasive cervical squamous cell cancer (stage IA1) [J]. Int J Gynecol Cancer, 2014,24(7):1306-1311.
[14]Karimi-Zarchi M, Mousavi A, Gilani M M,etal. Conservative treatment in early cervical cancer [J].Int J Biomed Sci, 2013,9(3):123-128.
[15]Lv X, Chen L, Yu H,etal. Intra-operative frozen section analysis of common iliac lymph nodes in patients with stage IB1 and IIA1 cervical cancer [J].Arch Gynecol Obstet, 2012,285(3):811-816.
[16]Martinez A, Mery E, Filleron T,etal. Accuracy of intraoperative pathological examination of SLN in cervical cancer [J]. Gynecol oncol,2013,130(3):525-529.
[17] Martinelli F, Schmeler K M, Johnson C,etal. Utility of conization with frozen section for intraoperative triage prior to definitive hysterectomy [J].Gynecol Oncol,2012,127(2):307-311.
[18] Karimi-Zarchi M, Mousavi A, Gilani M M,etal. Conservative treatment in early cervical cancer [J]. Int J Biomed Sci,2013, 9(3):123-128.
[19]Zhang D, Ge H, Li J,etal. A new method of surgical margin assuring for abdominal radical trachelectomy in frozen section [J]. Eur J Cancer, 2015,51(6):734-741.
[20]Ren F, Feng W, Shi H R,etal. Value of frozen section examination in diagnosis and treatment of high-grade cervical intraepithelial neoplasia[J].Chin Med J (Engl),2012,125(14):2462-2465.
[专业责任编辑:张冠军]
Diagnosis and treatment of 66 cases of stage IA1 of cervical microinvasive carcinoma and literature review
ZHENG Jing-jie, CHEN Hui-jun, ZHU Hua,ZHOU Kai
(Department of Gynecology, First Affiliated Hospital of Wenzhou Medical University, Zhejiang Wenzhou 325000, China)
Objective To evaluate the application value of conization in the diagnosis and conservative treatment of stage IA1 of cervical microinvasive carcinoma so as to discuss guidelines of diagnosis and treatment by following a review of relative literatures. Methods A retrospective analysis was conducted on 66 cases of stage IA1 of cervical microinvasive carcinoma by pathological diagnosis, who were diagnosed from 2009 to 2014 in the First Affiliated Hospital of Wenzhou Medical University, and then data were collected to compare the pathological diagnosis as well as the strength and weakness of different operation schemes. Results Among 66 cases of IA1 stage of cervical microinvasive carcinoma, only 26 cases (39.4%) were diagnosed as included early invasive carcinoma by colposcopic biopsy, and up to 60.6% cases were diagnosed as CIN III or even lower levels by colposcopic biopsy. Among the total 66 cases, 49 cases accepted cervical conization surgery, including two cases undergoing a second surgery for positive margins (one case accepted conization again, and the other accepted radical trachelectomy), and 8 cases of young patients with good follow-up conditions and requiring the remaining uterus and desire of future fertility were followed up closely. The remaining 39 patients without reproductive requirements received total hysterectomy. Except five patients who were lost in follow-up, the remaining patients showed no evidence of recurrence after review of TCT and (or) HPV tests or colposcopy. Eight of 49 patients with cervical conization accepted frozen section during surgery and postoperative pathological examination, indicating the accuracy rate of the confirmed or suspected stage IA1 of cervical microinvasive was 87.5%. Conclusion Patients with IA1 stage of cervical microinvasive carcinoma should require pathological confirm after cervical conization. For young patients with good follow-up conditions and fertility requirements can be closely followed up if the negative margin of cone incisura presents. For the patients with positive margin of cone incisurea, conization for a second time and radical trachelectomy serve as important considerations. Total hysterectomy surgery is a reasonable choice for elder women (>45 years old) after delivery. Besides, the value of frozen section during conization still deserves further explorations with larger samples.
cervical conization; cervical microinvasive carcinoma; cervix intraepithelial neoplasia (CIN); clinical value
2016-03-13
郑静洁(1987-),女,主治医师,博士,主要从事妇科疾病的临床诊治工作。
周凯,副主任医师。
10.3969/j.issn.1673-5293.2016.08.028
R737.33
A
1673-5293(2016)08-0987-05
