不同生理病理状态下美罗培南药动学/药效学差异性研究进展
2016-09-20葛卫红
张 红, 金 路, 葛卫红, 王 皓, 梁 培
不同生理病理状态下美罗培南药动学/药效学差异性研究进展
张 红, 金 路, 葛卫红, 王 皓, 梁 培
美罗培南; 药动学; 药动学/药效学; 抗生素
美罗培南是20世纪90年代面市的第二代碳青霉烯类抗生素,为广谱β内酰胺类抗生素,对需氧或厌氧的革兰阴性菌和阳性菌均有强大的抗菌作用,主要针对革兰阴性菌,临床应用广泛。然而,由于其广泛的使用导致细菌对药物的敏感性下降甚至产生耐药,从而降低了临床有效性。同时,由于不同患者的生理病理状态有差异性,导致其对美罗培南的分布、代谢和排泄等药动学(pharmacokinetic, PK)特征也不尽相同,因此有必要针对不同生理病理状态患者的药动学/药效学(pharmacokinetics/pharmacodynamics, PK/PD) 进行分类讨论,从而制定个体化给药方案,提高美罗培南抗感染的治疗效果。
1 药动学
美罗培南具有线性动力学特征,药物进入人体后广泛分布于各组织和体液中,在普通感染患者中能很好地穿透进入包括脑脊液在内的大部分体液和组织中,达到有效浓度,渗透率大约为20%,但根据感染程度的不同,个体间也会存在差异。健康志愿者美罗培南输注250 mg、 500 mg、 1 g和2 g时,最大血药浓度Cmax分别为12.10~15.80、24.80~26.90、 53.10~61.60和>100 mg/L,消除半衰期(T1/2)为1.00~1.40 h,终末半衰期为3.80 h,血浆清除率、肾清除率分别为16.70和11.70 L/h,表观分布容积为12.50~23.00 L,美罗培南血浆蛋白结合率较低,约2%,主要分布于细胞外液,在不同器官之间的分布存在差异。美罗培南主要通过肾小球滤过经肾脏排泄,54%~79%以原形从尿液排出,19%~27%以无活性的代谢物从粪便排出,也有研究显示其胆汁浓度随着时间延长而增加,胆汁排泄率约为25%[1-2]。由于不同的生理病理状态会导致美罗培南的药动学参数有所不同,现就不同脏器受损,不同人群分类进行阐述。
1.1器官功能损害患者
1.1.1肾损伤患者 美罗培南主要经肾脏排泄,因此对于肾损伤患者需要调整剂量。通过健康受试者与肾损伤患者比较(500 mg美罗培南30 min输注),发现随着损伤程度的增加,终末半衰期也相应增加,终末期无尿肾病患者,其半衰期延长至13.70 h,而接受血液透析的患者,其半衰期更为正常值的10倍[3]。因此在临床使用中,应考虑肾脏功能对药物清除的影响,并作出相应的调整,适当减少美罗培南的给药剂量或延长给药间隔。美罗培南总清除率和肌酐清除率存在线性关系,因此肌酐清除率是肾损伤患者剂量调整的重要参考因素。如果肌酐清除率<50 mL/min,则需调整剂量,具体方案为:①肌酐清除率26~50 mL/min:常规剂量,每12小时1次静脉滴注;②肌酐清除率10~25 mL/min:常规剂量的一半,每12小时1次静脉滴注;③肌酐清除率<10 mL/min:常规剂量的一半,每日1次静脉滴注。
对于肾功能不全患者,治疗方式如连续性肾脏替代治疗(continuous renal replacement therapy,CRRT)、血液透析、腹膜透析等置换液的流量以及滤膜的性质、肾小球滤过率(glomerular filtration rate,GFR)均会影响药物的清除,见表1。例如CRRT患者[3],美罗培南1 g静脉滴注1 h后血浆峰浓度为18.00~45.00 mg/L,低于健康志愿者的血浆峰浓度(53.00~62.00 mg/L)。另有研究发现,对于进行CRRT的患者间歇输注的有效性优于持续输注[4]。此外,GRF<30 mL/min时,有大约20%美罗培南发生了非肾清除。
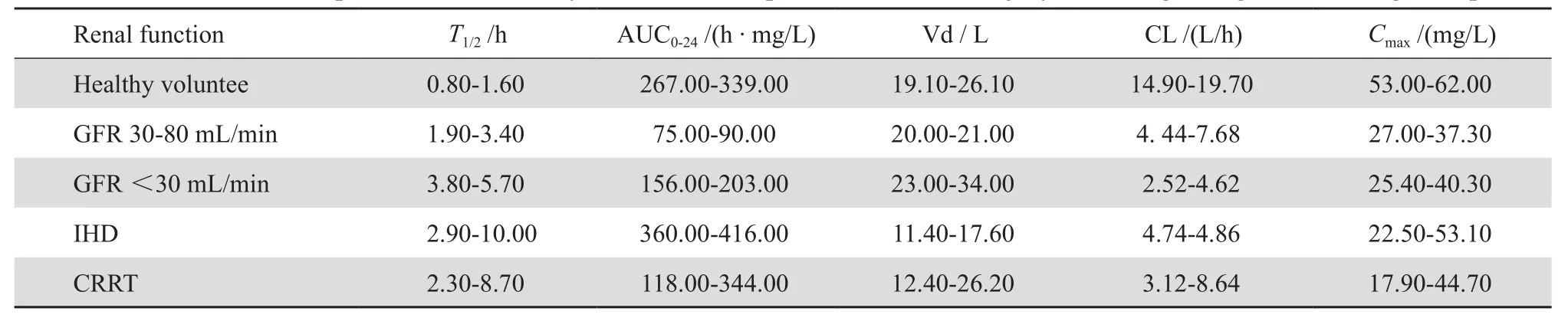
表1 肾损伤患者与健康志愿者美罗培南药动学参数比较[3]Table 1 Pharmacokinetic parameters in healthy volunteers and patients with renal injury following a single dose of 1 g meropenem
1.1.2肝损伤患者 通过比较肝硬化患者和正常肝功能患者(重复给予美罗培南)的药动学发现,半衰期(1.40±0.10)对(1.20±0.20)h、峰浓度(51.20±3.60)对(54.60±4.00) mg/L及表观分布容积(18.80±1.40)对(22.20±3.40)L等,差异并无统计学意义[5],提示在此类患者中美罗培南剂量不需调整[6]。
1.2特殊人群
1.2.1老年患者的药动学 通过给予20~34岁男性患者和67~80岁男性患者500 mg美罗培南30 min输注,比较其药动学参数,发现随着年龄的增加,肾功能减退,肾排泄率随之下降,血浆清除率降低。但是对于肌酐清除率≥50 mL/min的患者无需调整剂量[6]。有文献报道,老年患者的半衰期及表观分布容积较健康志愿者延长与增加,见表2[7]。
1.2.2儿童及新生儿的药动学 一般来说,儿童的半衰期与成人相似,但对于6月龄以下的婴儿略有不同,主要是因为美罗培南经肾脏排泄,而婴儿的肾脏功能并未完全成熟,表现为婴儿美罗培南半衰期延长,表观分布容积小于成人,因此血浆峰浓度高于成人,需要密切关注有无不良反应的发生[8],见表2。由于美罗培南可以很好地渗透进入脑脊液,因此美罗培南也用于儿童中枢神经系统感染的治疗[9]。
1.2.3肥胖患者的药动学 由于病态肥胖患者脂肪组织及体液的增加,临床医师一般会因其增大的分布容积而增加药物剂量,但缺乏相关指南,存在随意性。CHEATHAM等[10]选择重症监护病房(ICU)中体质指数≥40 kg/m2的9例患者,发现其谷浓度与半衰期较普通受试者增加和延长,与普通受试者相比,其表观分布容积增大,清除率减慢,见表2。虽然病态肥胖患者的表观分布容积高于普通患者,但是该研究指出标准给药方案已经足以达到药效暴露病原菌,只有对于不敏感菌引起的下呼吸道感染需要增加剂量或者延长给药时间。
1.3不同疾病患者
1.3.1脓毒症及脓毒症休克患者 脓毒症和脓毒症休克患者病理生理的改变,导致药动学和药效学的改变。GONCALVES-PEREIRA等[12]对多项研究进行荟萃分析发现与健康志愿者相比,β内酰胺类药物在ICU脓毒症患者体内的药动学参数发生不均一变化,表观分布容积均有不同程度的增加。这是由于脓毒症患者因感染引发了全身炎性反应综合征,导致体液从损伤内皮细胞和毛细血管渗透到组织间隙。此外,脓毒症引起肾脏和(或)肝脏器官受损,抗生素的清除降低,使得原药和代谢物在体内蓄积。TACCONE等[13]研究发现与健康志愿者相比,美罗培南在重症脓毒血症及脓毒性休克患者体内表观分布容积值增加,最大血药浓度及清除降低,见表3。UDY等[14]发现重度脓毒症和脓毒性休克患者肌酐清除率增加,美罗培南谷浓度降低,使得部分重症患者β内酰胺类抗生素初始治疗出现亚治疗浓度,达不到相应靶浓度,也说明了脓毒症和脓毒症休克患者病理生理的变化对抗生素的药动学有明显影响,需要制定有针对性的给药方案。同样,也有学者发现美罗培南对于脓毒症患者具有高稳态表观分布容积和清除率,但是在发生脓毒症休克的患者间存在很大变异性,谷浓度水平在休克早期和中期>20.00 mg/L,但是晚期只有一半患者能达到此浓度。此外,脓毒症患者常伴有低蛋白血症,导致游离血药浓度增加,而游离抗生素比例不仅对药物清除有意义,更对药物体内分布具有重要作用,因此低蛋白血症的脓毒症患者美罗培南分布容积和清除率均有所增加,提示我们对这类患者需要制定特殊的给药方案[15]。
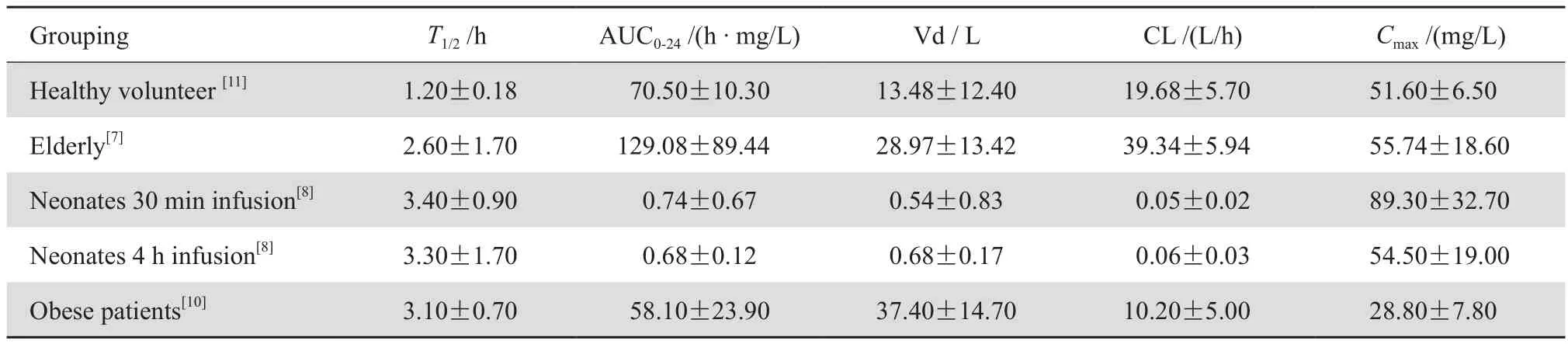
表2 特殊人群患者与健康志愿者美罗培南药动学参数比较Table 2 Pharmacokinetic parameters of meropenem in special populations and healthy volunteers (mean±SD)
1.3.2重症肺炎患者 肺炎是危重患者最常见的感染形式,其发病率和病死率居高不下,因此对重症肺炎患者抗菌药物的药动学研究尤其重要,而美罗培南是治疗重症肺炎的一线药物。美罗培南能迅速渗透进入肺部组织和骨骼肌,并且药物在肺组织的达峰时间要早于血液的达峰时间,美罗培南1 g静脉滴注20 min,药物在肺组织和骨骼肌的峰浓度均高于血清中的浓度,药物肺组织的半衰期与血清半衰期相近,曲线下面积(AUC)为血清的五分之二,见表3[16]。全身给药后,美罗培南首先穿过肺泡毛细血管屏障,到达上皮细胞衬液内发挥药效,上皮细胞衬液对药物的渗透程度主要通过上皮细胞衬液药物浓度与血药浓度比值来反映。FRIPPIAT等[17]研究发现重症肺炎患者美罗培南1 g每8小时1次静脉滴注3 h,其上皮细胞衬液/血浆渗透系数要高于美罗培南1 g每8小时静脉滴注30 min,分别为0.29±0.03与0.20±0.03。对于择期肺部手术患者,术前给予患者30 min单剂量输注1 g美罗培南,1 h后其肺、支气管黏膜、胸膜组织的峰浓度分别为3.90、 6.60、 2.80 mg/L[18]。
1.3.3烧伤患者 林彩等[11]对28例烧伤患者给予500 mg美罗培南30 min静脉滴注,测得血药浓度明显高于健康受试者;半衰期也较健康受试者延长,但尿中美罗培南的回收率(58%)低于健康受试者(75%),其原因可能是烧伤患者毛细血管通透性增加,创面液体大量渗出,增加了非肾清除,因此肾清除率减少,见表3。给药2 h后,水疱液美罗培南的浓度要高于血浆中的浓度,表明美罗培南在创面有较好的渗透性,适用于烧伤患者创面感染治疗。
1.3.4腹腔感染患者 术前给予腹腔感染患者30 min单剂量输注1 g美罗培南,研究发现1 h后进入腹内组织和腹膜液(腹膜液浓度为血浆浓度的45%),2~4 h后胆汁和肌肉组织达到峰浓度,腹膜液的浓度为12.20 mg/L,高于腹内病原菌的MIC(0.03~4 mg/L)值。类似的发现还有患者术前30 min单剂量输注500 mg美罗培南,腹膜液/血浆浓度比例为0.52,胆汁/血浆浓度比例为0.25,表明其穿透性良好,对于腹腔感染的患者常规剂量美罗培南可以达到有效抗感染浓度,见表3。对于妇科手术患者,术前给予30 min单剂量输注500 mg美罗培南,美罗培南能迅速进入组织(1 h),峰浓度为血浆浓度的14.3%~63.9%,腹膜液的浓度为8.80 mg/L,为血浆浓度的三分之二[2, 18]。
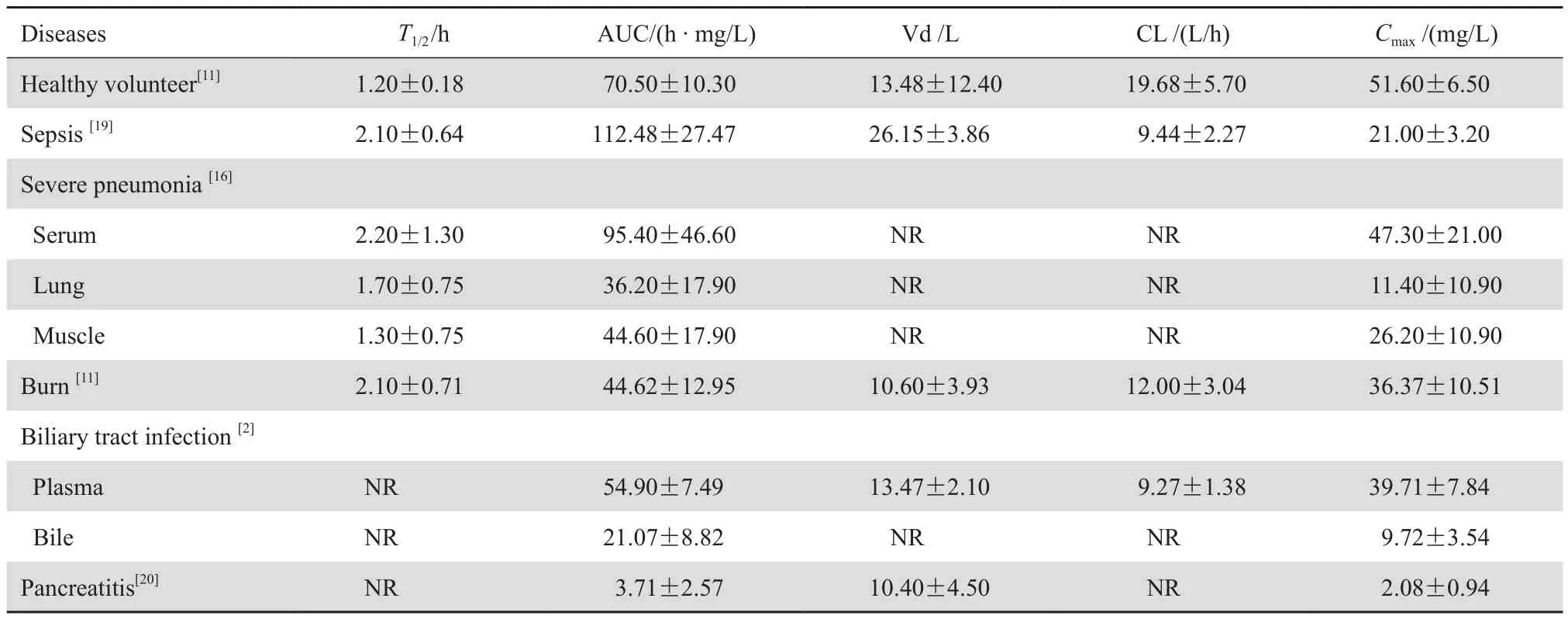
表3 不同疾病患者与健康志愿者美罗培南药动学参数比较Table 3 Pharmacokinetic parameters of meropenem in patients with different diseases and healthy volunteers
1.3.5胰腺炎患者 KONDO等[20]通过对鼻胰管引流患者给予30 min单剂量输注500 mg美罗培南,研究发现在(1.03±0.18) h胰液浓度达到峰浓度(2.08±0.94) mg/L。血浆峰浓度为(39.60±10.46)mg/L,达峰时间为0.5 h,胰液/血浆浓度比值为0.055 ±0.028,AUC0-∞为0.061。该研究表明美罗培南在胰液中渗透率较低,胰腺炎患者可能需要增加给药剂量,见表3。
2 药动学/药效学
美罗培南属于时间依赖性抗生素,评价其抗菌效果的主要参数是血药浓度维持在细菌MIC以上的时间即%T>MIC,但美罗培南半衰期较短,普遍认为至少40%T>MIC才能维持其杀菌活性,最近有数据显示54%~76%T>MIC能很好地预测其临床和细菌学治愈;但是也有学者认为40%T>MIC只能达到临床治愈,40%T>4~5MIC能更好地达到临床和病原学治愈,尤其是感染高MIC值病原菌的严重感染患者,甚至需要考虑达到100%T>4~5 MIC。为达到理想的T>MIC,可以增加给药次数或者延长给药时间,24 h持续输注法是理想方案,但JARURATANASIRIKUL等[21]发现美罗培南室温下稳定性差,32~37℃时2、 4、 8 h后药效降低3.14%、 5.86%和11.85%,即使是20℃也会降低1.66%、 3.31%和5.80%,因此可实现性不高。目前,一般通过蒙特卡罗模拟获得各种给药方案能够满足理想的PK/PD参考值的达标概率(probability of target attainment,PTA),认为达标概率>90%的给药方案可能是抗菌药物治疗的理想选择。
2.1特殊患者
2.1.1儿童及新生儿 OHATA等[22]通过研究日本新生儿建立药动学模型,通过蒙特卡罗模拟推测出治疗敏感菌美罗培南20 mg/kg每8 小时静脉输注30 min,能达到50%T > MIC。但如果是铜绿假单胞菌等MIC≥2 mg/L的细菌感染,美罗培南40 mg/kg每8 h静脉输注30 min,50%T > MIC达标率仅为60.7%,通过延长其输注时间至4 h,达标率提高到97%;VAN DEN ANKER等[23]通过研究23例29~36周的早产新生儿和15例37~42周的足月新生儿,发现早产新生儿的清除率要高于足月组,通过蒙特卡罗模拟,对于MIC值较高(4~8 mg/L)的细菌,40 mg/kg每8小时静脉滴注4 h为理想给药方案,见表4。对于接受CRRT治疗的儿童,NEHUS等[24]通过建立药动学模型,得出当靶目标为%T>MIC为40%时,5岁及以上的儿童推荐给药方案为20 mg/kg每12小时静脉滴注,而5岁以下的儿童推荐给药方案则为20 mg/kg每8小时静脉滴注,见表4。
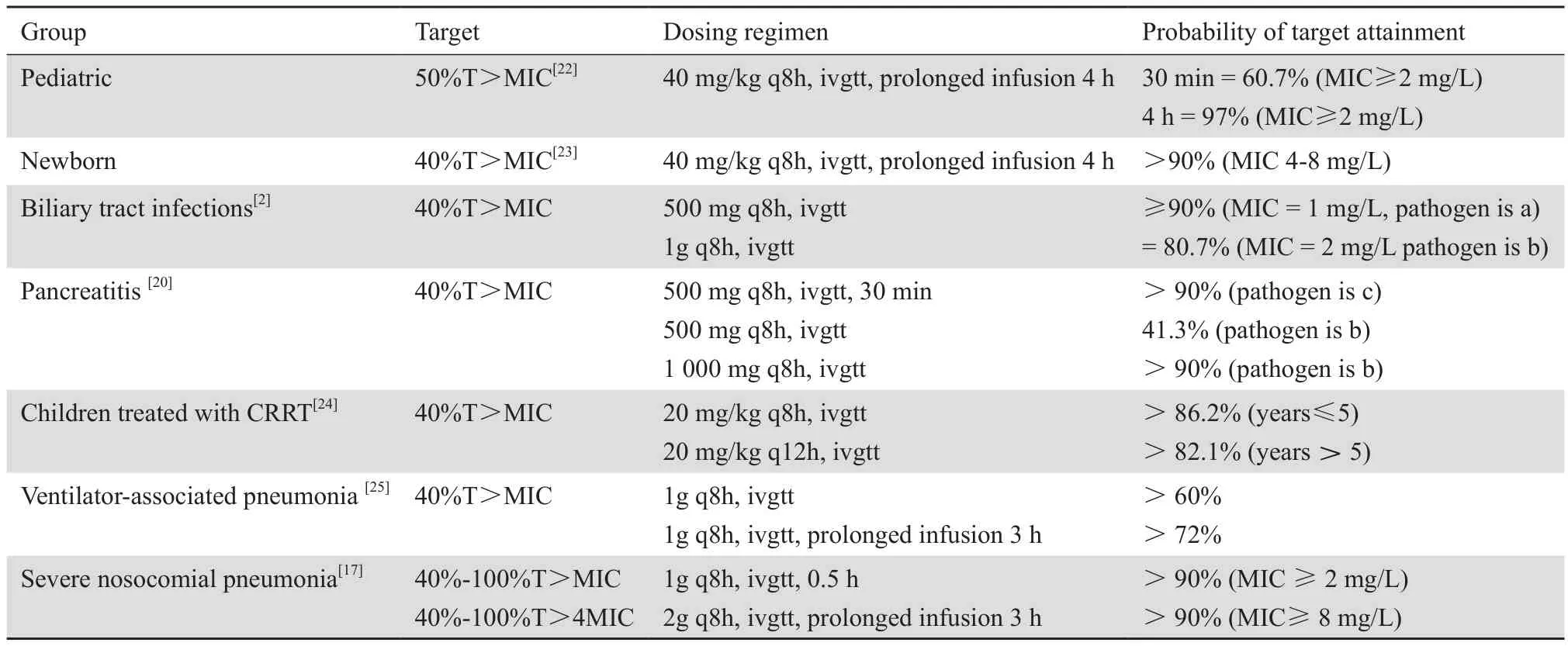
表4 美罗培南在不同类型患者中的蒙特卡洛模拟PK/PD达标率Table 4 Probability of target PK/PD attainment of meropenem with Monte Carlo simulation in different types of patients
T >MIC: time above the target minimum inhibitory concentration; MIC: minimum inhibitory concentration; ivgtt: intravenous infusion; a: Escherichia coli, Klebsiella pneumoniae, Enterobacter cloacae, b: Pseudomonas aeruginosa, c: Escherichia coli, Klebsiella spp., Enterobacter spp., Proteus spp..
2.1.2肥胖患者 TACCONE等[26]通过对1例广泛耐药的铜绿假单胞菌的感染性休克肥胖患者研究发现,美罗培南1 g每8小时静脉输注30 min,%T>4MIC为37%,调整为3 g每6 h静脉输注3 h, %T >4 MIC为51%能达到理想疗效,提示对于广泛耐药铜绿假单胞菌的感染性休克肥胖患者需要通过药物监测调整给药方案,从而更好地达到临床疗效,见表5。

表5 美罗培南在临床研究中达到有效抑菌浓度时间百分率Table 5 Time above effective inhibitory concentration of meropenem against target pathogens in various clinical trials
2.2不同疾病患者
2.2.1脓毒症及脓毒症休克患者 对于脓毒症患者,相较于T>MIC采用T>4MIC评价疗效可能会获得更好的临床治愈率和细菌清除率。通过轻度和重度脓毒症患者比较,药动学存在明显差异,当MIC=4 mg/L时,重度组%T > 4MIC达标率仅(26.70±4.33)%,提示重度脓毒症患者需加大剂量或(和)增加给药频率[19]。
对于接受CRRT治疗的ICU患者,ISLA等[32]通过建立群体药动学模型,发现其显著协变量为肌酐清除率和患者类型(脓毒症或者多发伤患者),MIC≥2 mg/L的脓毒症或者多发伤患者推荐持续输注美罗培南,MIC≥8 mg/L的伴随肾损伤的多发伤患者需要增加剂量;对于脓毒症患者,薄世宁等[31]对接受CRRT治疗的ICU患者研究分析发现MIC=8 mg/L时,美罗培南500 mg每6小时持续输注3 h,能达到理想疗效;BEUMIER等[33]认为对接受CRRT治疗的ICU患者,使用标准剂量的美罗培南大约有10%患者达不到治疗革兰阴性杆菌尤其是铜绿假单胞菌的有效浓度,然而大约53%患者可能会存在药物蓄积;SEYLER等[28]的研究发现接受CRRT治疗的患者首个48 h使用正常剂量的美罗培南即1 g每8小时静脉滴注,血药浓度在有效范围内,但是48 h后可能会有药物蓄积,因此需要调整剂量。同样,ULLDEMOLINS等[34]表示在治疗首日起始剂量应能迅速达到药物有效浓度(不考虑肾功能损伤),从第2天开始根据CRRT设置的改变及残余肾功能进行剂量调整。JAMAL等[29]通过比较接受CRRT治疗患者间歇输注与持续输注后发现,两者都可以达到理想疗效,同时指出,相较于输注方式,剂量的选择更加重要。
2.2.2重症肺炎患者 FRIPPIAT等[17]通过蒙特卡罗模拟发现MIC≥2 mg/L时,以40%~100%T>MIC为靶值,1 g 每8小时输注0.5 h就能达到治疗效果,而MIC≥8 mg/L时以40%~100%T>4 MIC为靶值,2 g 每8小时输注3 h才能达到治疗效果,因此对于重症肺炎患者推荐给药方案为美罗培南2 g 每8小时持续输注3 h,见表4。通过比较呼吸机相关性肺炎患者美罗培南3 h延长输注和0.5 h快速输注药动学变化,发现3 h滴注时T>MIC值显著高于0.5 h滴注,其中1 g美罗培南3 h输注T>MIC (MIC = 4 mg/L)达标率可达72%,而滴注0.5 h达标率则为60%,见表4。另一项研究也显示与3 h延长输注相比0.5 h滴注能更好地达到临床疗效,提高治疗各病原菌的达标概率[19,25,35]。
2.2.3腹腔感染患者 KARJAGIN等[27]通过研究继发腹膜炎的感染性休克患者发现,当MIC= 4 mg/L时,美罗培南1 g每8小时静滴能获得理想的达标率;当MIC=16 mg/L时,美罗培南1 g 每6小时静滴,血浆和腹膜液才能达到有效浓度,又因美罗培南在腹膜液中存在潜在的不稳定性,因此对于继发腹膜炎的感染性休克患者推荐给药方案为美罗培南1 g每6小时静滴。
IKAWA等[2]研究胆道感染患者,通过蒙特卡罗模拟发现500 mg美罗培南每8小时30 min输注,治疗大肠埃希菌、肺炎克雷伯菌、阴沟肠杆菌胆汁中40%T>MIC达标率相似均≥90%;对于铜绿假单胞菌美罗培南1 g静滴每8 小时达标率为80.7%;在胆汁中MIC值为1 mg/L,推荐给药方案为500 mg每8小时静滴,当MIC值为2 mg/L时,推荐给药方案为1 g每8小时静脉滴注,见表4。
KONDO等[20]对胰腺炎患者给予30 min单剂量输注500 mg美罗培南,然而,通过蒙特卡罗模拟发现30 min单剂量输注500 mg美罗培南每8小时,以40%T>MIC为PK/PD靶目标治疗大肠埃希菌、克雷伯菌属、肠杆菌属、变形杆菌都可获得理想达标概率而铜绿假单胞菌的达标率只有41.3%,见表4。
不同疾病患者生理病理状态不同,导致其对美罗培南的分布、代谢和消除等药动学特征也不尽相同,而近年来美罗培南对病原菌MIC值也在不断升高,使得常规剂量的美罗培南在众多患者中达不到理想的抗感染PK/PD靶目标。目前,国内针对不同类型的患者考察美罗培南PK/PD相关研究较少,大多参考国外文献。因此,有必要针对我国不同生理病理特征的患者使用美罗培南的药动学差异性进行更深入的分析,确定临床药效学参数,通过更大的临床样本量建立PK/PD模型,指导临床美罗培南合理使用,实现个体化给药,防止细菌耐药的发生,在保证疗效的前提下防止过度治疗,值得深入研究。
[1]BRIILH D, TEXIER-MAUGEIN J, ALLAOUCHICHE B , et al. Carbapenems[J]. J Chemother, 2013, 25(1):1-17.
[2]IKAWA K, NAKASHIMA A, MORIKAWA N, et al. Clinical pharmacokinetics of meropenem and biapenem in bile and dosing considerations for biliary tract infections based on site-specific pharmacodynamic target attainment[J]. Antimicrob Agents Chemother, 2011, 55(12): 5609-5615.
[3]THALHAMMER F, HÖRL WH. Pharmacokinetics of meropenem in patients with renal failure and patients receiving renal replacement therapy[J]. Clin Pharmacokinet, 2000, 39(4): 271-279.
[4]LANGGARTNER J, VASOLD A, GLÜCK T, et al. Pharmacokinetics of meropenem during intermittent and continuous intravenous application in patients treated by continuous renal replacement therapy[J]. Intens Care Med,2008, 34(6): 1091-1096.
[5]THYRUM PT, YEH C, BIRMINGHAM B, et al. Pharmacokinetics of meropenem in patients with liver disease[J]. Clin Infect Dis, 1997,24(Suppl 2):s184-s190.
[6]AstraZeneca Pharmaceuticals. MERREM I.V.( meropenem for injection) [Z/OL].(2014-12)[2015-03-09]. http://www. astrazeneca-us.com/medicines/astrazeneca-medications/ 2014.
[7]张弨, 周勇, 周庆涛, 等. HPLC法测定美罗培南血清浓度及其在ICU老年患者中的药代动力学研究[J]. 中国临床药理学杂志, 2013, 29(4): 273-275.
[8]PADARI H, METSVAHT T, KÕRGVEE LT, et al. Shortversus long infusion of meropenem in very-low-birth-weight neonates[J]. Antimicrob Agents Chemother, 2012, 56(9):4760-4764.
[9]SULLINS AK, ABDEL-RAHMAN SM. Pharmacokinetics of antibacterial agents in the CSF of children and adolescents[J]. Pediatric Drugs, 2013, 15(2): 93-117.
[10]CHEATHAM SC, FLEMING MR, HEALY DP, et al. Steady-state pharmacokinetics and pharmacodynamics of meropenem in morbidly obese patients hospitalized in an intensive care unit[J]. J Clin Pharmacol, 2014, 54(3): 324-330.
[11]林彩, 刘松青, 戴青, 等. 美罗培南在烧伤患者的药代动力学研究[J]. 中国抗生素杂志, 2004, 29(2): 118-123.
[12]GONÇALVES-PEREIRA J, PÓVOA P. Antibiotics in critically ill patients: a systematic review of the pharmacokinetics of b-lactams[J]. Crit Care, 2011, 15(5): R206.
[13]TACCONE FS, LATERRE PF, DUGERNIER T, et al. Insufficient β-lactam concentrations in the early phase of severe sepsis and septic shock[J]. Crit Care, 2010, 14(4):R206.
[14]UDY AA, VARGHESE JM, ALTUKRONI M, et al. Subtherapeutic initial β-lactam concentrations inselect critically ill patients:association between augmented renal clearance and low trough drug concentrations[J]. Chest, 2012, 142(1): 30-39.
[15]GONCALVES-PEREIRA J, SILVA NE, MATEUS A, et al. Assessment of pharmacokinetic changes of meropenem during therapy in septic critically ill patients[J]. BMC Pharmacol Toxicol, 2014, 15 (1): 21.
[16]TOMASELLI F, MAIER A, MATZI V, et al. Penetration of meropenem into pneumonic human lung tissue as measured by in vivo microdialysis[J]. Antimicrob Agents Chemother, 2004, 48 (6): 2228-2232.
[17]FRIPPIAT F, MUSUAMBA FT, SEIDEL L, et al. Modelled target attainment after meropenem infusion in patients with severe nosocomial pneumonia: the PROMESSE study[J]. J Antimicrob Chemother, 2015, 70(1): 207-216.
[18]NICOLAU DP. Pharmacokinetic and pharmacodynamic properties of meropenem[J]. Clin Infect Dis, 2008, 47(Suppl 1): s32-s40.
[19]牛莎, 张睢扬, 王英, 等. 美罗培南在脓毒症及脓毒症休克患者中的PK/PD 研究[J]. 中华肺部疾病杂志( 电子版), 2013,6(3): 4-8.
[20]KONDO N, IKAWA K, MURAKAMI Y, et al. Clinical pharmacokinetics of meropenem in pancreatic juice and sitespecific pharmacodynamic target attainment against Gramnegative bacteria: dosing considerations[J]. Pancreatology,2014, 14(2): 95-99.
[21]JARURATANASIRIKUL S, SRIWIRIYAJAN S. Stability of meropenem in normal saline solution after storage at room temperature[J]. Southeast Asian J Trop Med Public Health,2003, 34(3):627-629.
[22]OHATA Y, TOMITA Y, NAKAYAMA M, et al. Optimal dosage regimen of meropenem for pediatric patients based on pharmacokinetic/pharmacodynamic considerations[J]. Drug Metab Pharmacokinet, 2011, 26(5): 523-531.
[23]VAN DEN ANKER JN, POKORNA P, KINZIG-SCHIPPERS M, et al. Meropenem pharmacokinetics in the newborn[J]. Antimicrob Agents Chemother, 2009, 53(9): 3871-3879.
[24]NEHUS EJ, MOUKSASSI S, VINKS AA, et al. Meropenem in children receiving continuous renal replacement therapy:clinical trial simulations using realistic covariates[J]. J Clin Pharmacol, 2014, 54(12): 1421-1428.
[25]LEE LS, KINZIG-SCHIPPERS M, NAFZIGER AN, et al. Comparison of 30-min and 3-h infusion regimens for imipenem/ cilastatin and for meropenem evaluated by Monte Carlo simulation[J]. Diagn Microbiol Infect Dis, 2010, 68(3): 251-258.
[26]TACCONE FS, COTTON F, ROISIN S, et al. Optimal meropenem concentrations to treat multidrug-resistant Pseudomonas aeruginosa septic shock.[J]. Antimicrob Agents Chemother, 2012, 56(4):2129-2131.
[27]KARJAGIN J, LEFEUVRE S, OSELIN K, et al. Pharmacokinetics of meropenem determined by microdialysis in the peritoneal fluid of patients with severe peritonitis associated with septic shock[J]. Clin Pharmacol Ther, 2007, 83(3): 452-459.
[28]SEYLER L, COTTON F, TACCONE FS, et al. Recommended β-lactam regimens are inadequate in septic patients treated with continuous renal replacement therapy[J]. Crit Care, 2011, 15 (3): R137.
[29]JAMAL J, MAT-NOR M, MOHAMAD-NOR F, et al. Pharmacokinetics of meropenem in critically ill patients receiving continuous venovenoushaemofiltration: a randomised controlled trial of continuous infusion versus intermittent bolus administration. [J]. Int J Antimicrob Agents,2015,45(1): 41-45.
[30]BILGRAMI I, ROBERTS JA, WALLIS SC, et al. Meropenem dosing incritically ill patients with sepsis receiving high-volume continuousvenovenous hemofiltration[J]. Antimicrob Agents Chemother, 2010, 54(7):2974-2978.
[31]薄世宁, 李宏亮, 朱曦,等. 连续性静-静脉血液滤过患者延长美罗培南静脉输注时间的药代动力学研究[J]. 中国危重病急救医学,2012,24(3)145-148.
[32]ISLA A, RODRÍGUEZ-GASCÓN A, TROCÓNIZ IF, et al. Population pharmacokinetics of meropenem in critically ill patients undergoing continuous renal replacement therapy[J]. Clin Pharmacokineti, 2008, 47(3): 173-180.
[33] BEUMIER M, CASU GS, HITES M, et al.β-lactam antibiotic concentrations during continuous renal replacement therapy[J]. Crit Care, 2014, 18(3): R105.
[34]ULLDEMOLINS M, VAQUER S, LLAURADó-SERRA M, et al. Beta-lactam dosing in critically ill patients with septic shock and continuous renal replacement therapy[J]. Crit Care, 2014,18(3): 227.
[35]JARURATANASIRIKUL S, SRIWIRIYAJAN S, Punyo J, et al. Comparison of the pharmacodynamics of meropenem in patients with ventilator-associated pneumonia following administration by 3-hour infusion or bolus injection[J]. Antimicrob Agents Chemother, 2005, 49(4): 1337-1339.
Research updates on pharmacokinetic/pharmacodynamic variation of meropenem in different physiological and pathological states
ZHANG Hong, JIN Lu, GE Weihong, WANG Hao, LIANG Pei. (Department of Pharmacy, Nanjing Drum Tower Hospital, Nanjing University of Traditional Chinese Medicine, Nanjing 210029, China)
·综述·
R978
A
1009-7708(2016)01-0092-07
10.16718/j.1009-7708.2016.01.021
南京中医药大学中西医结合临床医学院附属南京市鼓楼医院药学部,南京 210029。
张红(1988—),女,硕士研究生,主要从事临床药动学/药效学研究。
葛卫红,E-mail: 6221230@sina.com。
2015-04-10
2015-05-13
