非达霉素和万古霉素对黄金地鼠艰难梭菌相关性腹泻动物模型治疗效果的评价
2016-09-20强翠欣田甜甜李志荣徐凯悦崔庆庆赵建宏
强翠欣, 杨 靖, 白 玉, 田甜甜, 李志荣, 徐凯悦, 崔庆庆, 王 倩, 张 娟,赵建宏
非达霉素和万古霉素对黄金地鼠艰难梭菌相关性腹泻动物模型治疗效果的评价
强翠欣1, 杨 靖1, 白 玉2, 田甜甜1, 李志荣1, 徐凯悦1, 崔庆庆1, 王 倩1, 张 娟2,赵建宏1
目的 评价非达霉素和万古霉素对黄金地鼠艰难梭菌相关性腹泻动物模型的体内抗菌作用。方法 以4×107CFU/ mL的艰难梭菌ATCC BAA-1870感染黄金地鼠后,用不同浓度的非达霉素(0.3、 0.8和2.5 mg·kg-1·d-1)或者万古霉素(5 mg·kg-1·d-1)灌胃,观察给药后黄金地鼠的体质量变化和存活率。结果 在艰难梭菌ATCC BAA-1870感染后,用非达霉素和万古霉素治疗7 d期间,动物生存率为100%。非达霉素(2.5 mg·kg-1·d-1)治疗组一直到观察终点生存率为100%,但是万古霉素组在观察第11天时出现感染复发并死亡,观察到30 d时生存率仅为20%。粪便培养显示非达霉素可以有效清除黄金地鼠粪便中的艰难梭菌。结论 非达霉素对高产毒艰难梭菌具有强效的体内抗菌作用,与目前临床常用万古霉素相比,其治疗复发率低,值得进一步在临床上试验。
艰难梭菌相关性腹泻; 非达霉素; 万古霉素; 动物模型
2003年以来,艰难梭菌相关性腹泻(Clostridium difficile associated diarrhea,CDAD)的发病率和疾病严重程度在全球范围内呈上升趋势,尤其是艰难梭菌高产毒株(BI/NAP1/027毒素Ⅲ型)的出现和暴发流行,使得艰难梭菌成为医院获得性和社区获得性腹泻的主要病原菌之一[1]。艰难梭菌主要通过分泌毒素A、毒素B以及二元毒素而致病,临床表现可从轻度自愈性腹泻至严重的伪膜性肠炎[2]。甲硝唑和万古霉素是治疗CDAD的一线药物,近年来国外有报道称细菌对这两种药的敏感性有所下降,且治愈后复发率可高达25%~60%[3]。非达霉素属于大环内酯类抗生素,其作用机制主要是通过抑制细菌的RNA聚合酶而产生迅速的抗艰难梭菌的作用。体内呈现低血浆浓度和高粪便浓度,对肠道正常菌群影响小,治疗非027型菌株,复发率显著低于万古霉素(7.8% 对 25.5%)[4]。该药于2011年在美国被FDA批准上市[5-6],在我国非达霉素尚未应用于临床,对于非达霉素在动物体内药效观察的研究较少。本次试验用艰难梭菌高产毒株ATCC BAA-1870来评价非达霉素和万古霉素对黄金地鼠艰难梭菌相关性腹泻模型的体内抗菌作用。
1 材料与方法
1.1实验材料
1.1.1实验菌株 艰难梭菌ATCC BAA-1870 (PFGE分型 NAP1, ToxinotypeⅢ, 二元毒素阳性),购自英国OXOID 公司。
1.1.2实验动物 SPF级黄金地鼠,体质量80~100 g。由北京维通利华实验动物技术有限公司提供,许可证编号:SCXK(京)2012-0001。实验动物质量合格证编号:11400700043184。
1.1.3实验药品 非达霉素(批号:20130803)200 mg/片,华北制药股份有限公司提供;注射用盐酸万古霉素(批号:C084826)0.5 g/瓶,Eli Lilly Japan K.K公司生产;克林霉素磷酸酯注射液(批号:PE02001)2 mL/0.3 g,华北制药股份有限公司提供。
1.1.4培养基与试剂 艰难梭菌琼脂基础、艰难梭菌拉氧头孢诺氟沙星(CDMN)添加剂、脑心浸液肉汤,均购自英国OXOID 公司;羊血购自北京陆桥公司。
1.2实验方法
1.2.1感染模型建立 选用无特定病原体的黄金地鼠60只,随机分成6组,每组10只;每3只或4只放入一个大鼠笼,每组3个笼。首先用30 mg/kg克林霉素磷酸酯注射液进行皮下注射。24 h后,1~5组用0.5 mL脑心浸液肉汤配制成0.5 麦氏浊度( 4×107CFU/mL)的艰难梭菌菌悬液灌胃,第6组用同等量不含任何细菌的脑心浸液肉汤灌胃,作为空白对照。灌胃后18 h,第1组用无菌生理盐水作为安慰剂治疗,第2组用万古霉素(5 mg·kg-1·d-1)治疗,第3、第4、第5组分别用非达霉素低、 中、 高剂量(0.3、0.8和2.5 mg·kg-1·d-1)治疗。从灌菌开始为试验第1天,试验第2天开始给予抗菌药物,治疗7 d,并持续30 d观察其复发情况。
1.2.2感染指标观察 实验期间每天观察黄金地鼠的一般情况(包括是否有步态异常,毛发耸立,嗜睡,消瘦,腹泻,湿尾或死亡)。每隔2~5 d监测体质量,并以空白组为对照比较体质量有无差异。
1.2.3粪便艰难梭菌培养 每隔2~5 d留取地鼠粪便进行艰难梭菌培养,同时对出现腹泻的地鼠粪便及自然死亡地鼠和到达实验终点处的地鼠全部进行解剖,取盲肠内容物进行培养,取0.5 g动物粪便保存于1.5 mL甘油肉汤中,再取0.5 mL接种于1.5 mL CDMN肉汤中(含0.1%牛磺胆酸钠)37 ℃有氧孵育5 d,加入2 mL无水乙醇室温孵育1 h,4 000 g离心10 min,取沉淀接种于CDMN培养基上,厌氧培养48 h。接种时分三区划线并评估菌落生长数量进行大致菌落计数,从而观察药物对艰难梭菌的清除情况。评估方法如下:如果二区和三区菌落均生长,计数为>105CFU/mL;仅第一区菌落生长,计数为104CFU/mL;103CFU/mL以下计数实际数出的菌落数。
1.2.4死亡率观察 在30 d的实验期间观察各组动物出现感染症状及死亡的情况,并绘制生存曲线。
1.2.5统计学分析 用SPSS13.0软件进行统计学分析,不同组间体质量比较用方差分析,生存率比较用卡方检验。P<0.05表示差异有统计学意义,P<0.01表示差异有极显著统计学意义。
2 结果
2.1实验期间体质量变化
对6组地鼠的体质量进行统计学分析,感染前各组间体质量差异无统计学意义。从灌菌后第7天起至第20天安慰剂治疗组与空白组比较体质量明显减轻,第24~30天无明显差异;从灌菌后第3~30天万古霉素组与空白组比较,动物体质量明显减轻,非达霉素低、中、高剂量组与空白组无明显差异,见图1。
2.2粪便培养
对留取的动物粪便培养显示,用药前和注射克林霉素磷酸酯后各个组别均无艰难梭菌生长。在整个观察过程中空白组无艰难梭菌生长,安慰剂治疗组艰难梭菌生长数量均>105CFU/mL。治疗第5天,万古霉素组2号笼菌落数明显减少仅有4个菌落生长,治疗第7天仅有2个菌落生长;万古霉素组1号和3号笼为104CFU/mL。停药后第4天,万古霉素组3个笼子菌落数明显增多,均>105CFU/mL;而非达霉素低、中、高剂量组菌落数均有减少。停药后第12天,非达霉素高剂量组3个笼中艰难梭菌生长数量明显减少,菌落数≤1个,见表1。对出现腹泻的地鼠粪便及自然死亡地鼠的盲肠内粪便进行艰难梭菌培养均为阳性,且菌落数均>105CFU/mL。
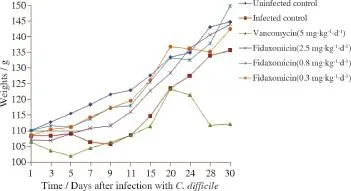
图1 艰难梭菌感染30 d内黄金地鼠的体重变化Figure 1 Change of body weight over 30 days of C. difficile infection in hamsters
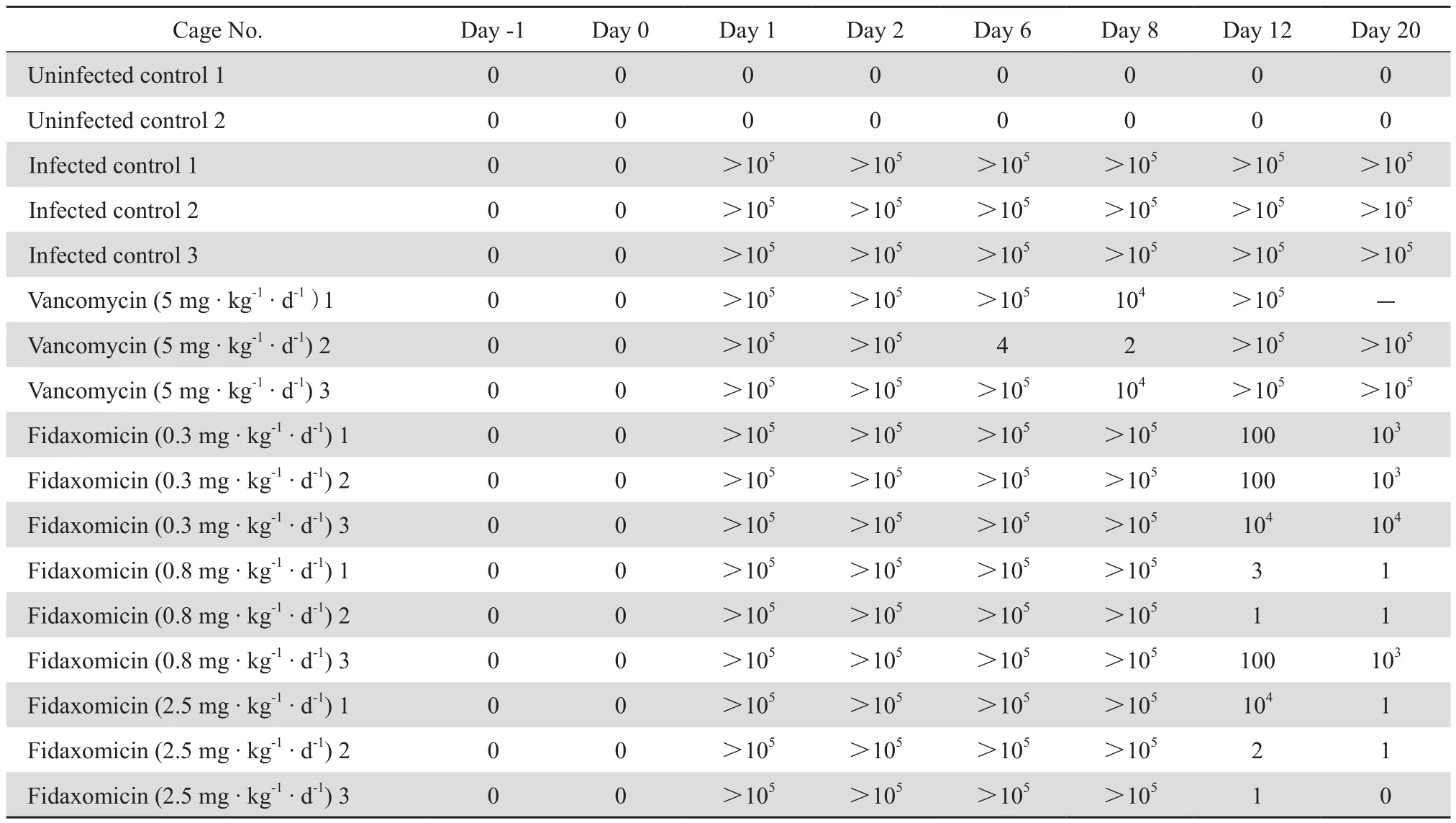
表1 实验期间各个笼子地鼠粪便艰难梭菌培养菌落数Table 1 Colony number of C. difficile in the stool of hamsters from different cages during experiment (CFU/mL)
2.3死亡率
地鼠空白对照组在实验期间30 d内均未出现任何感染症状也未死亡;安慰剂治疗组在灌菌后3~5 d出现了感染症状,包括湿尾、体质量减轻、脱毛等症状,在感染后15 d内有4只死亡,死亡率40%;万古霉素组在用药期间没有出现感染症状,停药后第4~11天有8只陆续出现感染症状并很快死亡,死亡率80%;非达霉素低剂量组在用药期间没出现任何感染症状,停药后第20~22天有4只陆续出现感染症状并很快死亡,死亡率40%;非达霉素中剂量组在用药期间没出现任何感染症状,停药后第20~21天有4只陆续出现感染症状并很快死亡,死亡率40%;非达霉素高剂量组在实验观察30 d内均没有出现任何感染症状也没有死亡,死亡率0,见图2。非达霉素治疗组存活率明显优于万古霉素治疗组(P<0.01)。

图2 抗菌药物治疗艰难梭菌感染黄金地鼠的生存率Figure 2 Survival of hamsters after treatment with antimicrobial agents
3 讨论
近年来在美国,艰难梭菌已经逐渐取代甲氧西林耐药金黄色葡萄球菌成为了医疗相关性感染(healthcare-associated infections)的首要病原菌[7]。甲硝唑和万古霉素是临床治疗CDAD的常用药物。有研究表明CDAD的复发和再感染率很高[8], CDAD治愈后2个月内的复发率可高达25%~85%[9]。有报道称,对于非027型菌株的治疗,非达霉素的复发率显著低于万古霉素(7.8% 对 25.5%)[4]。一项来自美国、加拿大、欧洲的多中心研究也显示,万古霉素和非达霉素对CDAD的最初治愈率很相近(>90%),但在用药后28 d的随访中,非达霉素组复发率比万古霉素组减少了50%[10]。国内华北制药集团已研发出非达霉素,为临床治疗反复复发性CDAD提供了新的选择。因此,评价国内生产的非达霉素对艰难梭菌感染动物模型的治疗效果,对CDAD的临床治疗具有重大意义。
本研究中,成功建立黄金地鼠CDAD模型是实验的关键。KUMAR 等[11]用30 mg/kg的克林霉素皮下注射作为诱导,24 h后给予5×107CFU/mL的艰难梭菌ATCC43255混悬液灌胃建立黄金地鼠CDAD模型。BUTLER 等[12]用5 mg/kg的克林霉素皮下注射作为诱导,24 h后给予3×108CFU/ mL的艰难梭菌ATCC43255芽孢混悬液灌胃建立黄金地鼠CDAD模型。SWANSON 等[13]用100 mg/kg的克林霉素皮下注射作为诱导,24 h后给予106CFU/mL的艰难梭菌ATCC9689混悬液灌胃建立黄金地鼠CDAD模型。由于本实验所用菌株为艰难梭菌高产毒株,考虑到菌株数量过多可能产毒量较大引起动物快速死亡,所以采用KUMAR等[11]方案,用30 mg/kg的克林霉素皮下注射作为诱导,24 h后给予4×107CFU/mL的艰难梭菌ATCC BAA-1870混悬液灌胃建立黄金地鼠CDAD模型。在研究期间发现安慰剂治疗组与空白组相比,黄金地鼠体质量下降有明显差异,并出现湿尾、脱毛等感染症状。但是安慰剂治疗组最后的死亡率仅为40%,与KUMAR[11]等5 d安慰剂治疗组死亡率为100%有较大差异。而徐少华等[14]通过对国内仓鼠CDAD动物模型的建立和评价发现,以100 mg/kg的克林霉素皮下注射作为诱导,24 h后非027型高产毒株给予108CFU/mL的菌混悬液灌胃建立仓鼠CDAD模型,直至第5天仓鼠全部死亡,而107CFU/mL的艰难梭菌非027型混悬液灌胃安慰剂治疗组至观察终点存活率为83.3%。本实验采用107CFU/mL的艰难梭菌非027型混悬液灌胃构建黄金地鼠CDAD模型,至终点存活率为60%,与国内较一致,但与国外数据差距较大,这种差异可能与国内外动物的品系、饲养环境、饲料等因素有关。
虽然安慰剂治疗组最后的死亡率仅为40%,但其粪便艰难梭菌培养的菌落数始终>105CFU/mL。说明安慰剂治疗组艰难梭菌始终在肠道内定植,感染模型构建基本成功。非达霉素高、 中、 低剂量治疗组在实验期间体质量与空白组无明显差异,且显著高于万古霉素组(P<0.01)。非达霉素治疗CDAD黄金地鼠的存活率显著高于万古霉素(P <0.01)。说明非达霉素对黄金地鼠CDAD动物模型有很好的体内抗菌作用。高剂量非达霉素组动物粪便中艰难梭菌生长数量明显减少,菌落数≤1个,说明非达霉素可以有效清除肠道中的艰难梭菌并抑制CDAD的复发。而万古霉素在治疗期间菌落数明显减少,但停药后又急剧增加,最终导致动物感染复发并死亡。本研究结果与KUMAR 等[11]报道万古霉素(5 mg·kg-1·d-1)治疗组在治疗后7~10 d全部死亡,SATTAR 等[15]报道万古霉素(10 mg·kg-1·d-1)治疗组在灌菌后11 d开始出现死亡直至观察终点28 d存活率为10%的结果一致。目前,对于CDAD的治疗复发主要存在2个问题:一是毒素可以引起结肠炎和肠梗阻,会延长病原菌的滞留时间,口服抗菌药物无法有效到达感染部位;二是艰难梭菌会产生芽孢在肠道内定植,很难被抗菌药物完全清除,阻止其复发并恢复正常肠道菌群功能也是治疗中存在的关键问题[16]。肠道正常菌群对病原菌有抗定植作用,一般认为CDAD的发生与肠道抗艰难梭菌定植作用减弱有关[17]。一项针对非达霉素和万古霉素治疗后CDAD患者肠道菌群变化的研究显示,万古霉素治疗过程中可使构成人肠道正常菌群的严格厌氧菌比例减少,兼性厌氧菌和微需氧菌群增多,非达霉素对其影响较万古霉素小[18]。万古霉素复发率高的原因可能是在其应用过程中影响了肠道正常菌群,停药后无法被完全清除的艰难梭菌芽孢萌发致病。本实验观察至终点发现,万古霉素组的死亡率甚至高于安慰剂治疗组,因此,明确万古霉素与非达霉素治疗CDAD后复发率不同的机制是至关重要的,我们将作进一步探索研究。
综上所述,本实验证实国产非达霉素对黄金地鼠CDAD动物模型有较好的体内抗菌保护作用,与目前临床常用万古霉素相比,其治疗复发率低,值得进一步在临床上试验。
[1]LESSA FC, GOULD CV, MCDONALD LC. Current status of Clostridium difficile infection epidemiology[J]. Clin Infect Dis,2012, 55( Suppl 2):s65-s70.
[2]RUPNIK M,WILCOX MH,GERDING DN.Clostridium difficile infection: new developments in epidemiology and pathogenesis[J]. Nat Rev Microbiol,2009,7(7):526-536.
[3]SURAWICZ CM, ALEXANDER J. Treatment of refractory and recurrent Clostridium difficile infection[J]. Nat Rev Gastroenterol Hepatol, 2011,8(6):330-339.
[4]EPSTEIN L, GOLAN Y. Fidaxomicin, a new treatment for Clostridium difficile infections[J]. Drugs Today( Barc), 2012,48(2):101-108.
[5]HARDESTY JS, JUANG P. Fidaxomicin: a macrocyclic antibiotic for the treatment of Clostridium difficile infection[J]. Pharmacotherapy,2011,31(9):877-886.
[6]LANCASTER JW, MATTHEWS SJ. Fidaxomicin: the newest addition to the armamentarium against Clostridium difficile infections[J]. Clin Ther, 2012,34(1):1-13.
[7]MILLER BA,CHEN LF,SEXTON DJ, et al. Comparison of the burdens of hospitalonset,healthcare facility-associated Clostridium difficile infection and of healthcare-associated infection due to methicillin-resistant Staphylococcus aureus in community hospitals[J]. Infect Control Hosp Epidemiol, 2011,32(4):387-390.
[8]KUIJPER EJ, VAN DISSEL JT, WILCOX MH.Clostridium difficile: changing epidemiology and new treatment options[J]. Curr Opin Infect Dis,2007, 20(4): 376-383.
[9]OKA K, OSAKI T, HANAWA T, et al. Molecular and microbiological characterization of Clostridium difficile isolates from single, relapse, and reinfection cases[J]. J Clin Microbiol,2012,50(3):915-921.
[10]CORNELY OA, CROOK DW, ESPOSITO R, et al. Fidaxomicin versus vancomycin for infection with Clostridium difficile in Europe, Canada, and the USA: a double-blind, noninferiority, randomised controlled trial[J]. Lancet Infect Dis,2012,12(4):281-289.
[11]KUMAR M, MATHUR T, BARMAN TK,er al.In vitro and in vivo activities of the novel Ketolide RBx 14255 against Clostridium difficile[J]. Antimicrob Agents Chemother, 2012,56(11):5986-5989.
[12]BUTLER MM, SHINABARGER DL, CITRON DM,er al. MBX-500, a hybrid antibiotic with in vitro and in vivo efficacy against toxigenic Clostridium difficile[J]. Antimicrob Agents Chemother, 2012,56(9):4786-4792.
[13]SWANSON RN, HARDY DJ, SHIPKOWITZ NL,er al. In vitro and in vivo evaluation of tiacumicins B and C against Clostridium difficile[J]. Antimicrob Agents Chemother, 1991,35(6):1108-1111.
[14]徐少华,宋晓蕾,周芬芬,等.仓鼠艰难梭菌相关性腹泻动物模型的建立和评价[J].中国感染与化疗杂志,2014,14(3):204-209.
[15]SATTAR A, THOMMES P, PAYNE L, et al. SMT19969 for Clostridium difficile infection( CDI): in vivo efficacy compared with fidaxomicin andvancomycin in the hamster model of CDI[J]. J Antimicrob Chemother, 2015,70(6):1757-1762.
[16]ZUCCA M, SCUTERA S, SAVOIA D. Novel avenues for Clostridium difficile infection drug discovery[J]. Expert Opin Drug Discov, 2013, 8(4): 459-477.
[17] WILSON KH. The microecology ofClostridium difficile[J]. Clin Infect Dis, 1993,16(Suppl 4):s214-s218.
[18]TANNOCK GW, Munro K, Taylor C,et al. A new macrocyclic antibiotic, fidaxomicin( OPT-80), causes less alteration to the bowel microbiota of Clostridium difficile-infected patients than does vancomycin[J]. Microbiology,2010,156(Pt 11):3354-3359.
Evaluation of the in vivo efficacy of fidaxomicin and vancomycin in a hamster model of Clostridium difficile-associated diarrhea
QIANG Cuixin, YANG Jing, BAI Yu, TIAN Tiantian, LI Zhirong, XU Kaiyue, CUI Qingqing, WANG Qian, ZHANG Juan, ZHAO Jianhong. (Second Hospital of Hebei Medical University, Hebei Clinical Laboratory Center,Shijiazhuang 050000, China)
Objective To assess the relative efficacy of fidaxomicin and vancomycin in the hamster model of Clostridium difficileassociated diarrhea (CDAD). Methods Hamsters were infected with C. difficile ATCC BAA-1870 (ribotype 027, 4×107CFU/mL)prior to treatment with fidaxomicin (0.3 mg·kg-1·d-1, 0.8 mg·kg-1·d-1and 2.5 mg·kg-1·d-1) or vancomycin (5 mg·kg-1·d-1) for 7 days. Animals were further monitored through day 30 to record weight change and survival status. Results Following infection with C. difficile ATCC BAA-1870, fidaxomicin and vancomycin treatment resulted in 100% survival during the 7-day dosing period. All the animals receiving fidaxomicin (2.5 mg·kg-1·d-1) survived until end of post-dosing follow-up period. However, mortality was observed on day 11 in the animals treated with vancomycin,and the survival rate was 20% by day 30. Stool culture showed that fidaxomicin can effectively remove Clostridium difficile from the feces of hamster. Conclusions Compared with vancomycin, fidaxomicin is highly effective in treatment of both acute infection and prevention of recurrent disease. It is worthwhile to design further investigation on fidaxomicin as a potential therapy for CDAD.
Clostridium difficile-associated diarrhea; fidaxo micin; vancomycin; animal model
·病例报告·
R378
A
1009-7708(2016)01-0075-05
10.16718/j.1009-7708.2016.01.017
河北省自然科学基金(2013206450);河北省科技厅基础条件平台建设项目(10966142D);河北医科大学第二医院科研基金(2H0201011);国家“重大新药创制”科技专项(2014ZX09201-001-003)。
1. 河北医科大学第二医院,河北省临床检验中心,石家庄 050000;
2. 华北制药集团新药研究开发有限责任公司。
强翠欣(1984—),女,学士,检验师,主要从事细菌感染性病原体的检测与流行病学研究。
赵建宏,E-mail: zhaojh_2002@yahoo.com。
2015-05-06
2015-06-26
