食管癌易感基因C20orf54的生物信息学分析*
2016-09-16黄志刚洪秋娜陈婷婷李戈楠伦嘉欣赖玉仙邓俏莲
黄志刚,洪秋娜,陈婷婷,李戈楠,何 臻,伦嘉欣,林 婉,赖玉仙,杨 威,邓俏莲
(广东医学院公共卫生学院东莞市环境医学重点实验室,广东东莞 523808)
食管癌易感基因C20orf54的生物信息学分析*
黄志刚,洪秋娜#,陈婷婷,李戈楠,何臻,伦嘉欣,林婉,赖玉仙,杨威,邓俏莲
(广东医学院公共卫生学院东莞市环境医学重点实验室,广东东莞 523808)
目的利用生物信息学方法对食管癌易感新基因C20orf54进行特征分析和功能预测,以获得该基因及其编码蛋白更多的功能提示。方法应用Blat、Blast、ProtParam、SOPMA、ScanProsite、SignalP4.1、TMHMM、PSORT和UniGene等软件或数据库,进行染色体定位、序列的相似性比较、理化性质、二级结构、亚细胞定位、功能位点识别。采用逆转录-聚合酶链反应(RT-PCR),验证C20orf54基因在食管癌细胞和鼻咽癌细胞中的表达情况。结果C20orf54基因进化保守,蛋白质不稳定,具有疏水性,定位于细胞膜的可能性最高,序列中预测有蛋白激酶C、酪蛋白激酶Ⅱ磷酸化位点和N-糖基化位点及N-豆蔻酰化位点。二级结构主要是α螺旋和无规则卷曲。C20orf54基因可在食管癌细胞和鼻咽癌细胞中表达。结论人类C20orf54蛋白是定位于细胞膜上的不稳定疏水蛋白,可能在体内参与多种生物学过程,但可能并不是在食管癌组织特异表达的分子标志。
食管肿瘤;生物信息学;C20orf54
食管鳞状细胞癌(简称食管癌)是全世界十大恶性肿瘤之一,具有特定区域高发的特点。世界上食管癌发病率和病死率最高的地区集中在我国的河南、河北和山西三省交界的太行山地区,食管癌仍是这些地区肿瘤相关死亡的主要原因[1]。尽管普遍认为食管癌的发生是由环境、遗传等多种因素综合作用的结果,但其致癌的分子机制至今未明。新近的全基因组关联研究(GWAS)在鉴定复杂性疾病易感基因方面取得的成就,为揭示食管癌的发病机制提供了重要证据。以我国人群为基础的食管癌GWAS发现,核黄素转运基因又称C20orf54基因的rs13042395位点是食管癌的易感位点,C20orf54成为新的食管癌易感基因而备受研究者重视[2]。
目前已有多篇文献报道了C20orf54基因的功能性遗传变异与食管癌的发生有关[3-5],但也有两项独立的研究认为C20orf54基因与食管癌无关[6-7]。因此,C20orf54基因的生物学功能是什么,其在食管癌的发生、发展过程中发挥什么作用等问题,亟待进一步研究解决。本研究利用生物信息学方法对C20orf54基因及其编码的蛋白进行了分析和功能预测,并观察C20orf54基因在不同上皮细胞内的表达情况,为进一步深入研究C20orf54基因的生物学功能提供参考依据。
1 材料与方法
1.1基因组定位及外显子分析用UCSC Genome Bioinformatics 的Blat数据库进行基因组定位及外显子分析(http:// genome.ucsc.edu/cgi-bin/hgBlat)。
1.2序列比对利用NCBI的Blastn程序进行C20orf54基因的核苷酸序列同源性分析;用BlastP程序进行氨基酸同源性对比(http://blast.ncbi.nlm.nih.gov/)。
1.3理化性质分析利用ExPASy 的ProtParam Tool 软件(http://web.expasy.org/protparam)预测等电点、分子量、疏水性、电荷分布等。
1.4蛋白质结构预测利用SOPMA程序(http://npsa-pbil.ibcp.fr/cgi-bin/ npsa_automat.pl?page= npsa_sopma.html)分析C20orf54蛋白的二级结构;利用ExPASy 的ScanProsite tool工具(http://prosite.expasy.org/scanprosite/)预测蛋白质的功能性位点;信号肽剪切位点利用SignalP4.1(http://www.cbs.dtu.dk/services/SignalP/)预测;TMHMM程序预测跨膜信息(http://www.cbs.dtu.dk/services/TMHMM/);保守结构域及其功能用NCBI/CDD预测。
1.5亚细胞定位分析利用PSORT (http://psort.hgc.jp/form2.html) 进行亚细胞定位预测。
1.6RT-PCR扩增C20orf54基因编码区Trizol法提取食管癌细胞(ECA109)、鼻咽癌细胞(CNE-2Z)总RNA,按逆转录试剂盒(QIAGEN)操作步骤进行逆转录。以cDNA为模板,扩增C20orf54 基因编码区序列,上游引物:5′-ATG GCC TTC CTG ATG CAC C-3′,下游引物:5′-CTA GGC TGG ACA GTG CAG AT-3′。扩增条件:94 ℃ 4 min;94 ℃ 50 s,58 ℃ 50 s,72 ℃ 1 min,共30个循环;72 ℃ 10 min。取5 μL PCR产物进行1.5%琼脂糖凝胶电泳鉴定。将扩增产物送上海立菲生物技术有限公司(广州分公司)测序,并将序列登录GenBank数据库。
2 结 果
2.1基因组定位及外显子分析将C20orf54基因序列(NM_033409)与人类基因组草图库进行比对,该cDNA 序列定位于20号染色体740,724~749,228区域(20p13),基因组跨越8,505 bp。外显子分析发现,C20orf54基因由5个外显子和4个内含子所组成,内含子和外显子交界区均符合AG-GT规则。
2.2序列比对结果经BLASTn在nr核苷酸序列数据库在线同源性分析C20orf54基因序列,发现人与大猩猩、长臂猿、恒河猴等灵长类哺乳动物的相似性在95%以上,其中大猩猩最高达98%;而人与狼犬、家猫、虎鲸及小鼠等物种的相似性分别为85%、85%、85%和83%。经对C20orf54的多物种氨基酸序列相似性比较发现,人与大猩猩、黑长臂猿的相似性最高达到99%,与松鼠猴、狨毛猴的相似性为94%,与家豚鼠、狼犬、海豚、小鼠和青将鱼的相似性分别为84%、82%、81%、74%和47%。C20orf54蛋白的氨基酸组成在脊椎动物中保守性较高。
2.3C20orf54蛋白的理化性质C20orf54基因编码的蛋白质氨基酸长度为469 aa,相对分子质量为50 805.1,理论等电点为5.46,pH7.0时带负电荷(-10.947)。该蛋白质的半衰期在哺乳动物网织红细胞中为30 h,在酵母体内超过20 h,大肠杆菌体内可超过10 h;不稳定指数为43.92(>40为不稳定),属于不稳定蛋白质;脂肪指数为119.06,总体平均亲水值为0.882,属于疏水蛋白质。
2.4蛋白质结构预测及亚细胞定位分析C20orf54蛋白二级结构预测发现,含α螺旋(Hh)36.46%,β折叠(Tt)5.12%,延伸链(Ee)和无规则卷曲(Cc)分别占15.35%、43.07%。 ScanProsite tool工具寻找蛋白质的功能性位点,结果发现在该蛋白质氨基酸序列中存在1个蛋白激酶C磷酸化位点、3个酪蛋白激酶Ⅱ磷酸化位点、3个N-糖基化位点及10个N-豆蔻酰化位点,未发现其他基序及保守结构域存在。TMHMM程序预测C20orf54蛋白可能存在11个跨膜区域,N末端在膜内的概率为99.621%。亚细胞定位分析认为,C20orf54蛋白在细胞膜表达的可能性最高(73.9%),其次为内质网(21.7%)和线粒体(4.3%)。而SignalP4.1未预测出信号肽剪切位点。
2.5RT-PCR结果本研究选择食管癌(ECA109)和鼻咽癌(CNE-2Z)两种细胞株,抽提细胞总RNA,进行RT-PCR,发现均可扩增出约1 400 bp的C20orf54基因编码区片段。琼脂糖凝胶电泳结果见图1、2。测序证实扩增片段与C20orf54基因编码区序列一致。
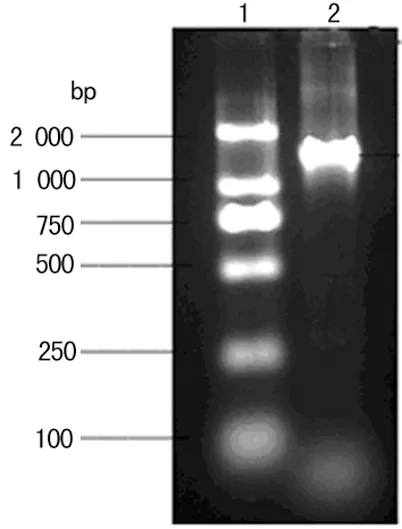
1:LD2000 Marker;2:扩增产物。
图1食管癌细胞ECA109扩增结果

1:LD2000 Marker;2:扩增产物。
图2鼻咽癌细胞CNE-2Z扩增结果
3 讨 论
食管癌GWAS发现,C20orf54基因rs13042395位点的遗传变异与食管癌有关,C20orf54基因作为新的食管癌易感基因成为研究热门[2]。C20orf54是人类核黄素转运基因,该基因定位于20p13,其编码产物为核黄素转运蛋白。目前,人类核黄素转运蛋白的生物学功能尚未阐明,因其与鼠核黄素转运蛋白有83%的相似性,所以推测人类核黄素转运蛋白与鼠相似,在小肠和结肠中高表达,在肠组织对核黄素的吸收中发挥重要作用[8]。
利用Blast程序在多个物种内发现与人C20orf54蛋白相似的序列,其相似度从高等灵长类动物大猩猩、类人猿到海洋哺乳动物海豚、从啮齿类动物小鼠到低等脊椎动物青将鱼等依次降低。说明人C20orf54基因进化上相对保守,其可能参与基本生物学过程。对C20orf54蛋白质的二级结构预测发现,其肽链上α螺旋和无规则卷曲水平较高,表明该蛋白具有较好的可塑性。理化性质分析发现,C20orf54蛋白是不稳定的疏水蛋白质,可能定位在细胞膜上(73.9%),发挥其多种生物学作用。C20orf54蛋白可能存在11个跨膜区域,而跨膜结构多构成受体、通道,执行信号传导等重要功能[9-10]。
对C20orf54蛋白进行功能性位点分析发现,其氨基酸序列中存在蛋白激酶C磷酸化位点、酪蛋白激酶Ⅱ磷酸化位点、N-糖基化位点及N-豆蔻酰化位点。蛋白激酶C和酪蛋白激酶Ⅱ磷酸化位点是信号传导调控中的常见分子结构,在细胞增殖及细胞周期中有着广泛的调节作用[11]。N-糖基化位点是蛋白质糖基化修饰的识别位点,蛋白质的糖基化修饰使糖链与糖结合蛋白相互作用,参与众多生理或病理过程,也可以作为微生物和有毒物质的结合位点。蛋白质的糖基化修饰是生物体调控蛋白质在组织和细胞中的定位、功能、活性、寿命和多样性的一种普遍的翻译后方式[12]。而豆蔻酰化位点可参与细胞生长发育、信号传导和肿瘤发生等重要生理过程。由于蛋白质结构特异性识别相关分子是其行使功能的关键,故该蛋白可能通过磷酸化、糖基化及豆蔻酰化而发挥多种重要的生物学作用。
本研究发现,食管癌(ECA109)和鼻咽癌(CNE-2Z)均可扩增出约1 400 bp的片段,经测序证实与C20orf54基因编码区序列一致,说明C20orf54基因在食管癌及鼻咽癌细胞中均是有表达,C20orf54基因可能不是在食管癌组织特异表达的分子标志。
在发现C20orf54基因与食管癌的关系之前,已有多篇报道认为,C20orf54基因突变与Brown-Vialetto-Van Laere综合征(BVVLS)有关。BVVLS是一种罕见的以进行性桥延麻痹伴有耳聋为特点的神经障碍疾病。目前认为,C20orf54基因突变是导致BVVLS发生的重要致病因素,尽管其具体致病机制尚不清楚[13-16]。可见,人类C20orf54基因可能在体内多种生理、病理过程中发挥作用,有必要对其进行更深入的研究。本文通过生物信息学分析初步揭示了人类食管癌新易感基因C20orf54及其编码产物的基本特性,为进一步开展C20orf54基因的功能和相关分子机制研究奠定了基础。
[1]邹小农.食管癌流行病学[J].中华肿瘤防治杂志,2006,13(18):1445-1448.
[2]Wang LD,Zhou FY,Li XM,et al.Genome-wide association study of esophageal squamous cell carcinoma in Chinese subjects identifies susceptibility loci at PLCE1 and C20orf54[J].Nat Genet,2010,42(9):759-763.
[3]Wei W,Ji A,Wang J,et al.Functional single nucleotide polymorphism in C20orf54 modifies susceptibility to esophageal squamous cell carcinoma[J].Dis Esophagus,2013,26(1):97-103.
[4]Ji A,Wang J,Yang J,et al.Functional SNPs in human C20orf54 gene influence susceptibility to esophageal squamous cell carcinoma[J].Asian Pac J Cancer Prev,2011,12(12):3207-3212.
[5]纪爱芳,魏武,杨建洲,等.核黄素转运蛋白基因位点单核苷酸多态性与食管鳞癌遗传易感性的关系[J].中华内科杂志,2012,51(12):982-986.
[6]Palmer AJ,Lochhead P,Hold GL,et al.Genetic variation in C20orf54,PLCE1 and MUC1 and the risk of upper gastrointestinal cancers in Caucasian populations[J].Eur J Cancer Prevention,2012,21(6):541-544.
[7]Gu H,Ding G,Zhang W,et al.Replication study of PLCE1 and C20orf54 polymorphism and risk of esophageal cancer in a Chinese population[J].Mol Biol Rep,2012,39(9):9105-9111.
[8]Yamamoto S,Inoue K,Ohta KY,et al.Identification and functional characterization of rat riboflavin transporter 2[J].J Biochem,2009,145(4):437-443.
[9]Breton G,Danyluk J,Charron JB,et al.Expression profiling and bioinformatic analyses of a novel stress-regulated multispanning transmembrane protein family from cereals and Arabidopsis[J].Plant Physiol,2003,132(1):64-74.
[10]White SH,Von Heijne G.Transmembrane helices before,during,and after insertion[J].Curr Opin Struct Biol,2005,15(4):378-386.
[11]姜铮,王芳,何湘,等.蛋白质磷酸化修饰的研究进展[J].生物技术通讯,2009,20(2):233-237.
[12]周蕾,顾建新.N-糖基化位点鉴定方法和非经典N-糖基化序列[J].生命科学,2011,23(6):605-611.
[13]Bandettini Di Poggio M,Gagliardi S,Pardini M,et al.A novel compound heterozygous mutation of C20orf54 gene associated with Brown-Vialetto-Van Laere syndrome in an Italian family[J].Eur J Neurol,2013,20(7):e94-95.
[14]Houlden H.A commentary on four novel C20ORF54 mutations identified in Brown-Vialetto-Van laere syndrome patients[J].J Hum Genet,2012,57(9):555.
[15]Dezfouli MA,Yadegari S,Nafissi S,et al.Four novel C20orf54 mutations identified in Brown-Vialetto-Van Laere syndrome patients[J].J Hum Genet,2012,57(9):613-617.
[16]Koy A,Pillekamp F,Hoehn T,et al.Brown-Vialetto-Van laere syndrome:a riboflavin-unresponsive patient with a novel mutation in the C20orf54 gene[J].Pediatr Neurol,2012,46(6):407-409.
东莞市社会科技发展项目(2013108101052);广东省大学生创新创业训练项目(2KY12023)。作者简介:黄志刚(1971-),副教授,博士,主要从事肿瘤流行病学研究。#并列第一作者。
·经验交流·10.3969/j.issn.1671-8348.2016.22.035
R735.1
B
1671-8348(2016)22-3121-03
2016-02-08
2016-03-15)
