激活素A在食管癌组织中的表达水平及与肿瘤分化和转移的关系*
2016-09-16王永连刘尚国陶义鹏王忠民李汉臣
王永连,刘尚国,陶义鹏,王 毅,王忠民,李汉臣
(新乡医学院第一附属医院胸外科,河南新乡 453100)
激活素A在食管癌组织中的表达水平及与肿瘤分化和转移的关系*
王永连,刘尚国,陶义鹏,王毅,王忠民△,李汉臣
(新乡医学院第一附属医院胸外科,河南新乡 453100)
目的探讨激活素A在食管癌组织中的表达水平变化,以及与肿瘤分化和转移之间的关系。方法选取该院2010年6月到2012年6月收治的57例食管癌患者作为研究对象,同时选取因食管不适来院检查确诊无病变的36例患者作为对照研究。分别采用实时荧光定量PCR和免疫组织化学分析食管癌组织和正常食管组织激活素A mRNA和蛋白的表达水平,并分析激活素A与食管癌患者肿瘤分化、转移和术后生存复发之间的关系。结果食管癌组织中激活素A mRNA和蛋白的表达水平明显高于正常食管组织(P<0.05)。低分化和中分化食管癌组织中激活素A表达水平明显高于正常食管组织和高分化食管癌组织(P<0.05),低分化食管癌组织中激活素A水平明显高于中分化(P<0.05)。淋巴结转移患者中激活素A水平明显高于未转移患者(P<0.05)。激活素A阳性患者术后1、2、3年累积生存率明显低于激活素A阴性患者(P<0.05),而累积复发率明显高于激活素A阴性患者(P<0.05)。结论食管癌组织中激活素A表达异常,与肿瘤分化、转移和术后生存和复发密切相关,可作为临床预后辅助诊断指标。
食管肿瘤;肿瘤分化;肿瘤转移;生存和复发;激活素A
食管癌是目前世界上常见的恶性肿瘤类型之一,严重影响人类的健康[1]。食管癌的发病具有明显地域性,在我国,河南、河北等地是食管癌的高发地区。食管癌主要以鳞癌为主,发病早期临床症状不明显,因此多数患者就诊时已经为晚期,此外,食管癌的全身转移是导致患者死亡的主要原因[2-3]。如何早期及时发现并确诊食管癌对于提高患者生存具有重要的意义。但是目前食管癌在临床上尚无用于诊断的分子靶标。
激活素A是转化生长因子超家族成员之一,是一种多功能的细胞因子,目前发现其广泛存在于人和动物的多器官中,在调节胚胎发育、心脏形成等诸多生理过程中发挥着重要作用[4-6]。近年来,研究显示激活素A在肿瘤组织中存在异常表达,可能参与了肿瘤的发生、发展、转移及侵袭[7-9]。但是激活素A在食管癌组织中的表达情况目前研究较少,本研究分析了食管癌组织中激活素A的表达情况,探讨了其与肿瘤分化、转移和术后生存复发的关系。
1 资料与方法
1.1一般资料选择本院2010年6月至2012年6月手术切除的57例食管癌患者的肿瘤组织作为研究对象(观察组),均经病理学检测诊断为食管癌。57例患者中男36例,女21例;年龄44~67岁,平均(50.4±10.4)岁;高分化17例,中度分化25例,低分化15例;淋巴结转移37例,未转移20例;所有患者手术后随访3年。同时选取36例因食管不适来本院进行身体检查且食管未见病变的食管病理学组织作为对照组。36例患者中男25例,女11例;年龄42~69岁,平均(51.7±11.1)岁。两组患者在年龄、性别等指标比较差异无统计学意义(P>0.05),具有可比性。
1.2实验材料逆转录试剂盒和2×SYBR Green qPCR Master Mix购自Takara公司;实时荧光定量PCR仪购自美国Applied biosysterm公司;激活素A单克隆抗体购自美国Santa公司;HRP标记的羊抗鼠二抗购自北京中杉金桥生物有限公司;Trizol购自Invitrigen公司;其他试剂均为国产分析纯,购自北京试剂公司。
1.3方法
1.3.1实时荧光定量PCR食管癌组织或正常食管组织置于1 mL Trizol溶液中,匀浆后加入200 μL氯仿,振荡混匀后,冰上放置15 min使溶液分层,然后12 000 r/min离心15 min,将上清转移至500 μL的异丙醇中,混匀后冰上放置15 min,12 000 r/min离心10 min使RNA沉淀,然后用预冷的75%乙醇洗涤2次,最后沉淀溶于DEPC处理的双蒸水中。测定样本浓度,并采用逆转录试剂盒将RNA转录为cDNA,作为PCR的模板。根据GeneBank提供的激活素A mRNA序列,设计如下引物。激活素A-F:5′-TTC TCG CTG TAC TGC TGC AGA-3′,激活素A-R:5′-CTT CCT GCA TGT CTT CAA GAG ATG-3′;β-actin-F:5′-GCG GGA AAT CGT GCG TGA C-3′,β-actin-R:CGT CAT ACT CCT GCT TGC TG-3′。引物稀释后首先对引物特异性和退火温度进行条件优化。然后按照下述反应体系制备反应混合物:2×SYBR Green通用型qPCR Master Mix 10 μL,上游/下游引物各(10 μmmol/L)各1 μL,cDNA 1 μL,补双蒸水至终体积为20 μL。根据检测样本的数量配制相应的体积,对应加入PCR板中,每孔20 μL。1 500 r/min离心将反应混合物离心至管底,根据下列反应条件进行PCR。预变性:95 ℃,30 s;变性:95 ℃,3 s;退火延伸:60 ℃,30 s;构建溶解曲线。最后从实时荧光定量PCR仪上直接读取数据。
1.3.2免疫组织化学石蜡包埋的标本组织连续切成5 μL的薄片,黏附于多聚赖氨酸处理的玻片上,在50 ℃烘箱中烤1 h,然后依次用二甲苯,100%、95%、80%和75%的乙醇进行水化,用蒸馏水洗涤3次。将玻片置于含柠檬酸钠的缓冲液中,加热处理8 min,重复2次,用磷酸盐缓冲液(PBS)洗涤3次;在玻片组织部位滴加3%的过氧化氢(75%甲醇配制)处理30 min去除内源性的过氧化氢酶。PBS洗涤3次,每次5 min。将稀释的激活素A一抗按照比例稀释,滴加到玻片组织上,4 ℃孵育过夜,次日PBST洗涤玻片3次,每次5 min;在玻片上滴加10%山羊血清稀释的羊抗鼠的二抗,室温孵育1 h后,用磷酸缓冲液(PBST)洗涤3次,每次5 min。在玻片上滴加50 μL的二氨基联苯胺(DAB)显色液,边染色边在显微镜下观察,染色结束后用自来水冲洗,并依此在70%、80%、90%和100%乙醇中脱水,在二甲苯中脱水干燥,并用中性树脂固定,在显微镜下进行固定。
1.4观察指标及评定标准观察食管癌组织、正常食管组织中激活素A mRNA和蛋白的表达水平,并分析不同分化程度、不同转移患者激活素A的表达水平,以及与患者术后生存和复发的关系。激活素A阳性患者:免疫组织化学视野中阳性细胞数量占总细胞数量大于或等于50%;阴性患者:视野中平均阳性细胞数量占总细胞术小于50%。

2 结 果
2.1两组激活素A mRNA水平比较实验设计的引物具有很好的特异性,溶解曲线良好,溶解温度为83.22 ℃。结果显示观察组组织中激活素A mRNA水平较对照组显著性增加,差异有统计学意义(P<0.05)。见图1。
A:溶解曲线;B:扩增曲线;C:激活素A mRNA水平分析图。
图1两组激活素A mRNA表达水平比较
2.2两组激活素A蛋白表达情况结果如图2所示,激活素A主要表达于细胞质中,免疫组织化学呈棕色。在对照组组织中,激活素A蛋白表达水平较低,而在观察组中其表达量明显增加,差异有统计学意义(P<0.05)。
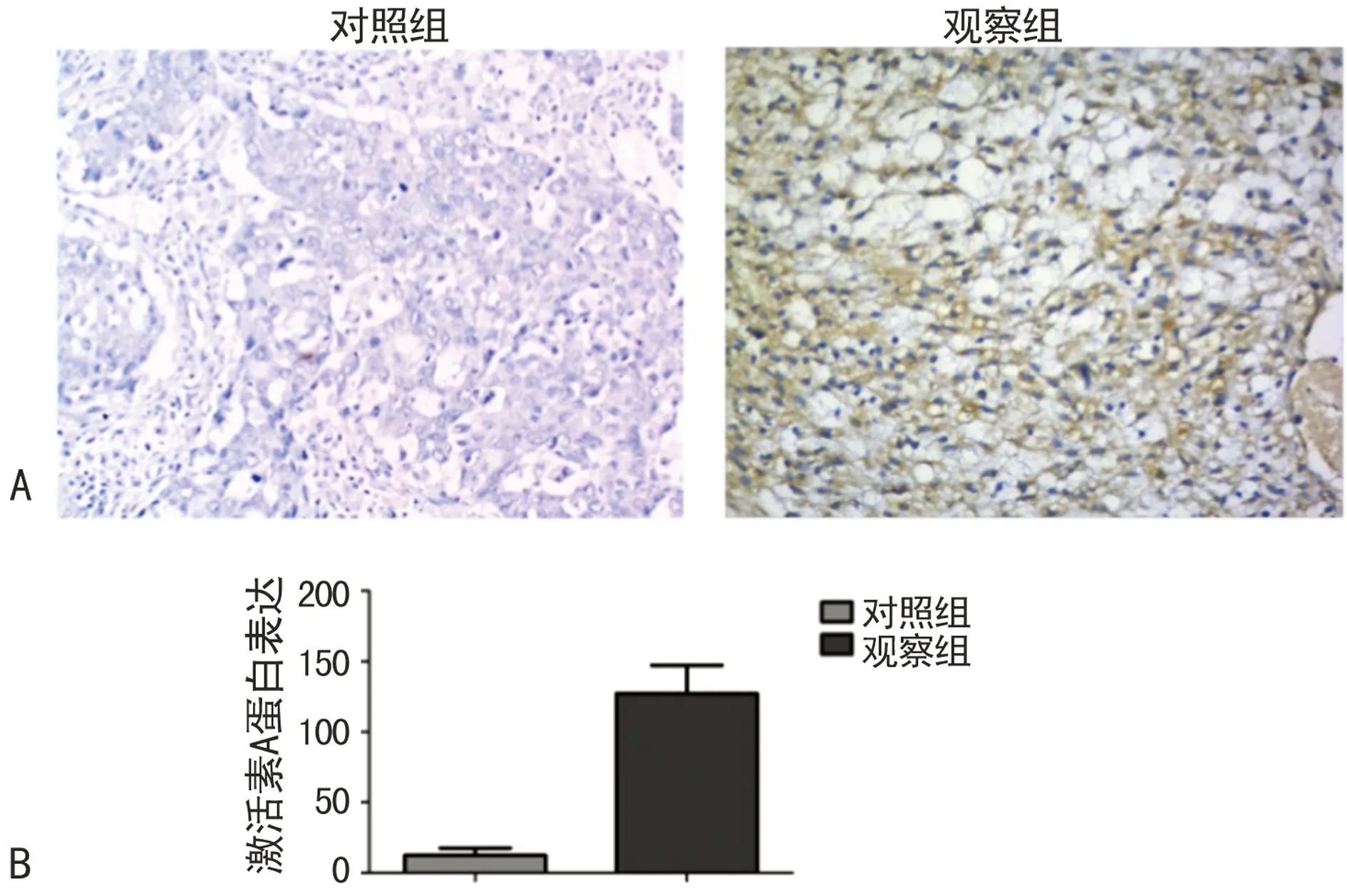
A:免疫组织化学图(10×20);B:免疫组织化学分析图。
图2两组激活素A蛋白表达比较
2.3不同分化对食管癌组织激活素A表达水平的影响定量分析显示观察组中中分化和低分化食管癌组织激活素A水平明显高于高分化和对照组组织(P<0.05),低分化明显高于中分化(P<0.05),而高分化明显高于对照组组织(P<0.05)。见图3。
2.4食管癌激活素A水平与肿瘤转移的关系本研究57例中37例出现了淋巴结转移,20例未见转移。以是否存在转移分组,定量分析结果如图4所示,淋巴结转移患者食管癌组织中激活素A表达水平明显高于未转移患者,差异有统计学意义(P<0.05)。
2.5食管癌组织激活素A水平与术后复发生存的关系根据免疫组织化学的评定标准,其中激活素A阳性38例,阴性19例。激活素A阳性患者的术后12个月、24个月和36个月的累计生存率分别为71.05%、50.00%、21.05%,激活素A阴性患者的术后12个月、24个月和36个月的累积生存率为84.21%、63.16%和36.84%,激活素A阳性患者生存率明显低于阴性患者(P<0.05)。激活素A阳性患者术后12个月、24个月和36个月的累积复发率分别为23.68%、42.11%和71.00%,激活素A阴性患者术后12个月、24个月和36个月的累积复发率分别为5.26%、21.05%和47.37%,激活素A阳性患者累积复发率明显高于阴性的患者(P<0.05)。见图5。

A:不同分化的免疫组织化学图(10×20);B:不同分化的免疫组织化学分析图。
图3不同分化对食管癌组织激活素A表达水平的影响
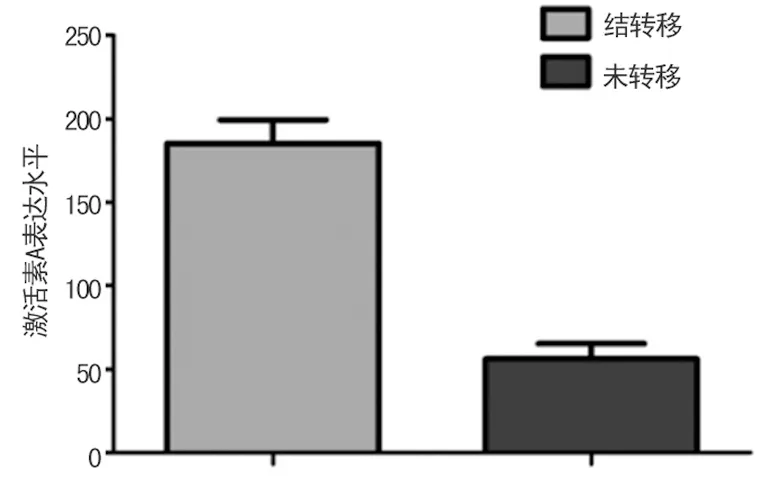
图4 淋巴结转移和未转移患者食管癌组织中激活素A表达水平比较

图5 激活素A阳性和阴性患者术后情况比较
3 讨 论
激活素A是转化生长因子β超家族球蛋白成员之一,是一种由性腺分泌的大分子糖蛋白,其最早在雌猪卵泡液中被分离出来。激活素A有3种不同类型的受体,其可在Ⅲ型受体的辅助下,与Ⅱ型受体结合,然后磷酸化Ⅰ型受体,并与磷酸化的ActR Ⅰ形成三元络合物,再使胞浆内的Smad2和Smad3磷酸化,最后将信号传递至细胞核,并在细胞核中调节目的基因的表达[10-11]。正常的激活素A在维持细胞增殖、黏附、凋亡及分化过程中发挥着重要作用[12-14]。但是近年来,研究发现,在诸多的肿瘤组织中激活素A表达水平显著性增加,并参与了肿瘤的进展、侵袭等行为,促进了肿瘤的发展和转移[15-16]。
食管癌是临床常见的恶性肿瘤类型之一,激活素A是否在食管癌发生、发展和转移过程中发挥着一定作用,有报道显示激活素A在食管癌患者血清中表达水平呈现异常[17]。但是这方面报道较少,缺乏普遍性。因此,本研究首先分析了正常食管和食管癌组织中激活素A mRNA和蛋白的表达水平,结果显示食管癌组织中激活素A mRNA和蛋白水平较正常食管组织显著性升高,说明激活素A在食管癌组织中呈现高表达。这一结果与目前报道结果一致。
免疫组织化学结果显示,低分化中激活素A表达水平最高,中分化次之,而高分化最低,提示激活素A表达与肿瘤分化程度存在相关性。以患者是否出现淋巴结转移为标准分类研究显示淋巴结转移患者激活素A的表达水平明显高于未转移患者,说明激活素A可能参与了食管癌的转移发生。这一结果在其他肿瘤类型中已得到了证实。手术治疗是食管癌治疗的主要方法,但是部分患者术后易出现复发,进而严重影响了生存时间。本研究显示激活素A阳性患者累积生存率明显低于激活素A阴性患者,而累积复发率明显高于激活素A阴性患者,这一结果说明激活素A表达水平与患者术后生存和复发有着密切关系。导致这一现象的主要的原因可能是激活素A一般高表达与低分化和淋巴结转移的患者,这些患者肿瘤恶性程度高,术后出现转移的机会较大。
综上所述,激活素A在食管癌组织中表达异常,并与肿瘤的分化程度、转移情况及术后生存和复发密切相关,有望成为食管癌患者术后预后诊断标志。
[1]Siegel R,Naishadham D,Jemal A.Cancer statistics,2012[J].CA Cancer J Clin,2012,62(1):10-29.
[2]Baba Y,Watanabe M,Yoshida N,et al.Neoadjuvant treatment for esophageal squamous cell carcinoma[J].World J Gastrointest Oncol,2014,6(5):121-128.
[3]Napier KJ,Scheerer M,Misra S.Esophageal cancer:A Review of epidemiology,pathogenesis,staging workup and treatment modalities[J].World J Gastrointest Oncol,2014,6(5):112-120.
[4]De Kretser DM,O′hehir RE,Hardy CL,et al.The roles of activin A and its binding protein,follistatin,in inflammation and tissue repair[J].Mol Cell Endocrinol,2012,359(1/2):101-106.
[5]Kariyawasam HH,Semitekolou M,Robinson DS,et al.Activin-A:a novel critical regulator of allergic asthma[J].Clin Exp Allergy,2011,41(11):1505-1514.
[6]闫枫,刘轶丹.激活素A及卵泡抑素在肝切除小鼠肝组织的表达[J].中国老年学杂志,2014,32(12):3460-3461.
[7]ThissenJP,LoumayeA.Roleofactivin
a and myostatin in cancer cachexia[J].Ann Endocrinol (Paris),2013,74(2):79-81.
[8]Hoda MA,Münzker J,Ghanim B,et al.Suppression of activin A signals inhibits growth of malignant pleural mesothelioma cells[J].Br J Cancer,2012,107(12):1978-1986.
[9]Hofland J,Van Weerden WM,Steenbergen J,et al.Activin a stimulates AKR1C3 expression and growth in human prostate cancer[J].Endocrinology,2012,153(12):5726-5734.
[10]Maeshima A,Miya M,Mishima K,et al.Activin a:autocrine regulator of kidney development and repair[J].Endocr J,2008,55(1):1-9.
[11]Xu J,Oakley J,Mcgee EA.Stage-specific expression of Smad2 and Smad3 during folliculogenesis[J].Biol Reprod,2002,66(6):1571-1578.
[12]Zalzman M,Anker-Kitai L,Efrat S.Differentiation of human liver-derived,insulin-producing cells toward the beta-cell phenotype[J].Diabetes,2005,54(9):2568-2575.
[13]Ferreira MC,Witz CA,Hammes LS,et al.Activin a increases invasiveness of endometrial cells in an in vitro model of human peritoneum[J].Mol Hum Reprod,2008,14(5):301-307.
[14]Kim YI,Kim BH,Khang I,et al.Cell growth regulation through apoptosis by activin in human gastric cancer SNU-16 cell lines[J].Oncol Rep,2009,21(2):491-497.
[15]Gold E,Risbridger G.Activins and activin antagonists in the prostate and prostate cancer[J].Mol Cell Endocrinol,2012,359(1/2):107-112.
[16]Zhang Y,Bao YL,Yang MT,et al.Activin a induces SLC5A8 expression through the Smad3 signaling pathway in human colon cancer RKO cells[J].Int J Biochem Cell Biol,2010,42(12):1964-1972.
[17]Liu SG,Li HC,Zhao BS,et al.Expression of activin A in tissue and serum of patients with esophageal squamous cell carcinoma and its clinical significance[J].Zhonghua Zhong Liu Za Zhi,2013,35(11):843-847.
The expression levels of activin A in esophageal cancer and its relationship with tumor differentiation and metastasis*
Wang Yonglian,Liu Shangguo,Tao Yipeng,Wang Yi,Wang Zhongmin△,Li Hanchen
(Department of Thoracic Surgery,the First Affiliated Hospital, Xinxiang Medical University,Xinxiang,Henan 453100,China)
ObjectiveTo investigate the changes of activin A expression levels in esophageal carcinoma and its relationship with tumor differentiation and metastasis.MethodsTotally 57 cases of esophageal cancer patients from June 2010 to June 2012 in our hospital were selected as research subjects,while 36 patients that esophageal discomfort and diagnosed without lesions were selected as a control study.Activin A mRNA and protein expression level were analyzed by real-time PCR and immunohistochemistry.The relationship between activin A and tumor differentiation,metastasis,survival and recurrence were analyzed.ResultsThe expression level of activin A mRNA and protein th in observation group significantly enhanced than that of normal esophageal tissues(P<0.05).The activin A levels in poorly and moderately differentiated esophageal tissue were significant higher than that of well-differentiated(P<0.05).The activin A levels in poorly differentiated esophageal tissue expression of were significant higher than that of and moderately differentiated esophageal tissue(P<0.05).There was positive correlation between differentiation degree and activin A expression levels.The activin A levels in patients with lymph node metastasis were were significantly higher than those without metastasis(P<0.05).1,2 and 3 year cumulative survival rate in high expression of activin patients was significantly lower than that of low expression of activin A(P<0.05).1,2 and 3 year cumulative recurrence rate in high expression of activin patients was significantly higher than that of low expression of activin A(P<0.05).ConclusionThe activin A in esophageal cancer tissue exhibit abnormal level.There are closely relationship between activin A and tumor differentiation,metastasis and postoperative survival and recurrence rates,can be used as a diagnostic marker of clinical outcomes.
esophageal neoplasms;tumor differentiation;neoplasm metastasis;survival and recurrence;activin A
河南省卫生厅立项课题(200803080)。作者简介:王永连(1973-),副主任医师,硕士,主要从事胸外科工作。△
,E-mail:wangyonglian777@163.com。
论著·临床研究10.3969/j.issn.1671-8348.2016.22.007
R735.1
A
1671-8348(2016)22-3043-03
2016-02-19
2016-03-26)
