兔纤维环细胞培养及生物学特性的实验研究*
2016-09-16白亦光陈巧玲冯刚刘康肖东琴
白亦光 陈巧玲 冯刚 刘康 肖东琴
(南充市中心医院·川北医学院第二临床医学院 1.骨科;2.肿瘤分院;3.组织工程与干细胞研究所,四川 南充 637000)
·论著·
兔纤维环细胞培养及生物学特性的实验研究*
白亦光1陈巧玲2冯刚3刘康3肖东琴3
(南充市中心医院·川北医学院第二临床医学院 1.骨科;2.肿瘤分院;3.组织工程与干细胞研究所,四川 南充 637000)
目的建立兔椎间盘纤维环细胞体外培养体系,并对其生物学特性进行鉴定。方法采用酶消化法分离兔椎间盘纤维环细胞,进行单层培养,实验在原代培养中使用体积分数为20%FBS的DMEM培养基。倒置相差显微镜观察其形态结构和生物学特性,通过甲苯胺蓝染色、免疫细胞化学染色和碱性磷酸酶染色等方法对其细胞表型进行鉴定,MTT法绘制髓核细胞生长曲线。 结果在相差显微镜下,单层培养的椎间盘纤维环细胞呈贴壁生长的梭形或多角形细胞, 细胞具有甲苯胺蓝异染性;Ⅰ型胶原和Ⅱ型胶原的表达阳性;细胞碱性磷酸酶染色阳性。结论采用酶消化法可成功培养兔椎间盘纤维环细胞,生物学特性鉴定符合纤维环细胞特征。
椎间盘;纤维环细胞;生物学特性;组织工程
椎间盘退行性变(intervertebral disc degeneration,IDD)是引起下腰痛的主要原因,它可引起一系列疾病如腰椎间盘突出症、腰椎管狭窄症、节段性腰椎不稳和退变性腰椎侧凸等。关于IDD的病因和病理生理机制尚未完全明确,一般认为主要是椎间盘细胞及细胞外基质(蛋白聚糖和胶原等)的丢失,改变了椎间盘生物力学机制。目前主要治疗方法是外科手术治疗,这些方法在解除病变节段的同时,又使邻近节段发生退变,还降低了关联运动阶段的灵活性,增加了邻近节段的负担。椎间盘退变必然会伴随其细胞学的改变,包括一些椎间盘细胞基因的异常表达及细胞外基质成分发生改变等[1]。其中纤维环破裂被认为是重要的诱发因素而使纤维环在临床和基础研究中倍受关注。纤维环结构位于椎间盘髓核组织外周,由多层纤维板同心圆排列包绕凝胶状的髓核组织,其纤维板层结构的完整性对于维持整个椎间盘系统的正常功能具有十分重要的意义[2]。纤维环细胞位于胶原纤维束之间,合成和分泌纤维环细胞外基质,维持正常的纤维环结构和功能[3]。
本实验拟通过体外分离组织块通过酶消化培养纤维环细胞,并通过多种细胞染色及免疫细胞化学方法综合鉴定纤维环细胞,从而为体外培养纤维环细胞提供一个新方法,为研究椎间盘退变机制的研究提供细胞学实验基础。
1 材料和方法
1.1实验动物与材料、仪器CO2孵箱(Thermo公司,美国),超净工作台(Airtech公司,美国),倒置相差显微镜(Nikon公司,日本)。甲苯胺蓝染液(碧云天公司,中国),Ⅱ型胶原免疫细胞化学试剂盒(Chondrex公司,美国),Ⅰ型胶原免疫细胞化学一抗山羊抗兔(Novus-Bio公司,美国),Ⅰ型胶原免疫细胞化学二抗驴抗山羊(Novus-Bio公司,美国),DAB显色试剂盒(碧云天公司,中国),胎牛血清(Hyclone公司,中国),DMEM高糖培养基(Hyclone公司,中国),BCIP/NBT碱性磷酸酶显色试剂盒(碧云天公司,中国)。健康2周龄日本大耳白兔4只,体重0.5~1.0 Kg,雌雄不限,由川北医学院实验动物中心提供。
1.2纤维环细胞的分离和原代培养取4只日本大耳白兔,1%戊巴比妥钠100 mL/Kg静脉注射过量麻醉处死;取背部正中切口切开皮肤,更换无菌手套和手术器械后沿棘突用剪剪开两旁肌肉,沿椎弓根剪断横突,尽量剥尽椎旁肌肉和椎间盘前缘所附着肌肉,无菌条件下将腰段脊柱整段取出;用含青、链霉素0.01 mol/L PBS液冲洗3 遍以上至无明显血迹,移入超净工作台,用手术刀片切断纤维环上下椎体,尽可能保留纤维环;用眼科镊将胶冻状椎间盘髓核组织完整剔除干净,将环状纤维环结构放入含青、链霉素0.01 mol/L PBS液中,用眼科剪将纤维环剪成1 mm3的小块,再用PBS 液漂洗2遍,800 r/min×2 min离心,收集沉淀。将沉淀组织放入50mL离心管,先用0.25%胰蛋白酶在37 ℃恒温水浴箱中加热消化预消化15 min,1000 r/min×2 min离心,去上清;然后加入0.2%的Ⅱ型胶原酶,在37 ℃恒温水浴箱中加热消化4 h,1000 r/min×5 min离心,收集絮状沉淀以及未被消化的组织块,用DMEM冲洗两遍;再次离心后加入含20%FBS的DMEM培养基,之后移至25 cm2细胞培养瓶中,置于37 ℃、饱和湿度、5%CO2培养箱中培养,每3天换1次液,倒置相差显微镜下逐日观察细胞情况。
1.3纤维环细胞传代培养原代细胞培养大约2周,镜下可见细胞生长至近25 cm2细胞培养瓶底面积的90%时进行传代,将培养液倒掉,用0.01 mol/L PBS洗涤细胞2次,弃掉液体,加入体积分数0.25%的胰蛋白酶(D-Hanks液稀释)1 mL,晃动培养瓶使胰酶与细胞充分接触,镜下观察消化情况,可见细胞皱缩、变圆,当有细胞漂浮时立即用含10% FBS的DMEM的培养液2 mL终止消化,再用移液管轻轻吹打细胞瓶底部数次制成细胞悬液,必要时再次镜下观察以确保细胞尽可能全部吹离细胞瓶底部,1000 r/min ×5 min离心弃上清液,加入上述培养基制成细胞悬液后按1∶2接种于75 cm2细胞培养瓶。
1.4纤维环细胞的生物学特性检测
1.4.1光镜下细胞形态学观察将第3代传代纤维环细胞按1×104个/mL接种至含盖玻片的6孔培养板中进行细胞爬片。培养至细胞基本长满单层时取出盖玻片,光镜下观察细胞大体形态。
1.4.2甲苯胺蓝染色将上述细胞爬片取出进行甲苯胺蓝染色。染色步骤:细胞爬片PBS冲洗后4 多聚甲醛室温固定30 min,PBS冲洗3次;1 甲苯胺蓝染色10 min,PBS冲洗3次;树脂封片光镜下观察。
1.4.3细胞免疫细胞化学检测将上述细胞爬片PBS冲洗后4 多聚甲醛室温固定30 min。Ⅱ型胶原免疫细胞化学染色步骤:2 牛透明质酸酶封闭30 min,3 过氧化氢封闭10 min,PBS冲洗,添加block buffer室温30 min,PBS冲洗,添加生物素一抗封闭(1∶250稀释)4℃过夜,PBS冲洗,添加生物素二抗(1∶200稀释)室温1小时,PBS冲洗,DAB显色1h,树脂封片倒置显微镜下观察。Ⅰ型胶原免疫组织化学染色步骤:2 牛透明质酸酶封闭30 min,3 过氧化氢封闭10 min,PBS冲洗,添加block buffer室温30 min,PBS冲洗,添加生物素一抗(采用Ⅰ型胶原免疫细胞化学一抗,山羊抗兔,1∶250稀释)4℃过夜,PBS冲洗,添加二抗(Ⅰ型胶原免疫细胞化学二抗,驴抗山羊,1∶200稀释)室温1小时,PBS冲洗,DAB显色1小时,树脂封片倒置显微镜下观察。
1.4.4碱性磷酸酶检测将上述细胞爬片磷酸盐缓冲液冲洗3~5遍,4%多聚甲醛固定30 min,蒸馏水冲洗3~5次,用新鲜配制的BCIP/NBT工作液37 ℃孵育1小时,蒸馏水冲洗3~5次,树脂封片后倒置显微镜下观察。
1.5MTT测定纤维环细胞生长曲线取原代细胞用含20%FBS的DMEM培养基配成单个细胞悬液,细胞计数1×104个/mL,以每孔体积200 μL加入96孔培养板中。分别于培养1、2、3、4、5、6、7、8 d,每孔加MTT溶液(5 mg/ mL)20 μL,继续孵育4 h,终止培养,弃上清液,每孔加150 μL DMSO,振荡10 min。选择 490 nm波长,在酶联免疫监测仪上测定各孔吸光度(OD)值。
2 结果
2.1光镜下纤维环细胞形态纤维环细胞轮廓清楚,多为长梭形、多角形、梭形或不规则形状,细胞核为圆形或椭圆形,胞浆内可见较多空泡。原代培养时,倒置显微镜下观察可见培养液中存在大量大小不等的圆形细胞悬浮,3d后细胞发生明显变化,贴壁细胞伸出突起逐渐变为梭形并且较原代细胞体积增大,少数细胞呈现多角形,并开始增殖以后细胞突起相互连接,高倍镜下可见细胞质丰富,细胞较大,轮廓清晰,核内可见核仁存在。1w左右大部分细胞贴壁延伸,体积变大,数目增多,培养基中偶见悬浮死亡细胞,见图1。
2.2甲苯胺蓝染色结果甲苯胺蓝染色显示细胞为梭形或多角形,细胞核完整,清晰可见,呈卵圆形,均一淡紫色,胞浆基质染为深蓝色,见图2。
2.3纤维环细胞碱性磷酸酶表达细胞碱性磷酸酶染色阳性,胞浆中可见棕黑色颗粒,见图3。
2.4纤维环细胞Ⅰ,Ⅱ型胶原免疫细胞化学染色结果两组免疫细胞化学染色均可见阳性表达,胞浆呈棕黄色,而胞核淡染,见图4。
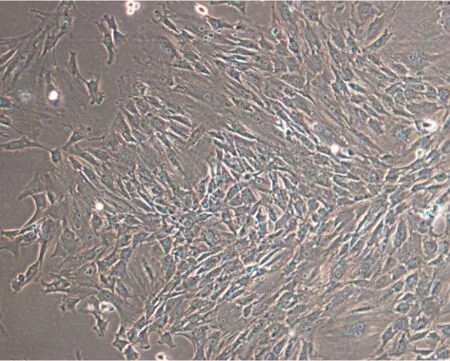
图1原代培养兔椎间盘纤维环细胞(×100)
Figure1Primary culture of rabbit annulus fibrosus cells (×100)
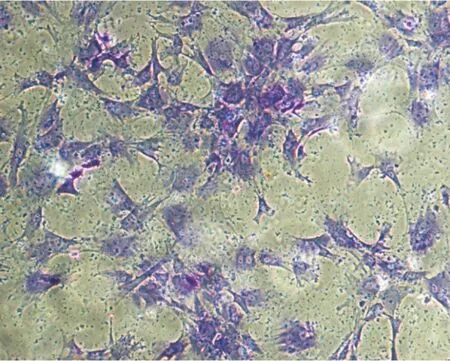
图2纤维环细胞甲苯胺蓝染色 (×400)
Figure 2Toluidine blue staining of cultured annulus fibrosus cells
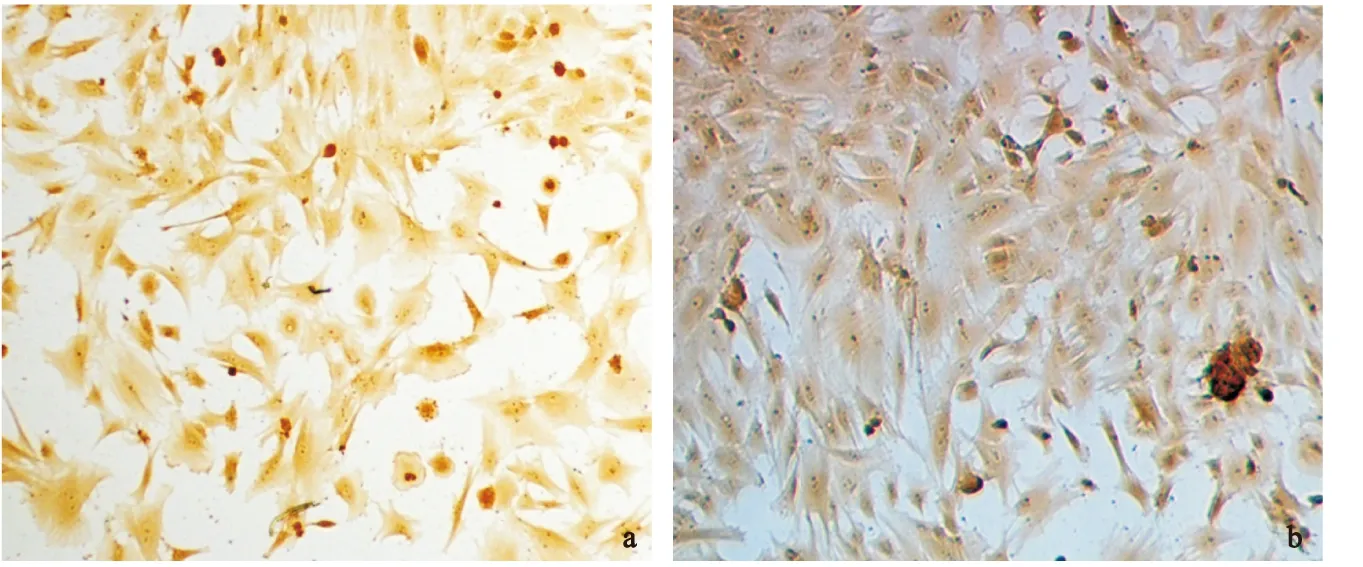
图3单层培养纤维环细胞碱性磷酸酶染色(×400)
Figure3Alkaline phosphatase staining of annulus fibrosus cells cultured in monolayer
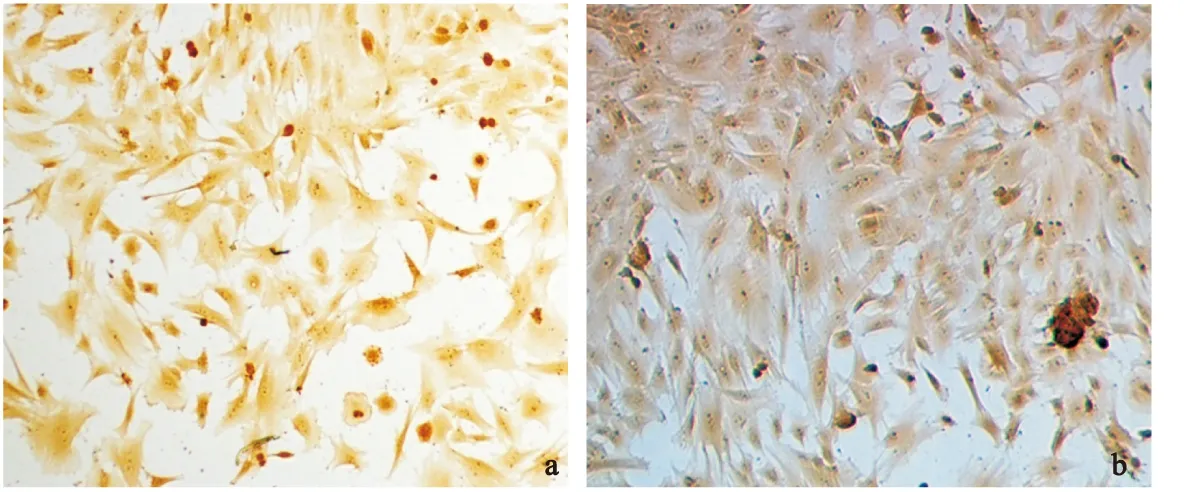
图4纤维环细胞Ⅰ型(a)和Ⅱ型(b)胶原免疫组织化学染色(×200)
Figure4Collagen I and II immunocytochemical staining of cultured annulus fibrosus cells
a:Collagen type Ⅰ;b:Collagen type Ⅱ
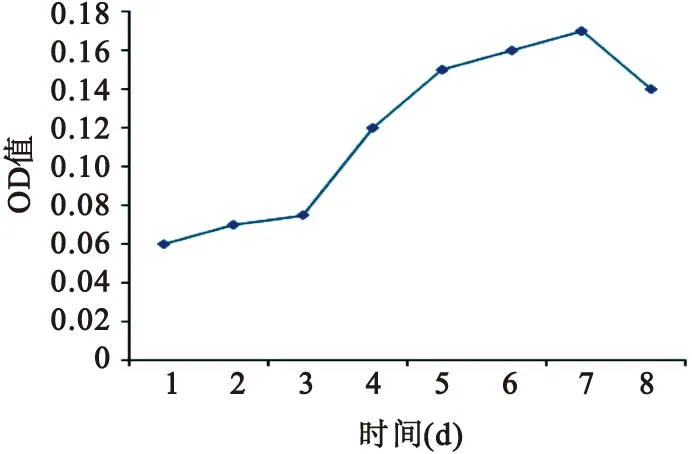
图5纤维环细胞生长曲线
Figure5Growth curve of annulus fibrosus cells
2.5MTT测定纤维环细胞生长曲线将各孔每个时间点所测结果取均数,绘制的细胞生长曲线与体外细胞培养时观察的生长过程相符,见图5。
3 讨论
椎间盘是连接两椎体的缓冲装置,主要由椎间盘细胞和细胞外基质构成,对于脊柱的活动及保持稳定的状态起着重要的作用。椎间盘具有一定的压缩、伸展和缓冲压力的功能[4]。随年龄的增加及各种因素的影响会逐渐发生退行性变化。椎间盘退变的病理改变之一为纤维环的应力损伤,纤维环微断裂, 导致髓核组织从纤维环损伤处突出[5]。退变的早期, 具有
修复能力的纤维环细胞上调蛋白多糖和其它间质中的大分子, 内部纤维环蛋白多糖含量的增加可在一定程度上弥补了早期髓核蛋白多糖的下降[6]。退变的晚期,椎间盘内细胞含量明显下降,导致椎间盘整体力学功能受损, 椎间盘内细胞外基质成分发生改变以致终板钙化和营养供应受限。 随纤维环细胞的自身修复能力的下降, 椎间盘发生不可逆的退变。
纤维环主要由纤维环细胞和细胞外基质构成。目前多种实验结果均显示纤维环细胞是一种纤维环软骨细胞,表达Ⅱ型胶原和蛋白多糖等成分[6],但对于其是否表达Ⅰ型胶原,学术界仍有争议。有学者采用Northen blot等方法检测培养的兔纤维环细胞mRNA 的表达情况,发现Ⅰ型胶原mRNA没有表达或者表达量极为有限[7]。但是,Gruber等采用免疫组织化学方法,利用Ⅰ型胶原单克隆或多克隆抗体对培养的人纤维环细胞进行检测,则检测到Ⅰ型胶原的阳性表达[8]。在本实验中,结果证明与Gruber等的研究结果一致。造成此种差异的原因可能有多方面的原因:如细胞培养方式的不同、所用检测方法和手段不同、细胞种属来源不同等。不同动物纤维环中Ⅰ型胶原和Ⅱ型胶原的含量和分布存在差异[9]。另外,实验还对培养的纤维环细胞进行甲苯胺蓝染色,该细胞具有异染性,表明细胞可以合成分泌蛋白多糖,与相关文献报道一致[10]。
有些学者认为含20%FBS的DMEM是椎间盘细胞体外培养的理想培养基[11], 本实验在培养原代细胞时亦采用含20%FBS的DMEM培养基,培养的细胞生长状态良好。实验在细胞传代后使用10%FBS的DMEM培养基培养,培养的细胞生长状态正常,可见采用此方法既保证了纤维环细胞的正常生长,又尽可能的节约资源。有学者采用Ⅱ型胶原和透明质酸酶消化,有的采用胶原酶和蛋白酶消化,上述方法消化时间较长。本研究先用0.25%胰蛋白酶预消化,然后加入0.02%胶原酶消化基质,可见到组织块变为絮状悬浮,同样取得良好消化效果,且操作时间较短,在三周内能够达到有效的细胞量。
4 结论
本实验采用酶消化法成功地分离培养了兔椎间盘纤维环细胞,通过对细胞形态的观察、细胞外基质免疫组化等检测手段,证实培养的细胞为纤维环细胞。为体外探讨椎间盘退变等疾病的机制提供了可靠的细胞培养模型。但随着细胞传代次数的增多,不可避免的出现了去极化和纤维化改变。因此,如何更好地为体外细胞培养提供良好的生存环境以最大限度的保持良好的生长状态将是未来椎间盘细胞体外培养新的研究方向。
[1]Tow BP, Hsu WK, Wang JC. Disc regeneration: a glimpse of the future[J]. Clin Neurosurg, 2007, 54:122-128.
[2]刘清毅,林宏,向勇,等.小切口椎板开窗髓核摘除术治疗腰椎间盘突出症疗效观察[J].川北医学院学报,2010,25(3):0231-0232.
[3]宋超敏,赵吕国,蔚芃.经后路椎间盘镜髓核摘除术治疗腰椎间盘突出症[J].川北医学院学报,2003,18(4):23-24.
[4]Gruber HE, Hanley EN Jr. Recent advances in disc cell biology[J]. Spine, 2003,28:186-193.
[5]Raj PP. Intervertebral disc: anatomy-physiology-pathophysiology- treatment[J]. Pain Pract, 2008, 8(1):18-44.
[6]Rannou F, Pioraudeau S, Foltz V,etal. Monolayer annulus fibrosus cell cultures in a mech anically active environment: Local culture condition adaptation and cell phenotype study[J]. J Lab Clin Med, 2000, 136(5): 412-421.
[7]Sha′ban M, Yoon SJ, Ko YK,etal. Fibrin promotes proliferation and matrix production of intervertebral disc cells cultured in three-dimensional poly(lactic-co-glycolic acid) scaffold[J]. J Biomater Sci Polym Ed, 2008,19(9):1219-1237.
[8]Gruber HE, Ingram J, Leslie K,etal. Gene expression of types I, II, and VI collagen, aggrecan, and chondroitin-6-sulfotransferase in the human annulus: in situ hybridization findings[J]. Spine J, 2008,8(5):810-817.
[9]Peter J, Roughleyl I,Melchingt F,etalThe structure and degradation of aggrecan in human intervertebral disc[J]. Eur Spine J, 2006, 15(Suppl3): S326-S332.
[10] Rannou F, Pioraudeau S, Foltz V,etal. Monolayer annulus fibrosus cell cultures in a mech anically active environment: Local culture condition adaptation and cell phenotype study[J]. J Lab Clin Med, 2000, 136(5): 412-421.
[11] Pioraudeau S, Monteiro I, Anract P,etal. Phenotype characteristics of rabbit intervertebral disc cells: comparison with cartilage cells from the same animals[J]. Spine,1999, 4(9): 837-844.
Study of culture of rabbit annulus fibrosus cells and biological feature of annulus fibrosus cells in vitro
BAI Yiguang,CHEN Qiaoling,FENG Gang, et al
(1.DepartmentofOrthopaedic,TheSecondClinicalCollegeofNorthSichuanMedicalCollege·NanchongCentralHospital,Nanchong637000,Sichuan,China;2.DepartmentofOncology,TheSecondClinicalCollegeofNorthSichuanMedicalCollege·NanchongCentralHospital,Nanchong637000,Sichuan,China;3.TissueEngineeringandStemCellInstitute,TheSecondClinicalCollegeofNorthSichuanMedicalCollege·NanchongCentralHospital,Nanchong637000,Sichuan,China)
ObjectiveTo establish the culture system of the annulus fibrosus cells of rabbit in vitro and identify the cell phenotype. MethodsThe annulus fibrosus cells of rabbit were isolated by enzyme digestion and cultured in monolayer. DMEM containing 20% fetal bovine serum was used in the primary culture. The morphology, structure and biological characteristics of cells were detected by an inverted microscope. The cell phenotype was identified by toluidine blue staining, immunocytochemistry and alkaline phosphatase detection. The growth curve was drawn through MTT.Results Under inverted microscope, annulus fibrosus cells were polygonal and spindle-like in monolayer culture. The cells displayed intense toluidine blue metachromasia. The cells showed positive expression of collagen I and II as well as alkaline phosphatase. ConclusionThe enzyme digestion method can be successfully applied to culture of rabbit annulus fibrsus cells which are accordance with the characteristics of annulus fibrsus cells by phenotypic identification.
Intervertebral disc; Annulus fibrosus cells; Biological feature; Tissue engineering
四川省教育厅资助项目(15ZA0216、15ZB0201);南充市科技支撑项目(14A0017、14A0022);川北医学院科研发展计划项目(CBY14-A-ZD02、CBY15-A-ZD02)
冯刚,教授,本刊副主编,E-mail: genecloner@163.com
R 392.12
A
10.3969/j.issn.1672-3511.2016.08.003
2016-04-22; 编辑: 张文秀)
