爱罗咳喘宁对COPD稳定期大鼠白细胞介素-6、髓过氧化物酶及肺组织结构的影响※
2016-09-16陈晓辉尚立芝谢文英高妙然赵晓云河南中医学院基础医学院郑州450046
陈晓辉 尚立芝 谢文英 高妙然 刘 坦 张 静 赵晓云(河南中医学院基础医学院,郑州 450046)
爱罗咳喘宁对COPD稳定期大鼠白细胞介素-6、髓过氧化物酶及肺组织结构的影响※
陈晓辉尚立芝*谢文英高妙然刘坦张静赵晓云
(河南中医学院基础医学院,郑州450046)
目的 探讨爱罗咳喘宁方对慢性阻塞性肺疾病(COPD)的抗炎机制,观察爱罗咳喘宁对COPD大鼠模型支气管肺泡灌洗液和肺匀浆中白细胞介素-6(IL-6)和髓过氧化物酶(MPO)的影响。方法 制备COPD稳定期大鼠模型,随机分为正常对照组、病理模型组、急支糖浆组,爱罗咳喘宁高、中、低剂量组。正常组、模型组灌胃蒸馏水(15.52 mL/(kg·d),急支糖浆组爱罗咳喘宁口服液高、中、低剂量组分别灌胃(31.04,15.52,7.75 g/(kg·d),连续14 d。酶联免疫法(ELISA)测定各组大鼠BALF和肺组织匀浆中IL-6含量,比色法测定MPO活性。结果 与正常对照组比较,模型组BALF和肺组织匀浆IL-6和MPO均显著升高(均P<0.05);与模型组相比,爱罗咳喘宁中剂量组IL-6和MPO均显著降低(均P<0.05)。结论 爱罗咳喘宁对COPD有抗炎作用,其机制可能与减少IL-6的释放、抑制MPO的活性有关。
慢性阻塞性肺疾病;白细胞介素-6;巨噬细胞;髓过氧化物酶;肺胀;痰饮;动物实验
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)以慢性非特异性炎症为主要特征,由多种炎症细胞及炎症介质参与且相互作用所致,发病率和病死率随着年龄的增长而增加[1]。COPD属中医“痰饮”“咳嗽”等范畴。中医认为本病肺、脾、肾均虚。本课题组依据方证相关理论,自拟爱罗咳喘宁方,兼顾宣肺化痰、止咳平喘、健脾固肾。临床观察十多年,发现爱罗咳喘宁能显著提高COPD患者肺功能,但其作用机制有待研究[2-7]。本研究自2012年8月—2015年8月,制备COPD稳定期大鼠模型,观察爱罗咳喘宁对COPD大鼠肺泡灌洗液 (bronchoalveolar lavage fluid,BALF)和肺组织匀浆中白细胞介素-6(interleukin-6,IL-6)含量、髓过氧化物酶 (myeloperoxidase,MPO)活性及肺组织结构的影响,探讨爱罗咳喘宁对COPD抗炎的机制。
1 材料与方法
1.1材料
1.1.1动物 6月龄SD大鼠60只,SPF级,雄雄各半,体质量(250±20)g。郑州大学医学院实验动物中心提供,合格证号SCXK(豫)2012-0001。
1.1.2药物 爱罗咳喘宁方药组成:炙麻黄6 g(批号1403125),苦杏仁10 g(批号1402001w),姜半夏10 g(批号1404001s),麦芽20 g(批号1312001s),党参15 g(批号1407002w),白术12 g(批号1403003s),葶苈子10 g(批号1308001s),苍术10 g(批号1405001w)、山药15 g(批号1405002S)等均为中药配方颗粒,由三九医药生产。急支糖浆(太极集团重庆涪陵制药厂有限公司,国药准字Z500206151,00 ml/瓶,批号141111020571)。1.1.3试剂与仪器 IL-6 ELISA试剂盒 (CK-E30646R)、MPO活性测定试剂盒 (A044)均购于南京建成生物工程有限公司。红旗渠牌香烟 (河南安阳卷烟厂,烤烟型,尼古丁含量1.1 mg/支,焦油含量14 mg/支),VIS-7220型分光光度仪(北京第二光学仪器厂),318C酶标仪(上海精密科学仪器有限公司),全波长扫描酶标仪(Powerwave XS,美国Bio-tek),全自动酶标洗板机(伯乐1575,美国伯乐公司)。显微摄像仪OLYMPUS TOKYO(JAPAN)等。
1.2实验方法
1.2.1动物分组 大鼠被分为正常组,COPD稳定期模型组,急支糖浆组,爱罗咳喘宁高、中、低剂量组,每组10只。
1.2.2模型制备 参照文献[7,8],以烟熏加滴菌的方法制备COPD稳定期大鼠模型。大鼠吸气时滴入鼻腔内肺炎克雷伯杆菌菌液0.l mL(6×108CFU/mL),每5天一次,持续12周。大鼠置于3.6 L的密闭烟室,烟熏,2次/d,30 min/次,2次烟熏间隔3 h,持续12周。
1.2.3给药方案 参考文献[9],各组于第13周的第1天开始灌胃。正常组、模型组灌胃生理盐水 [15.52 mL/ (kg·d)],急支糖浆组给予急支糖浆口服液每天3 ml(稀释成6 ml),2次/d灌胃,爱罗咳喘宁高、中、低剂量组分别灌胃 [31.04,15.52,7.75 g/(kg·d)],稀释成6 ml,灌胃2次/d,连续14 d。
1.2.4BALF制备 参考文献及前期研究制备支气管肺泡灌洗液。原液计数细胞后,取BALF 1 ml以2000 r/min离心5 min后,将上清液置入EP管保存于-20℃冰箱中待检。按试剂盒说明书操作检测BALF上清液中IL-6浓度。
1.2.5肺组织匀浆中IL-6浓度及MPO活性测定[10]取右肺组织1.0 g,用冷盐水制备成10%的肺匀浆,-20℃冻存待测。酶联免疫吸附法(ELISA)测定上清液IL-6质量浓度。根据MPO测定试剂盒说明书测定MPO活性。
1.2.6HE染色标本制备 取肺组织,10%多聚甲醛固定,常规石蜡包埋,切片,HE染色。
2 结果
2.1大鼠一般情况 正常组和急支糖浆组无死亡,体重增长,一般状况好。模型组,低剂量组体重下降,各死亡2只。爱罗咳喘宁中、高剂量组大鼠体重增加,各死亡1只。
2.2肺泡灌洗液和肺匀浆中IL-6和MPO变化 模型组肺泡灌洗液中IL-6和MPO都显著高于正常组 (均P<0.05);爱罗咳喘宁高、中剂量组和急支糖浆组IL-6含量、MPO活性均显著低于模型组 (均P<0.05)。与正常组比较,模型组肺匀浆中IL-6和MPO均显著升高 (均P<0.05);与模型组相比,爱罗咳喘宁中、高剂量组,急支糖浆组IL-6和MPO均显著降低 (均P<0.05,表1,表2)。
表1 爱罗咳喘宁对各组COPD大鼠肺泡灌洗液中IL-6含量、MPO活性的影响 (±s)
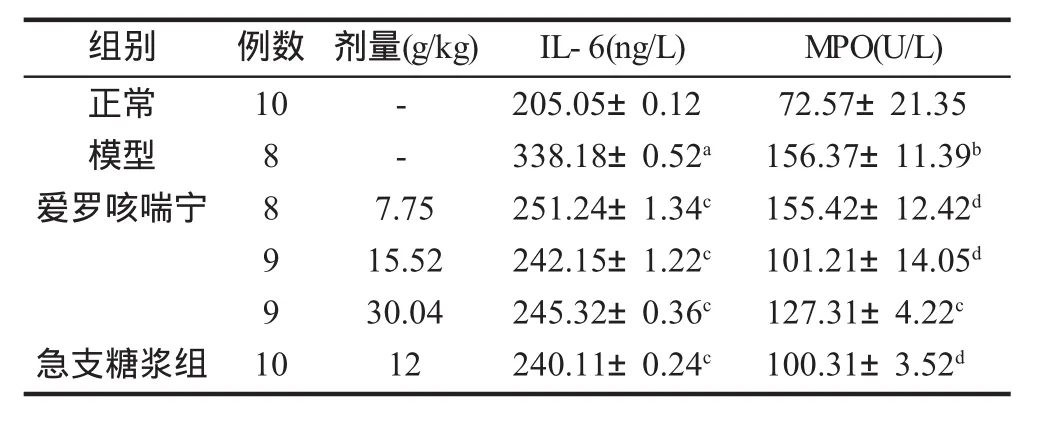
表1 爱罗咳喘宁对各组COPD大鼠肺泡灌洗液中IL-6含量、MPO活性的影响 (±s)
注:与正常组比较,t=2.876,aP=0.02;t=3.356,bP=0.005;与模型组比较 ,IL-6:(t=2.897、2.762、2.842、2.766),cP=0.02;MPO:t=2.852,cP=0.02;t=4.502、4.298、4.586,dP=0.001、0.005、0.001
组别 例数 剂量(g/kg) IL-6(ng/L)正常模型爱罗咳喘宁10--急支糖浆组8 8 9 9 1 0 7.75 15.52 30.04 12 205.05±0.12 338.18±0.52a251.24±1.34c242.15±1.22c245.32±0.36c240.11±0.24cMPO(U/L)72.57±21.35 156.37±11.39b155.42±12.42d101.21±14.05d127.31±4.22c100.31±3.52d
表2 爱罗咳喘宁对各组COPD大鼠肺组织匀浆中IL-6含量、MPO活性的影响 (±s)
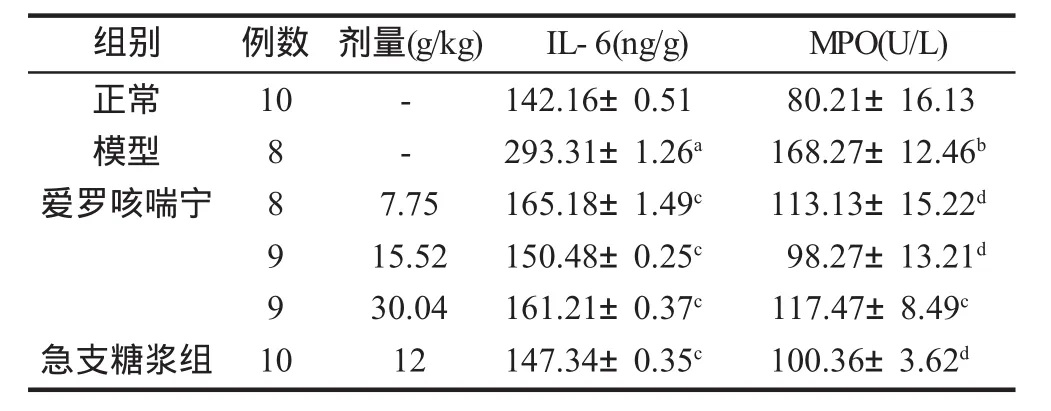
表2 爱罗咳喘宁对各组COPD大鼠肺组织匀浆中IL-6含量、MPO活性的影响 (±s)
注:与正常组比较,t=2.876,aP=0.02;t=3.354,bP=0.005;与模型组比较,IL-6:(t=2.889、.875、2.822、2.764),cP=0.02;MPO:t=2.852,cP=0.02;t= 3.689、4.784、4.589,dP=0.001、0.005、0.001
组别 例数 剂量(g/kg) IL-6(ng/g)正常模型爱罗咳喘宁10--急支糖浆组8 8 9 9 1 0 7.75 15.52 30.04 12 142.16±0.51 293.31±1.26a165.18±1.49c150.48±0.25c161.21±0.37c147.34±0.35cMPO(U/L)80.21±16.13 168.27±12.46b113.13±15.22d98.27±13.21d117.47±8.49c100.36±3.62d
2.3肺组织结构改变(HE染色) 光镜下显示,正常组气道管腔内无渗出物,气管、支气管黏膜结构完整,上皮细胞排列整齐,管壁各层均无炎细胞浸润、无腺体和纤维组织增生;肺泡结构正常,无肺气肿以及炎性渗出(图1)。模型组管壁上皮多处脱落,黏膜下层黏液腺增生,管壁各层炎细胞弥漫浸润细支气管腔内有渗出物积聚(图2);部分血管周围水肿,局部细支气管管壁因间质水肿而增厚,在病变较重的细支气管周围可见肺大泡,局限性肺不张;肺泡壁血管扩张充血,肺泡隔明显增厚,其中可见炎细胞浸润,肺泡腔内有渗出液、炎细胞(图3)。高剂量组多数细支气管壁周围有淋巴细胞及淋巴滤泡(图4)。
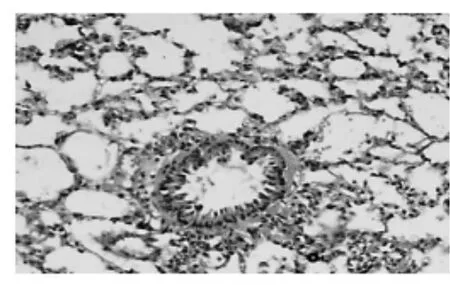
图1 正常组细支气管、肺组织(HE,×100)

图2 模型组支气管(HE,×100)
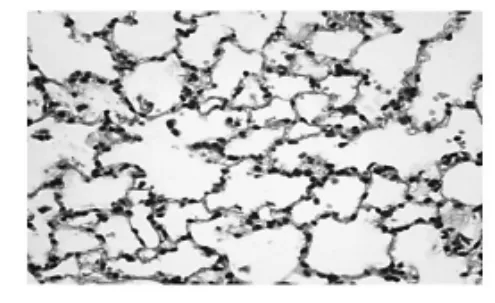
图3 急支糖浆组肺组织(HE,×100)
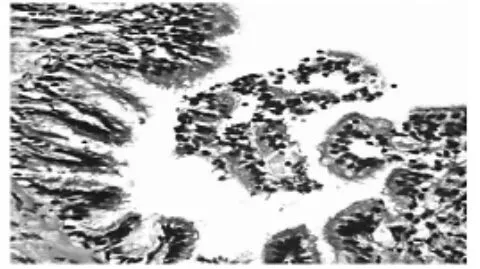
图4 爱罗咳喘宁30.04 g·kg-1组支气管(HE,×100)
与模型组比较,爱罗咳喘宁中剂量组见细支气管内少量渗出物,细支气管黏膜上皮趋于完整,肺泡内出现少量巨噬细胞和红细胞、肺泡有部分扩张,肺组织结构基本正常(图5)。低剂量组与模型组接近,疗效较差(图6)。
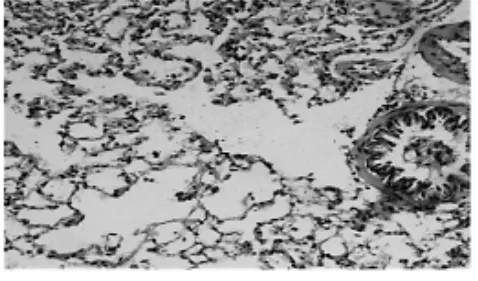
图5 爱罗咳喘宁15.52g·kg-1组肺组织(HE,×100)
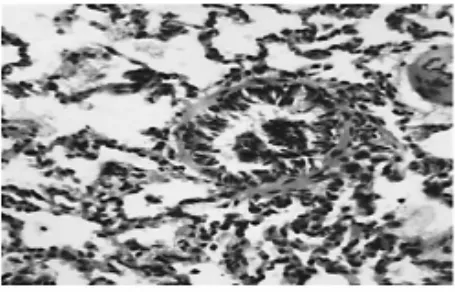
图6 爱罗咳喘宁7.75 g·kg-1肺组织(HE,×100)
3 讨论
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD),是以持续气流受限为特征的可以预防和治疗的疾病,气流受限多呈进行性发展。其发病与理化因素(吸烟、空气污染、寒冷等)、感染因素、过敏反应及内在体质有关。病理改变包括慢性支气管炎、慢性阻塞性肺气肿、支气管哮喘、肺动脉高压及慢性肺源性心脏病。临床以咳嗽、咯痰、喘息或胸闷为主要表现,合并右心衰竭后表现为体循环淤血。
COPD属中医“咳嗽”“痰饮”“喘证”等范畴。爱罗咳喘宁方由炙麻黄、苦杏仁、半夏、苍术、葶苈子、干姜、山药等药物组成。有祛痰止咳,温肺化饮、活血祛瘀、健脾益肺、养肺固肾之功效。
COPD的发病机制目前不清,其特征性病理改变是气管、支气管及肺组织的慢性炎症,常急性发作。病变部位以中性粒细胞、淋巴细胞和巨噬细胞浸润为主,炎细胞释放炎症介质。在COPD患者的气道、肺实质和肺血管中均存在着巨噬细胞、嗜酸细胞、中性粒细胞和T淋巴细胞增加,本研究组织病理也予以证实,参与COPD反应的炎症细胞释放多种炎症介质[11],导致肺实质破坏,引起气道狭窄。炎症可刺激气道、肺泡、血管壁结构重建,肺功能下降。对C0PD积极有效的抗炎治疗,将起到预防和治疗肺心病的作用。
在COPD炎症中IL-6升高[12-14],是COPD严重程度的重要标志[15]。MPO是中性粒细胞产生的过氧化物酶,MPO可作为中性粒细胞的活化标志物[16]。气道内中性粒细胞的聚集和活化与特异性的趋化因子密切相关[17],本研究结果显示,模型组BALF和肺组织匀浆中MPO较正常组显著增高,与文献[18,19]报道结果相一致,提示MPO诱导了气道炎症。COPD大鼠肺组织内存在中性粒细胞的聚集、活化,中性粒细胞释放过量髓过氧化物酶、蛋白酶、弹性酶等溶解细胞外基质,进而炎细胞浸润,诱发小气道和肺组织炎症反应[20-22]。
本研究结果显示,BALF和肺组织匀浆中,模型组较正常组IL-6、MPO均显著增高,与文献报道[23,24]相近,提示IL-6和MPO均参与COPD稳定期的炎症反应。与模型组比较,BALF和肺组织匀浆在爱罗咳喘宁中、高剂量组,急支糖浆组IL-6水平、MPO活性均显著低于模型组,提示爱罗咳喘宁可减低BALF和肺组织匀浆中IL-6水平、抑制MPO活性,肺组织病理形态证实忠告剂量治疗组和急支糖浆组的炎细胞浸润明显减轻,这可能是爱罗咳喘宁治疗COPD的作用机制之一[25-28]。
[1]钟南山.慢性阻塞性肺疾病在中国[J].中国实用内科杂志,2011,31(5): 321-322.
[2]尚立芝,谢文英,张良芝,等.爱罗咳喘宁对慢性阻塞性肺疾病大鼠白三烯B4,白细胞介素-6和肺组织病理变化的影响[J].中国实验方剂学杂志,2014,20(12):148-151.
[3]谢文英,景晓平.爱罗咳喘口服液治疗支气管哮喘42例[J].中国中医药信息杂志,2005,12(2):82-83.
[4]谢文英,常学辉,张良芝.爱罗咳喘宁汤治疗咳嗽变异性哮喘30例[J].中医研究,2007,20(5):35-37.
[5]谢文英,常学辉,张良芝.爱罗咳喘宁口服液对支气管哮喘患者白细胞介素2及白细胞介素13的影响[J].中医杂志,2007,48(7):614-615.
[6]谢文英,张良芝,刘霖,等.爱罗咳喘宁口服液对慢性支气管炎大鼠白细胞介素-13和肿瘤坏死因子-α含量的影响[J].中国新药杂志,2012,21 (5):551-554.
[7]王至婉,李建生,王明航,等.慢性阻塞性肺疾病稳定期肺功能与证候分布规律的相关性[J].中医杂志,2011,52(16):1376-1378.
[8]李建生,周红艳,乔翠霞,等.慢性阻塞性肺疾病急性加重期痰热证模型的建立与评价[J].中国中医基础医学杂志,2010,16(7):553-556.
[9]宋一平,崔德健,茅培英,等.慢性阻塞性肺疾病大鼠模型的建立及药物干预的影响[J].中华内科杂志,2000,39:556-557.
[10]胡坚,陈发秀,邱元芝,等.髓过氧化物酶在老年慢性心力衰竭患者中的临床意义[J].中国老年学杂志,2014,34(1):13-15.
[11]Ross Vlahos,Steven Bozinovski.Recent advances in pre-clinical mouse models ofCOPD.Clin Sci,2014,126(4):253-265.
[12]Enrique Z,Fisman,Michael M,etal.Cardiovascular diabetology in the core of a novel interleukins class ification the bad the good and the aloof Cardiovase Diabetoly2003,2(1):11-15.
[13]HERFS M,HUBERT P,POIRRIER AL,et al.Proinflammatory cytokines induce bronchial hyperplasia and squamous metaplasia in smokers:implications for chronic obstructive pulmonary disease therapy[J].Am J Respir Cell Mol Biol,2012,47(1):67-79.
[14]郭式敦,蒋庆贺.COPD的炎症机制[J].山东医药,2010,50(27):106-107.
[15]姚坚,陈金亮,陶一江.COPD患者血清中LTB4和TNF-α的检测及其临床意义[J].临床肺科杂志,2012,17(3):459-460.
[16]Forte E,Salinas RE,Chang C,et al.The Epstein Barr virus(EBV)-induced tumor suppressor microRNA MiR-34a is growth promoting in EBV-infected Bcells[J].Virol,2012,86(12):6889-6898.
[17]DONNELL RO,PEELLESC,WARD J,et al.Relationship between peripheral airway dysfunction,airway obstruction and neutrophilic inflammation in COPD[J].Thorax,2004,59:837-842.
[18]彭红星,杨荣时,曾玉兰,等.吸烟诱导的慢性支气管炎大鼠模型巨噬细胞炎性蛋白-2及髓过氧化物酶研究[J].中国现代医学杂志,2012,22(12): 10-13.
[19]茅培英,崔德健,宋一平,等.大鼠吸入烟雾后支气管肺组织ICAM-1及中性粒细胞炎症因子的变化[J].基础医学与临床,2001,21(3):222-225.
[20]CrulT,SpruitMA,et al.Markers of inflammation and disuse in vastus lateralis of chronic obstructive pulmonary disease patients[J].European journal of clinical investigation,2007,11(37):897-904.
[21]March TH,BarrEB,FinchGL,et al.Effects of concurrentozone exposure on the pathogenesisofcigarette smokeinduced emphysema in B6C3F1 mice[J].InhalToxicol,2002,10,14(12):1187-213.
[22]陈涛,刘金华,吴金星,等.噻托溴铵对轻、中度稳定期COPD患者小气道肺功能的影响[J].中国医院药学杂志,2011,1(24):2038-2041.
[23]方苏榕,谷伟,谭焰,等.烟熏联合内毒素构建COPD大鼠模型[J].南京医科大学学报(自然科学版),2013,33(9):1226-1230.
[24]谢文英,尚立芝,张良芝,等.爱罗咳喘宁对慢性阻塞性肺疾病大鼠肿瘤坏死因子-α,白细胞介素-8和白细胞介素-18及炎细胞的影响[J].中国中医基础医学杂志,2014,20(4):448-451.
[25]谢文英,尚立芝,潘晓丽,等.爱罗咳喘宁对慢性阻塞性肺疾病大鼠肺功能,血气指标及病理变化的影响[J].中国实验方剂学杂志,2014,20(22):105-110.
[26]尚立芝,谢文英,张良芝,等.爱罗咳喘宁对COPD大鼠p38MAPK、TNF-α及AQP5基因表达的影响[J].中国实验方剂学杂志,2014,20(23):174-
179.
[27]尚立芝,谢文英,张良芝,等.爱罗咳喘宁对COPD大鼠水通道蛋白5和黏蛋白5AC基因表达的影响 [J].中国实验方剂学杂志,2014,20(22):111-117.
[28]尚立芝,谢文英,张良芝,等.爱罗咳喘宁对COPD大鼠肺组织炎症因子及氧化应激的影响[J].中国实验方剂学杂志,2014,20(24):168-171.
Effect of Ailuokechuanning on IL-6 and Myeloperoxidase Inflammatory Cells in Rats with Chronic Obstructive Pulmonarydisease
CHEN Xiaohui,SHANG Lizhi*,XIE Wenying,GAO Miaoran,LIU Tan,ZHANG Jing,ZHAO Xiaoyun (School of Basic Medicine Science,Henan University of Traditional Chinese Medicine,Zhengzhou 450046,China)
Objective To study the effect of Ailuokechuanning on interleukin-6(IL-6),myeloperoxidase(MPO)and inflammatory cells in rats with chronic obstructive pulmonary disease(COPD).Methods The method of smoke add drops of bacteria preparation was used to rat model COPD with stabilization,the rats were randomly divided into normal control group,model group,Ailuokechuanning group(31.04,15.52,7.75 g/(kg·d),euzyme-linked immunosorbent assay was used to determine the change of IL-6 level,and colorimetric was used to determine the activity of MPO in BALF and Lung homogenates in the rats of all groups before and after treatment.Results The levels of IL-6 and MPO in BALF and lung homogenates of the model group were significantly higher than those in the normal control group,comparing with the model group,the levels of IL-6 and MPO in BALF and lung homogenates of the rats treated with Ailuokechuanning(15.52 g/(kg·d)significantly decreased.Conclusion The mechanism of Ailuokechuanning for treatment of COPD may be related to the inhibition of IL-6 and MPO release.
chronic obstructive pulmonary disease;interleukin-6(IL-6);macrophage;myeloperoxidase;lung-distention;retention of phlegm and fluid;animal experiment
10.3969/j.issn.1672-2779.2016.16.061
1672-2779(2016)-16-0141-04
��张文娟 本文校对:吕翠田
2015-12-29)
国家自然科学基金面上项目(No:81573881);河南省科重点技攻关(No:152102310337);河南省高等学校重点科研项目 (No:15A360030);河南中医学院研究生教育研究课题(No:2014YJX001);河南中医学院基础医学院教学项目(No:2015JCJX10);河南中医学院大学生创新学习项目(No:CXXM [2015]0017,CXXM[2015]0063);郑州市科技领军人才项目(No:121PLJRC535)
lzshang2014@163.com
