陈化进程中大米淀粉与谷蛋白的相互作用
2016-09-14刘成梅徐梦涵钟业俊杨晓会南昌大学食品科学与技术国家重点实验室江西南昌330047
刘成梅,徐梦涵,钟业俊,杨晓会(南昌大学食品科学与技术国家重点实验室,江西南昌330047)
陈化进程中大米淀粉与谷蛋白的相互作用
刘成梅,徐梦涵,钟业俊*,杨晓会
(南昌大学食品科学与技术国家重点实验室,江西南昌330047)
为进一步阐明大米陈化机理,本研究以荧光和紫外光谱等为手段,探讨加速陈化过程中大米淀粉-谷蛋白混合物的相互作用,及其对复合物溶解性、起泡性和消化性能的影响。结果显示,陈化过程中谷蛋白溶解度和起泡性逐渐下降,且随着大米淀粉的加入进一步降低。紫外及荧光分析表明,陈化过程中,淀粉的加入影响了陈化进程中谷蛋白的三级结构,色氨酸和酪氨酸残基周围微环境发生改变,蛋白质分子与淀粉相互缔合,且随着陈化的进行愈加紧密,造成荧光发射峰红移并产生荧光猝灭,以及谷蛋白与淀粉消化性能的下降。随着淀粉含量增加,谷蛋白的消化率降低速率增大,与此相应,谷蛋白比例增加也迫使淀粉消化率下降。
大米淀粉,谷蛋白,陈化,相互作用
陈化是稻米收割以后,随着储藏时间、温度和水分而变化的一种非人为、自然发生的现象[1]。陈化过程中,稻米组织硬化,柔性与韧性变弱,淀粉细胞变硬,持水能力减退[2]。一般认为,大米陈化受内部成分影响较大。研究表明,陈化过程中淀粉微晶束得到加强,组织结构变得紧密,导致内部淀粉难以糊化[3];此外,陈化过程中蛋白-SH含量减少,空间结构变得松散,造成米饭粘性下降[4]。
实际上,大米陈化机理仍未完全阐明,目前国际上主要从热力学性质[3]、糊化特性[5]、晶体结构[1]和表面疏水性[6]等角度来探讨大米陈化行为和结构的关系,如Hamaker等[7]通过破坏蛋白质的二硫键观察大米的流变学特性,发现二硫键破坏后米饭的粘性提高;Hamaker等[8]报道陈化过程中大米蛋白总量基本不变,但在光、热等作用下,蛋白质巯基逐渐氧化成二硫键;Likitwattanasade等[9]报道陈化过程中蛋白与淀粉的相互作用和二硫键的变化会影响大米糊化性质。
整体而言,目前关于大米陈化主要还是集中在理化性质变化的探讨和分析上,关于陈化导致淀粉分子与蛋白结构相互作用变化的报道还很缺乏。由此,本文从分子结构及相互作用等角度,探讨分子结构变化对复合物消化性能、溶解性及起泡性的影响,采用荧光光谱、紫外-可见光光谱等手段,研究陈化过程中淀粉和谷蛋白的相互作用,为进一步阐析大米陈化机理提供依据。
1 材料与方法
1.1 材料与仪器
谷蛋白、大米淀粉 均购于江西金农生物科技有限公司;α-淀粉酶(10080-25G,EC 3.2.1.1,50 U/mg)、胃蛋白酶(P7000-25G,EC 3.4.23.1,250 U/mg) 购于Sigma公司;胰蛋白酶(PTN 6.0S,EC 3.4.21.4,1350 U/mg) 购于诺维信(中国)生物技术有限公司;考马斯亮蓝G-250 国产分析纯试剂。
F-7000型荧光分光光度计 日本HITACHI公司;UV-1600型紫外可见光分光光度计 上海美普达仪器有限公司;T18型高速均质分散机 德国IKA公司;Anke LXJ-HB型离心机 上海安亭科学仪器总厂;恒温恒湿培养箱 上海鸿都电子科技有限公司;FD-1型冷冻干燥机 北京德天佑科技发展有限公司。
1.2 实验方法
1.2.1 样品陈化 淀粉是大米的主要成分,然而储藏过程中,只有局部的淀粉能与谷蛋白发生相互作用。因此,本实验称取谷蛋白与大米淀粉,分别按质量比1∶0、1∶1和2∶1混合均匀,参照Likitwattanasade等[9]的方法进行改进,置于恒温恒湿培养箱(48℃、湿度75%、三组样品水分含量为9.3%±0.4%)加速陈化60 d,每15 d取一次样进行检测。
1.2.2 溶解度测定 考马斯亮蓝法测定[10]:以标准牛血清蛋白测定标准曲线,得到公式y=0.0095x+0.1494,R2=0.998。将样品混合物配制成谷蛋白浓度为400 μg/mL的溶液,调节pH至12,取0.5 mL样品溶液,加入0.5 mL蒸馏水,以1 mL蒸馏水作为空白,分别加入5 mL考马斯亮蓝溶液,混合均匀后2 min~1 h内于595 nm下测定样品的A值,代入公式计算可得所溶解的谷蛋白含量。
谷蛋白溶解度(%)=(样品中溶解的谷蛋白含量/溶液中谷蛋白含量)×100
1.2.3 起泡性测定 参照涂宗财等[11]方法,采用搅打法测定样品的起泡性:50 mL样品溶液在室温下于高速均质分散机中搅打2 min,均质压力在8000~12000 Pa,然后快速转移至100 mL量筒中,记录泡沫高度,即为起泡性。
1.2.4 紫外可见光光谱测定 采用UV-1600紫外可见光分光光度计,记录230~360 nm波长范围内的扫描光谱。
1.2.5 荧光光谱测定 采用F-7000荧光分光光度计,扫描速度:1500 nm/min,Delay:0 s,EX Slit:5.0 nm,EM Slit:5.0 nm。以280 nm为激发波长,记录300~450 nm波长范围内的发射光谱。
1.2.6 模拟体外消化性的测定 参照Pérez(2014)等
[12]的方法,样品糊化后置于锥形瓶中,加入30 mL磷酸二氢钠-柠檬酸缓冲液(pH5.2),混匀后37℃预热5 min,加入α-淀粉酶,37℃恒温振荡120 min后取样。用DNS比色法测定还原糖含量[13],计算还原糖释放率。用盐酸溶液调节pH至1.5后加入胃蛋白酶120 min后,加入胰蛋白酶再消化120 min取样测定谷蛋白消化率。
1.3 统计分析
每实验重复3次,采用SPSS 13.0统计软件进行数据处理,结果以x±s表示。
2 结果与讨论
2.1 陈化过程中大米淀粉对谷蛋白溶解性和起泡性的影响
在60 d的陈化过程中,谷蛋白样品溶解度逐渐由37.2%降低到31.9%,下降了5.3%;当谷蛋白与淀粉质量比2∶1时,溶解度则由36.3%降低到28.3%,下降了8.0%;当谷蛋白与淀粉质量比1∶1时溶解度由35.6%降低到23.0%,下降幅度达到12.6%(如图1)。可见,陈化过程中谷蛋白的溶解性逐渐降低,加入大米淀粉后,蛋白溶解性降幅增大,且淀粉比重越高,降幅越大。据报道,陈化过程中,极性的巯基转化成二硫键降低了蛋白质分子与水分子的相互作用,导致大米谷蛋白的水合能力下降[14]。与此类似,高瑀珑等[15]报道,储藏后稻米中蛋白质的水溶性下降,这在本研究中得到证实。卢薇等[16]研究表明,大米谷蛋白的添加(0%~20%)会逐渐降低大米淀粉的持水能力,延迟其水化过程。
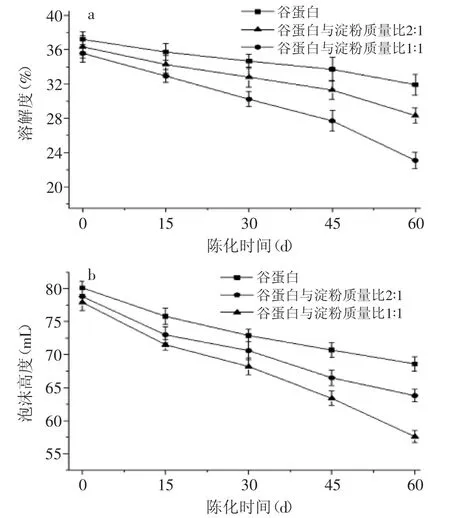
图1 陈化过程中蛋白溶解性和起泡性的变化Fig.1 The changes of solubility and foaming property of glutelin during aging
此外,在60 d的陈化过程中,谷蛋白样品起泡性逐渐由80.1 mL降低到68.6 mL,降低了11.5 mL;当谷蛋白与淀粉质量比2∶1时,起泡性则由78.8 mL降低到63.8 mL,下降了15.0 mL;当谷蛋白与淀粉质量比1∶1时起泡性由77.9 mL降低到57.6 mL,下降幅度达到20.3 mL(如图2)。可见,陈化过程中谷蛋白的起泡性逐渐下降,而淀粉的加入进一步抑制了泡沫的形成,且增加淀粉比重,抑制效果更明显。谷蛋白分子具有典型的两亲结构,在分散液中表现出较强的界面活性,具有一定程度的降低界面张力的作用,在剧烈搅拌时形成泡沫[11,17]。蛋白质的溶解性及起泡性与其扩散并吸附在空气/水界面的能力有关,氢键、疏水作用和静电相互作用等非共价键作用均会影响蛋白质的水合性质[14,18]。同时,陈化后大米蛋白质中巯基氧化交联成二硫键,分子量增大,蛋白质碱提取率降低[8,19]。李彤等[20]将大米加速陈化数周后发现谷蛋白起泡性及起泡稳定性下降。
2.2 紫外光谱分析
蛋白质在紫外吸收光谱的280 nm附近有特征吸收峰[17],这是由肽链上色氨酸和酪氨酸残基的芳杂环π→π*跃迁引起的。在60 d的陈化过程中,样品在280 nm附近的特征吸收峰均未发生位移;然而,谷蛋白在280 nm处的吸收值逐渐从0.5874降低至0.4399(降低0.1475)(图2a);当谷蛋白与淀粉质量比2∶1时,280 nm处紫外吸收值在陈化过程中降低速率加快,由0.5506逐渐降低至0.3905(降低0.1601)(图2b);而谷蛋白与淀粉质量比1∶1时,285 nm处紫外吸收值由0.5914逐渐降低至0.3936(降低0.1978)(图2c)。可见,淀粉的加入导致蛋白在280 nm处的紫外吸收值下降,且随淀粉比例升高,下降速率增大,表明淀粉的加入可能影响了陈化过程中谷蛋白的三级结构,使色氨酸和酪氨酸残基周围微环境发生变化[17],推测是由于蛋白与淀粉分子可能相互缔合造成的。据赵学伟等[21]报道,大米陈化过程中,大米蛋白质与淀粉相互作用增加,导致淀粉与蛋白质的结构及性质发生变化。

图2 陈化过程中谷蛋白紫外光谱的变化Fig.2 The changes of UV spectrum of glutelin during aging
2.3 荧光光谱分析
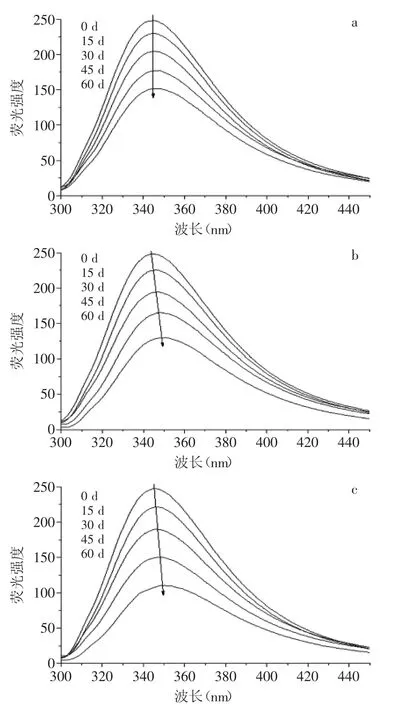
图3 陈化过程中谷蛋白荧光光谱的变化Fig.3 The changes of fluorescence spectroscopy of glutelin during aging
蛋白的内源荧光是由其内部色氨酸(Trp)和酪氨酸(Tyr)残基激发产生的,它们对周围环境(微环境)非常敏感,当微环境发生变化时,荧光光谱也发生相应变化[17]。在60 d的陈化过程中,谷蛋白的荧光峰值均出现在345.0 nm处,荧光强度则逐渐由248.4下降至151.8(图3a);当谷蛋白与淀粉质量比2∶1时,荧光强度由248.1下降至129.6,荧光峰值由344.4 nm红移到348.6 nm(图3b);而当谷蛋白与淀粉质量比1∶1时,荧光强度由247.7下降至110.4,荧光峰值则由345.0 nm红移到了350.4 nm(图3c)。可见,在加入淀粉后,谷蛋白在陈化过程中不仅荧光强度降低,荧光峰值也发生红移,且淀粉比例增加,荧光强度下降更多,红移更为明显。该结果表明,陈化过程中,蛋白质分子与淀粉相互缔合,这种结合随着陈化进行愈加紧密,导致荧光发射峰红移并产生荧光猝灭[22]。实际上,淀粉和蛋白质的相互作用是影响稻米质构特性的关键,与稻米陈化密切相关[23];通过相互作用,陈化后的淀粉与谷蛋白混合物主要以复合物形式存在,蛋白质以膜状物形式包裹在淀粉颗粒的周围[24]。
2.4 陈化过程中大米淀粉与谷蛋白消化性的变化
在60 d的陈化过程中,纯谷蛋白的消化率降低了6.57%,当谷蛋白与淀粉质量比为2∶1时降低了12.48%,谷蛋白与淀粉质量比为1∶1时降低了24.20%(图4a)。可见,陈化过程中谷蛋白的消化率逐渐降低,且随着样品中淀粉含量的增加,谷蛋白的消化率降低速率增大。此外,陈化过程中,谷蛋白比例增加也使淀粉的消化率明显降低,至第60 d时,谷蛋白与淀粉质量比1∶1样品的还原糖释放率降低了23.60%,谷蛋白与淀粉质量比2∶1的样品则降低了34.14%(图4b)。这可能是陈化过程中,谷蛋白与淀粉逐渐相互结合,以及复合物中的空间位阻效应影响了复合物的消化性能(谷蛋白与淀粉在陈化过程中逐渐相互结合已通过紫外与荧光光谱分析得到证实)。实际上,蛋白能与淀粉形成网状结构,降低淀粉的体外水解速率[25];蛋白类物质也可包裹在淀粉周围形成膜状物质,增加慢消化性淀粉含量[23]。在大米储藏过程中,蛋白质的低分子量肽减少,高分子量肽增加,肽亚基之间的结合力发生改变,进而影响谷蛋白的消化性[15]。此外,在陈化过程中,大米淀粉体系中慢消化性淀粉和抗性淀粉含量也显著增加[26]。
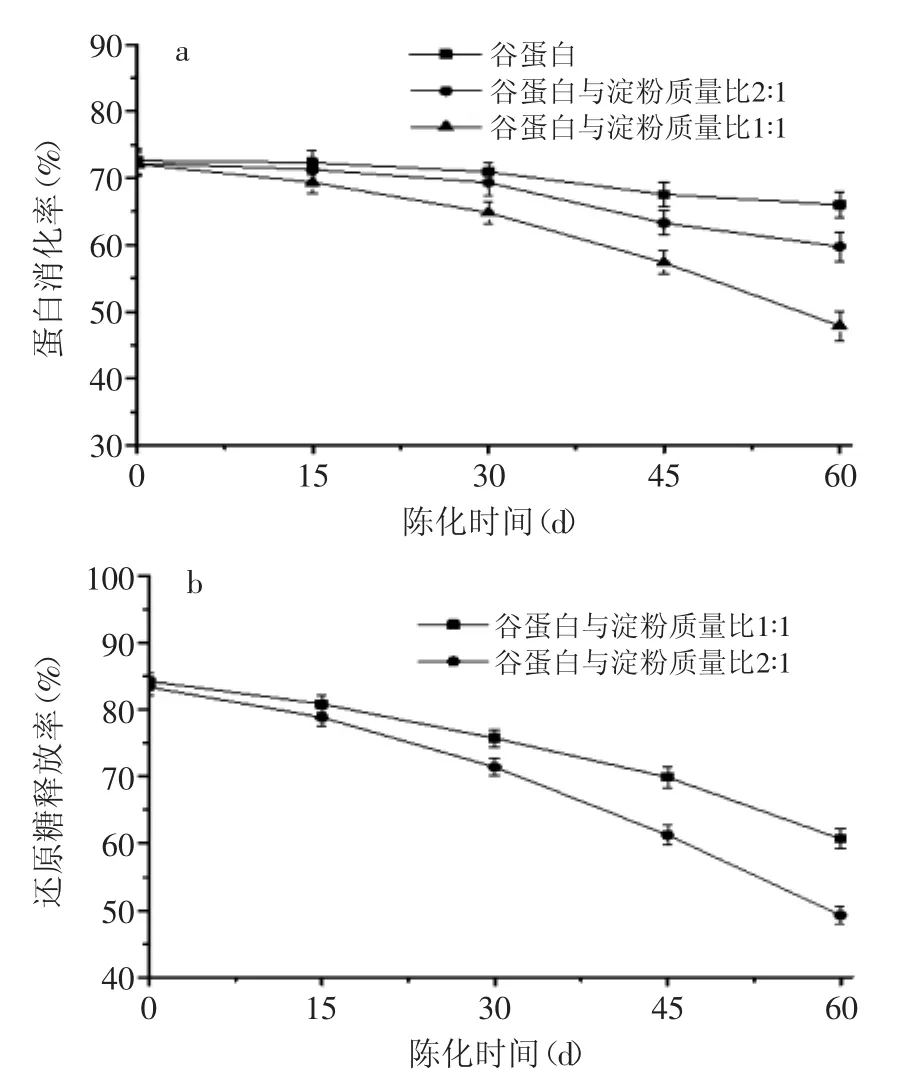
图4 陈化过程中谷蛋白(a)与淀粉(b)消化性的变化Fig.4 The changes of digestibility of glutelin(a)and starch(b)during aging
3 结论
本研究表明,陈化过程中,谷蛋白吸附在空气/水界面的能力逐渐降低,导致溶解度和起泡性下降,且随淀粉比例增加,降幅增大。结构分析显示,陈化过程中,淀粉的加入使谷蛋白色氨酸和酪氨酸残基周围微环境发生了变化,荧光发射峰红移并产生荧光猝灭。此外,陈化过程影响了谷蛋白与淀粉的消化性能。随着复合物中淀粉含量的增加,谷蛋白的消化率降低速率增大,与此对应,谷蛋白比例增加也使淀粉的消化率明显降低,这可能是陈化过程中谷蛋白和淀粉相互渗透、逐步缔合导致的。本研究探讨了陈化过程中淀粉和谷蛋白的相互作用,可为进一步阐析大米陈化机理提供依据。
[1]Soponronnarit S,Chiawwet M,Prachayawarakorn S,et al.Comparative study of physicochemical properties of accelerated and naturally aged rice[J].Journal of Food Engineering,2008,85 (2):268-276.
[2]Katekhong W,Charoenrein S.The effect of rice aging on the freeze-thaw stability of rice flour gels[J].Carbohydrate Polymers,2012,89(3):777-782.
[3]钱海峰,陈玉铭.大米陈化过程中淀粉性质变化研究[J].粮食与饲料工业,2001(11):12-14.
[4]Chrastil J,Zarins Z.Influence of storage on peptide subunit composition of rice oryzenin[J].Journal of Agricultural and Food Chemistry,1992,40(6):927-930.
[5]Zhou Z,Robards K,Helliwell S,et al.Effect of rice storage on pasting properties of rice flour[J].Food Research International,2003,36(6):625-634.
[6]Shanthilal J,Anandharamakrishnan C.Computational and numerical modeling of rice hydration and dehydration:A review [J].Trends in Food Science&Technology,2013,31(2):100-117.
[7]Hamaker B R,Griffin V K.Changing the viscoelastic properties of cooked rice through protein disruption[J].Cereal Chemistry,1990,67(3):261-264.
[8]Hamaker B R,Griffin V K.Effect of disulfide bond-containing protein on rice starch gelatinization and pasting[J].Cereal Chemistry,1993,70(4):377-380.
[9]Likitwattanasade T,Hongsprabhas P.Effect of storage proteins on pasting properties and microstructure of Thai rice[J].Food Research International,2010,43(5):1402-1409.
[10]王孝平,邢树礼.考马斯亮蓝法测定蛋白含量的研究[J].天津化工,2009,23(3):40-42.
[11]涂宗财.蛋白质动态超高压微射流改性研究及机理初探[D].南昌:南昌大学,2007.
[12]Pérez O E,David-Birman T,Kesselman E,et al.Milk protein vitamin interactions:Formation of beta-lactoglobulin/folic acid nano-complexes and their impact on in vitro gastro-duodenal proteolysis[J].Food Hydrocolloids,2014(38):40-47.
[13]卢薇,王金梅,杨晓泉.烹制工艺对米饭品质及体外消化特性的影响[J].现代食品科技,2013,29(2):264-268.
[14]邱明发,金铁成,周瑞芳,等.米谷蛋白与淀粉组分在大米陈化过程中的变化[J].中国粮油学报,1998,13(1):12-15.
[15]高瑀珑,鞠兴荣,姚明兰,等.稻米储藏期间陈化机制研究[J].食品科学,2008,29(4):470-473.
[16]卢薇,夏宁,王金梅,等.大米谷蛋白对大米淀粉理化特性的影响[J].现代食品科技,2012,28(12):1632-1635.
[17]Liu W,Zhang Z Q,Liu C M,et al.The effect of dynamic high-pressure microfluidization on the activity,stability and conformation of trypsin[J].Food Chemistry,2010,123(3):616-621.
[18]Balny C,Masson P.Effects of high pressure on proteins[J].Food Reviews International,1993,9(4):611-628.
[19]Chrastil J.Correlations between the physicochemical and functional properties of rice[J].Journal of agricultural and food chemistry,1992,40(9):1683-1686.
[20]李彤,吴晓娟,吴伟,等.陈化对籼米米谷蛋白功能特性影响[J].粮食与油脂,2013,26(7):22-24.
[21]赵学伟,卞科,王金水,等.蛋白质与淀粉的相互作用对陈化大米质构特性的影响[J].郑州粮食学院学报,1998,19(3):25-31.
[22]刘伟,谢明勇,钟业俊,等.低压段DHPM作用对木瓜蛋白酶结构影响的荧光光谱分析[J].光谱学与光谱分析,2010,30 (2):387-390.
[23]唐为民,呼玉山.稻米陈化对品质的影响及陈化机理[J].中国食物与营养,2004(4):9-12.
[24]张慧,洪雁,顾正彪,等.3种谷物全粉中淀粉的消化性及影响因素[J].食品与发酵工业,2012,38(11):26-31.
[25]Yang N,Liu Y,Ashton J,et al.Phase behaviour and in vitro hydrolysis of wheat starch in mixture with whey protein[J].Food chemistry,2013,137(1):76-82.
[26]王月慧,丁文平.大米淀粉凝胶储藏过程中消化特性的变化[J].食品科学,2005,26(1):64-66.
Interaction between rice starch and glutelin during aging
LIU Cheng-mei,XU Meng-han,ZHONG Ye-jun*,YANG Xiao-hui
(The National Key Laboratory of Food Science,Nanchang University,Nanchang 330047,China)
Fluorescence spectroscopy and UV spectrum were used in this study to elucidate the mechanism of rice aging.Investigated.interactions between rice starch and glutelin,and the impacts of their interaction on solubility,foaming property and digestibility.The results showed that solubility and foaming property of glutelin were gradually reduced during aging,and the reduced rate was growing with the addition of starch.UV spectrum and Fluorescence spectroscopy analysis showed that the addition of starch affected the tertiary structure of glutelin during aging,and microenvironment around tryptophan and tyrosine residues were changed.Glutelin and starch was associated tightly during aging which further caused red-shift of fluorescence emission peaks and fluorescence quenching.Besides,the digestibility of glutelin and starch were also decreased.With increasing of the content of starch,the reduced rate of digestibility of glutelin was increased,correspondingly,the increased proportion of glutelin also caused the drop of starch digestibility.
rice starch;glutelin;aging;interaction
TS201.1
A
1002-0306(2016)02-0156-05
10.13386/j.issn1002-0306.2016.02.023
2015-06-15
刘成梅(1963-),男,博士,教授,主要从事食品资源利用及开发方面的研究,E-mail:liuchengmei@aliyun.com。
*通讯作者:钟业俊(1982-),男,博士,副教授,主要从事农产品资源的开发与利用方面的研究,E-mail:zhongyejun@126.com。
“十二五”国家科技支撑计划(2012BAD37B02-02)与农业部热带作物产品加工重点实验室开放基金(KLTCPP-201404)共同资助。
