盐藻β-胡萝卜素微波提取工艺研究
2016-09-12孙协军薛晓霞李秀霞毕海燕潘龙飞刘羽纯
孙协军,薛晓霞,李秀霞,毕海燕,潘龙飞,刘羽纯
(渤海大学食品科学与工程学院,辽宁锦州 121013)
盐藻β-胡萝卜素微波提取工艺研究
孙协军,薛晓霞,李秀霞*,毕海燕,潘龙飞,刘羽纯
(渤海大学食品科学与工程学院,辽宁锦州 121013)
建立了一种从盐藻粉中快速提取β-胡萝卜素的微波辅助提取方法,考察了不同溶剂、液固比、温度、时间和搅拌速率对提取效率的影响,同时比较了最佳提取条件下(微波提取、超声波提取和传统溶剂浸提)盐藻β-胡萝卜素的提取效率。优化后的微波提取工艺条件为:乙酸乙酯为溶剂,微波功率500 W,液固比232 mL/g,提取温度42 ℃,萃取时间7.0 min,搅拌转速180 r/min,在优化条件下,盐藻β-胡萝卜素的得率为1.03%;与传统的溶剂浸提方法相比,微波提取和超声波提取都有效的提高了盐藻β-胡萝卜素的提取效率,且超声波提取的效率最高。
盐藻,β-胡萝卜素,乙酸乙酯,微波提取
盐藻,即盐生杜氏藻(DunalselalSalina),为绿色单细胞藻,形态微小,没有细胞壁,盐藻细胞中富含甘油和β-胡萝卜素等脂溶性活性成分,是国际上公认的天然β-胡萝卜素来源。β-胡萝卜素具有良好的营养和保健功能,从盐藻中提取β-胡萝卜素作为食品添加剂或化妆品原料等,具有重要的意义。溶剂浸提法是提取盐藻中β-胡萝卜素的传统方法,而超声波震荡、离心分离技术及超临界二氧化碳萃取等新技术能提高β-胡萝卜素的提取效率[1-3],微波萃取技术的本质是微波对萃取溶剂和物料的内加热作用,用在非热敏性活性成分的提取实验中有助于提高提取效率,Garofuli? et al.(2013)报道微波辅助提取技术提高了樱桃中多酚的提取效率,且微波提取具有短时高效、有机溶剂用量少的优点[4]。但是微波的热效应可能会引起原料中热敏性成分的降解,Hiranvarachat et al.(2013)报道持续功率的微波加热提取条件下,胡萝卜中类胡萝卜素的提取效率低于索氏抽提法[5]。因此,单纯控制微波功率的微波提取法在类胡萝卜素微波辅助提取中是有很大局限的。因此,在本实验中,采用了一种控温微波加热方法来提取盐藻β-胡萝卜素,并比较了不同方法(微波提取、超声波提取和溶剂浸提法)的提取效率,为微波技术在热敏性成分提取的应用上奠定基础。
1 材料与方法
1. 1材料与仪器
盐藻粉大连丰源达饵料有限公司生产;β-胡萝卜素标准品(纯度≥98%)上海源叶生物科技有限公司;色谱级甲醇和丙酮天津大茂化学试剂厂;其他试剂均为分析纯。
P680型高效液相色谱仪(配DAD检测器)美国戴安公司;ETHOS T微波消解/提取系统意大利Milestone公司;S-4800型场发射扫描电镜日本日立公司;SCIENTZ-ⅡD 超声波破碎仪宁波新芝生物科技股份有限公司;PS02-AD-DI超纯水机上海讯辉环保科技有限公司。
1.2实验方法
1.2.1液相色谱检测条件Develosil C30色谱柱;甲醇∶丙酮(30/70;v/v)为流动相;流速1.0 mL/min;柱温25 ℃;检测波长:452 nm;进样量:20 μL。
1.2.2标准曲线的绘制准确称取β-胡萝卜素标准品4.8 mg,丙酮溶解并定容至25 mL,配制成β-胡萝卜素浓度为192 μg/mL的标准储备液,再分别稀释至β-胡萝卜素浓度为192、153.6、115.2、76.8、38.4和19.2 μg/mL的系列标准使用溶液。
1.2.3盐藻β-胡萝卜素提取方法
1.2.3.1微波辅助提取(MAE)(1)MAE提取方法:准确称取一定量盐藻粉于微波样品罐中,按实验设计加入一定量的提取溶液,设定合适的提取温度、搅拌速度,风冷时间为10 min,在不同的微波功率下提取一定时间,到设定风冷时间结束后,取出样品罐,将提取液减压抽滤,用等体积的提取溶剂洗涤抽滤瓶中滤渣,所得滤液在50 ℃旋转蒸发掉大部分溶剂后,乙酸乙酯溶解并定容至50 mL,0.45 μm膜过滤后,HPLC检测其β-胡萝卜素浓度。盐藻β-胡萝卜素得率定义为盐藻β-胡萝卜素质量和样品质量的比值。
(2)微波加热曲线的制作:按实验方案精确称取2份质量为2 g盐藻粉,置于微波样品内罐中,按液固比为10 mL/g加入相同的提取溶剂,同时放入搅拌子,将内罐置于制样外罐中,拧紧压盖,将全部样品罐放入微波提取系统中,主控罐接上温度和压力传感器,关闭微波炉门。微波输出功率设定为600 W、提取温度60 ℃、提取时间3 min、搅拌速度100 r/min和风冷时间10 min,开启微波提取系统。每2 s记录一次温度传感器的温度,绘制时间-温度曲线。
1.2.3.2溶剂浸提方法(SME)参照孙协军等[6]报道的盐藻β-胡萝卜素提取方法进行,称取一定质量的盐藻粉于具塞锥形瓶中,按液固比为200 mL/g加入体积分数为95%的乙醇溶液为提取溶剂,置于恒温磁力搅拌器上,溶液温度调节到25 ℃后,搅拌提取42 min,减压抽滤,用等体积的提取溶剂洗涤抽滤瓶中滤渣,所得滤液在50 ℃旋转蒸发掉大部分溶剂后,乙酸乙酯溶解并定容至50 mL,0.45 μm膜过滤后,HPLC检测其β-胡萝卜素浓度。
1.2.3.3超声波辅助提取(UAE)参照孙协军等(2015)报道的超声波辅助提取盐藻β-胡萝卜素的优化工艺条件进行[7],准确称取一定量盐藻粉,置于100 mL玻璃烧杯中,按照液固比为500 mL/g的比例向烧杯中加入无水乙醇为提取溶剂,设定超声波破碎仪功率为500 W,探头置于液面下1.5 cm处,超声2 s/间歇2 s,超声7 min,提取后的混合液减压抽滤,等体积的提取溶剂洗涤抽滤瓶中滤渣,所得滤液在50 ℃旋转蒸发掉大部分溶剂后,乙酸乙酯溶解并定容至50 mL,0.45 μm膜过滤后,HPLC检测其β-胡萝卜素浓度。
1.2.4微波辅助提取的正交实验依据design-expert 8.0进行响应面实验设计,以β-胡萝卜素得率为考察指标,以液固比(X1)、提取温度(X2)、提取时间(X3)和搅拌速度(X4)为自变量,共设立20个处理组,具体实验设计见表1。

表1 盐藻β-胡萝卜素微波提取的响应面实验设计
2 结果与分析
2.1β-胡萝卜素标准曲线的制作
将配好的β-胡萝卜素标准溶液依次进样,标准溶液的色谱图如图1所示,反式β-胡萝卜素保留时间为15.150 min,最大吸收波长为453.1 nm。以峰面积(mAU·min)为横坐标,β-胡萝卜素浓度平均值(μg/mL)为纵坐标,得到一条标准曲线,标准曲线的回归方程为:Y=0.3815X-0.7905,R2=0.9991,其中Y为β-胡萝卜素浓度(μg/mL),X为峰面积(mAU·min),回归方程的线性范围为19.2~192 μg/mL。

图1 β-胡萝卜素标准品溶液的色谱图Fig.1 Chromatogram of β-carotene standard
盐藻β-胡萝卜素提取液色谱图见图2所示,图2中的光谱扫描图为色谱峰3的,根据保留时间和DAD检测器光谱扫描信息,确认保留时间为15.175 min色谱峰3为反式β-胡萝卜素,此时,样品溶液中β-胡萝卜素最大吸收波长为451.9 nm。

图2 盐藻β-胡萝卜素提取液的色谱图Fig.2 Chromatogram of β-carotene extract from D. salina
2.2微波加热曲线的制作
不同提取溶剂的微波升温曲线如图3所示。在提取温度低于58 ℃时,β-胡萝卜素提取效率随着温度升高而增加[4],而在高于60 ℃提取温度下,β-胡萝卜素提取率随时间延长而降低[5],因此,微波曲线的溶剂温度设定为60 ℃。不同溶剂的升温曲线见图3所示,由图3可知,在设定功率下,不同浸提剂对微波的吸收能力及将微波能转化为热能的能力不同。β-胡萝卜素在所选溶剂中的溶解度顺序从高到低为:石油醚>正己烷>乙酸乙酯>丙酮>乙醇[8],β-胡萝卜素在乙醇中的溶解度仅为其在乙酸乙酯中溶解度的1/2左右,但实际提取效率却相差无几[9]。可见,提取效率的高低受许多因素的影响,在提取溶剂的选择中,溶解度并不是决定因素。在本实验中,虽然β-胡萝卜素在正己烷和石油醚中溶解度最高,但由于这2种溶剂吸收微波能的能力很弱,因而温度升高幅度很小,在3 min内也没有升高指定温度,不适合用作微波提取的溶剂。

图3 不同溶剂的升温曲线Fig.3 Temperature curve of different solvents
在选择微波提取溶剂时,除考虑它对目标提取物有较强的溶解能力外,必须考虑两个参数:介电常数,ε′(描述分子在电场的极化率),和介电损失因子ε″(量度所吸收的微波能转换为热能的效率)。耗散因子:tanδ=ε″/ε′表示一种介质在一定的频率和温度下,将所吸收的微波能量转换为热能的效率[10]。据此应选择一个具有高的ε′值和tan δ值的溶剂。表2为乙醇、乙酸乙酯和丙酮的物理常数[11],从表1中可以看出,丙酮的介电常数(20.7)大于乙醇(7.0)和乙酸乙酯的介电常数(6.02),丙酮吸收微波的能力大于乙醇和乙酸乙酯吸收微波的能力,再加上丙酮的黏度也比较小,有利于溶剂分子的转动,使基体内部很快就能达到设定温度,所以升温速率较快。但丙酮(11.5)的介电损失因子同样大于乙醇(1.6)和乙酸乙酯(3.2),最终,这三种溶剂将吸收的微波能转化为热能的效率基本一致。从图3中可以看出,乙醇和丙酮这2种溶剂获得微波热后的升温速率和降温速率都比较快,难以维持在一个恒定的提取温度,而乙酸乙酯虽然升温速率较慢,但对热量的保持能力高于乙醇和丙酮,鉴于β-胡萝卜素对高热敏感,对提取温度的控制要求较高,因此,本实验中选择乙酸乙酯为提取溶剂进行盐藻β-胡萝卜素的微波提取研究。

表2 乙醇、丙酮和乙酸乙酯的物理常数
2.3不同功率下乙酸乙酯的微波加热曲线
由于乙酸乙酯的升温速率较慢,需要了解在不同功率下,乙酸乙酯达到提取温度所需的时间,以便设定升温程序。按2.2方法制作不同微波功率下的加热曲线,限定温度为60 ℃,结果见图2所示。由图2可知,随微波功率的增大,乙酸乙酯升温速率加快。在90 s时间内,微波功率为300 W时,乙酸乙酯溶液温度刚好达到60 ℃,而微波功率为500 W时,乙酸乙酯的升温在1 min内即可完成,因此,在用乙酸乙酯为溶剂进行对热不稳定物质的微波萃取时,微波功率设置在500 W以上较为合适。
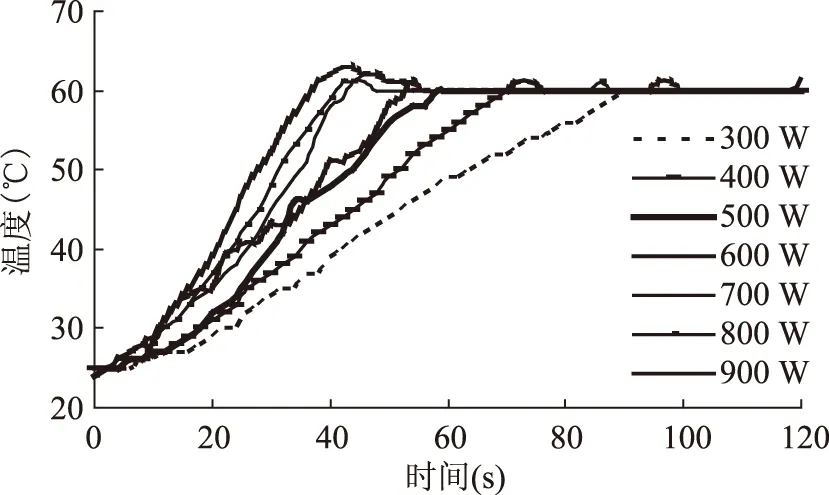
图4 乙酸乙酯的升温曲线Fig.4 Temperature curve of ethyl acetate
2.4微波提取盐藻β-胡萝卜素响应面实验
2.4.1实验设计及结果分析通过预实验,发现微波功率(≥500 W)和提取次数对盐藻β-胡萝卜素得率影响不大,因此固定功率为500 W,提取次数确定为1次,选取液固比(X1)、浸提温度(X2)、浸提时间(X3)和搅拌速度(X4)进行四因素三水平的响应面实验,实验设计及结果分析见表3。

表3 提取正交实验结果及分析
用design expert7.0软件对实验结果进行回归分析,去掉不显著项后,得到盐藻β-胡萝卜素得率的回归方程如下:Y=1.040+0.016X1+0.026X2-0.011X3+0.032X4-0.017X1X4-0.036X2X2-0.011X4X4
回归方程的显著性检验与方差分析结果见表4,以乙酸乙酯作为溶剂微波提取盐藻β-胡萝卜素的回归方程检验结果如下:模型的F值极显著(p<0.01),而失拟的F值不显著(p>0.05),回归方程的复相关指数R2=91.44%,说明回归方程适合用于乙酸乙酯作为溶剂微波辅助提取盐藻β-胡萝卜素的理论预测。在所选的各因素水平范围内,液固比和搅拌速度之间存在交互作用(p<0.05),4个考查因素对盐藻中β-胡萝卜素得率的影响排序为:搅拌速度>提取温度>液固比>提取时间。
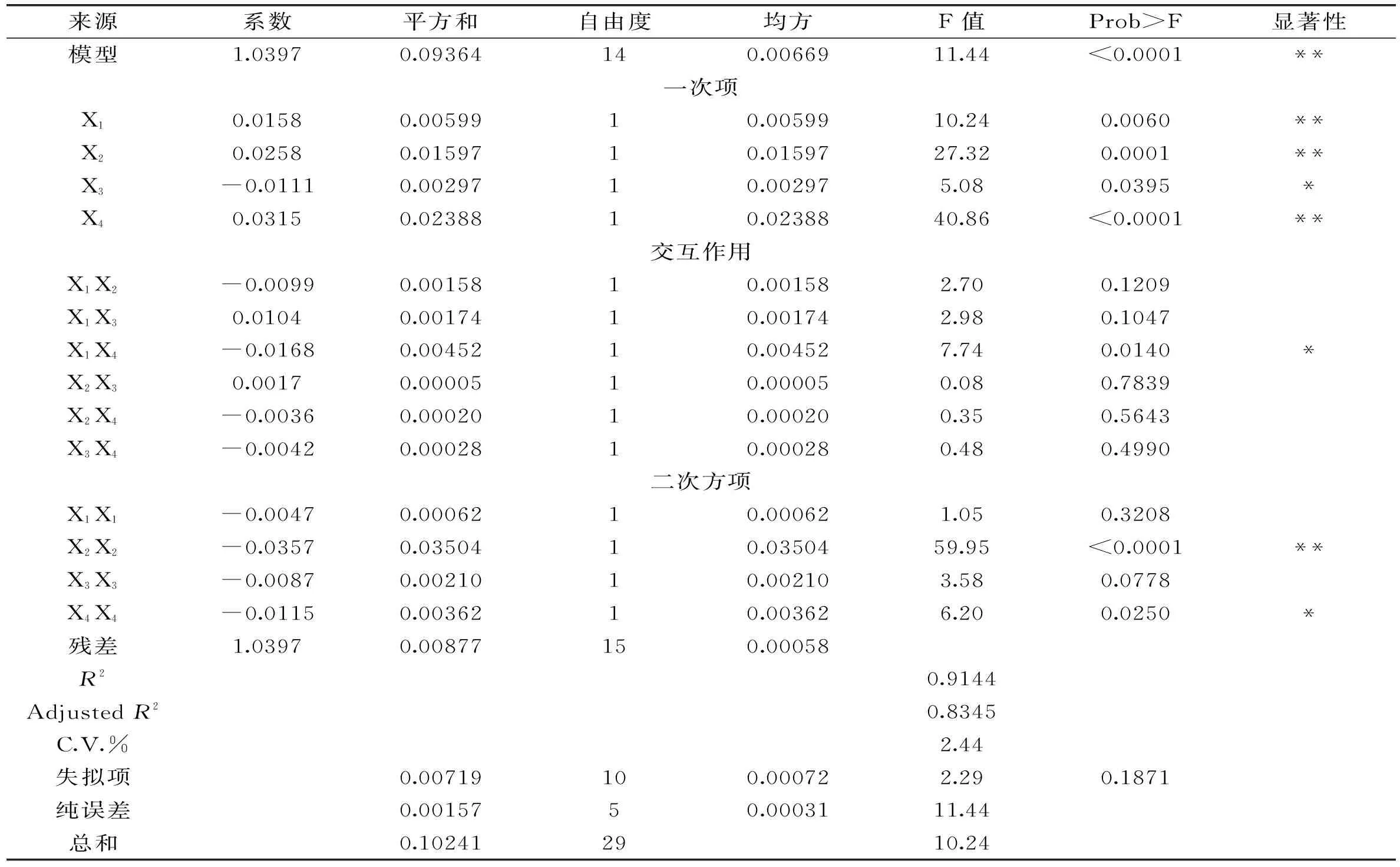
表4 方差分析结果
注:* Prob>F小于0.05,模型或考察因素影响显著;** Prob>F小于0.01,模型或考察因素影响极显著。

表5 不同提取方法(MAE、UAE、SME)盐藻β-胡萝卜素提取效率的比较
注:同列字母完全不同为差异显著(p<0.05)。
2.4.2最优提取工艺参数的优化通过软件的寻优分析,得到最佳工艺参数为:液固比231.5 mL/g,提取温度41.6 ℃,提取时间6.9 min,搅拌速度179.7 r/min。根据实验具体情况调整为:液固比232 mL/g,提取温度42 ℃,提取时间7 min,搅拌速度180 r/min。盐藻β-胡萝卜素得率预测值为1.07%。在优化工艺条件下微波提取盐藻β-胡萝卜素,其得率为1.03%,与预测值的相对误差为3.7%。
2.5不同提取方法的比较
对不同提取方法(MAE、UAE、SME)的提取条件(溶剂、温度、时间等)和盐藻β-胡萝卜素得率进行了比较,其中SME和UAE[7]的提取条件是前期实验的优化结果,不同提取方法最优条件下的提取效率见表5,从表5可知,超声波辅助提取和微波辅助提取方法均缩短了盐藻β-胡萝卜素的提取时间且提高了提取效率(p<0.05),而超声波辅助提取方法的提取效率(得率为1.37%±0.12%)显著高于微波辅助提取方法(得率为1.03%±0.10%)(p<0.05)。这与β-胡萝卜素是热敏性物质有关,微波提取的优点在于短时高热,据报道,当新鲜橙汁的温度保持在70 ℃或80 ℃1 min,β-胡萝卜素含量分别降低了54%和34%[12]。而在本实验中,在42 ℃的提取温度下保持7 min后,盐藻β-胡萝卜素得率(1.03%±0.10%)显著高于溶剂浸提法(室温提取40 min,得率为0.40%±0.05%)。为了解释这一现象,对不同提取方法得到的盐藻残渣进行了扫描电镜分析,结果见图5,由图5A可见,没有经过任何处理的盐藻细胞膜表面光滑完整,而从图5B、图5C和图5D可见,在经过不同提取方法处理后,盐藻残渣细胞表面完整性被破坏,经过微波和超声波处理后的盐藻细胞明显膨大,这主要是因为细胞膜破坏后,疏水性增加,细胞出现叠加和聚集[13]。而β-胡萝卜素位于盐藻细胞内的杯状色素体中,超声波和微波对于细胞整体结构的破坏更利于β-胡萝卜素的溶出[14],因此,与传统的溶剂浸提法相比,超声波和微波辅助提取方法更有利于盐藻β-胡萝卜素提取效率的提高,与热效应为主的微波辅助提取方法相比,超声波辅助提取无疑是最有利于盐藻β-胡萝卜素的提取方法。

图5 不同提取方法所得盐藻残渣的扫描电镜图。Fig.5 Scanning electron micrographs of D. salina residuesin the extraction after different treatment(A)未处理;(B)溶剂浸提法;(C)微波辅助提取;(D)超声波辅助提取。
3 结论
对微波辅助提取盐藻β-胡萝卜素工艺进行了研究,建立了微波辅助提取盐藻β-胡萝卜素的数学模型为Y=1.040+0.016X1+0.026X2-0.011X3+0.032X4-0.017X1X4-0.036X2X2-0.011X4X4。各因素对β-胡萝卜素得率影响的主次顺序为:搅拌速度>提取温度>液固比>提取时间,采用design-expert8.0对提取工艺参数进行优化,得到优化结果为:液固比232 mL/g,浸提温度42 ℃,浸提时间7 min,搅拌速度180 r/min,在该条件下,模型预测的单位盐藻粉微波辅助提取后β-胡萝卜素得率为1.07%,对优化的条件进行了验证,得到结果为1.03%±0.10%,相对误差很小,说明回归方程的预测精度较高,优化结果可信。对不同提取方法的盐藻β-胡萝卜素提取效率进行了比较,结果发现,与传统溶剂浸提法相比,微波辅助提取和超声波辅助提取都提高了盐藻β-胡萝卜素的提取效率,扫描电镜分析结果表明,超声波和微波辅助技术破坏了盐藻细胞的完整性,更利于细胞内部生物活性组分的溶出,提高了提取效率,相比于微波辅助提取方法,超声波辅助提取法对盐藻β-胡萝卜素的提取效率更高。
[1]Dey,S. and Rathod,V.K. Ultrasound assisted extraction ofβ-carotene from Spirulina latensis[J]. Ultrasonics Sonochemistry. 2013,20(1):271-276.
[2]Kha,T.C.,Phan-Tai,H.,and Nguyen,M.H. Effects of pre-treatments on the yield and carotenoid content of Gac oil using supercritical carbon dioxide extraction[J]. Journal of Food Engineering. 2014,120:44-49.
[3]Marchal,L.,Mojaat-Guemir,M.,Foucault,A.,and Pruvost,J. Centrifugal partition extraction ofβ-carotene from Dunaliella salina for efficient and biocompatible recovery of metabolites[J]. Bioresource Technology. 2013,134:396-400.
Marasca(Prunus cerasus var. Marasca)[J]. Journal of Food Engineering. 2013,117(4):437-442.
[5]Hiranvarachat,B.,Devahastin,S.,Chiewchan,N.,and Raghavan,G.S.V. Structural modification by different pretreatment methods to enhance microwave assisted extraction ofβ-carotene from carrots[J]. Journal of Food Engineering. 2013,115(2):190-197.
[6]孙协军,李秀霞,励建荣,李娇,田鑫,陶秀春. 杜氏盐藻β-胡萝卜素提取皂化工艺参数优化[J]. 中国食品学报. 2014,14(11):90-95.
[7]孙协军,李佳伟,李秀霞,毕海燕,薛晓霞. 响应面法优化盐藻β-胡萝卜素超声波提取工艺[J]. 食品工业科技. 2015,36(12):278-290.
[8]张爱,赵波,王正武. 基于量子化学计算的β-胡萝卜素溶解性能的QSPR研究[J]. 食品科学. 2007,28(9):68-71.
[9]赵永彬,尹明安. 不同溶剂对胡萝卜中类胡萝卜素提取的影响[J]. 安徽农业科学. 2005,33(4):671,673.
[10]Hiranvarachat,B. and Devahastin,S. Enhancement of microwave-assisted extraction via intermittent radiation:Extraction of carotenoids from carrot peels[J]. Journal of Food Engineering. 2014,126:17-26.
[11]李核,李攻科,张展霞. 影响微波辅助萃取虎杖中白藜芦醇产率的一些重要操作参数[J]. 分析化学. 2003,31(11):1341-1344.
[12]Fratianni,A.,Cinquanta,L.,& Panfili,G. Degradation of carotenoids in orange juice during microwave heating[J]. Food Science and Technology. 2010,43(6):867-871.
[13]Zhang,B.,Yang,R.,and Liu,C. Microwave-assisted extraction of chlorogenic acid from flower buds of Lonicera japonica Thunb[J]. Separation and Purification Technology. 2008,62(2):480-483.
[14]Pasqueta,V.,Che'rouvriera,J.R.,Farhata,F.,Thiéry,V.,Piot,J.M.,Bérard,J.B.,Kaas,R.,Serive,B.,Patrice,T.,Cadoret,J.P.,and Picot,L. Study on the microalgal pigments extraction process:Performance of microwave assisted extraction[J]. Process Biochemistry. 2011,46(1):59-67.
Study on microwave-assisted extraction technology ofβ-carotenoid fromDunaliellasalina
SUN Xie-jun,XUE Xiao-xia*,Li XIU-xia,BI Hai-yan,PAN Long-fei,LIU Yu-chun
(College of Food Science and Technology,Bohai University,Jinzhou 121013,China)
A quickly microwave-assisted extraction method was built forβ-carotene extraction fromDunaliellasalina,different solvents,ratio of liquid to solid,extracting time,extracting temperature,and stirring speed were investigated. The effect of microwave-assisted extraction method was compared with ultrasonic assisted extraction method,and conventional solvent maceration extraction method under optimal conditions,The optimized condition of microwave-assisted extraction method was that ethyl acetate was used as solvent,ratio of liquid to solid 232 mL/g,extracting temperature 42 ℃,extracting time 7.0 min,and stirring speed 180 r/min,β-carotene yield ofDunaliellasalinawas 1.03% when it was extracted under the optimal conditions. Compared to the conventional solvent maceration extraction method,theβ-carotene yield was improved significantly by microwave-assisted extraction method and ultrasonic assisted extraction method,respectively,and the maximumβ-carotene extraction efficiency was deserved by ultrasonic assisted extraction method.
Dunaliellasalina,β-carotene,Ethyl acetate,Microwave-assisted extraction
2015-06-03
孙协军(1969-),男,本科,实验师,研究方向:食品资源开发利用,E-mail:sunxj111@163.com。
李秀霞(1973-),女,博士,副教授,研究方向:水产品贮藏加工,E-mail:lixiuxiaxxx@163.com。
辽宁省食品安全重点实验室开放课题(LNSAKF2011015)。
TS219
A
1002-0306(2016)01-0000-00
10.13386/j.issn1002-0306.2016.01.000
