离子液体中酶催化合成硬脂酸淀粉酯及其流变学特性研究
2016-09-12代飞云汤晓智
卢 玥,代飞云,汤晓智
(南京财经大学食品科学与工程学院 江苏省现代粮食流通与安全协同创新中心江苏高校粮油质量安全控制及深加工重点实验室,南京 210023)
离子液体中酶催化合成硬脂酸淀粉酯及其流变学特性研究
卢玥,代飞云,汤晓智*
(南京财经大学食品科学与工程学院 江苏省现代粮食流通与安全协同创新中心江苏高校粮油质量安全控制及深加工重点实验室,南京 210023)
以1-丁基-3-甲基咪唑醋酸盐([BMIM]Ac)和1-丁基-3-甲基咪唑四氟硼酸盐([BMIM]BF4)的混合离子液体为介质,脂肪酶催化淀粉硬脂酸甲酯合成硬脂酸淀粉酯,并采用核磁共振(1H NMR)、X-射线衍射对其进行结构表征。通过快速黏度仪及动态流变仪分析了硬脂酸淀粉酯的流变学特性。结果表明:和原淀粉相比,硬脂酸淀粉酯的峰值黏度显著降低,并随着取代度的增大,黏度呈下降趋势;动态流变学测定结果显示酯化后的淀粉储能模量和损失模量比原淀粉显著下降(p<0.05);静态流变学测定结果显示淀粉(包括酯化淀粉)为非牛顿流体,出现了剪切稀化的现象,且取代度越高,黏度越低,表明长链硬脂酸基团的引入,削弱了淀粉分子之间氢键作用。
离子液体,脂肪酶,硬脂酸淀粉酯,动态流变学,静态流变学
淀粉来源丰富、价格低廉、易于生物降解并且具有一定的粘结性和成膜性,而被广泛应用于工业生产和人们日常生活中。但随着现代工业技术的发展以及一些特殊需求的出现,原淀粉由于其天然性能的缺陷已经无法满足其在工业中的应用,比如原淀粉糊化后稳定性差、易凝沉,成膜后拉伸强度和弯曲强度差、透水性高等[1]。
酯化是改变淀粉特性的最常用手段。硬脂酸淀粉酯是在淀粉的葡萄糖残基上引入长链硬脂酸基团,通常由淀粉及其衍生物与硬脂酸[2]、硬脂酸甲酯[3]、硬脂酸酰氯[4]、或硬脂酸酐[5]反应制得。因其具有特殊的疏水性、热塑性、乳化性和可生物降解性而被广泛应用于食品、材料、医药、化工等领域。
高级脂肪酸的直接酯化得到的产品通常取代度较低,淀粉在反应过程中还会有一定程度的降解[6]。高取代度的产品通常是在二甲亚砜、吡啶中与酸酐制得,然而所用到的有机溶剂和化学试剂均存在着毒性大、易挥发、操作性差等缺点。离子液体的出现带来了一个新的契机[7-8]。与传统的有机溶剂相比,“绿色溶剂”离子液体具有不挥发,溶解范围广,均相催化效率高,稳定性好等一系列优点。已有研究证明多种离子液体对淀粉有良好的溶解性[9-10],同时多种脂肪酶在离子液体中表现出强的催化活性[11-13]。

表1 不同脂肪酶添加量下硬脂酸淀粉酯的取代度
注:相同字母表示差异不显著,不同字母表示差异显著(p<0.05)。
本文以离子液体作为反应介质,脂肪酶催化大米淀粉与硬脂酸甲酯合成硬脂酸淀粉酯,采用核磁共振(1H NMR)及X-射线衍射对产品结构进行鉴定,研究硬脂酸淀粉酯的流变特性。
1 材料与方法
1.1材料与仪器
大米淀粉芜湖好亦快食品有限公司;褶皱假丝酵母脂肪酶(700 U/mg)Sigma-Aldrich;硬脂酸甲酯国药集团化学试剂有限公司;离子液体[BMIM]Ac、[BMIM]BF4上海成捷化学有限公司。
磁力搅拌器WSJB-03河南中良科学仪器有限公司;电热鼓风干燥箱101-3AS上海苏进仪器设备厂;核磁共振仪AVANCE 400瑞士Bruker公司;X-射线衍射分析仪D/max 2500/PC型日本理学公司;快速黏度仪(RVA)澳大利亚Newport Scientific仪器公司;动态流变仪Anton Paar MCR 302奥地利安东帕有限公司。
1.2实验方法
1.2.1不同取代度硬脂酸淀粉酯的合成取烘干的大米淀粉12 g加入到1-丁基-3-甲基咪唑醋酸盐(50 g)和1-丁基-3-甲基咪唑四氟硼酸盐(190 g)的混合离子液体中120 ℃恒温搅拌1 h;将溶解后的混合体系降温至60 ℃,加入硬脂酸甲酯和脂肪酶CRL,硬脂酸甲酯与淀粉(葡萄糖单元AGU)的摩尔比为3∶1,60 ℃下反应3 h;脂肪酶CRL的添加量分别为0、0.25、0.5、0.75、1 g,反应结束,待溶液冷却后加入无水乙醇洗涤、抽滤,重复3次,得到的沉淀物在40 ℃下干燥48 h。采用酸碱滴定法测定所得产物的取代度[14]。
1.2.2核磁共振谱分析(1H NMR)测试方法及条件将10 mg的样品溶于约0.5 mL DMSO-d6中,观测核:1H;观测频率为100 MHz,室温下扫描16次。
1.2.3X-射线衍射分析(XRD)测试方法及条件将待测样品在50 ℃下干燥12 h,取出冷却至室温。将样品装填到样品板上进行检测。X射线衍射测试条件为40 kV,40 mA,测量角度2θ范围为3°~60°,所用扫描步长为0.02°,扫描速度为17.7 s/步。
1.2.4硬脂酸淀粉酯RVA糊化特性的测定RVA所用条件为:取3.5 g样品,加蒸馏水25 mL,在50 ℃下保温1 min,后以6 ℃/min的速度升温至95 ℃,保温5 min,再以6 ℃/min的速度降至50 ℃,保温2 min。前10 s内搅拌速率为960 r/min,而后以160 r/min搅拌速率进行黏度测试。
1.2.5硬脂酸淀粉酯流变学测定
1.2.5.1动态流变学测定将上述RVA制备的淀粉糊置于流变仪上,平板直径5 cm,设置间隙0.5 mm,测定温度25 ℃,扫描应变1%,频率扫描范围为1~100 rad/s(0.1~10 Hz)。记录样品的储能模量和损失模量随角频率的变化曲线。
1.2.5.2静态流变学测定将上述测定RVA制备的淀粉糊置于流变仪上,平板直径5 cm,设置间隙0.5 mm,测定温度25 ℃,测定剪切速率0~300 s-1范围内样品黏度的变化。记录样品黏度随剪切速率的变化曲线。
2 结果与分析
2.1硬脂酸淀粉酯的合成
通过改变脂肪酶用量,合成得到了不同取代度的硬脂酸淀粉酯,如表1所示。
2.2核磁共振谱分析
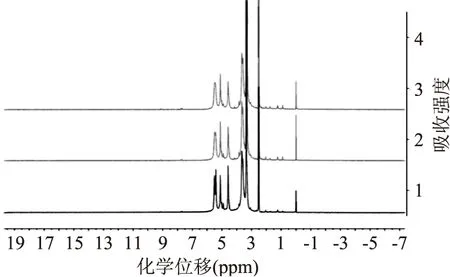
图1 原淀粉和硬脂酸淀粉酯1H NMR谱图Fig.1 1H NMR spectra of raw starch and starch stearate注:从下往上依次为原淀粉、取代度0.032、取代度0.076的硬脂酸淀粉酯。
图1为原淀粉和硬脂酸淀粉酯的1H NMR谱图,其中选择具有代表性的中间取代度(0.032)和高取代度(0.076)的硬脂酸淀粉酯进行比较。图1中,2.5 ppm处为溶剂d6-DMSO的质子峰,3.34 ppm处为水的质子峰,而3.15、3.31、3.58、3.65 ppm处的质子峰分别对应淀粉葡萄糖残基AGU上的H-2,H-3,H-4,H-5,葡萄糖残基AGU上余下的H-1和OH-2,3,6质子峰分布在4.58~5.50 ppm之间[15]。与原淀粉相比,在硬脂酸淀粉酯的1H NMR谱图中,在0~2.4 ppm之间出现了四个增强的的质子峰,归属于酯化反应后淀粉链上引入的脂肪酰基上的氢原子,其中0.91 ppm对应的是脂肪酰基链上末端甲基的三个氢,2.04 ppm对应的是酰基链上与羰基相连的亚甲基氢,1.75 ppm对应的是紧随其后的亚甲基氢,1.24 ppm对应酰基链上剩余的氢[16]。随着硬脂酸淀粉酯取代度的增加,脂肪酰基所对应的质子峰的振动信号逐渐增强。1H NMR谱图的结果证明淀粉分子上成功接枝了硬脂酸酰基,合成了硬脂酸淀粉酯。
2.3X-射线衍射分析
如图2所示,原大米淀粉在衍射角2θ为15°、17°、18°和23°附近存在衍射峰,属于典型的A型结晶[17]。而取代度为0.032、0.076的硬脂酸淀粉酯的X射线-衍射曲线与原淀粉明显不同,上述2θ范围内的特征衍射峰消失或者明显降低,在13°、19°附近产生了弥散峰,峰强度较低,峰宽增大,表明改性后原淀粉的晶型结构遭到破坏,形成无定型结构。这种晶型结构的破坏可能是由于溶解过程中离子液体的影响[18-19]。
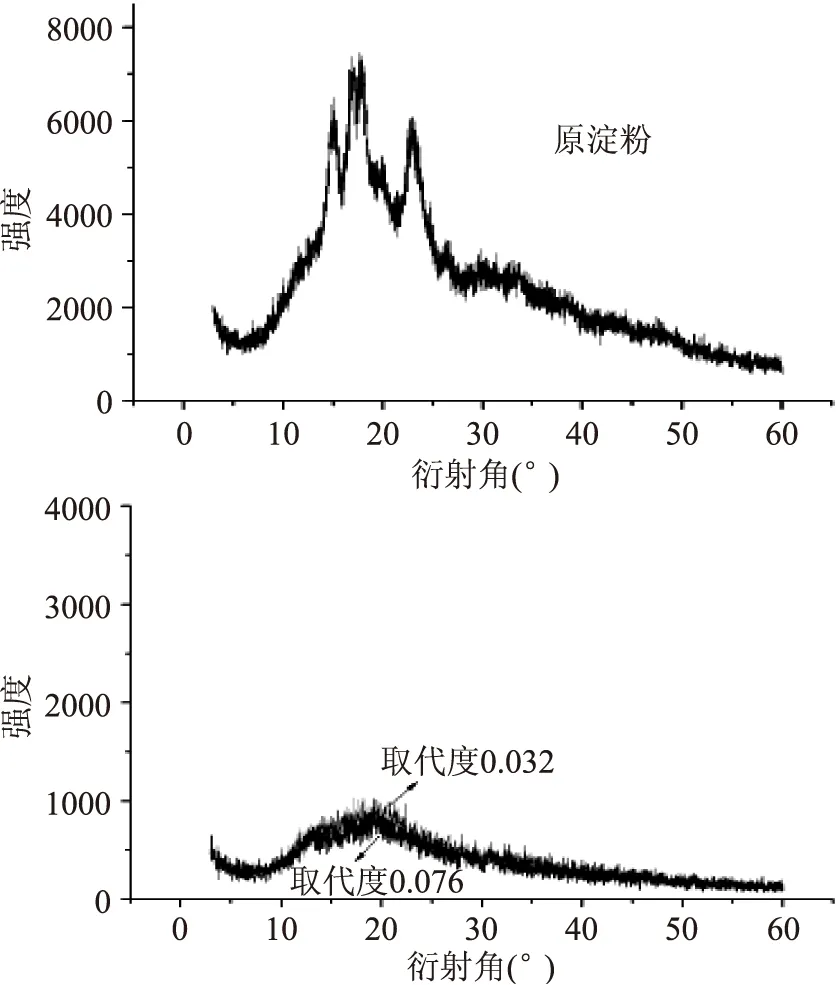
图2 原淀粉及硬脂酸淀粉酯的X射线衍射图Fig.2 X-ray diffraction pattern of raw starch and starch stearate
2.4硬脂酸淀粉酯RVA糊化特性
从图3可以看出,和原淀粉相比,硬脂酸淀粉酯的峰值黏度明显降低,并随着取代度的增大,黏度呈下降趋势。主要原因在于离子液体溶解以及酯化反应后原淀粉的结晶结构遭到破坏,硬脂酸基团的引入增强了疏水性,削弱了淀粉分子之间的氢键结合力,从而降低了其黏度。在糊化结束后,原淀粉由于回生现象而导致黏度增加,而硬脂酸淀粉酯黏度几乎保持不变,且最终粘度远远低于起始黏度,可能由于剪切稀化作用致使黏度下降。
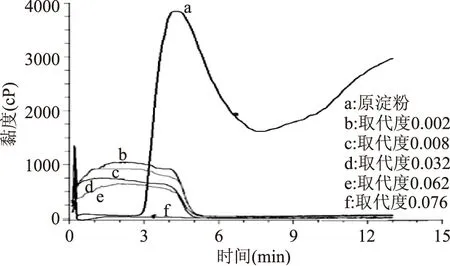
图3 原淀粉和不同取代度硬脂酸淀粉酯的RVA曲线图Fig.3 RVA curves of raw starch and starch stearate
2.5硬脂酸淀粉酯的流变学特性
2.5.1动态流变学特性储能模量(G′)与周期形变中能量的储存与释放有关,反映的是形变和应力同相位的部分,表征聚合物的弹性;损耗模量(G″)反映的是聚合物材料在形变过程中发生黏性流动而产生的内耗,反映了形变与应力相差90°的部分,表征聚合物的黏性。动态流变学测定结果如图4所示:
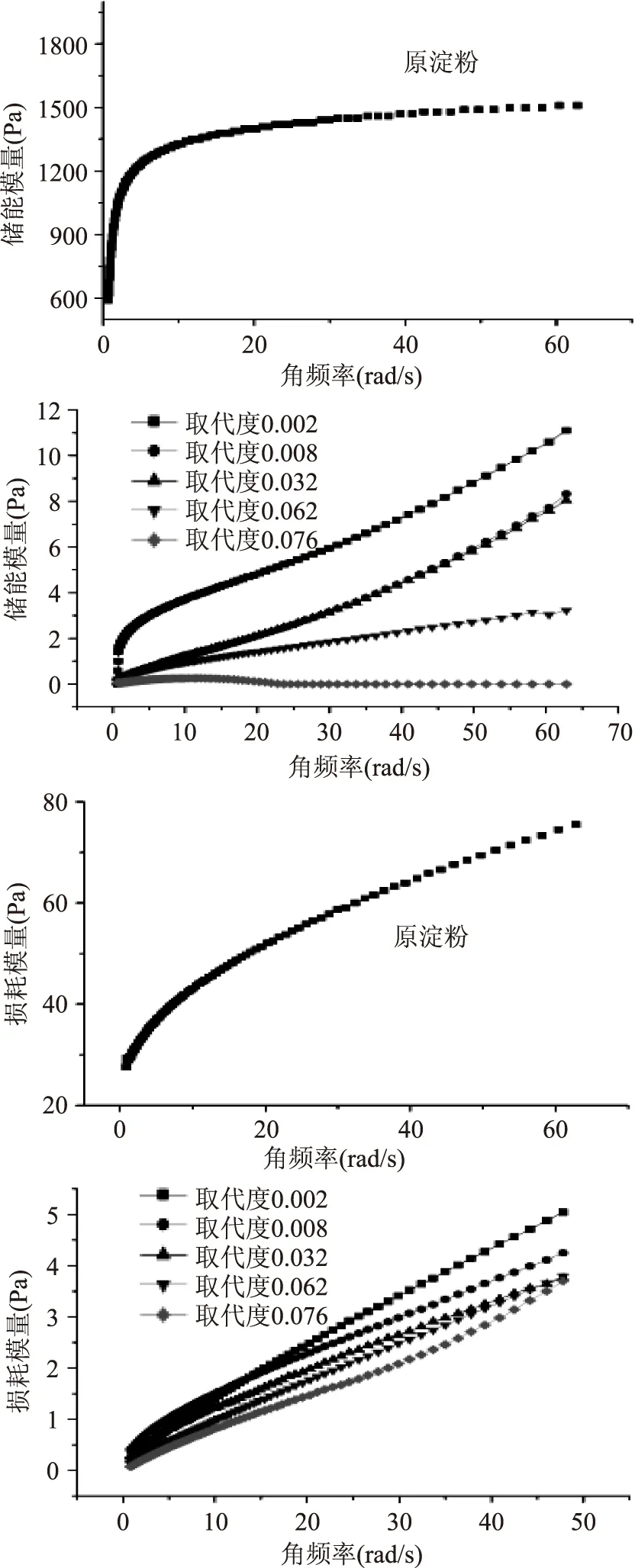
图4 原淀粉和不同取代度硬脂酸淀粉酯动态流变特性Fig.4 Dynamic rheological properties of raw starch and starch stearate注:a. 原淀粉储能模量;b. 硬脂酸淀粉酯储能模量;c. 原淀粉损失模量;d. 硬脂酸淀粉酯损失模量。
由图4比较可以看出,酯化后的淀粉储能模量相比原淀粉显著下降。且随着取代度的增大,硬脂酸淀粉酯储能模量呈下降趋势,可能是由于随着取代度的增大,淀粉分子上接入的长链硬脂酸基团增多,空间位阻增大,淀粉分子之间由于氢键形成的缔合作用减弱,所以形成的凝胶弹性较小,也反应了硬脂酸淀粉酯形成凝胶的能力较弱;酯化后的淀粉损失模量也比原淀粉明显下降。且随着取代度的增大,硬脂酸淀粉酯损失模量逐渐下降。一方面可能由于离子液体的溶解作用,淀粉的结晶结构遭到破坏,另一方面可能是由于长链脂肪酸基团的引入,酯化淀粉的疏水性增强淀粉分子间的氢键结合力变的松弛,表现为黏性降低。
2.5.2静态流变学特性从图5可以看出,原淀粉与硬脂酸淀粉酯均为非牛顿流体,表现出剪切稀化现象。当施加剪切力时,剪切作用使淀粉分子间的作用力减弱,其相互缠绕的网络结构被破坏。随着剪切速率的增大,分子结构重塑的速率要小于这种网络结构被破坏的速率导致分子对流动抵抗的能力减弱,从而使得表观黏度降低[20]。在同一剪切速率下,硬脂酸淀粉酯的黏度远远低于原淀粉,且取代度越高,黏度越低,这主要也归因于长链硬脂酸基团的引入,削弱了淀粉分子之间通过氢键结合的力,以致黏度降低。
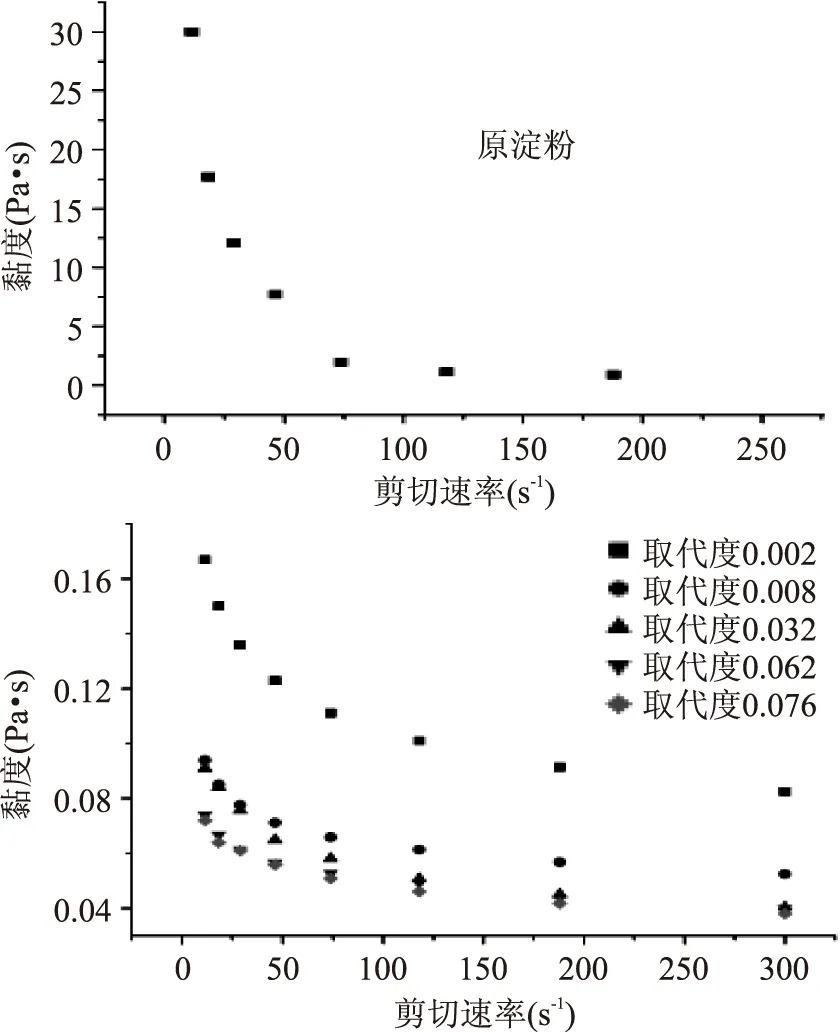
图5 原淀粉和不同取代度硬脂酸淀粉酯静态流变特性Fig.5 Static rheological properties of raw starch and starch stearate
3 结论
以1-丁基-3-甲基咪唑醋酸盐([BMIM]Ac)和1-丁基-3-甲基咪唑四氟硼酸盐([BMIM]BF4)的混合离子液体为介质,通过调节脂肪酶的添加量,合成了不同取代度的硬脂酸淀粉酯。和原淀粉相比,硬脂酸淀粉酯的峰值黏度显著降低,并随着取代度的增大,黏度呈下降趋势;动态流变学测定显示酯化后的淀粉储能模量和损失模量比原淀粉显著下降,且随着取代度的增大,硬脂酸淀粉酯储能模量和损失模量逐渐下降;静态流变学测定结果显示淀粉(包括变性淀粉)均为非牛顿流体,出现了剪切稀化的现象,且取代度越高,黏度越低,表明离子液体溶解以及酯化反应后,原淀粉的结晶结构遭到破坏,硬脂酸基团的引入增强了疏水性,削弱了淀粉分子之间的氢键结合力。
[1]Tang X Z,Alavi S,Herald T J. Barrier and mechanical properties of starch-clay nanocomposite films[J]. Cereal Chemistry,2008,85(3):433-439.
[2]Singh J,Singh N,Saxena S K. Effect of fatty acids on the rheological properties of corn and potato starch[J]. Journal of food engineering,2002,52(8):9-16.
[3]程发,张晓红. 淀粉硬脂酸酯的制备[J]. 天津大学学报,1995,28(6):814-819.
[4]Whister R L,Madson M A,Zhao J,et al. Surface derivatization of corn starch granules[J]. Cereal Chemistry,1998,75(1):72-74.
[5]Martin M T,Robert L B. Preparation of starch esters[J]. Journal of environmental polymer degradation 1996,4(2):85-89.
[6]刘凤茹. 挤压法制备硬脂酸玉米淀粉酯的工艺、性质及应用研究[D]. 无锡:江南大学,2009.
[7]Bonhote P,Dias A P,Papageorgiou N,et al. Hydrophobic,highly conductive ambient-temperature molten salts[J]. Inorganic Chemistry,1996,35(5):1168-1178.
[8]Endres F. Ionic liquids:solvents for the electrodeposition of metals and semiconductors[J]. ChemPhysChem,2002,3(2):144-154.
[9]Seoud E O A,Koschella A,Fidale L C,et al. Applications of ionic liquids in carbohydrate chemistry:a window of opportunities[J]. Biomacromolecules,2007(8):2629-2647.
[10]Liu Q B,Janssen M H A,Van R F,et al. Room-temperature ionic liquids that dissolve carbohydrates in high concentration[J].Green Chemistry,2005,7(1):39-42.
[11]Rantwijk F V,Lau R M,Sheldon R A. Biocatalytic transformations in ionic liquids[J]. Trends in Biotechnology,2003,21(3):131-138.
[12]夏咏梅,吴红平,张玥,等. 离子液体的制备及其在酶催化反应中的应用[J].化学进展,2006,18(12):1660-1667.
[13]Kragl U,Eckstein M,Kaftzik N. Enzyme catalysis in ionic liquids[J]. Current Opinion in Biotechnology,2002,13(6):565-571.
[14]Miladinov V D,Hanna M A. Physical and molecular properties of starch acetates extruded with water and ethanol[J]. Industrial&Engineering Chemistry Research,1999,38(10):3892-3897.
[15]Goheen S M,Wool R P. Degradation of polyethylene starch blends in soil[J]. Journal of Applied Polymer Science,1991,42(10):2691-2701.
[16]Namazi H,Fathi F,Dadkhah A. Hydrophobically modified starch using long-chain fatty acids for preparation of nanosized starch particles[J]. Iranian Journal of Science and Technology,2011,18(3):439-445.
[17]Zobel H F.Starch crystal transformation and their industrial importance[J]. Starch,1988,40(1):1-7.
[18]Biswas A,Shogren R L,Stevenson D G,et al. Ionic liquids as solvents for biopolymers:Acylation of starchand zein protein[J]. Carbohydrate Polymers,2006(66):546-550.
[19]Xie W L,Li S,Liu Y W. Synthesis of Starch Esters in Ionic Liquids[J]. Journal of Applied Polymer Science,2010,116(1):218-224.
[20]Yoo D,Yoo B. Rheology of rice starch-sucrose composites[J]. Starch,2005,57(6):254-261.
Lipase-catalyzed synthesis of starch stearate in ionic liquids and its rheological properties
LU Yue,DAI Fei-yun,TANG Xiao-zhi*
(College of Food Science and Engineering Collaborative Innovation Center for Modern Grain Circulation and Safety Key Laboratory of Grains and Oils Quality Control and Processing,Nanjing University of Finance and Economics,Nanjing 210023,China)
The synthesis of starch stearate with lipase in the mixed ionic liquids of[BMIM]Ac and[BMIM]BF4was investigated. The structure of the starch stearate was characterized by1H NMR and XRD and the rheological properties were studied by rapid viscosity analyzer(RVA)and dynamic rheometer. The results showed that the peak viscosity of starch stearate significantly decreased compared to raw starch. Dynamic rheology studies showed that the storage modulus and the loss modulus of starch significantly dropped after esterification. Static rheology studies showed that starch and modified starch were both non-Newtonian fluids,which exhibited shear thinning. With the increase of the degree of substitution,the viscosity decreased,indicating introduction of long chain stearic acid weakened the hydrogen bond forces between starch molecules.
ionic liquids;lipase;starch stearate;dynamic rheology;static rheology
2015-04-13
卢玥(1991-),女,硕士研究生,研究方向:粮油加工,E-mail:1528451833@qq.com。
汤晓智(1977- ),男,博士,教授,研究方向:粮油加工,E-mail:warmtxz@njue.edu.cn。
江苏省自然科学基金项目(BK2012471);江苏高校优秀科技创新团队(苏教科【2013】10号);江苏高校优势学科建设工程资助项目。
TS
A
1002-0306(2016)01-0000-00
10.13386/j.issn1002-0306.2016.01.000
