粪便微生物粗提液修复溃疡性结肠炎的研究
2016-09-12杜金城丁秀云于上富霍贵成
徐 敏,边 鑫,杜金城,丁秀云,于上富,霍贵成
(东北农业大学,乳品科学教育部重点实验室,黑龙江哈尔滨 150030)
粪便微生物粗提液修复溃疡性结肠炎的研究
徐敏,边鑫,杜金城,丁秀云,于上富,霍贵成*
(东北农业大学,乳品科学教育部重点实验室,黑龙江哈尔滨 150030)
研究了粪便微生物粗提液对溃疡性结肠炎修复作用的影响。将64只健康小鼠随机分为4组,即完全空白组(n=20)、肠炎空白组(n=20)、SASP(柳氮硫胺吡啶)组(n=12)和FMT(粪便微生物移植)组(n=12),处理组小鼠自由饮用3%葡聚糖硫酸钠盐(DSS)溶液8 d,建立溃疡性结肠炎(UC)模型,并于建模第8 d,解剖完全空白组、肠炎空白组小鼠各8 只,以验证UC模型是否建立成功。造模后,SASP组、FMT组同时分别给予柳氮硫胺吡啶片及鼠源粪便微生物提取液干预治疗4周,灌胃频率2 d/次,然后进行为期两周的后续观察,期间观察各组小鼠表观状态、体重变化,结肠组织长度变化,结肠组织病理学改变,并测定各组血清IL-1β、IL-6、TNF-α的浓度变化。结果表明:与肠炎空白组小鼠相比,粪便微生物移植疗法使小鼠血清IL-1β、IL-6、TNF-α水平显著降低(p<0.05),并使结肠长度及体重显著增加,结肠组织更加完整。因此证实,粪便微生物提取液对溃疡性结肠炎具有较好的治疗作用,具有应用于临床医学的潜力。
粪便微生物粗提液,溃疡性结肠炎,结肠,血清
炎症性肠病(IBD)是一种病因尚不十分清楚的慢性非特异性肠道炎症性疾病,包括溃疡性结肠炎(UC)和克罗恩病(CD)[1]。我国尚缺乏IBD群体调查资料,估计UC患病率约为11.6/10万,然而,近年来我囯UC的患病人数呈明显上升趋势[2]。溃疡性结肠炎临床表现为腹泻,黏液脓血便,腹痛,里急后重等,多呈反复发作的慢性病程[3]。溃疡性结肠炎严重影响到患者的身体健康和生活质量,被世界卫生组织列为现代难治病之一[4]。临床上治疗 UC 的药物主要有氨基水杨酸类药物、肾上腺糖皮质激素类和免疫抑制剂类等[5]。总体来说,上述药物治疗见效快、疗效好,可缓解UC患者燃眉之苦,但仍存在很多问题,如耐药抗药性,易引起患者头疼、恶心,造成机体消化系统、血液系统异常。临床研究表明,粪便微生物作为一种SASP的替代品,能有效治疗溃疡性结肠炎。
粪菌移植,定义为将健康机体粪便中的功能菌群,移植到患者胃肠道内,重建具有正常功能的肠道菌群,实现肠道及肠道外疾病的诊疗。粪菌移植能够发挥确切疗效的原因,是移植的人粪菌群尽可能维持了健康供者的功能肠道菌群,并最终在受者肠道内重建适合受者的功能菌群[4]。
本研究以健康小鼠的粪便微生物提取液为目标菌群,通过建立溃疡性结肠炎动物模型和灌胃鼠源粪便微生物提取液方法,研究粪便微生物提取液对肠黏膜损伤的BALB/c小鼠表观状态、体重、结肠长度、组织病理学及血清细胞因子的影响,旨在探讨粪便微生物提取液对溃疡性结肠炎小鼠疾病的治疗效果。
1 材料与方法
1.1材料与仪器
BALB/c小鼠,64只,雌性,清洁级,7周 购自北京维通利华实验动物技术有限公司,保持饲养环境温度(23±2)℃,每天人工灯光照明12 h,标准小鼠饲料喂养,自由饮水;IL-1β提取试剂盒,IL-6试剂盒,IL-10试剂盒购自武汉博士德生物科技有限公司;甲醛溶液天津博迪化工股份有限公司。
电子显微镜Motic;注射器江苏治宇医疗器械有限公司;液氮罐成都金凤液氮容器有限公司;眼科解剖盒沈阳市久鸣铝制品厂。
1.2实验方法
1.2.1粪便微生物提取液的制备观察小鼠精神状态、毛发情况、排便频率、粪便形态等信息,筛选出目标小鼠,并对其进行标记,作为粪便微生物移植捐赠组小鼠。制备时,将捐赠组小鼠的新鲜晨便标本置于无菌厌氧容器中,冰上保存,2 h内运至实验室进行处理,按7∶15(g/mL)的比例将粪便溶于无菌PBS中,分别用2.0、1.0、0.5、0.25 mm的不锈钢筛过滤,6000×g、15 min离心,取菌体,无菌PBS清洗3次,重置于PBS溶液中,4 ℃冰箱保存[6]。
1.2.2动物模型的建立将64只BALB/c雌鼠随机分成4组,Ⅰ完全空白组(20只)、Ⅱ肠炎空白组(20只)、Ⅲ SASP组(12只)和Ⅳ FMT组(12只)。将3%葡聚糖硫酸钠(DSS)溶于水瓶中,让Ⅱ、Ⅲ和Ⅳ组小鼠自由饮用8 d,以诱发实验性溃疡性结肠炎小鼠模型[7],然后第8 d,分别解剖完全空白组、肠炎空白组小鼠8只(参考ELISA实验血清的用量),摘眼球取血,并取小鼠结肠组织,记录小鼠结肠组织长度;然后以小鼠体重变化、表观状况、结肠长度、病理学等为指标,验证小鼠溃疡性结肠炎模型是否建立成功。Ⅰ完全空白组小鼠饮用灭菌蒸馏水。
1.2.3实验设计本研究实验设计如下:Ⅰ完全空白组(20只):正常饮食,无特殊处理;Ⅱ肠炎空白组(20只):建模后,按照0.3 mL PBS/只进行灌胃,灌胃持续4周,灌胃频率1次/2 d;Ⅲ SASP组(12只):DSS造模后,按照0.0092 g SASP溶液/0.3 mL PBS/只进行灌胃,灌胃持续4周,灌胃频率1次/2天;Ⅳ FMT组(12只):造模后,按照0.14 g粪便微生物/0.3 mL PBS/只进行灌胃,灌胃持续4周,灌胃频率1次/2 d。灌胃期间每天记录小鼠体重、粪便性状、毛发情况、隐血等[7];灌胃结束后,每组分别处死小鼠8只,摘眼球取血,并取小鼠结肠组织,记录小鼠结肠组织长度;并对小鼠结肠组织行HE染色,记录病理学指标图片;每组剩余的小鼠进行后续观察,2周后同上进行处理。本研究实验设计图如图1。

图1 实验方案Fig.1 The experimental design
1.2.4小鼠的表观观测在小鼠灌胃期间(如图1,2~6周)及后续观察期间(如图1,6~8周),每天观察并记录各组小鼠生长状态,包括体重变化、进食情况、外观毛发、粪便性状及粪便隐血、便血情况。
1.2.5小鼠结肠组织长度的变化灌胃结束后,各组随机选取待解剖小鼠,对其腹腔注射20%氨基甲酸乙酯麻醉(6 mL/kg),固定于解剖台上,眼球取血分离血清,脱颈处死小鼠,然后沿腹部正中切口,将结肠从盲肠、直肠中间剪开,快速剖取结肠,观察各组小鼠结肠的变化,测量整个结肠长度[8]。后续观察结束后,进行同样的处理。
1.2.6病理组织学分析小鼠肠黏膜组织灌胃结束后,各组随机选取待解剖小鼠,对其腹腔注射20%氨基甲酸乙酯麻醉(6 mL/kg),固定于解剖台上,眼球取血分离血清,脱颈处死小鼠,然后沿腹部正中切口,将结肠从盲肠、直肠中间剪开,快速剖取结肠,沿着肠系膜剪开,取出肛门至盲肠末端的整个结肠和直肠段,并于结肠末端(距肛门1 cm)处剪取0.5 cm长的结肠,福尔马林浸泡,进行HE染色以做病理检查。后续观察结束后,进行同样的处理[9]。
1.2.7小鼠血清IL-1β、IL-6、TNF-α含量的测定研究表明,溃疡性结肠炎与炎性细胞水平密切相关。当机体受到外界刺激(如脂多糖、IL-1β、IL-6、TNF-α)时,NF-κB会与IκB分离,游离的NF-κB将进入细胞核,从而调控IL-1β、IL-6、TNF-α等炎性细胞因子的表达,从而活化机体NF-κB信号通路,迫使机体处于持续的活化状态,过多的炎性细胞因子会引起机体炎症,从而导致溃疡性结肠炎等炎症性疾病。因此,选取IL-1β、IL-6、TNF-α等炎性细胞因子为指标,研究鼠源粪便微生物提取液对人工溃疡性结肠炎小鼠的作用[10]。灌胃结束后,各组随机选取待解剖小鼠,对其腹腔注射20%氨基甲酸乙酯麻醉(6 mL/kg),固定于解剖台上,眼球取血,室温自然凝固1 h后,离心,取血清,待所有样品收集完后分别用细胞因子(IL-1β、IL-6、TNF-α)ELISA试剂盒检测[9]。

表1 灌胃期间粪便微生物提取液对溃疡性结肠炎小鼠结肠组织长度的影响Table 1 The effects of fecal microbial extracts on the colon length UCmice in the period of the oral administration
注:表中数据均与肠炎空白组数据对比进行显著性分析,标不同字母表示差异显著(p<0.05)。
1.3统计学分析
实验结果经SPSS13.0统计软件分析,两两比较采用Duncan法。实验结果采用Mean±SD表示,p<0.05为差异有显著性意义。
2 结果与讨论
2.1实验说明
灌胃期间,肠炎空白组小鼠进行仅PBS灌胃处理,不进行治疗,结果灌胃期间肠炎空白组小鼠死亡11只,以上死亡小鼠均及时进行解剖,死亡原因均为消化道出血;一方面说明溃疡性结肠炎模型建立成功,另外一方面说明溃疡性结肠炎小鼠不能靠自我修复得以痊愈;所以,后续的对比实验,均为横向对比,即同组前后的对比,小鼠治疗后与治疗前的对比。
2.2溃疡性结肠炎小鼠模型的验证
从建模起始(第0 d)到建模结束(第8 d),小鼠体重下降率为13.76%,肠炎空白组小鼠表观状态不佳,具体表现在小鼠目光呆滞、毛发暗沉卷曲,有羌毛现象,见图2a;并且,肠炎空白组小鼠尾根处有血斑,说明小鼠有显性便血现象,见图2b;由HE染色图(见图2c)可知,肠炎空白组相对于完全空白组HE染色图,小鼠结肠组织,肠黏膜萎缩,黏膜表面钝化,隐窝破坏,结构不完整,因此急性溃疡性结肠炎模型建立成功,可进行下一步治疗实验。
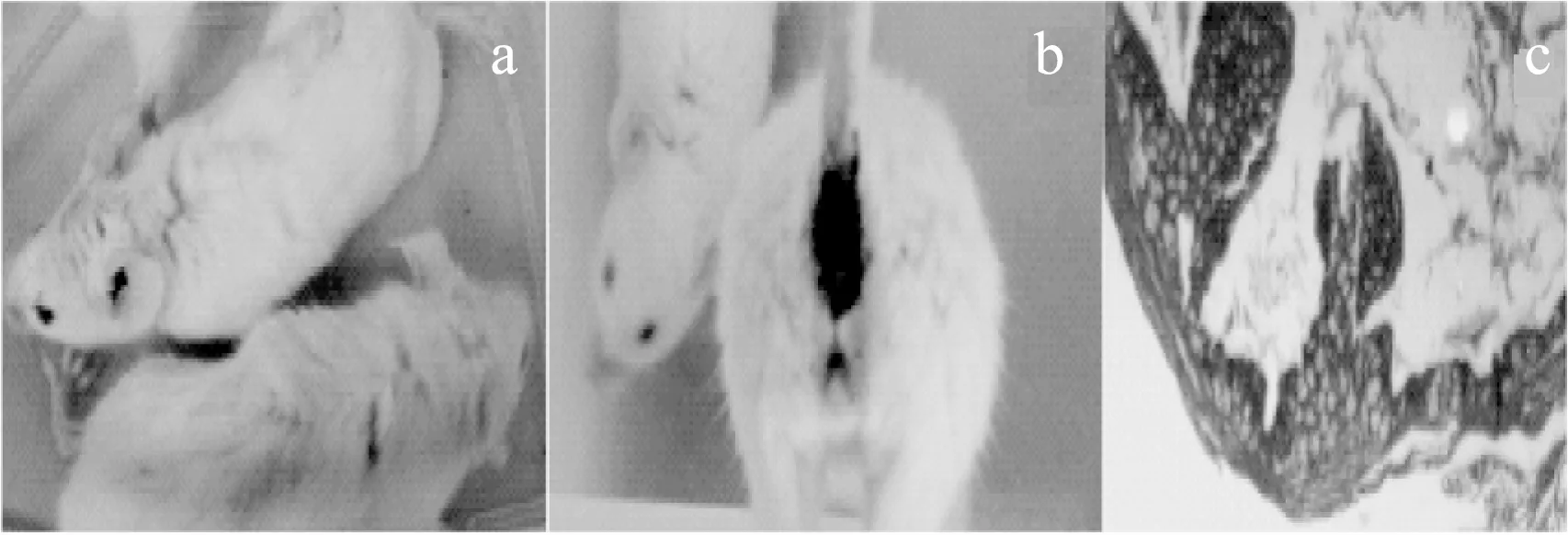
图2 溃疡性结肠炎小鼠症状Fig.2 Clinical symptoms of UC mice
2.3粪便微生物提取液对溃疡性结肠炎小鼠体重的影响
小鼠实验灌胃及后续观察期间,每天称重,取平均值,做出粪便微生物提取液对溃疡性结肠炎小鼠体重变化的影响图,如图3。由图3可知,两个疗程的灌胃结束后,粪便微生物提取液作用显著,表现在FMT组小鼠非但没有因为肠炎的原因体重下降而死亡,反而体重增长了(4.57±0.21)g,说明粪便微生物粗提液具有一定的抗溃疡性结肠炎功效,可改善UC小鼠的体重;后续观察2周(即从灌胃结束至后续观察结束的期间)的结果表明,FMT组小鼠体重持续增长,说明粪便微生物移植疗法并未出现快速消退的现象。
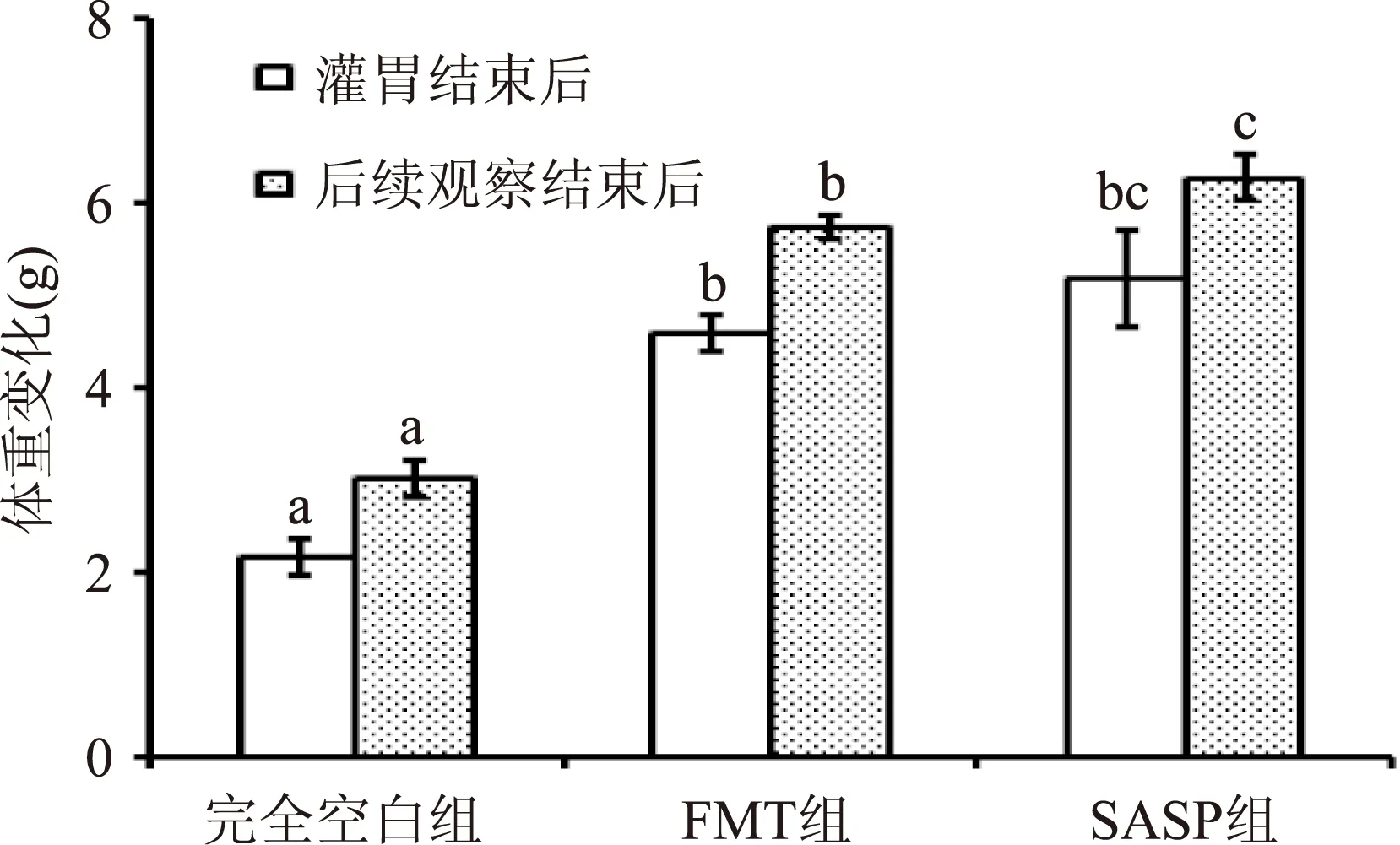
图3 粪便微生物提取物 对溃疡性结肠炎小鼠体重变化的影响Fig.3 The effects of the fecal microbial extracts on the weight of UC mice注:同一类型不同组小鼠均与完全空白组小鼠对比, 进行显著性分析,标不同字母表示差异显著(p<0.05)。
2.4粪便微生物提取液对溃疡性结肠炎小鼠结肠组织的影响
肠炎空白组、SASP组、完全空白组和FMT组的小鼠结肠全长的标本照片见图4,所得的粪便微生物提取液对溃疡性结肠炎小鼠结肠组织长度的影响见表1。由图4、表1可知,完全空白组小鼠结肠约为12.82 cm,肠管内充满成型粪便,肠炎空白组结肠长度约为8.64 cm,整个肠管内粪便较少,粪便不成型状态,说明建立溃疡性结肠炎之后,小鼠的结肠长度变短。粪便微生物移植组与SASP组长度均约为12.2 cm左右,与正常空白组小鼠的结肠长度无显著的差异,结肠内充满成型粪便,说明粪便微生物移植疗法显著增长了肠炎小鼠的结肠长度,与SASP疗法具有很好的修复小鼠结肠组织完整性的作用。

图4 各组小鼠结肠长度Fig.4 The colon length of different groups
2.5粪便微生物提取液对溃疡性结肠炎小鼠结肠组织病理学的影响
肠炎空白组、FMT组、SASP组、完全空白组的HE染色病理图见图5。
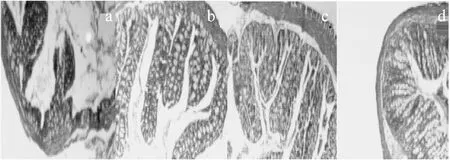
图5 小鼠HE染色图Fig.5 The HE staining picture of different groups mice注:a为肠炎空白组小鼠,b为FMT组小鼠, c为SASP组小鼠,d为完全空白组小鼠。
由图5可知,肠炎空白组小鼠,肠黏膜萎缩,黏膜表面钝化,隐窝破坏,基本处于肠黏膜屏障失衡状态(5a);经过两个疗程的粪便微生物移植疗法治疗之后,FMT组小鼠肠黏膜细胞排列基本整齐,肠黏膜结构完整,无组织坏死现象(5b),说明粪便微生物移植疗法可以很好的修复溃疡性结肠炎小鼠的肠黏膜损伤;并且与SASP组、完全空白组小鼠HE染色图相比,无明显的差异,说明粪便微生物提取液具有很好的抗溃疡性结肠炎作用。
2.6小鼠血清细胞因子水平
用酶标仪在450 nm处检测细胞因子反应板的OD值。在平行标准品OD值中选取一组线性相关性较大的点建立标准曲线方程。利用SPSS13.0统计软件建立标准曲线方程。其中,TNF-α的标准曲线方程为:y=0.0008x+0.0623,R2=0.9916;x为TNF-α浓度,y为TNF-α的OD值,相关系数为0.9916。IL-6的标准曲线方程为:y=0.0022x+0.0218,R2=0.9993;x为IL-6浓度,y为IL-6的OD值,相关系数为0.9993。IL-1β的标准曲线方程为:y=0.0028x+0.0541,R2=0.9992;x为IL-1β浓度,y为IL-1β的OD值,相关系数为0.9992。
根据细胞因子标准曲线,得出灌胃结束后小鼠血清细胞因子水平含量表见表2。

表2 灌胃结束后小鼠血清细胞因子水平(X±SD)Table 2 The serum levels of cytokines in mice after the oral administration(X±SD)
注:单位为pg/mL;均与肠炎空白组数据对比进行显著性分析,标不同字母表示差异显著(p<0.05)。
由表2可知,从IL-1β角度来看,肠炎空白组小鼠血清中IL-1β含量相对于其他组,其含量显著较高,可能是由于患溃疡性结肠炎,促使机体持续活化,从而促进IL-1β的高度表达;而经过粪便微生物移植疗法,使溃疡性结肠炎小鼠血清中IL-1β含量显著降低,并于SASP组小鼠此种细胞因子含量无显著的差异,说明鼠源粪便微生物提取液可以显著降低机体细胞因子IL-1β的水平。从IL-6角度来看,肠炎空白组小鼠血清细胞因子IL-6的水平与FMT组、SASP组及完全空白组细胞因子水平有显著差异,说明FMT及SASP处理均可以降低机体此种细胞因子水平,其中,FMT组小鼠与SASP组小鼠此种细胞因子水平差异不显著,说明粪便微生物移植疗法能达到市面上传统治疗溃疡性结肠炎的方法。从TNF-α角度来看,肠炎空白组小鼠血清TNF-α水平较高,经过2个疗程的治疗之后,FMT及SASP组小鼠血清TNF-α水平显著降低,说明鼠源粪便微生物移植疗法可显著降低血清炎性因子水平。
2.7讨论
溃疡性结肠炎的发病机制多认为与环境因素、遗传因素、免疫因素等有关,其中,遗传及免疫因素在UC致病中起着至关重要的作用,可以肯定的是,肠黏膜屏障功能失调参与了UC的发生[11]。肠道上皮屏障破坏,黏膜通透性增加,肠组织长期暴露于大量抗原中,导致肠道免疫系统过度反应和错误识别,引起巨噬细胞和淋巴细胞的激活,释放一系列细胞因子和炎症介质,激活机体的免疫应答,炎症反应逐级放大,最终导致组织损伤,出现UC的病理改变和临床表现[12]。最近的研究热点多集中于,溃疡性结肠炎与炎性细胞水平及NF-kB信号通路的研究。当机体受到外界刺激(如脂多糖、IL-1β、IL-6、TNF-α)时,NF-κB会于IκB分离,游离的NF-κB将进入细胞核,从而调控IL-1β、IL-6、TNF-α等炎性细胞因子的表达,从而活化机体NF-κB信号通路,迫使机体处于持续的活化状态,过多的炎性细胞因子会引起机体炎症,从而导致溃疡性结肠炎等炎症性疾病[13-14]。
本实验建立溃疡性结肠炎小鼠模型,以小鼠病理学状态及与NF-κB信号通路密切相关的IL-1β、IL-6、TNF-α等炎性细胞因子为指标,研究鼠源粪便微生物提取液对人工溃疡性结肠炎小鼠的作用,得出鼠源粪便微生物粗提物可显著改善UC小鼠的病理学损伤,并通过抑制NF-κB信号通路来降低小鼠机体炎症反应,从而降低与NF-κB信号通路密切相关的IL-1β、IL-6、TNF-α等炎性细胞因子的含量。粪便微生物移植疗法发挥作用的机制可能是因为,一方面,正常健康小鼠粪便微生物粗提取液中可能存在某种活性物质,如LPS或者过氧化物,可能通过抑制NF-κB与IκB分离,从而阻止游离的NF-κB进入细胞核,抑制机体NF-κB信号通路的持续活化,来起到抗溃疡性结肠炎的功效[15-16];另一方面粪便微生物提取液可以平衡肠道菌群,粪便微生物移植之前,患者肠道菌群多样性减小,以厚壁菌门和拟杆菌门为主,而粪便微生物移植可以增加小鼠肠道菌群多样性,主要是拟杆菌门及产生丁酸盐的菌群组成,其中,厚壁菌门和拟杆菌门在维持肠道内环境稳态方面均具有重要作用,厚壁菌门通过产生丁酸盐维持肠上皮细胞的完整性,并增强机体免疫反应,拟杆菌门能抑制有害菌的增殖[17-18]。
3 结论
本研究证实粪便微生物提取液能够改善溃疡性结肠炎小鼠的病理学状态,增加小鼠体重,维持小鼠结肠组织完整,增强小鼠隐窝深度,并增长小鼠结肠组织长度,由灌胃之前的8.64 cm左右增长至12.86 cm左右。另外,鼠源粪便微生物提取液可显著降低溃疡性结肠炎小鼠血清中IL-1β含量、IL-6含量及TNF-α含量,使溃疡性结肠炎小鼠IL-1β含量、IL-6含量及TNF-α含量从103.5、84.8、91.0 pg/mL,分别降低至21.9、19.8、31.4 pg/mL,差异显著(p<0.05),从而抑制了机体炎性细胞因子持续活化状态,从而发挥抗炎性功效。
[1]赵晶. 杨梅素对DSS诱导的小鼠急性溃疡性结肠炎的保护作用研究[D].长春:吉林大学,2013.
[2]陈蕾蕾. 美沙拉嗪联合思密达治疗溃疡性结肠炎大鼠的疗效及机制[D].杭州:浙江大学,2013.
[3]侯天舒. 电针对溃疡性结肠炎模型大鼠肠道微生态及宿主代谢的影响研究[D].成都:成都中医药大学,2012.
[4]林敏怡,陈烨.粪菌移植治疗复发性艰难梭菌感染[J].现代消化及介入诊疗,2014,23(06):411-414.
[5]江学良.粪菌移植的研究现状、存在问题与发展方向[J].中华消化病与影像杂志,2014,23(04):152-155.
[6]陈文敏. 川弓嗪对实验性溃疡性结肠炎NF-KB/COX-2信号通路的影响[D].重庆:重庆医科大学,2012.
[7]王婷婷. 嗜酸乳杆菌对感染大肠杆菌O157∶H7小鼠肠道微生物区系的影响[J].食品工业科技,2014,21(04):341-345.
[8]王学红. 防治溃疡性结肠炎的益生菌的筛选及其部分机制的影响[D].长沙:中南大学,2007.
[9]李飞. 凝结芽孢杆菌对恶唑酮诱导的大鼠溃疡性结肠炎的治疗作用研究[D].青岛:青岛科技大学,2011.
[10]徐敏,杜金城,于上富,等.藏式酥油茶生产工艺研究[J].食品研究与开发,2015,36(18):72-75.
[11]LI G J.Intestinal probiotics:Interactions with bile salts and reduction of cholesterol[J].Procedia Environmen-tal Sciences,2012,12:1180-1186.
[12]徐敏,田辉,杜金城,等.多菌种共固定化发酵制备枸杞红枣乳酸饮料[J].中国酿造,2015,34(7):164-167.
[13]Hu J T,Wang C F,Ye L P,et al.Anti-tumour immune effect of oral administration of Lactobacillus plantarum to CT26 tumour-bearing mice[J].Indian Academy of Sciences,2015,40(10):269-279.
[14]Mariman R,Tielen F,Koning F,et al.The Probiotic Mixture VSL#3 Has Differential Effects on Intestinal Im-mune Parameters in Healthy Female BALB/c and C57BL/6 Mice[J].The Journal of Nutrition,2015,145(10):1354-1361.
[15]Whelan R A,Rausch S,Ebner F,et al.A Transgenic Probiotic Secreting a Parasite Immunomodulator for Site-Directed Treatment of Gut Inflammation[J].The American Society of Gene & Cell Therapy,2014,22(10):1730-1740.
[16]Wang L F,Zhang J C,Guo Zh,et al.Effect of oral consumption of probiotic Lactobacillus planatarum P-8 on fecal microbiota,SIgA,SCFAs,and TBAs of adults of different ages[J].Nutrition,2013,30(10):776-783.
[17]Moeinian M,Ghasemi-Niri S F,Mozaffari S,et al.Beneficial effect of butyrate,Lactobacillus casei and L-carn itine combination in preference to each in experimental colitis[J].World Journal of Gastroenterol,2014,20(31):10876-10885.
[18]Sang L X,Chang B,Dai C,et al.Heat-killed VSL#3 Ameliorates Dextran Sulfate Sodium(DSS)-Induced Acute Experimental Colitis in Rats[J].Molecular Sciences,2014,15(31):15-28.
Recovery effect of fecal microbial extracts on mouse with ulcerative colitis
XU Min,BIAN Xin,DU Jin-cheng,DING Xiu-yun,YU Shang-fu,HUO Gui-cheng*
(Northeast Agriculture University,Key Laboratory of Dairy Science,Ministry of Education,Harbin 150030,China)
The recovery effect of fecal microbial extracts on ulcerative colitis mouse was studied.64 healthy mice were randomly divided into 4 groups,which was the sham group(n=20),the negative control group(n=20),the positive control group(n=12),and the FMT group(n=12).The mice from the treated groups were freely drunken 3% dextran sulfate sodium salt(DSS)solution for 8 days to establish the ulcerative colitis(UC)model,and 8 mice from the sham group and 8 mice from the negative group were died to verify whether the UC model was set successfully at the 8-th day.After the UC model,the SASP group mice were treated with the SASP solution for four weeks,2 days/time,and the FMT group mice were treated with the fecal microbial extracts from the healthy mouse for four weeks,2 days/time.After that,the follow-up of the mice was studied for two weeks,to observe the mouse state,the weight,the colon length,the colon organization pathology and the serum IL-1β,and IL-6,and TNF-α. Results showed that the serum levels of IL-6,IL-1βand TNF-αwere significantly decreased in fecal microbial extracts group(p<0.05),compared with the negative group,the length and weight of the colon were significantly increased in fecal microbial extracts group,and the colon was made more complete.Thus,stool microbial extracts had good effect on the ulcerative colitis and have the potential to be applied into the clinical medicine.
fecal microbial extracts;ulcerative colitis;colon;serum
2015-10-30
霍贵成(1958-),男,博士,教授,研究方向为食品微生物与生物技术,E-mail:1252017463@qq.com
徐敏(1991-),女,硕士研究生,研究方向为食品科学,E-mail:15104595049@126.com。
国家自然科学基金(31401512);国家863 项目:乳酸菌特色资源库及乳酸菌发酵剂和代谢工程技术研究(2011AA100902)。
TS201.4
A
1002-0306(2016)09-0367-05
10.13386/j.issn1002-0306.2016.09.064
