超声波辅助提取中国木茎皮多糖的工艺优化及抗氧化活性研究
2016-09-12王一峰
靳 洁,王一峰
(西北师范大学生命科学学院,甘肃兰州 730070)
靳洁,王一峰*
(西北师范大学生命科学学院,甘肃兰州 730070)
以中国楤木(AraliachinensisL.)茎皮为原料,研究了超声波辅助提取中国楤木茎皮多糖的最优工艺条件及体外抗氧化活性。根据Box-Behnken设计原理,在单因素实验基础上,选取液料比、提取温度、超声功率和提取时间四个因素进行四因素三水平的响应面实验,结果表明超声波辅助提取多糖的最优条件为:液料比33 mL/g、提取温度71 ℃、超声功率124 W、提取时间93 min,该条件下多糖提取率预测值为12.897%,验证值为12.871%±0.11%。体外抗氧化活性研究结果显示:在实验范围内,随着浓度的升高,中国楤木茎皮多糖对DPPH自由基、羟基自由基、超氧阴离子的清除能力逐渐增强,还原能力也逐渐增强。表明该响应面实验产生的回归模型用于优化中国楤木茎皮多糖的超声波提取工艺是可行的;中国楤木茎皮多糖具有一定的体外抗氧化能力,可以考虑将其开发成为一种天然抗氧化剂在医学或功能食品领域中使用。
中国楤木茎皮多糖,超声波辅助提取,响应面法,抗氧化活性
活性氧是细胞代谢过程中产生的副产品,过多的活性氧自由基可以引起许多疾病,如氧化应激、老化、慢性肾衰竭、肺炎、尿毒症、风湿性关节炎等[1]。为了减少活性氧对人体的伤害,抗氧化剂被普遍使用。目前主要有两类抗氧化剂,一种是人工合成的,一种是天然存在的。人工合成的抗氧化剂因具有显著的毒性而使其治疗效果受限,因此从自然资源中寻找安全有效的抗氧化剂受到越来越多的关注。近几年的研究表明,一些从植物中分离得到的多糖具有有效的抗氧化活性,可以开发其成为新型的天然抗氧化剂[2-5]。
中国楤木(AraliachinensisL.)隶属五加科楤木属,又名鹊不踏、虎阳刺、海桐皮、鸟不宿、通刺、刺树椿等,在全国大部分地区均有分布[6]。中国楤木是常用的中草药,以根皮和茎皮入药,具有镇痛消炎、祛风行气、祛湿活血之效[6]。研究发现中国楤木含有多种活性成分,包括皂苷、多糖、黄酮、齐墩果酸、挥发油等[7-9]。在之前的工作中,课题组已经对中国楤木根皮多糖的超声波辅助提取工艺及多糖含量进行了研究,得到其最佳工艺条件为:提取温度70 ℃,料液比1∶30 g/mL,提取时间80 min,超声功率100 W,此条件下多糖得率为11.13%[7]。此外,课题组还对中国楤木粗多糖的降血糖作用进行了研究,结果发现中国楤木粗多糖能够显著降低糖尿病大鼠血糖水平,有效调节糖药病大鼠血脂代谢紊乱[8]。
传统的多糖提取方法需要较高的提取温度和较长的提取时间,并且多糖得率并不理想,超声波辅助提取技术因其低的能量消耗、低的溶剂消耗和高的提取效率而在近年被广泛应用[10]。在提取过程中,很多因素如提取温度、提取时间、料液比等都会影响多糖得率,为了得到最优提取条件,需要对提取工艺进行优化。响应面分析法是一种有效精确的优化方法,它的优点主要是可以减少必要的实验次数但不影响优化结果[11]。截止目前,对中国楤木茎皮多糖的提取工艺以及抗氧化活性研究还未见报道。本研究以中国楤木茎皮为材料,主要研究超声波辅助提取中国楤木茎皮多糖的最优工艺条件及体外抗氧化活性,以期为中国楤木茎皮多糖的进一步开发利用提供一定的理论基础。
1 材料与方法
1.1材料与仪器
中国楤木茎皮采自甘肃省陇南市徽县,洗净,在恒温干燥箱中烘干至恒重(50 ℃),然后粉碎过40目筛备用。
无水乙醇、无水乙醚、氯仿、磷酸、甲醇、盐酸(HCl)、三氯化铁(FeCl3)均为分析纯,上海中秦化学试剂有限公司提供;1,1-二苯基苦基苯肼(DPPH)、1,1-二苯基苦基苯肼(DPPH)、脱氧核糖、乙二胺四乙酸(EDTA)、硫酸亚铁铵、硫代巴比妥酸(TBA)、三氯乙酸(TCA)、还原性辅酶I(NADH)、四唑氮蓝(NBT)、吩嗪硫酸甲酯(PMS)、铁氰化钾、三氯化铁(FeCl3)均为分析纯,北京索莱宝科技有限公司提供。
WGL-230B型电热鼓风干燥箱天津市泰斯特仪器有限公司;BS223S型电子天平北京赛多利斯仪器系统有限公司;KQ-250DE型超声波提取仪昆山超声仪器厂;RE-52AA型旋转蒸发仪上海亚荣生化仪器厂;Allegra 64R型高速冷冻离心机普瑞麦迪实验室技术有限公司;LGJ-18S型冷冻干燥机北京松原华兴科技发展有限公司;U-2000型分光光度计优尼科仪器有限公司。
1.2实验方法
1.2.1超声波辅助提取精确称取10.00 g 干燥的中国楤木茎皮粉末于烧杯中,按照实验设定的条件进行超声波辅助提取,然后过滤,滤渣按照同样方法再次进行提取,两次滤液合并,抽滤,离心(4000 r/min,10 min),收集上清液,在60 ℃旋转蒸发仪中浓缩,然后在浓缩液中加入4倍体积无水乙醇,4 ℃放置24 h,之后依次用无水乙醇和乙醚洗涤3次,离心(4000 r/min,10 min),收集沉淀,Sevage法脱蛋白,流水和蒸馏水各透析24 h,减压浓缩,乙醇沉淀,离心(4000 r/min,10 min),沉淀物冷冻干燥得中国楤木茎皮多糖(ACSP)。
1.2.2多糖得率测定按照侯宏红等人[7]的方法测定样品提取得到的总糖质量。多糖得率根据下列公式计算:

1.2.3单因素实验设计选取液料比(10~50 mL/g)、提取温度(50~90 ℃)、超声功率(100~140 W)和提取时间(70~110 min)四个因素进行单因素实验,考察它们对ACSP得率的影响。当以液料比为考察因素时,其他条件设置为:提取温度70 ℃,超声功率120 W,提取时间90 min;当以提取温度为考察因素时,其他条件设置为:液料比30 mL/g,超声功率120 W,提取时间90 min;当以超声功率为考察因素时,其他条件设置为:液料比30 mL/g,提取温度70 ℃,提取时间90 min;当以提取时间为考察因素时,其他条件设置为:液料比30 mL/g,提取温度70 ℃;超声功率120 W。
1.2.4响应面实验设计在单因素实验基础上,选取液料比(X1)、提取温度(X2)、超声功率(X3)和提取时间(X4)四个因素,采用Box-Behnken设计方案进行四因素三水平的响应面实验,实验的因素和水平见表1。以X1、X2、X3和X4为自变量,多糖得率(Y)为响应值,实验方案见表2,实验结果采用Design expert 9.0 进行分析。
1.2.5抗氧化活性测定DPPH自由基清除能力测定:参照Wang等人[12]的方法,以VC为阳性对照;羟基自由清除能力测定:参照Zhao等人[13]的方法,以VC为阳性对照;超氧阴离子清除能力测定:参照Wang等人[14]的方法,以VC为阳性对照;还原力测定:参照Qi 等人[15]的方法,以VC为阳性对照。
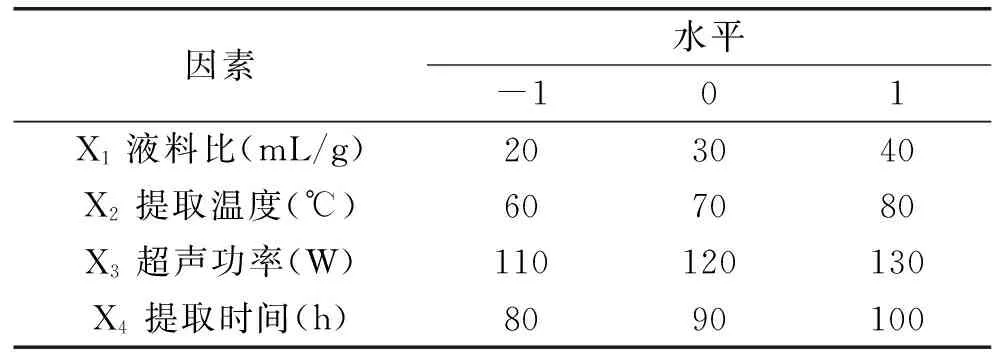
表1 响应面分析因素及水平Table 1 Variables and levels in response surface design
1.3数据统计分析
实验数据采用SPASS 20.0进行ANOVA分析,实验重复3次,显著性水平为0.05。
2 结果与分析
2.1多糖得率
以葡萄糖的质量浓度(ρn)为横坐标,吸光度(D)为纵坐标绘制标准曲线,得到的回归方程为D=0.0042ρn+0.151,R2=0.9914,根据该方程可以计算出样品提取得到的总糖质量,多糖得率根据1.2.2中公式计算。
2.2单因素实验
许多研究结果表明不同的液料比、提取温度、超声功率和提取时间等对多糖得率均有显著的影响[3,11,16]。
从图1a中可以看出,当液料比从10 mL/g增加到30 mL/g时,多糖得率迅速增加至最大值,之后随着液料比的增加多糖得率逐渐降低。这可能是因为增加溶剂量可以增加植物组织细胞内外的浓度差,从而促进多糖的析出,但溶剂量过高会导致扩散距离增加,同时导致后续浓缩过程中多糖亏损增大,反而不利于多糖得率的提升[17],所以选取30 mL/g为最佳液料比。
图1b显示,随着温度的增加,多糖得率不断增加,但当温度超过70 ℃时,多糖得率迅速降低。温度升高可以提高多糖的溶解度和扩散率,增加多糖得率,但过高的温度会破坏多糖的结构,引起多糖的降解,从而降低多糖得率[10],因此70 ℃为最适提取温度。
图1c表明,当超声波功率小于120 W时,多糖得率与超声功率呈正相关,超声波功率大于120 W时,两者呈负相关。说明在一定范围内增加超声功率可以提高多糖得率,这是因为增加功率有利于植物组织细胞壁的破裂,促进多糖的溶出,但过高的功率会导致热量的不稳定以及多糖的化学降解[18],因此选取120 W为最适功率。
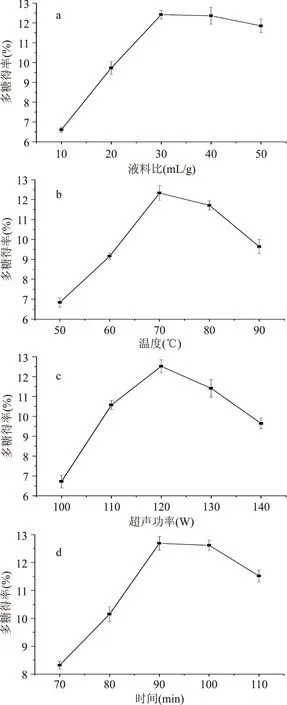
图1 不同因素对多糖得率的影响Fig.1 Effect of different factors on the yield of ACSP
观察图1d发现,提取时间的增加有利于多糖得率的升高,但当时间超过90 min时,多糖得率开始下降,因为过长的时间可能引起多糖的降解、聚集以及水解,并且造成能量的浪费[1],所以将最适提取时间定为90 min。
2.3响应面优化
四因素三水平的响应面实验结果见表2,对表2数据进行分析得到二次多元回归方程:
Y=12.48+0.88X1+0.46X2+0.96X3+0.62X4-0.05X1X2+0.25X1X3+0.12X1X4-0.27X2X3-0.43X2X4+0.29X3X4-1.62X12-1.44X22-1.57X32-1.144X2
式中Y代表多糖得率,X1代表液料比,X2代表提取温度,X3代表超声波功率,X4代表提取时间。
回归模型的响应面图见图2。图2显示,各因素对ACSP得率的影响作用与单因素实验结果基本一致,结合回归方程可知,超声功率对多糖得率的影响最为显著,每组实验在实验范围内多糖得率均存在极值,即响应面的最高点[20]。
应用响应面优化法得到的ACSP最优提取条件为:液料比33.1 mL/g,提取温度70.7 ℃,超声功率123.5 W,提取时间93.2 min,此条件下ACSP的理论提取率为12.897%。为了实际操作方便,将该最优提取条件修正为:液料比33 mL/g,提取温度71 ℃,超声功率124 W,提取时间93 min,在修正条件下进行验证实验,ACSP的实际提取率为12.871±0.11%(n=3),与理论值基本吻合。说明该回归方程能较为真实地反应各因素对ACSP得率的影响,证明该模型用于优化ACSP的超声波提取工艺是可行的[21]。
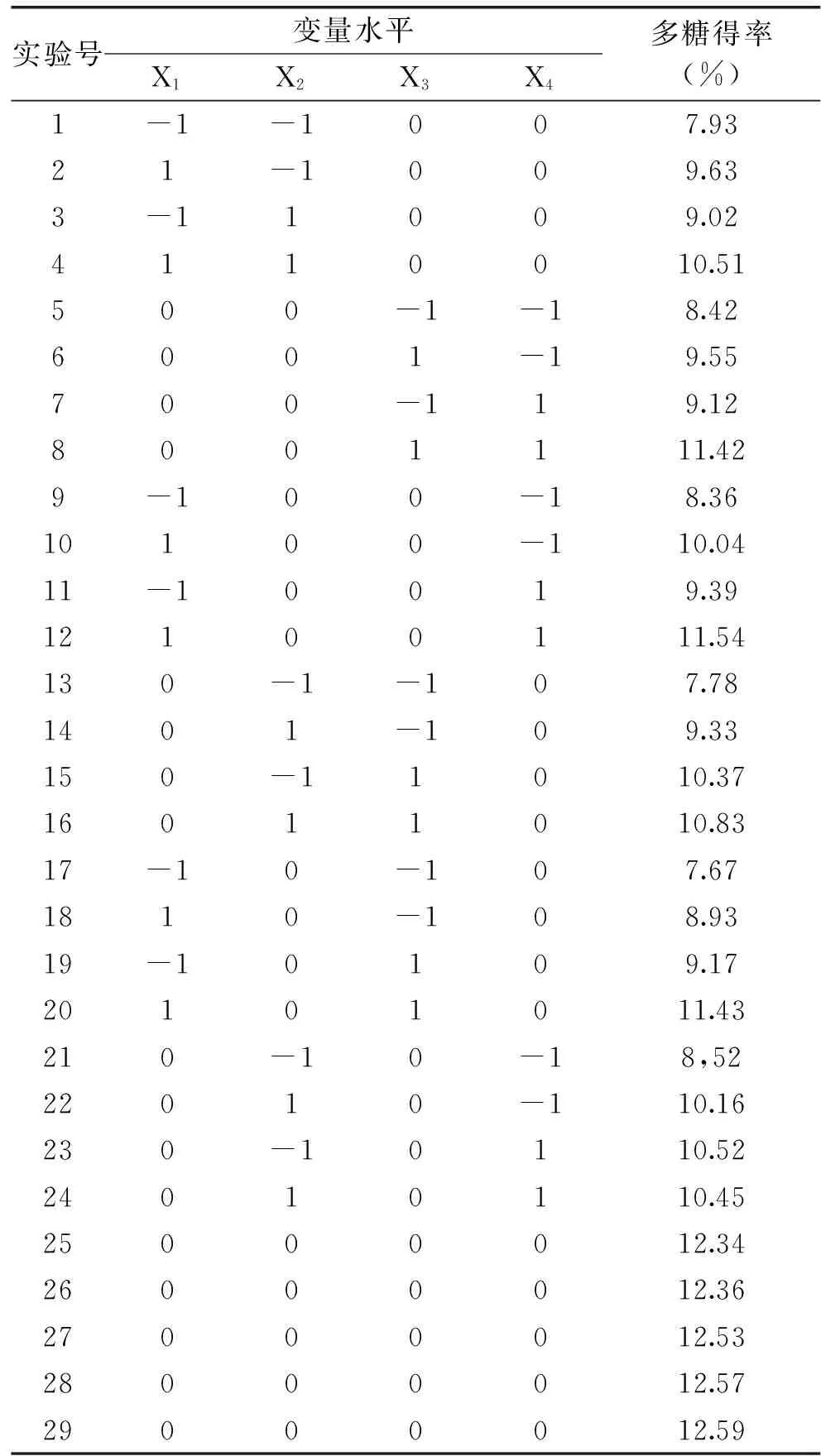
表2 响应面实验设计及多糖得率Table 2 Response surface experimental design and the results for extraction yield of ACSP
2.4抗氧化活性
2.4.1DPPH自由基清除能力DPPH自由基清除能力的测定已经成为评价天然化合物自由基清除能力的一种有效方法。DPPH的甲醇溶液在517 nm处具有最大吸收峰,当溶液被还原时,其在517 nm处的吸光度就会降低,并且溶液颜色会发生改变。本研究中,以VC为阳性对照,ACSP对DPPH自由基清除能力的测定结果见图3a。观察图3a发现,在实验浓度范围内,ACSP对DPPH自由基的清除能力随着浓度的升高而逐渐增大,具有浓度依赖性,其半抑制浓度IC50为0.887 mg/mL,说明ACSP具有一定的清除DPPH自由基的能力,但清除能力弱于VC。这与许多研究结果类似[16,22]。研究认为,一些化合物之所以能清除DPPH自由基,可能是因为这些化合物能提供一个电子使其与DPPH自由基的单电子配对,从而使DPPH自由基的吸收逐渐消失[23]。
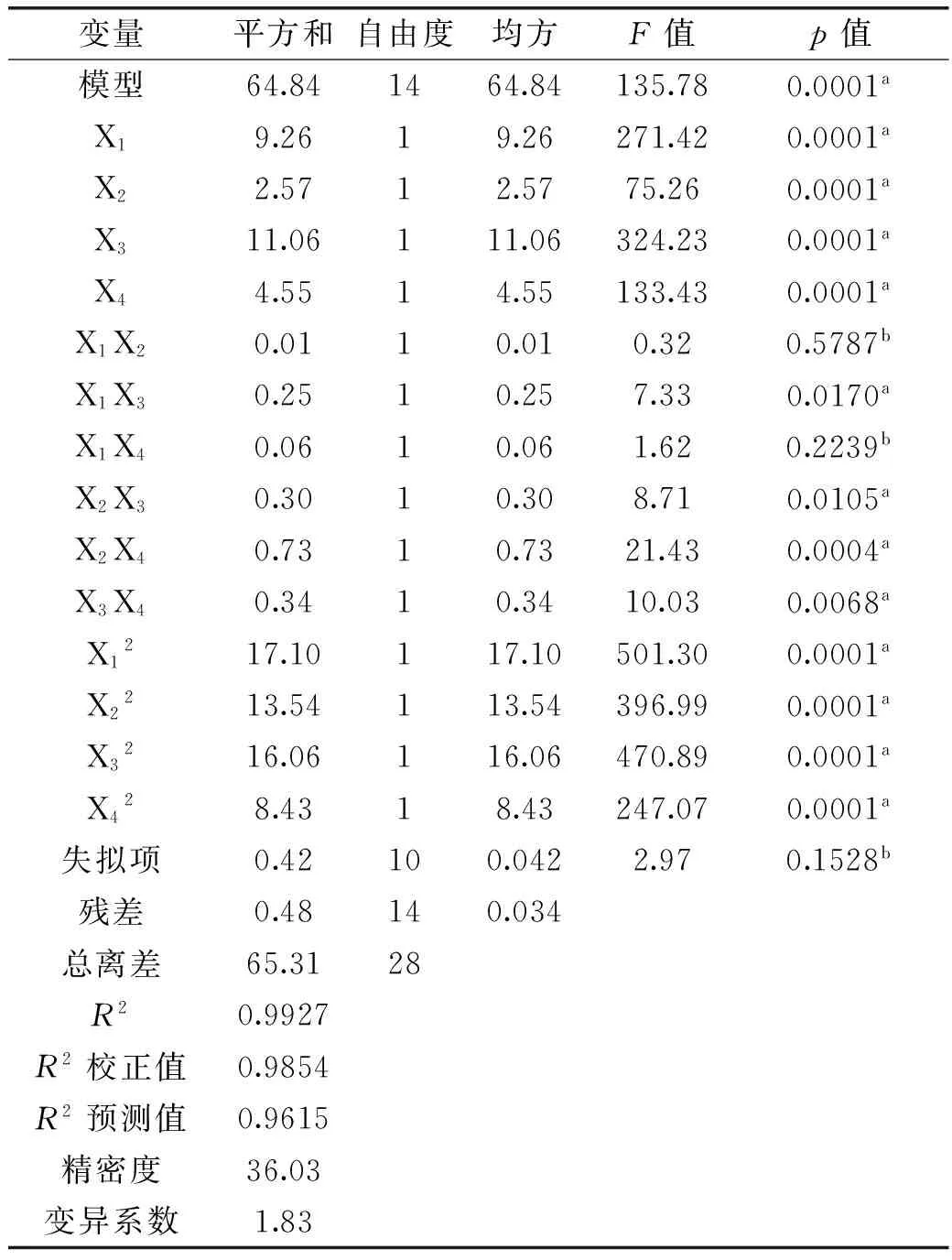
表3 响应面实验分析结果Table 3 Analysis of variance of response surface experiment
注:a表示差异显著(p<0.05),b表示差异不显著(p>0.05)。
2.4.2羟基自由基清除能力羟基自由基是体内产生的一类典型的活性氧,它能穿过细胞膜与细胞内大多数生物活性分子(如多糖、蛋白质、脂质和DNA等)反应,对细胞具有很大的伤害作用,因此清除羟基自由基就显得尤为重要[24]。ACSP和VC对羟基自由基清除能力的测定结果见图3b,可以看出两者对羟基自由基的清除能力均具有浓度依赖效应。当浓度从0.02 mg/mL升至0.5 mg/mL时,ACSP和VC的清除能力分别迅速增至57.6%和79.9%,之后随着浓度的增加,两者的清除能力均缓慢上升。实验结果说明ACSP具有清除羟基自由基的能力,其半抑制浓度IC50为0.632 mg/mL。研究表明多糖能清除羟基自由基的机制可能是多糖中的羟基能够贡献一个质子使其与羟基自由基结合,从而达到清除的目的[17]。
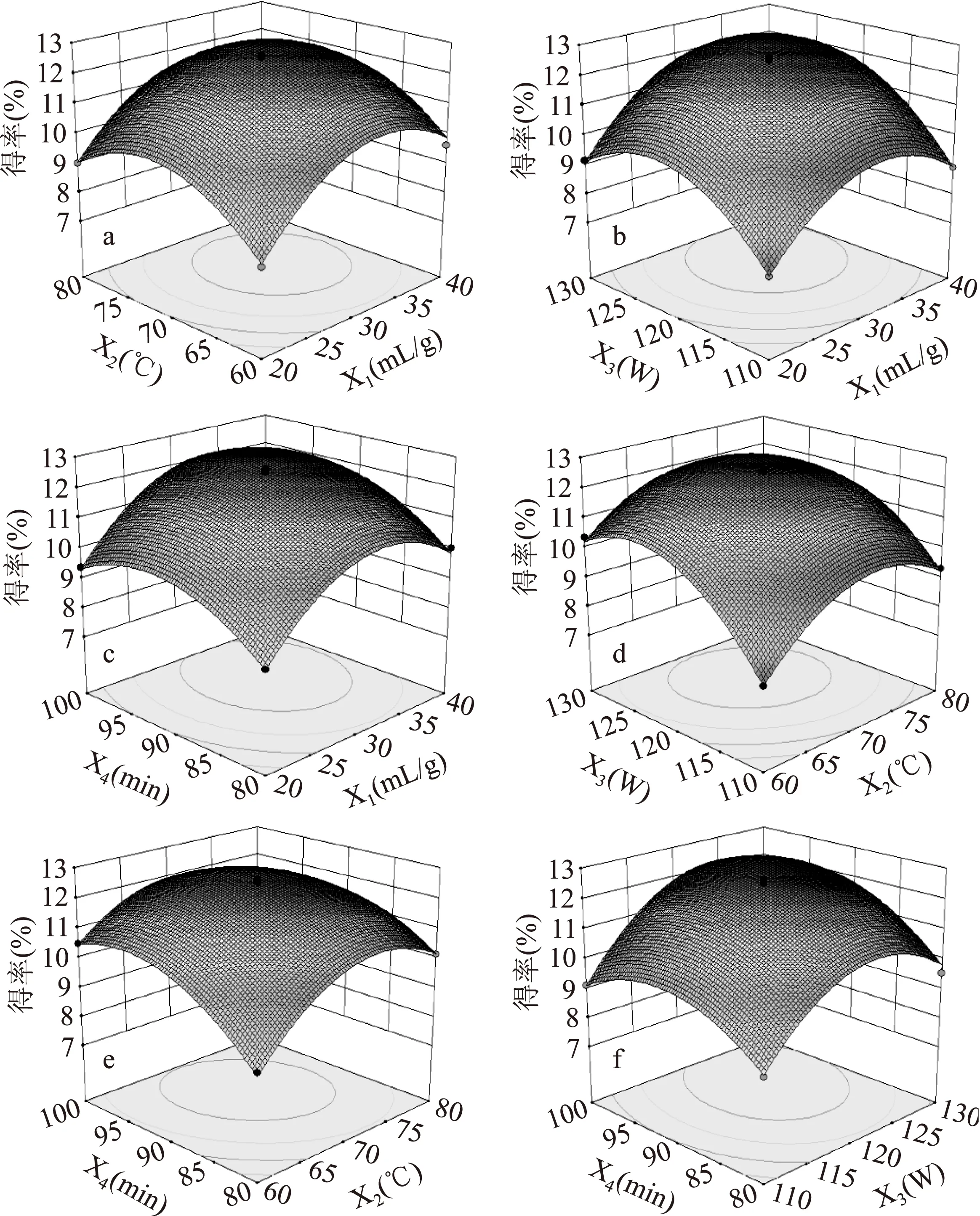
图2 各因素对中国楤木茎皮多糖提取率影响的响应面图。Fig.2 Response surface plots showing the effect of variables on the extraction yield of ACSP
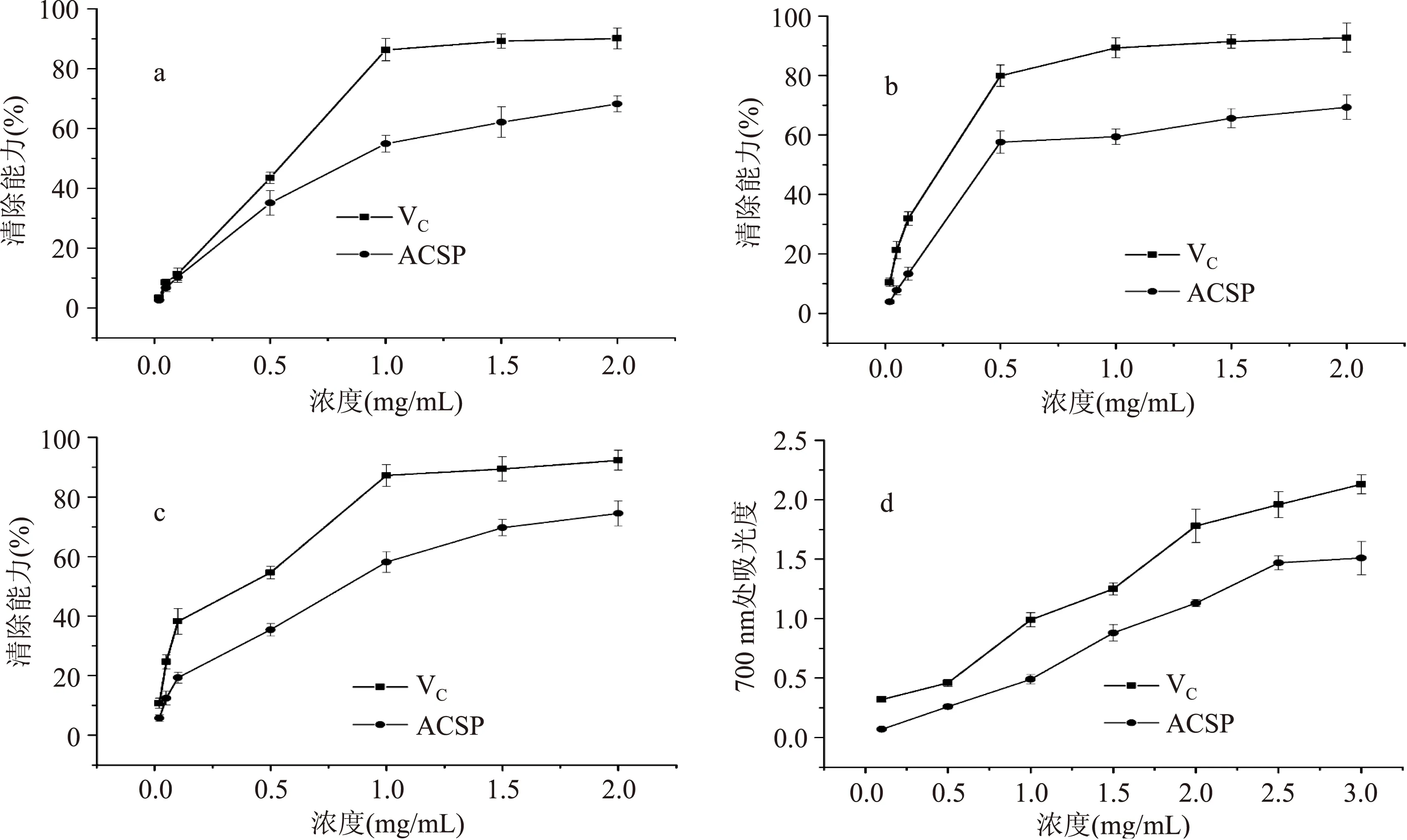
图3 不同浓度的中国楤木茎皮多糖的活性Fig.3 Activity of ACSP at different concentration注:a:DPPH自由基清除能力;b:羟基自由基清除能力;c:超氧阴离子自由基清除能力;d:还原能力。
2.4.3超氧阴离子清除能力超氧阴离子是在线粒体电子传递系统中产生的一种有毒物质,它被认为是单线态氧和羟基自由基的前体[25]。超氧阴离子的存在可以损害一些生物活性分子,并且启动一些病理反应,如关节炎和阿尔茨海默氏症[26]。图3c显示了ACSP对超氧阴离子的清除能力,当浓度从0.02 mg/mL升至2 mg/mL,ACSP对超氧阴离子的清除能力从5.7%升至74.5%,半抑制浓度为0.652 mg/mL,清除能力整体低于对照VC。许多研究指出从植物中提取的多糖对超氧阴离子具有很强的清除能力,认为它们可以被发展成为极具潜力的新型抗氧化剂[2,27]。
2.4.4还原能力具有还原能力的物质(如抗氧化剂)的出现可以使带有Fe3+的化合物变成亚铁化合物,因此通过检测反应后亚铁化合物的吸光度就可以测定样品的还原能力[28]。从图3d可以看出,ACSP和VC的还原能力均随着其浓度的升高而增加,当浓度升至3 mg/mL时,两者的吸光度分别为1.51和2.13,表明ACSP具有一定的还原能力。研究表明还原力的产生通常与还原酮的出现有关,还原酮可以通过贡献一个质子来破坏自由基反应链,从而起到还原作用[15]。
3 结论
此次研究根据Box-Behnken设计原理,应用响应面分析法建立了影响ACSP得率的二次多项式回归模型,优化了超声波辅助提取ACSP的工艺条件(液料比33 mL/g、提取温度71 ℃、超声功率124 W、提取时间93 min),该条件下多糖提取率预测值为12.897%,验证值为12.871%±0.11%(n=3),无显著差异,说明该回归模型用于优化ACSP的超声波提取工艺是可行的,具有实际价值。
对ACSP的体外抗氧化活性进行了初步研究,结果表明ACSP具有一定的体外抗氧化能力,可以考虑将其开发成为一种天然抗氧化剂在医学或功能食品领域中使用,这为中国楤木多糖的进一步开发利用提供了理论和实验依据。
[1]Tahmouzi S,Ghodsi M.Optimum extraction of polysaccharides from motherwort leaf and its antioxidant and antimicrobial activities[J].Carbohydrate Polymers,2014,112:396-403.
[2]Feng K,Chen W,Sun L W,et al..Optimization extraction,preliminary characterization and antioxidant activityinvitroof polysaccharides from Stachys sieboldii Miq.Tubers[J]. Carbohydrate Polymers,2015,125:45-52.
[3]Wang C Y,Wang Y,Zhang J,et al..Optimization for the extraction of polysaccharides from Gentiana scabra Bunge and their antioxidantinvitroand anti-tumor[J].Journal of the Taiwan Institute of Chemical Engineers,2014,45:1126-1132.
[4]Dalonso N,Petkowicz C.Guarana powder polysaccharides:characterisation and evaluation of the antioxidant activity of a pectic fraction[J].Food Chemistry,2012,134:1804-1812.
[5]Zhang D Y,Li S J,Xiong Q P,et al..Extraction,characterization and biological activities of polysaccharides from Amomum villosum[J].Carbohydrate Polymers,2013,95:114-122.
[6]石铸,靳淑英.中国植物志,第54卷[M].北京:科学出版社,1999,159-160.
[7]侯宏红,王一峰,赵博,等.中国楤木根皮多糖超声提取工艺及含量测定[J].生物加工过程,2015,13(2):19-23.
[8]赵博,王一峰,侯宏红.中国楤木粗多糖对糖尿病大鼠的降血糖作用[J].食品科学,2015,36(13):211-214.
[9]Miyase T,Sutoh N,Zhang D M,et al..Araliasaponins XII-XVIII,triterpene saponins from the roots of Aralia chinensis[J]. Phytochemistry,1996,42(4):1123-1130.
[10]Chen C,You L J,Abbasi A M,et al..Optimization for ultrasound extraction of polysaccharides from mulberry fruits with antioxidant and hyperglycemic activityinvitro[J].Carbohydrate Polymers,2015,130:122-132.
[11]Wu Z,Li H,Tu D W,et al.Extraction optimization,preliminary characterzation,andinvitroantioxidant activities of crude polysaccharides from finger citron[J].Industrial Crops and Products,2013,44:145-151.
[12]Wang J L,Zhang J,Wang X F,et al.A comparison study on microwave-assisted extraction of Artemisia sphaerocephala polysaccharides with conventional method:Molecule structure and antioxidant activities evaluation[J].International Journal of Biological Macromolecules,2009,45:483-492.
[13]Zhao B T,Zhang J,Guo X,et al.Microwave-assisted extraction,chemical characterization of polysaccharides from Lilium davidii var.Unicolor Salisb and its antioxidant activities evaluation[J].Food Hydrocolloids,2013,31:346-356.
[14]Wang J L,Zhang J,Zhao B T,et al.A comparison study on microwave-assisted extraction of Potentilla anserina polysaccharides with conventional method:Molecule structure and antioxidant activities evaluation[J].Carbohydrate Polymers,2010,80:84-93.
[15]Qi H M,Zhang Q B,Zhao T T,et al.Antioxidant activity of different sulfate content derivatives of polysaccharide extracted from Ulva pertusa(Chlorophyta)invitro[J].International Journal of Biological Macromolecules,2015,37:195-199.
[16]Wang Q H,Sun Y P,Yang B Y,et al.Optimization of polysaccharides extraction from seeds of Pharbitis nil and its anti-oxidant activity[J].Carbohydrate Polymers,2014,102:460-466.
[17]Zhao Z Y,Zhang Q,Li Y F,et al.Optimization of ultrasound extraction of Alisma orientalis polysaccharides by response surface methodology and their antioxidant activities[J].Carbohydrate Polymers,2015,119:101-109.
[18]Zhu C P,Zhai X C,Li L Q,et al.Response surface optimization of ultrasound-assisted polysaccharides extraction from pomegranate peel[J].Food Chemistry,2015,177:139-146.
[19]杨凤杰,沈素媚,冯文婕.响应面法优化超声提取食药用猴头菇多糖的工艺研究[J].山东化工,2015,44(8):22-27.
[20]王明艳,杨凡,李燕,等.响应面法优化百部多糖提取条件研究[J].食品科学,2009,30(6):80-83.
[21]刘玉芬,夏海涛,张丹妮,等.马兰头多糖提取工艺的响应面法优化及不同部位多糖含量的测定[J].食品科学,2011,32(24):153-157.
[22]Zha X,Wang J,Yang X,et al.Antioxidant properties of polysaccharide fractions with different molecularmass extracted with hot-water from rice bran[J].Carbohydrate Polymers,2009,78:570-575.
[23]Ye C L,Huang Q.Extraction of polysaccharides from herbal Scutellaria bar-bata D.Don(Ban-Zhi-Lian)and their antioxidant activity[J].Carbohydrate Polymers,2012,89:1131-1137.
[24]Fan L,Li J,Deng K,et al.Effects of drying methods on the antioxidant activities of polysaccharides extracted from Ganoderma lucidum[J].Carbohydrate Polymers,2012,87:1849-1854.
[25]Shen S,Chen D J,Li X,et al.Optimization of extraction process and antioxidant activity of polysaccharides from leaves of Paris polyphylla[J].Carbohydrate Polymers,2014,104:80-86.
[26]Liu W,Wang H,Pang X,et al.Characterization and antioxidant activity of two low-molecular-weight polysaccharides purified from the fruiting bodies of Ganoderma lucidum[J]. International Journal of Biological Macromolecules,2010,46:451-457.
[27]Yuan Q X,Xie Y F,Wang W,et al.Extraction optimization,characterization and antioxidant activityinvitroof polysaccharides from mulberry(Morus alba L.)leaves[J].Carbohydrate Polymers,2015,128:52-62.
[28]Qi H M,Zhang Q B,Zhao T T,et al.Invitroantioxidant activity of acetylated and benzoylated derivatives of polysaccharide extracted from Ulva pertusa(Chlorophyta)[J].Bioorganic & Medicinal Chemistry Letters,2006,16:2441-2445.
Optimization of ultrasonic-assisted extraction of polysaccharides fromAraliachinensisL.stem-bark and its antioxidant activities evaluation
JIN Jie,WANG Yi-feng*
(College of Life Science,Northwest Normal University,Lanzhou 730070,China)
UsingAraliachinensisL.stem-bark as materials,optimal process conditions of ultrasonic-assisted extraction ofAraliachinensisL.stem-bark polysaccharides(ACSP)and its antioxidant activities were studied.According to the Box-Behnken design principle,based on the single factor experiment,four-factor(ratio of water to material,extraction temperature,ultrasonic power and extraction time)three-level response surface methodology(RSM)was conducted.The optimal extraction conditions of ACSP were determined as follows:ratio of water to material was 33 mL/g,extraction temperature was 71 ℃,ultrasonic power was 124 W,extraction time was 93 min.Under optimal conditions,predicted value of polysaccharides yield was 12.897%,verified value was 12.871±0.11%.The results of antioxidant activities of ACSPinvitroshowed that the scavenging activity of DPPH,hydroxyl radical,superoxide radical and reducing power increased with the increase of polysaccharides concentration in the experimental range.Conclusion:the regression model generated from RSM was feasible to optimize the ultrasonic-assisted extraction process of ACSP.ACSP has good antioxidant activity,which may be explored as a natural antioxidant in medicine or functional foods areas.
AraliachinensisL stem-bark polysaccharides(ACSP);ultrasonic-assisted extraction;response surface methodology(RSM);antioxidant activities
2015-09-24
靳洁(1992-),女,硕士研究生,研究方向:植物资源的开发及利用,E-mail:jinjie920119@aliyun.com。
王一峰(1964-),男,博士,教授,研究方向:植物资源的利用与开发,E-mail:wangyifeng6481@aliyun.com。
国家自然科学基金项目(31460105);兰州市科技局项目(2013-4-89)。
TS201.1
B
1002-0306(2016)09-0218-07
10.13386/j.issn1002-0306.2016.09.034
