裂壶藻补糖发酵及糖氮代谢对产油的影响
2016-09-12林源锋谢鑫磊何东平
付 杰,林源锋,谢鑫磊,田 华,陈 涛,何东平,*
(1.武汉轻工大学食品科学与工程学院,湖北武汉 430023;2.中国科学院武汉病毒研究所,湖北武汉 430071)
裂壶藻补糖发酵及糖氮代谢对产油的影响
付杰1,林源锋1,谢鑫磊1,田华1,陈涛2,何东平1,*
(1.武汉轻工大学食品科学与工程学院,湖北武汉 430023;2.中国科学院武汉病毒研究所,湖北武汉 430071)
为了探索裂壶藻(Schizochytriumlimacinum)突变株生长及产油过程中对碳源和氮源的需求,本文对发酵各阶段的碳源和氮源利用变化情况进行测定,并设定五个在不同时期的补糖实验组进行研究,分别观测各组各时期生物量、油脂产量。结果表明,前96 h是裂壶藻生长的重要时期,生物量大幅度增长,在发酵144~168 h时,油脂产量达到最大,各组经发酵7 d收获总的藻体,对生物量、油脂产量、DHA含量和DHA产量进行综合测定,结果表明,在发酵120 h时进行补糖为最佳时期,且油脂产量及DHA产量相比于对照组分别高出18.80%和22.44%。当氮源耗尽时补糖不仅可以促进油脂的产生,而且对DHA的形成也是有利的。
裂壶藻突变株,营养代谢,补糖发酵
DHA具有防治心血管疾病,提高人体免疫力、预防和减轻精神疾病、消炎、抗癌等功能。1993年世界卫生组织正式推荐婴幼儿生长发育早期阶段要补充DHA后,DHA吸引了越来越多的关注[1-2],裂壶藻(Schizochytriumlimacinum)是一种海洋真菌,该菌富含DHA,油脂含量高、生长快、易于培养、对人畜无毒害,并且细胞内脂肪酸组成简单、分离纯化工艺简单,是一种极具工业化生产前景的微生物油脂资源[3-4]。
裂壶藻在生长对数期之前主要利用碳源和氮源进行自身的生长繁殖和油脂积累,生长对数期之后若没有及时的碳源补给,裂壶藻便会分解自身的油脂来提供生存所必需的能量[5]。因此,及时的补糖有利于裂壶藻油脂积累[6-7]。卢英华等[8]利用流加技术高密度培养裂壶藻生产DHA,生物量、脂肪酸及DHA含量分别达到60.6、40.2和8.0 g/L。De Swaaf等[9]报道,当发酵液中葡萄糖浓度过高会抑制菌体生长,只有当碳氮浓度适中,并且达到一个适合的碳氮比才有可能尽量的提高产油率和DHA含量。本文通过研究裂壶藻发酵过程中的碳氮含量的变化,通过每天对发酵液碳氮含量进行测定,并且观测生物量、油脂产量及DHA产量,了解裂壶藻发酵过程中,碳氮代谢对产油的影响,并且通过对不同的培养时间补糖发酵,以期来增加油脂产量,从而为大规模生产化提供了必要的科学基础。
1 材料与方法
1.1材料与仪器
裂壶藻株ATCC20888广东微生物菌种保藏中心,并经过等离子诱变获得的裂壶藻突变株15k-160s-2-3,本实验室保存。葡萄糖、氯化钠、碳酸氢钠、硫酸钠天津博迪化工股份有限公司;酵母膏北京奥博星生物技术有限责任公司;谷氨酸钠上海如吉生物科技发展有限公司;硫酸镁国药集团化学试剂有限公司;氯化钴天津市恒兴化学试剂制造有限公司;正己烷天津市科密欧化学试剂有限公司;磷酸二氢钾、氯化钙天津市凯通化学试剂有限公司;无水乙醇天津天力化学试剂有限公司;纤维素酶、碱性蛋白酶江苏锐阳生物科技有限公司;实验所用的试剂均为分析纯。
Agilent 7890A气相色谱仪安捷伦科技(中国)有限公司;SPX-150C恒温恒湿箱上海博讯实业有限公司医疗设备厂;HYQ-150S全温摇床武汉汇诚生物科技有限公司;YM75立式压力蒸汽灭菌器上海三申医疗器械有限公司;SW-CJ-1F 单人双面净化工作台苏州净化设备有限公司;XSP-BM-2CA生物显微镜宁波永新光学有限公司。
固体培养基:葡萄糖80 g/L、谷氨酸钠18 g/L、酵母膏12 g/L、海水晶24 g/L、硫酸铵2.4 g/L、金属离子混合液1 mL、维生素混合液2 mL、琼脂2%。液体培养基:葡萄糖80 g/L、谷氨酸钠18 g/L、酵母膏12 g/L、海水晶24 g/L、硫酸铵2.4 g/L、硫酸钠6 g/L、磷酸二氢钾5.76 g/L、金属离子混合液1 mL、维生素混合液2 mL。
1.2实验方法
1.2.1发酵补糖代谢设计设计五个实验组分别在发酵24、48、72、96、120 h时补15 g/L糖和一个不补糖发酵的对照组,并且五个实验组和对照组初始葡萄糖质量浓度均为80 g/L,每24 h检测各组糖、氮利用情况,并收获藻体,分别测定各阶段产油量。最后对整个发酵周期完全的各组进行生物量、产油量、DHA含量及DHA产量的整体测定。
1.2.2无菌培养条件种子培养:从无菌长势良好的藻种的斜面上取一定量纯净的藻落,用无菌破口试管取10%接种到种子培养液中,置于摇床上,pH6.5,26 ℃、180 r/min条件下培养。
发酵培养:用灭过菌的破头吸管吸取10%的种子液,转接于发酵培养基中,于26 ℃、180 r/min的条件下振荡培养。
1.2.3还原糖质量浓度的测定参照菲林试剂法[10]
1.2.4氨基酸质量浓度的测定参照甲醛滴定法[11]
1.2.5生物量的测定裂壶藻的生物量以收集的菌体细胞干质量计。取培养好的菌体发酵液100 mL预先称重的离心管中5000 r/min离心20 min,弃上清液,沉淀用蒸馏水清洗后再次离心、弃上清液,反复操作3次,置于干燥箱中,60 ℃条件下烘干至质量恒定,称质量。生物量的计算公式如下:

1.2.6油脂的提取及产量测定油脂的提取:将裂壶藻发酵液经过离心分离,去除上清液,在藻泥中加入一定量的蒸馏水混合均匀,置于恒温磁力搅拌器中,温度60 ℃下搅拌,调节pH到8左右,按发酵液质量体积的0.5%和0.025%分别加入碱性蛋白酶和纤维素酶,55 ℃酶解6~8 h,用显微镜观察破壁情况,破壁完成置于真空冷冻干燥至质量恒定,研磨成藻粉,用乙醚索氏抽提至藻粉至无色,旋转蒸发残留溶剂,置于烘箱干燥至两次质量变化<0.2 mg/L,计算油脂质量。油脂产量及含油率的计算公式如下:

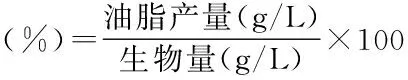
1.2.7DHA含量测定
1.2.7.1待测样品的处理精密称取0.2 g的油脂于20 mL试管中,加入0.5 mol/L的NaOH-CH3OH溶液2 mL,60 ℃水浴加热至油珠完全溶解(约30 min),冷却后加入25%的BF3-CH3OH 溶液2 mL,60 ℃水浴酯化20 min。冷却后加入2 mL正己烷并振荡,再加入2 mL饱和NaCl溶液并振荡。静置30 min后取上层有机相于一只干燥试管中,并加入少量无水硫酸钠以去除微量水分,经气相色谱分析得到DHA相对含量。
DHA产量计算公式如下:
DHA产量(g/L)=油脂产量(g/L)×DHA含量(%)
1.2.7.2气相色谱分析条件色谱柱:Agilent SP-2560(100 m×25 μm,0.2 μm);升温程序:100 ℃保持4 min,以3 ℃/min升温至230 ℃,保持20 min,载气(N2)流速25 mL/min,压力2.4 kPa,进样量1 μL;分流比15∶1。
2 结果与分析
2.1裂壶藻突变株对碳、氮的利用变化及不同时期的补糖对产油的影响
裂壶藻突变株对碳、氮利用的变化及补糖发酵对产油的影响的情况见图1~图6,图1为A组对照组,图2~图6为B、C、D、E、F组分别为发酵24、48、72、96、120 h时补15 g/L糖组,将对照组和各实验组发酵培养7 d,每隔24 h用斐林试剂法和甲醛滴定法对各组各时刻的碳、氮变化进行测定,并计算碳、氮消耗情况、碳氮比,确定生物量及油脂产量。首先测定了每组实验初始葡萄糖和氨基酸质量浓度将近为80.92 g/L和14.86 g/L,其次在各组分别补糖,补糖组在补糖时刻,糖的含量都高于其他各组,当发酵144 h以后测定A、B、C、D、E、F组葡萄糖和氨基酸质量浓度基本不变。最后在发酵168 h后收获藻体,测定各组总的生物量、油脂产量、DHA含量、DHA产量,进行综合对比。
从图1首先看出对照组A前96 h糖耗为86.76%左右,氮耗为92.92%左右;说明前96 h是裂壶藻利用营养物质的主要时期,96 h后碳源和氮源消耗趋于稳定;其次前96 h糖耗的速率先慢后快,而氮耗的速率则是先快后慢,表明裂壶藻突变株前期较快利用氮源进行营养生长。并且前96 h生物量大幅度增长,说明前96 h为裂壶藻快速增长期,96 h之后生物量增长比例变小,而油脂产量增长比例逐渐增大。在144 h达到产量最大值,说明裂壶藻在发酵后期为产油脂重要时期。当168 h收获时发酵液中剩余残糖质量浓度仅8.62 g/L,氨基酸质量浓度为1.02 g/L,碳/氮质量浓度(g/L)比约为8.5∶1。
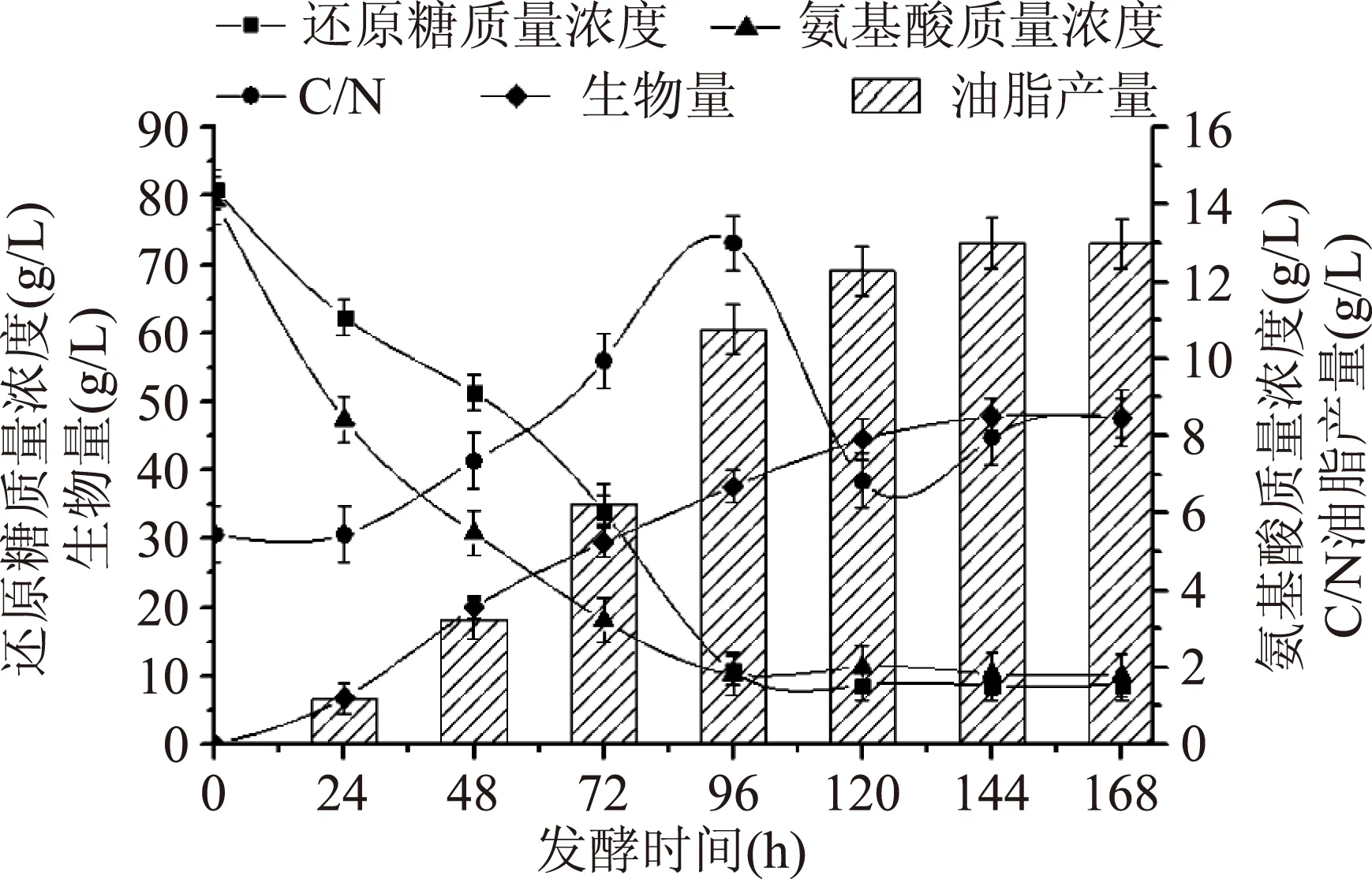
图1 对照组A碳、氮利用变化Fig.1 Contrast group A changes of the use of sugar and nitrogen
从图2看出实验组B与对照组A相比氨基酸质量浓度曲线基本不变,还原糖质量浓度曲线在24 h时略有上升;96 h后趋于稳定,此时糖耗为86.13%左右,氮耗为92.60%左右;在前48 h生物量及油脂产量相比于对照组有所下降,可能是因为发酵24 h补糖后,糖浓度过高对裂壶藻生长有一定的抑制作用。当168 h放瓶收获时发酵液中剩余残糖质量浓度仅8.52 g/L,氨基酸质量浓度为1.04 g/L,碳/氮质量浓度(g/L)比约为8.2∶1。

图2 实验组B碳、氮利用变化Fig.2 Test group B changes of the use of carbon and nitrogen
从图3看出实验组C与对照组A相比氨基酸质量浓度曲线基本不变,还原糖质量浓度曲线在48 h时略有上升;96 h后趋于稳定,此时糖耗为86.51%左右,氮耗为90.71%左右;生物量和油脂产量相比于对照组A、B都有小幅度的提高。当168 h放瓶收获时发酵液中剩余残糖质量浓度仅8.28 g/L,氨基酸质量浓度为1.28 g/L,碳/氮质量浓度(g/L)比约为6.5∶1。

图3 实验组C碳、氮利用变化Fig.3 Test group C changes of the use of carbon and nitrogen
从图4看出实验组D与对照组A相比氨基酸质量浓度曲线基本不变,还原糖质量浓度曲线在72 h时略有上升;96 h后趋于稳定,此时糖耗为87.33%左右,氮耗为91.39%左右;生物量和油脂产量相比于对照组A、B、C都有一定幅度的提高。当168 h放瓶收获时发酵液中剩余残糖质量浓度仅8.32 g/L,氨基酸质量浓度为1.29 g/L,碳/氮质量浓度(g/L)比约为6.5∶1。
图4 实验组D碳、氮利用变化Fig.4 Test group D changes of the use of carbon and nitrogen
从图5看出实验组E与对照组A相比氨基酸质量浓度曲线基本不变,还原糖质量浓度曲线在96 h时略有上升;前72 h糖耗为52.81%左右,氮耗为85.24%左右;当96 h补15 g时时,发酵液中残糖浓度为47.19%左右,氨基酸浓度为9.89%左右;生物量相比于对照组A没有太大增长,而油脂产量相比于A、B、C、D组却有一定幅度提高,说明发酵中后期补糖对裂壶藻产油脂有比较大的影响。当168 h放瓶收获时发酵液中剩余残糖质量浓度仅8.46 g/L,氨基酸质量浓度为1.05 g/L,碳/氮质量浓度(g/L)比约为8∶1。
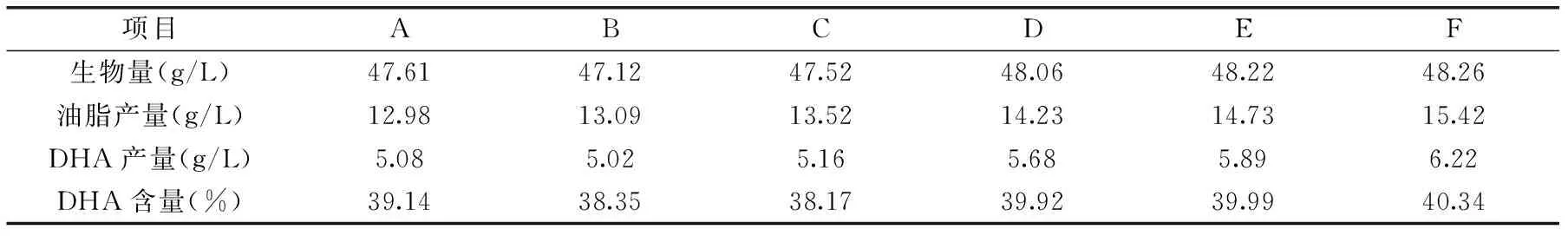
表1 对照组和实验组的生物量、油脂产量、DHA产量及含量Table 1 The Biomass,oil production,DHA production and content of contraet group and test group
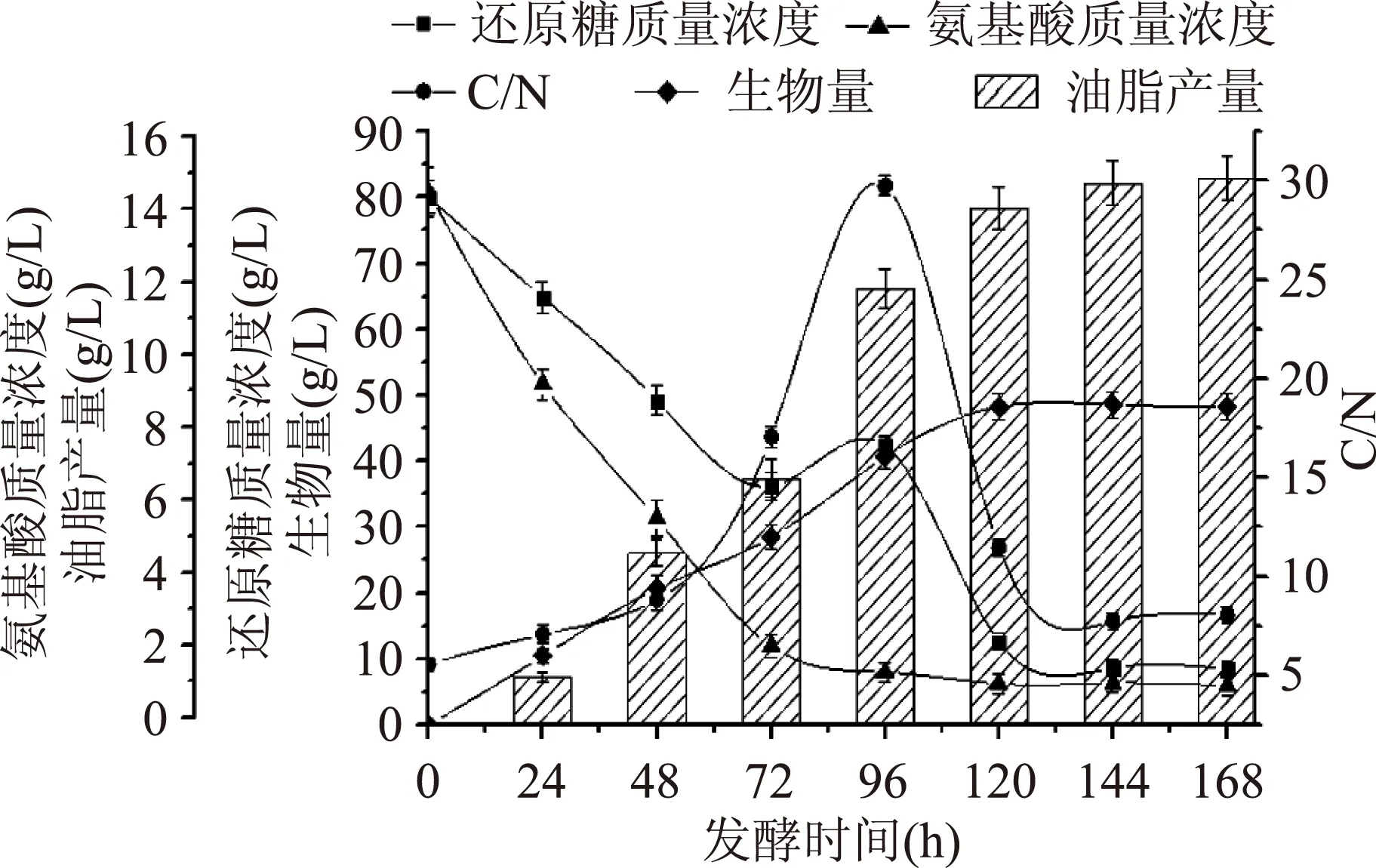
图5 实验组E碳、氮利用变化Fig.5 Test group E changes of the use of carbon and nitrogen
从图6看出实验组F与对照组A相比氨基酸质量浓度曲线基本不变,还原糖质量浓度曲线在120 h时略有上升;前96 h糖耗为84.37%左右,氮耗为92.02%左右;当120 h补糖15 g时,发酵液中残糖浓度为29.16%左右,氨基酸浓度为7.70%左右;图中可以看出F组生物量、油脂产量相比于其他各组都有相当程度的提高,说明在发酵后期补充一定量的碳源对于裂壶藻产油是非常有利的。当168 h放瓶收获时发酵液中剩余残糖质量浓度仅8.70 g/L,氨基酸质量浓度为1.10 g/L,碳/氮质量浓度(g/L)比约为8∶1。
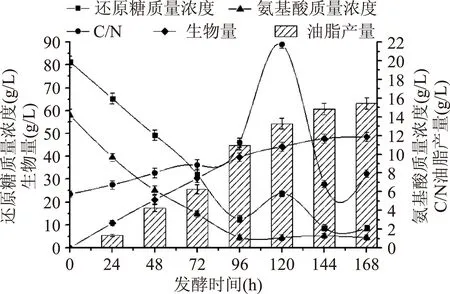
图6 实验组F碳、氮利用变化Fig.6 Test group F changes of the use of carbon and nitrogen
2.2补糖发酵对裂壶藻突变株干重、产油率及DHA的影响
将对照组及实验组发酵7 d后,对它们的生物量、油脂产量、及DHA产量及含量进行综合测定,得出表1。
从表1中可以看出,实验组B、C、D、E、F中生物量、油脂产量、DHA产量、DHA含量多数都高于对照组A,尤其是实验组F油脂产量及DHA产量相比于对照组A分别高出18.80%和22.44%。
3 结果与讨论
本文通过对裂壶藻糖、氮代谢变化进行观测,得出前96 h是裂壶藻生长的重要时期,随着发酵的不断进行,碳/氮比会一直下降。当对照组发酵至120 h时,发酵液中碳/氮比约为7∶1,此时补糖的F组生物量、油脂产量DHA产量及含量都达到本实验最高。从补糖角度来分析,五个不同的补糖实验组油脂的生物量、油脂产量、DHA产量及含量多数高于对照组。卢英华等通过流加培养裂壶藻表明,当裂壶藻受到氮源的限制,油脂浓度成指数增长。说明油脂的积累是在细胞生长受限的条件下进行的,细胞不会消耗自身合成的油脂;在线性生长时,营养限制使得细胞生长受限因此产生更多的油脂,并且充足的营养供给可能导致更多的饱和脂肪酸合成,相反氮源的限制可能使得更多的不饱和脂肪酸形成。本实验结果也表明当氮源耗尽时补糖不仅可以促进油脂的产生,而且对DHA的形成也是有利的。
[1]陈亚非,黄珮珊.二十二碳六烯酸单细胞油(DHASCO——婴幼儿及孕产妇的DHA营养补充剂[J].中国油脂,2005,30(8):68-72.
[2]朱路英,张学成,王淑芳,等.一种海洋真菌——裂殖壶菌的营养成分分析[J].食品科学,2009,30(24):272-275.
[3]van der Meeren,Gro,Tlusty,Michael F.,Metzler,Anita,et al.Effects of dietary DHA and EPA on neurogenesis,growth,and survival of juvenile American lobster,Homarus americanus[J]. New Zealand Journal of Marine and Freshwater Research,2009,43(1):225-232.
[4]郭小婧,龚阳敏,梁焯,等.温度和碳源对隐甲藻生长及DHA积累的影响[J].中国油料作物学报,2013,35(5):597-603.
[5]朱路英,张学成,宋晓金,等.碳、氮源浓度和培养时间对裂殖壶菌生长和脂肪酸组成的影响[J].中国海洋大学学报(自然科学版),2007,37(2):293-298.
[6]Marina Bely,Alessandra Rinaldi,Denis Dubourdieu,et al.Influence of Assimilable Nitrogen on Volatile Acidity Production by Saccharomyces cerevisiae during High Sugar Fermentation[J].Journal of Bioscience and Bioengineering,2003,
96(6):507-512.
[7]陈丽珠.高密度培养裂殖壶菌生产二十二碳六烯酸[D].厦门:厦门大学,2008.
[8]卢英华,凌雪萍,敬科举,等.流加培养裂殖壶菌发酵生产二十二碳六烯酸[J].厦门大学学报:自然科学版,2009,48(1):84-88.
[9]M.de Swaaf,J.Pronk,L.Sijtsma.Fed-batch cultivation of the docosahexaenoic-acid-producing marine alga Crypthecodinium cohnii on ethanol[J].Applied microbiology and biotechnology, 2003,61(1):40-43.
[10]赵书林,何东平,陈涛,等.寇氏隐甲藻突变株的糖、氮代谢对产油的影响[J].中国粮油学报,2014,29(11):65-69.
[11]佘隽,田华,陈涛,等.高产DHA的寇氏隐甲藻突变株的筛选[J].食品科学,2013,34(17):230-23.
Effect of oligosaccharide-adding fermentation and sugar-nitrogen metabolism onSchizochytriumlimacinumproducing oil
FU Jie1,LIN Yuan-Feng1,XIE Xin-lei1,TIAN Hua1,CHEN Tao2,HE Dong-ping1,*
(1.College of Food Science and Engineering,Wuhan Polytechnic University,Wuhan 430023,China;2.Wuhan Institute of Virus,Chinese Academy of Sciences,Wuhan 430071,China)
In order to explore the requirement of sugar and nitrogen sources in the vegetative growth and oil production of limacinumSchizochytriummutant strain,this study determined the change of carbon source and nitrogen source at different fermention stages,and the experimental groups oligosaccharide-adding were set up at five different periods,and the biomass and oil production of each group were measured.The research showed that the first 96 h was the important period of the limacinumSchizochytriumgrowth,and the biomass increased rapidly.When it was fermented for 144~168 h,the oil yield reached at the maximum value.The total biomass,lipid production,DHA content and DHA production were comprehensively measured after fermenting for 7 d.The result showed that it was the optimal time to adding oligosaccharide when fermented for 120 h,and the yield of oil and DHA were increased by 18.80% and 22.44% compared with the control group.When the nitrogen source was depleted,oligosaccharide supplement can not only promote the production of oil,but also benefit the formation of DHA.
Schizochytriumlimacinummutant strain;nutrient metabolism;oligosaccharide supplement fermentation
2015-10-16
付杰(1991-),男,硕士研究生,研究方向:微生物油脂,E-mail:2683802254@qq.com。
何东平(1957-),男,博士,教授,研究方向:粮食、油脂及植物蛋白,E-mail:hedp123456@163.com。
国家粮食局粮食公益性行业科研专项(201313012-03)。
TS201.3
A
1002-0306(2016)09-0175-05
10.13386/j.issn1002-0306.2016.09.026
