东紫苏(Elsholtizabodinieri Vaniot)总黄酮的提取及其抗氧化、免疫活性的研究
2016-09-12吕留庄刘克武刘克海
毛 媛,吕留庄,刘克武,刘克海,*
(1.上海海洋大学食品学院,上海 201306;2.黑龙江省林副特产研究所,黑龙江省非木质林产品研发重点实验室,黑龙江牡丹江 157011)
东紫苏(ElsholtizabodinieriVaniot)总黄酮的提取及其抗氧化、免疫活性的研究
毛媛1,吕留庄1,刘克武2,刘克海1,*
(1.上海海洋大学食品学院,上海 201306;2.黑龙江省林副特产研究所,黑龙江省非木质林产品研发重点实验室,黑龙江牡丹江 157011)
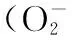
东紫苏,总黄酮,抗氧化,免疫
东紫苏别名凤尾茶、野山茶、小山茶、小香薷、牙刷草等,是唇形科香薷属的矮小半灌木状植物,主产于我国云南、贵州、甘肃等地[1]。据报道,东紫苏是香薷属植物中现存的唯一食药两用的植物[2]。东紫苏外形美观,植株含挥发油,气味清香,还含有黄酮类、甾体、萜类、酚类、鞣质、氨基酸、多肽、蛋白质、多糖、苷类等活性成分,且含有多种有益的微量元素,具有较高的食用、药用和观赏价值[1]。
据研究表明,东紫苏中黄酮含量丰富,高达10%以上,不同产地有所差异[3]。目前对东紫苏的研究多集中在挥发油,但对其黄酮研究较少,除木犀草素和槲皮素的抑菌活性外,其他活性尚未见报道。黄酮化合物药理作用主要包括降血脂、抗氧化、抗炎、调节免疫、镇痛、抗肿瘤等。本文通过正交实验提取了东紫苏的总黄酮,并首次对其清除自由基活性、免疫活性进行研究,为东紫苏的开发利用提供了一定的理论依据。
1 材料与方法
1.1材料与仪器
东紫苏购买于云南省文山,常温避光储藏;芦丁标准品纯度>96.6%,购买于Sigma;鲁米诺纯度≥97%,Sigma,购买于国药集团化学试剂有限公司;乙醇、甲醇、正丁醇、亚硝酸钠、硝酸铝、氢氧化钠、碳酸钠、碳酸氢钠、EDTA、双氧水、邻苯三酚、印度墨水等:分析纯,购买于国药集团化学试剂公司。
ICR小鼠SPF级,18~20 g,上海斯莱克实验动物有限责任公司,合格证号:2007000577656.动物于实验前在动物房环境中适应一周。
毛细管100 mm,1.8~2.2 mm,购买于国药集团化学试剂有限公司粉碎机,FW100型,上海安锐自动化仪表有限公司;水浴锅HH2型,上海比朗仪器制造有限公司;旋转蒸发仪RE-52C型,上海青浦沪西仪器厂;分光光度计PharmaSpec UV-3600,日本shimadzu公司;酶标仪SH-1000型,北京华拓鸿达科技有限公司。
1.2实验方法
1.2.1东紫苏总黄酮含量的测定
1.2.1.1标准曲线的绘制东紫苏中总黄酮含量的测定方法采用NaNO2-Al(NO3)3-NaOH分光光度法[4]。准确称取10 mg干燥的芦丁标准品于50 mL容量瓶中,加无水乙醇定容,摇匀。分别吸取该溶液0,1,2,3,4,5 mL于25 mL容量瓶中,加入1 mL 5%的NaNO2溶液,摇匀,还原6 min后,加入1 mL 10%的Al(NO)3溶液,摇匀,络合6 min后,加入10 mL 4%的NaOH溶液,摇匀,显色15 min后,用水定容,继续静置15 min,在500 nm处测定各溶液的吸光度,并以吸光度值(A)作为纵坐标,溶液浓度(C)作为横坐标绘制标准曲线,得出线性方程。
1.2.1.2样品测定取0.1 mL提取液,按上述方法,测定各提取液在500 nm处的吸光度。根据所得线性方程及稀释倍数计算东紫苏中总黄酮的含量,计算公式为:
式中:w-东紫苏中总黄酮的含量;c-根据样品吸光度及标品线性方程得出的浓度;a-提取液的稀释倍数;V-萃取溶剂的体积;m-东紫苏的质量。
1.2.2东紫苏总黄酮的提取
1.2.2.1提取流程东紫苏洗净→烘干、剪碎→粉碎→称量→乙醇回流→上清液→蒸干→水复溶→正丁醇萃取→正丁醇相→蒸干→乙醇溶解→4 ℃保存[4]
1.2.2.2提取工艺优化采用1.2.2.1的提取工艺流程,根据前期单因素实验结果选择提取温度、回流时间和料液比3个因素,采用L9(34)正交表按照表1进行实验。
1.2.3东紫苏总黄酮抗氧化活性的研究
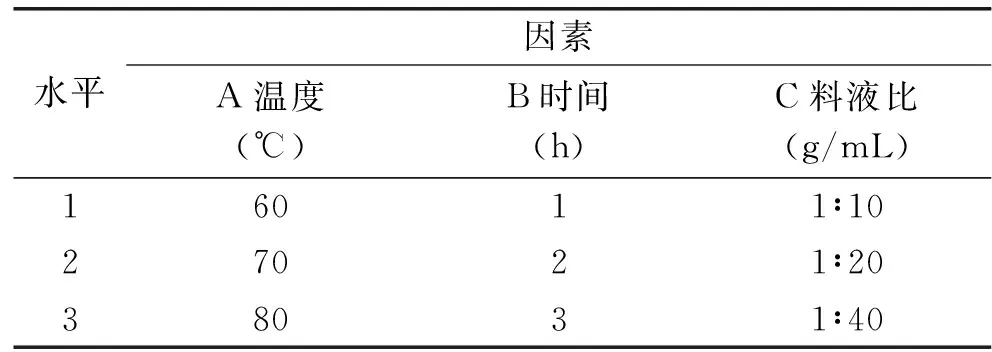
表1 因素水平表Table 1 Factor and level
1.2.3.2清除双氧水能力(H2O2)的测定东紫苏总黄酮清除双氧水的能力通过鲁米诺-过氧化氢化学发光体系测定[6]。配制0.1 mmol/L 的鲁米诺碳酸盐缓冲液(Na2CO3-NaHCO30.05 mol/L,pH=9.4)和0.15 mol/L的H2O2,将样品溶液用60%乙醇稀释成50、100、150、200 μg/mL、1 mg/mL。测量时,样品组依次加入样品10 μL、双氧水10 μL、鲁米诺-磷酸盐缓冲溶液150 μL;对照组依次加入蒸馏水10 μL、双氧水10 μL、鲁米诺-磷酸盐缓冲溶液150 μL。在20 ℃下,每隔0.6 s记录一次发光强度,连续记录30 s。
自由基清除率计算公式为:
式中:R-自由基清除率,%;Lc-对照组的发光强度;Ls-样品组的发光强度。
1.2.4东紫苏总黄酮免疫活性的研究免疫活性通过碳粒廓清实验测定[7-8]。将24 只小鼠随机分为4组,每组6只。分别为模型对照组、黄酮低剂量组(100 mg/kg)、黄酮中剂量组(150 mg/kg)、黄酮高剂量组(200 mg/kg)。每天称重、灌胃提取液1次,模型对照组给以生理盐水(0.2 mL/10 g)。于第14 d给药1 h后,对每只小鼠尾静脉注射用生理盐水稀释5倍的印度墨汁(0.1 mL/10 g),待墨汁注入,立即计时。2 min(T1)和10 min(T2)后,分别从每只小鼠眼眶取血100 μL,加到4 mL 0.1%的NaHCO3溶液中,在660 nm处测其吸光度值,计算碳粒廓清指数K。然后将小鼠处死,取肝脏、脾脏,用滤纸吸干表面的血液,称其重量,计算吞噬指数α。计算公式如下:
式中:K-碳粒廓清指数;OD1、OD2-2 min和10 min时采血的吸光值;T2、T1-两次采血的时间差,min。
式中:α-吞噬指数;BW-小鼠的体重,g;LW-小鼠的肝脏重量,g;SW-小鼠的脾脏重量,g。
2 结果与分析
2.1总黄酮含量测定标准曲线
以干燥的芦丁为标准品,采用NaNO2-Al(NO3)3-NaOH分光光度法绘制标准曲线,如图1。回归方程为Y=15.400X+0.0128,r=0.9989。标准曲线显示,在0.008~0.04 mg/mL的浓度范围内,芦丁标准品的500 nm处的吸光度与浓度呈良好的线性关系。
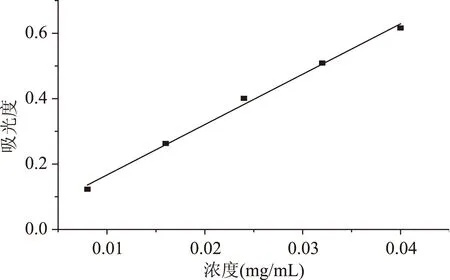
图1 芦丁标准曲线Fig.1 Standard curve of rutin
2.2总黄酮提取工艺的优化
提取温度、回流时间和料液比3个因素正交实验结果见表2。由表2可知,对东紫苏总黄酮提取效果的影响因素大小依次为料液比>回流时间>提取温度。由表3可知,B、C具有显著性差异,为影响黄酮提取工艺的主要因素,而A则不具有显著性意义,为次要因素。

表2 正交实验结果Table 2 Result of orthogonal experiment
对主要因素B、C水平选择,从综合评分B3>B2>B1、C2>C1>C3,宜分别选B3、C2;因素A影响较小,为节约能源,应选A1。故确定优化条件为A1B3C2,即提取温度为60 ℃,回流提取为3 h,料液比为1∶20(g/mL)。
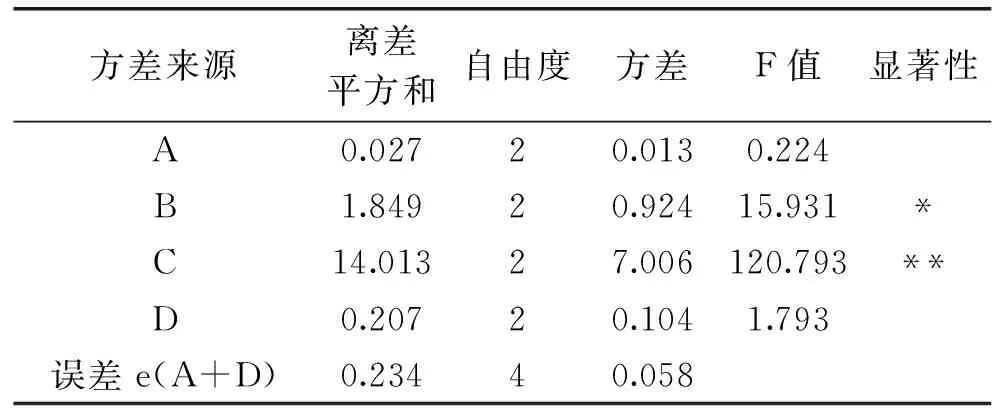
表3 方差分析Table 3 Analysis of variance
注:F0.05(2,4)=6.94,F0.01(2,4)=18.00。
2.3东紫苏总黄酮抗氧化活性
清除率的影响(n=4,x±s)
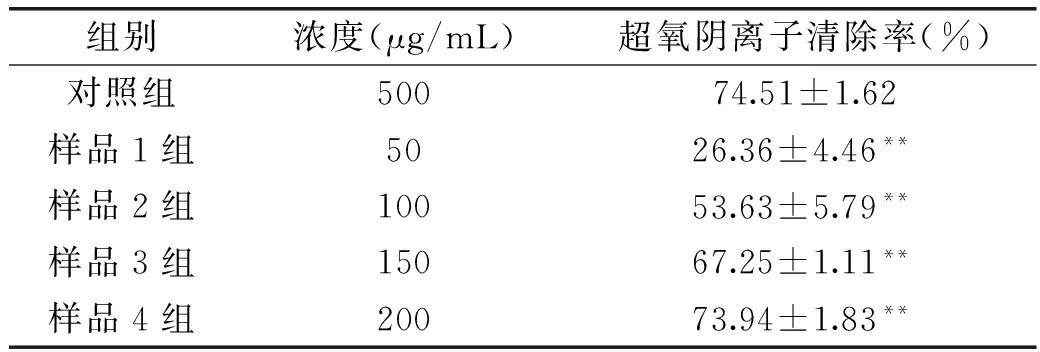
组别浓度(μg/mL)超氧阴离子清除率(%)对照组50074.51±1.62样品1组5026.36±4.46**样品2组10053.63±5.79**样品3组15067.25±1.11**样品4组20073.94±1.83**
注:与对照组对照,**p<0.01,差异极显著;表5同。
2.3.2双氧水(H2O2)清除能力在碱性条件下,H2O2会氧化冷发光剂鲁米诺,产生化学发光。通过测定发光信号的变化来检验样品对H2O2的清除能力[5]。同2.3.1,由发光强度与样品浓度的关系可知东紫苏总黄酮对H2O2的清除率,由表5可知,东紫苏总黄酮的浓度越高,对H2O2的清除率越大,并且在50~200 μg/mL的浓度范围内,清除率为48.56%~77.39%,半抑制浓度IC50为 50.59 μg/mL,表明东紫苏总黄酮对H2O2具有较高的清除作用。
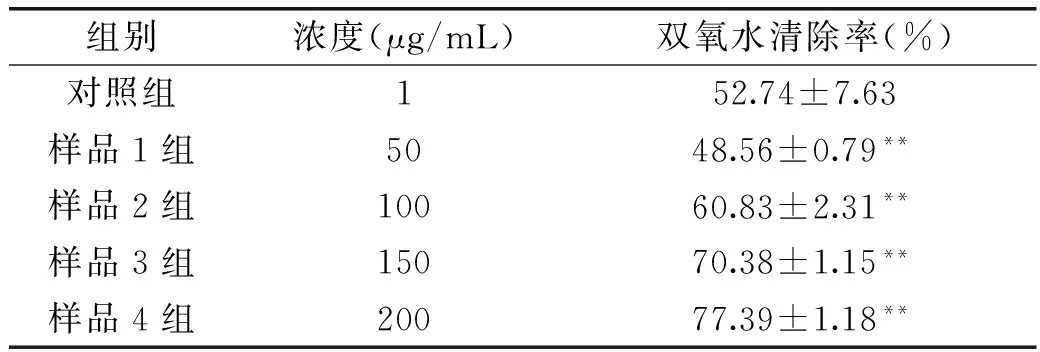
表5 东紫苏总黄酮对双氧水(H2O2) 清除率的影响(n=4,x±s)Table 5 Effect of flavonoids from EBV on H2O2(n=4,x±s)
2.4东紫苏总黄酮免疫活性
碳粒廓清实验是通过测定血液中碳粒的消失速度来反映单核巨噬细胞系统吞食异物的能力,碳粒廓清指数K和吞噬指数α越大,表明其体内免疫作用越强[8]。由表6可知,相对于对照组,实验组的K值和α值都有提高,并且高剂量组呈现了极显著性差异(p<0.01),说明东紫苏黄酮可以明显增强小鼠腹腔巨噬细胞的吞噬功能,具有促进小鼠免疫功能的作用。有研究表明:减少过氧化脂质LPO损伤,可提高机体的免疫作用[9]。因此,推测东紫苏总黄酮的免疫功能与其具有良好的抗氧化活性和清除自由基能力,从而降低LPO损伤免疫细胞的风险有关[10]。但其确切的作用机理还需进一步研究。
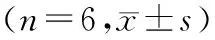
表6 东紫苏总黄酮对小鼠巨噬细胞 吞噬功能的影响Table 6 Effect of flavonoids from EBV on carbon clearance test of ±s)
注:与模型组对照,*p<0.05,**p<0.01。
3 结论
本实验通过正交实验筛选了回流提取东紫苏总
黄酮的最佳工艺条件:料液比1∶20(g/mL)、温度60 ℃、时间3 h,且料液比对提取效果的影响最大,其次为时间,温度对其影响较小。此外,东紫苏总黄酮的含量丰富,并且对超氧阴离子自由基和双氧水的清除效果明显,IC50分别为108.07 μg/mL和50.59 μg/mL,表明东紫苏总黄酮具有良好的抗氧化作用,是一种天然抗氧化剂。通过小鼠体内碳粒廓清实验,表明东紫苏总黄酮可增强小鼠体液免疫,对小鼠体质有一定的改善作用。本实验对东紫苏的进一步研究和开发提供了理论依据,今后有必要对东紫苏黄酮的具体成分,以及与活性相关的成分进行深入研究。
[1]云南省植物研究所.云南植物志[M].北京:科学出版社,1997,1:731.
[2]Gong MX,Zhou GP.Textual reserch of Elsholtzia plants.Beijing Tradit Chin MedPress,1996.
[3]陈海云,高言明.分光光度法对凤尾茶中总黄酮的含量分析[J].微量元素与健康研究,2006,23(6):18-19.
[4]库咏峰.肉桂总黄酮提取分离分析及抗氧化活性研究[D].广西:广西大学,2012.
[5]郭晓青,陈晓靓,杨春梅,等.紫苏叶活性成分及抗氧化性研究[J].食品与机械,2014,30(4):179-185.
[6]李书艺,周玮婧,孙智达,等.荔枝皮原花青素的体外抗氧化活性和对DNA损伤的保护作用[J].食品科学,2010,31(1):14-18.
[7]王钦博.桑黄抗氧化活性成分的筛选及其分离纯化[D].上海:上海师范大学,2011.
[8]George A,Chinnappan S,Choudhary Y,et al. Immunomodulatory activity of an aqueous extract of Polugonum minus Huds on Swiss albino mice using carbon clearance assay[J].Asian Pacific Journal of Tropical Disease,2014,4(5):398-400.
[9]罗千古,周玖瑶,李毓祺,等.黄芪丹参提取液对小鼠免疫系统的影响[J].中国医药导报,2011,8(2):23-24.
[10]储岳峰.九种中药成分的免疫增强活性及其作用机理研究[D].南京:南京农业大学,2003.
Extraction and its antioxidant,immune activities of total flavonoids fromElsholtziabodinieriVaniot
MAO Yuan1,LV Liu-zhuang1,LIU Ke-wu2,LIU Ke-hai1,*
(1.College of Food Science and Technology,Shanghai Ocean University,Shanghai 201306,China;2.Heilongjiang Forest By-Product and Speciality Research Institute,Heilongjiang Provincial Key Laboratory of Non-wood Forest Product Development,Mudanjiang 157011,China)
ElsholtizabodinieriVaniot;flavonoids;antioxidant activity;immune activity
2015-11-05
毛媛(1991-),女,硕士研究生,研究方向:食品科学与工程,E-mail:13262975153@163.com。
刘克海(1977-),男,博士,副教授,研究方向:中药新制剂,E-mail:khliu@shou.edu.cn。
上海市教育委员会重点学科建设项目(J50704);黑龙江省森林工业总局攻关项目(sgzjY201402)。
TS201.4
A
1002-0306(2016)09-0085-04
10.13386/j.issn1002-0306.2016.09.008
