莲子多酚氧化酶的分离与纯化
2016-09-12贺玉珊刘小如邓泽元黄伊宁杨小院胡蒋宁
贺玉珊,刘小如,邓泽元,黄伊宁,杨小院,胡蒋宁
(南昌大学食品科学与技术国家重点实验室,南昌大学食品学院,江西南昌 330047)
莲子多酚氧化酶的分离与纯化
贺玉珊,刘小如*,邓泽元,黄伊宁,杨小院,胡蒋宁
(南昌大学食品科学与技术国家重点实验室,南昌大学食品学院,江西南昌 330047)
由多酚氧化酶(polyphenol oxidase,PPO)导致的酶促褐变严重影响莲子的外观。本研究旨在探讨莲子PPO的提取纯化方法,为研究其蛋白结构、进一步探究莲子褐变机理提供理论依据。以酶活力和酶比活力为指标,对比了提取PPO的四种方法,发现匀浆吸附后丙酮沉淀法提取莲子PPO可获得较高的酶比活力,达289.04 U/mg;采用单因素实验对该提取方法进行优化,得最佳提取参数为:料液比1∶5、提取时间2 h、pH=7、含2% PVPP和0.8% TritonX-100提取溶液,优化后PPO粗酶液酶比活力为294.40 U/mg;采用DEAE Sepharose Fast FLow阴离子交换层析、Sephadex G-75凝胶柱层析对粗酶液进行纯化,得到分子量大约为58 ku莲子PPO,酶比活力为7926.68 U/mg,纯化倍数为26.92,回收率为38.48%。
莲子,多酚氧化酶,分离纯化
莲子,睡莲科莲属(NelumbonucifereGaertn)植物的成熟种子经剥壳去芯后的果实,已列入卫生部药食两用物品名单[1]。新鲜莲子,口感清甜,最大限度的保存了莲子的营养成分,具有较高的营养和经济价值。然而,新鲜莲子采收和储运过程中较易褐变,外观与风味随之劣变,严重影响了莲子的营养及经济价值,并制约莲产品的多元性开发。多酚氧化酶(polyphenol oxidase,PPO)是导致植物褐变的关键酶。有氧条件下,PPO与植物内源性酚类物质形成邻醌,邻醌通过自氧化途径形成聚合色素分子,产生褐变[2]。张有林等[3]研究表明多酚氧化酶为莲藕褐变的主要因素,而在富集PPO和酚类物质较多的莲子尖端褐变尤其明显[4]。因此提取纯化获得莲子PPO是探究莲子褐变机理的基础。目前,关于各种植物PPO分离纯化的研究不少,如采用匀浆或者丙酮提取,阴离子柱和凝胶柱进行纯化,得到的纯化倍数为17~259,相对分子质量为39~112 ku的PPO[5-7],但关于莲子PPO的分离纯化仍未有报道。本文研究对比了几种常见的PPO提取方法,确定了莲子PPO的最适提取方法并优化了提取工艺,继而对粗提酶液进行纯化,得到高纯度的莲子PPO,为研究其蛋白结构、探究莲子褐变机理提供实验基础。
1 材料与方法
1.1材料与仪器
鲜莲子江西广昌-80 ℃冻藏;交联聚乙烯吡咯烷酮(PVPP)、TritonX-100、丙酮、磷酸二氢钠、磷酸氢二钠、醋酸、醋酸钠、邻苯二酚、考马斯亮蓝G-250、牛血清蛋白、乙醇、磷酸等,均为分析纯。
超声细胞粉碎仪无锡市上佳生物科技有限公司;722G型可见分光光度计上海精科仪器有限公司;Neofuge 15R型台式高速冷冻离心机力康发展有限公司;稳压稳流电泳仪、电泳槽Bio-Rad公司;恒流泵保定兰格仪器有限公司。
1.2实验方法
1.2.1提取PPO的四种方法对比
1.2.1.1提取PPO的四种方法匀浆浸提法:取莲子尖端5.0 g,加入pH=7的 20 mmol/L预冷过含2% PVPP(m/v)的PBS缓冲溶液中,料液比为1∶4,冰浴研磨匀浆,4 ℃下浸提1.5 h,四层纱布过滤。于4 ℃、8500 r/min离心20 min,取上清液为粗酶液;匀浆后丙酮沉淀法:如匀浆浸提法中,冰浴研磨成匀浆4 ℃下浸提1.5 h后,置于4 ℃下 8500 r/min离心20 min。取上清液,加入2.5倍体积的冷冻丙酮(-20 ℃),同条件再次离心。取沉淀溶于4 ℃预冷的pH=7 Tris-HCl(含2%的PVPP)缓冲溶液,搅拌30 min,静置,重复数次。上清液即为粗酶液;丙酮沉淀后吸附法:如匀浆浸提法中冰浴研磨成匀浆,4 ℃下8500 r/min 离心20 min,取上清液加入2.5倍体积的冷冻丙酮(-20 ℃),4 ℃下 8500 r/min离心20 min,将沉淀物在4 ℃溶于pH=7的Tris-HCl缓冲溶液(含2%的PVPP),搅拌30 min,静置,反复数次。在4 ℃下 8000 r/min离心10 min,上清液为粗酶液;超声吸附法:如匀浆浸提法中,冰浴研磨成匀浆,在冰浴下超声(功率300 W,超声3 s,间隔15 s,超声10次)。四层纱布过滤,4 ℃ 8500 r/min离心20 min,取上清液为粗酶液。
1.2.1.2残存活力对比将四种不同方法提取的粗酶液置于温度为32 ℃,分别于2、4、6、8、9、10 d后检测酶活力。
1.2.1.3酶活力测定取1 mL pH=6.5的磷酸缓冲溶液和0.4 mL 0.2 mol/L邻苯二酚配成反应底物体系,加入0.1 mL的酶液后立即测定OD420值的变化,每10 s记录吸光度数值,以吸光度对时间曲线最初直线段的斜率表示为PPO活力,一个酶活力单位定义为在测定条件下,每分钟引起吸光度改变0.001所需的酶量。PPO的活力计算公式如下:
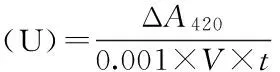
式中:ΔA420为420 nm处吸光度变化值;V为酶液的体积(mL);t为酶促反应时间(min)。
1.2.1.4酶比活力测定酶比活力是酶纯度的量度,即:单位重量的蛋白质中所具有酶的活力单位数,一般用U/mg表示,活力比越大,PPO的纯度越高。计算公式如下:

式中:酶活力单位为U/mL;蛋白质含量为mg/mL。
1.2.1.5蛋白质含量测定采用Bradford考马斯亮蓝法测定蛋白质含量,以牛血清蛋白制作蛋白标准曲线,标准曲线方程为y=0.0035X+0.005,R2=0.9993(式中:y为吸光度,X为蛋白质含量μg),根据方程计算出蛋白质含量。
1.2.2匀浆后丙酮提取法条件优化
1.2.2.1料液比固定提取溶液组分pH=7 PBS(含2% PVPP)、浸提1.5 h,于同等条件研究不同料液比(w/v):1∶1、1∶2、1∶3、1∶4、1∶5、1∶6、1∶7对莲子PPO粗提液酶活力及酶活力比的影响。
1.2.2.2提取液pH固定提取溶液组分2% PVPP、料液比为1∶4、浸提1.5 h,于同等条件下研究不同pH(4.5、5.0、5.5乙酸-乙酸钠缓冲溶液;6.0、6.5、7.0、7.5磷酸盐缓冲溶液)对莲子PPO粗提液酶活力及酶活力比的影响。
1.2.2.3浸提时间固定提取溶液组分pH=7 PBS(含2% PVPP)、料液比为1∶4,于同等条件研究不同浸提时间(0、1、2、3、4、5、6 h)对莲子PPO粗提液酶活力及酶活力比的影响。
1.2.2.4提取液的不同组成成分固定料液比为1∶4,pH=7,浸提1.5 h,于同等条件下研究不同组分的提取液(设置如表1)对莲子PPO粗提取液酶活力及酶活力比的影响。
1.2.3莲子多酚氧化酶的纯化
1.2.3.1DEAE Sepharose Fast Flow阴离子交换层析粗酶液经10 ku超滤管去除丙酮并浓缩,取3 mL浓缩液加于20 mmol/L Tris-HCl(pH=7)平衡的DEAE Sepharose Fast Flow 阴离子交换层析柱(1.0×20 cm),依次用含0.1、0.2、0.3 mol/L NaCl的Tris-HCl缓冲液(pH=7)各120 mL分阶段洗脱。洗脱速度为0.8 mL/min,每管8 mL,280 nm处监测波长。检测各管PPO活性,收集PPO活性峰,用10 ku超滤管浓缩备用。
1.2.3.2Sephadex G-75凝胶柱层析取经1.2.3.1步骤纯化的酶3.5 mL,加于经20 mmol/L Tris-HCl(pH=7)缓冲液平衡的Sephadex G-75凝胶柱(1.6×60 cm),以20 mmol/L Tris-HCl(pH=7)缓冲液进行洗脱,流速为0.5 mL/min,每管5 mL,280 nm处检测波长。检测各管PPO活性,收集酶活力高的溶液经10 ku超滤管浓缩后,置于-80 ℃备用。
1.2.3.3SDS-PGAE电泳采用4%浓缩胶和10%分离胶,上样量均为20 μL,电压分别为80 V和120 V,电泳完毕,经染色,脱色至电泳带清晰,背景干净后,用凝胶成像系统成像并采集数据。
1.2.3.4Native-PAGE电泳参照刘芳[8]方法略加改进,采用4%浓缩胶和10%分离胶(电压分别为80 V和120 V),样品缓冲液(1.5 mL pH=6.8 1 mol/L Tris-HCl,3 mL甘油,0.4 mL 0.5%溴酚蓝,用蒸馏水定容至10 mL)与酶提取液15 μL等体积混合。Native-PAGE染色:参照Conde-Petit[9]的方法,以0.06%邻苯二胺(0.01 mol/L草酸溶解)、1.0%邻苯二酚(20 mmol/L pH=6.5 PBS溶解)、20 mmol/L pH=6.5 PBS三种溶液按体积1∶2∶1混合制成染色液。电泳完毕后染色至酶带显现,取出漂洗后,成像并采集数据。
2 结果与分析
2.1提取PPO的四种方法对比
由图1可知,四种提取方法所得PPO粗提液均有较高的酶活力,表明四种方法均可用于提取莲子PPO。匀浆浸提有利于PPO的溶出,所得粗酶液酶活较高,但杂蛋白较多,酶比活力相对较低。丙酮的加入可助于分离沉淀蛋白质,减少杂质,提高酶的纯度,因而丙酮沉淀后吸附法所得粗酶液酶比活力较高,但丙酮会使部分酶蛋白变性沉淀或失活,酶活力较低。超声吸附法所得PPO粗提液酶活力最高(2934 U/mL),但其酶比活力相对较低。因超声辅助可加速莲子组织细胞破碎,有助于细胞内PPO溶出,表现为较高的酶活力,但超声也促使杂蛋白的溶出,导致酶纯度不高,即酶比活力并非最高。匀浆后丙酮沉淀法结合了匀浆浸提法和丙酮沉淀后吸附法的优点,先使用匀浆浸提增加PPO的溶出,浸提后加入丙酮沉淀,避免了丙酮先期加入所导致的酶蛋白变性失活。该方法所得PPO粗提液酶比活力最大,达289.04 U/mg,明显优于其他三种方法。
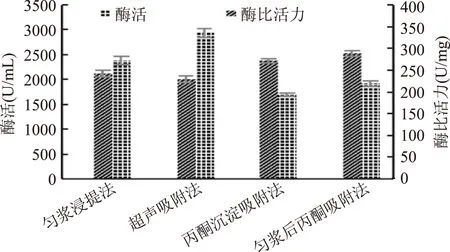
图1 四种提取PPO的方法对酶活力和酶比活力的影响Fig.1 Effect of four extracting methods on the PPO activity and specific activity
对比设置温度为32 ℃下,放置2、4、6、8、9、10 d后,四种方法所得粗酶液的酶活力下降情况,结果见图2。超声吸附法所得粗酶液因超声空化作用所产生的冲击波和热效应可能改变酶的构象,使酶蛋白稳定性较差,因而PPO活力下降较为明显,10 d后,酶活力仅为初提时的4.3%。匀浆浸提法所得粗酶液PPO活力亦有显著的下降。丙酮的加入可助于分离沉淀蛋白质,可提高酶纯度,有利于酶的保存。因而,丙酮沉淀吸附法和匀浆后丙酮吸附法所得粗酶液PPO活力下降较为缓慢,室温静置10 d后依然有较强的PPO活力。综合比较上述四种方法的优劣,本文采用匀浆后丙酮沉淀法作为莲子PPO的提取方法[10]。
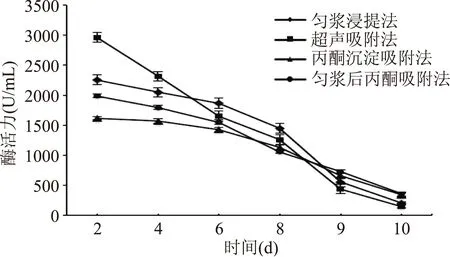
图2 四种提取PPO的方法酶活力变化Fig.2 Comparison between the four methods of extraction PPO by PPO activity
2.2匀浆后丙酮提取法优化分析
影响匀浆后丙酮沉淀法提取莲子PPO的因素较多,但尤以料液比、提取液pH、浸提时间、提取液成分影响显著。选择上述4种因素,以莲子PPO酶比活力和酶活力为指标,分析各单因素对匀浆后丙酮沉淀法提取莲子PPO效率及纯度的影响,优化提取工艺参数。
2.2.1料液比由图3可知,在料液比为1∶5时,酶粗提液的酶活力和酶比活力达到峰值,因提取溶液过少,溶解PPO的量有限,无法高效地提取PPO。但过量的提取溶液反而会降低莲子PPO浓度,不利于PPO的提取[11]。
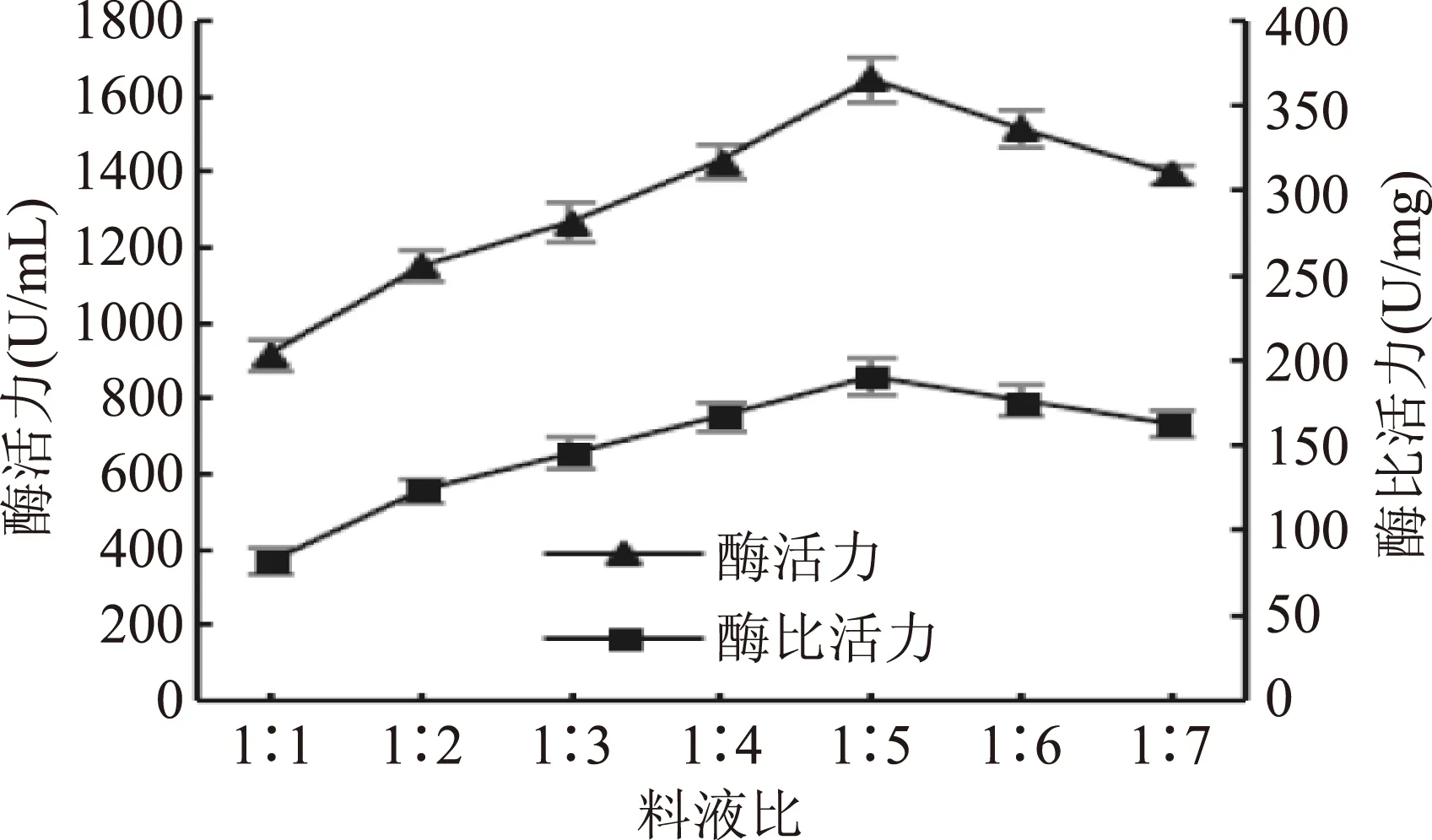
图3 料液比对莲子酶活力和酶比活力的影响Fig.3 Effect of the ratio of solid-to-solvent on the PPO activity and specific activity
2.2.2提取溶液pH由图4可知,随着提取液pH的增加,匀浆后丙酮沉淀所得酶粗提液的酶活力和酶比活力均有显著的增加,在pH=7.0时达到峰值。这是由于PPO为酸性蛋白[12],较低的pH条件下PPO易集聚沉淀,影响提取效果,而中性提取溶液则有助于莲子中酶和蛋白的溶出。弱碱性条件下(pH=7.5),所得酶粗提液的酶活力和酶比活力有较大幅度的降低,是PPO为含铜金属酶[12]。碱性的条件下,活性中心的Cu2+发生解离氧化甚至转化成Cu(OH)2沉淀,使得酶活力大大降低[12]。
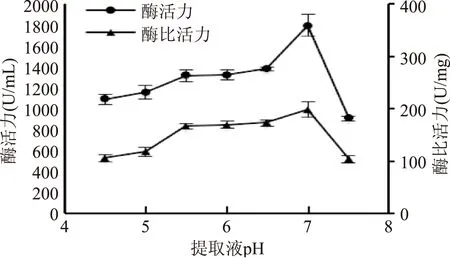
图4 提取液pH对莲子酶活力和酶比活力的影响Fig.4 Effect of the buffer pH on the PPO activity and specific activity of lotus seed extracts
2.2.3提取时间由图5可知,随着提取时间的增加,粗提液的酶活力和酶比活力均有显著的增加,提取2 h时,提取效率最高。继续延长提取时间,粗提液的酶活力和酶比活力有一定幅度降低。表明适度延长提取时间,有助于PPO的提取,而时间过长,多酚物质并不是能全部被PVPP吸附,所以,未被PVPP吸附的多酚物质,一定时间后会与PPO反应,使得酶活力与酶比活力下降[13-14]。
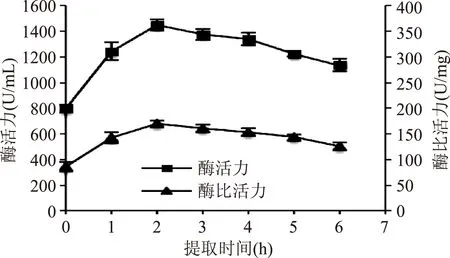
图5 提取时间对莲子酶活力和酶比活力的影响Fig.5 Effect of extraction time on the PPO activity and specific activity of lotus seed extracts
2.2.4不同提取液组分TritonX-100、PEG为表面活性剂,有助于细胞内物质的溶出。PVPP是多酚吸附剂,不溶于水,可通过离心去除,不构成影响。从表1中可以看出,提取溶液中加入1%的PEG,对提取效率影响不大。分别加入2%的PVPP、0.8%的TritonX-100均可有效提高提取率,由于两种成分的协同作用含0.8% TritonX-100及2% PVPP的提取溶液所提酶液酶比活力最高,达到257.01 U/mg。为减少提取液组分构成,便于操作,本文选择0.8% TritonX-100及2% PVPP溶液为最优缓冲液组合。

表1 不同缓冲液对酶活力和酶比活力的影响Table 1 Effect of buffer solution type on the PPO activity and PPO specific activity of lotus seed extracts
2.3莲子PPO的纯化
2.3.1DEAE Sepharose Fast Flow阴离子交换层析及Sephadex G-75凝胶柱层析优化提取后的PPO粗提液经DEAE-Sepharose Fast Flow阴离子交换层析纯化,结果见图6,收集酶活性最高的25~27号管,合并脱盐浓缩后经Sephadex G-75凝胶柱层析纯化,结果见图7,取酶活最高的29号管,收集浓缩后置于-80 ℃冰箱保存备用。
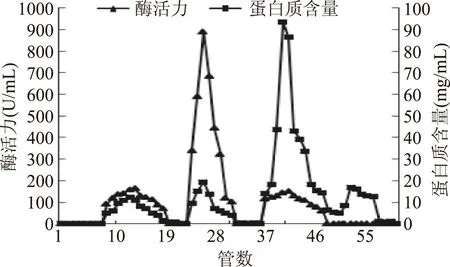
图6 DEAE Sepharose Fast Flow层析的不同NaCl洗脱曲线Fig.6 Chromatographic elution profile of lotus seed PPO with gradients of NaCl
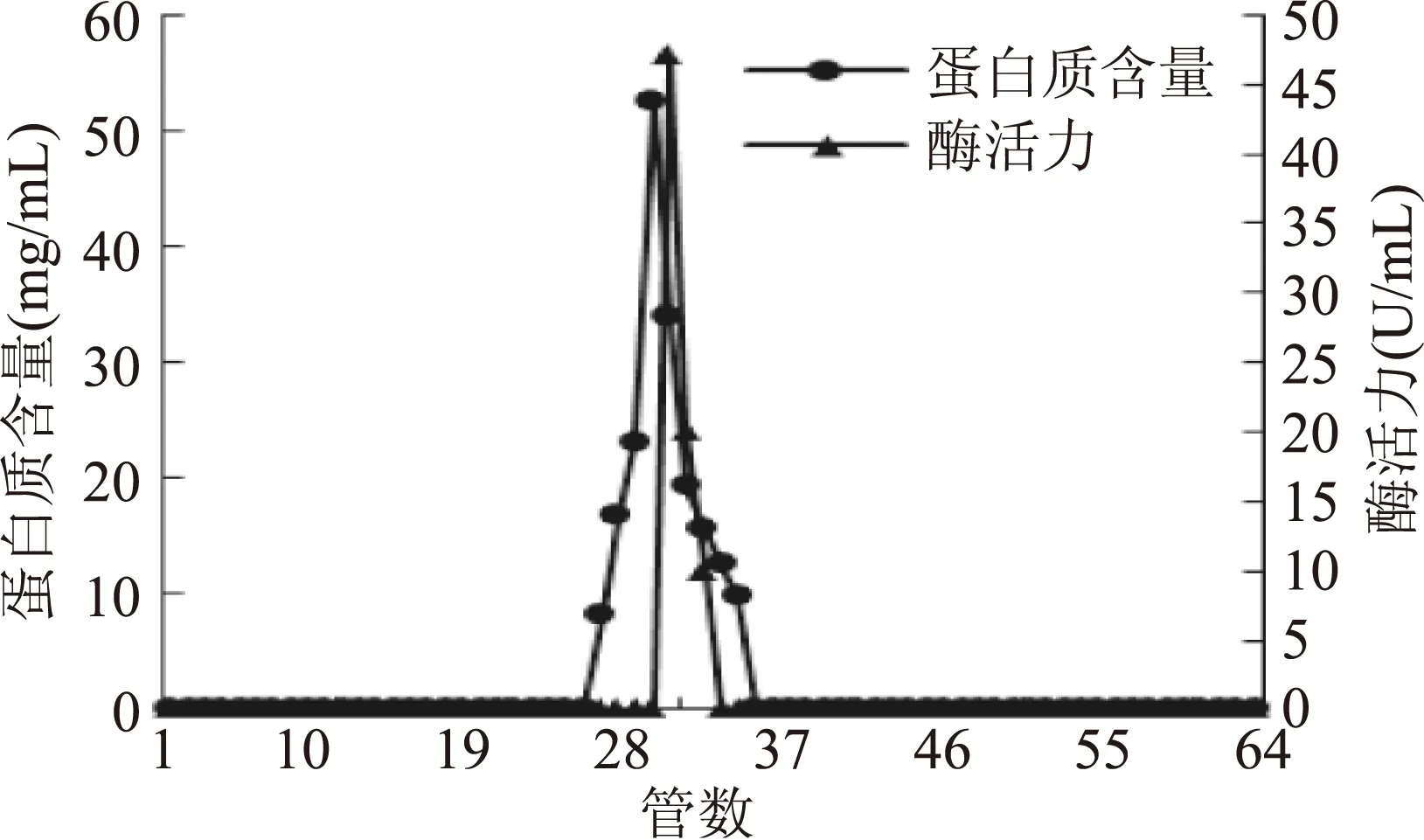
图7 莲子PPO的Sephadex G-75凝胶过滤层析图 Fig.7 Sephadex G-75 gel filtration chromatography of lotus seed PPO
2.3.2SDS-PAGE及Native-PAGE电泳SDS-PAGE谱图显示为单一蛋白条带,表明纯化后的PPO达到电泳纯,根据谱图测定莲子PPO分子量大约为58 ku。文献报导丝瓜PPO为67.8 ku[15],金银花PPO为43 ku[16],苹果PPO为67 ku[17],莲藕PPO为66 ku[18],PPO分子量不同是由植物间种属差异决定,提取纯化方法差异亦会对蛋白有一定影响,比如造成酶蛋白的分解等。经Native-PAGE谱图(图8)验证,莲子PPO分子量为58 ku,与SDS-PAGE谱图所测结果一致。
2.3.3莲子PPO的分离纯化结果如表2,经DEAE Sepharose Fast Flow层析纯化后,纯化倍数为14.78,回收率为64.66%,得到一定纯化,但纯化结果并不特别理想,但经Sephadex G-75纯化后,纯化后的PPO总酶比活力为7926.68 U/mg,是粗酶液的26.92倍,表明PPO得到有效纯化,且回收率为38.48%,表明酶得到较好的富集。
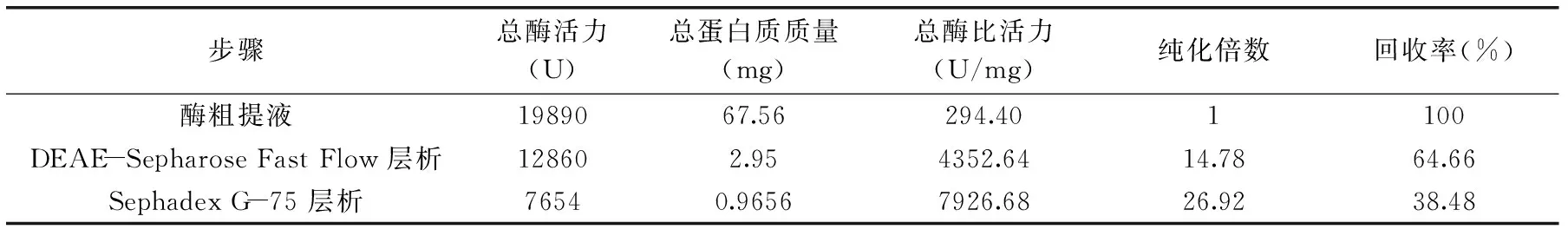
表2 莲子PPO提取过程酶比活力及纯化倍数的变化Table 2 Purification of PPO from lotus seed
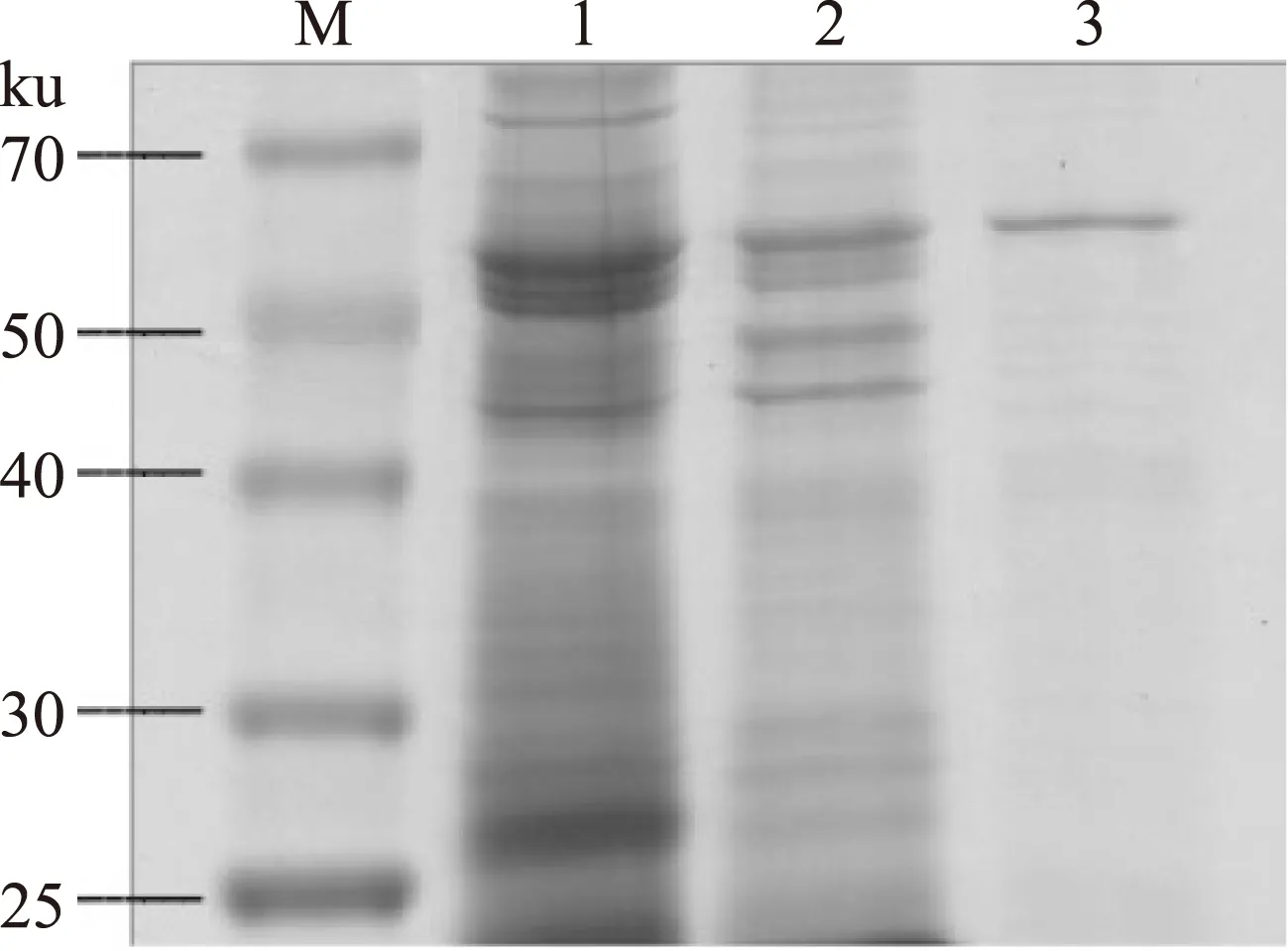
图8 莲子PPO的SDS-PAGE图Fig.8 SDS-PAGE of PPO from lotus seed注:1.匀浆吸附丙酮沉淀法提取的PPO; 2.经DEAE-Sepharose Fast Flow纯化后的PPO; 3.经SephadeX G-75纯化后的PPO,图9同。

图9 莲子PPO的Native-PAGE图Fig.9 Native-PAGE of PPO from lotus seed
3 结论
本研究以酶活力及酶比活力为指标,对比了目前常用的四种多酚氧化酶提取方法,发现匀浆吸附后丙酮沉淀法较适合莲子PPO提取,其优化后的提取工艺参数为:料液比1∶5、提取时间2 h、pH=7(含2% PVPP和0.8%的TritonX-100)条件下所提粗酶液酶比活力最高,为294.40 U/mg。再经DEAE Sepharose Fast FLow阴离子交换层析及Sephadex G-75凝胶柱层析纯化后,酶比活力达7926.68 U/mg,提纯倍数为26.92,回收率为38.48%,分子量约为58 ku。
[1]曾绍校,陈秉彦,郭泽镔,等.莲子生理活性的研究进展[J].热带作物学报,2012,33(11):2110-2114.
[2]Tanaka T,Mine C,Kouno I.Structures of two new oxidation products of green tea polyphenols generated by model tea fermentation[J].Tetrahedron,2002,58(43):8851-8856.
[3]张有林,朱芬.莲藕贮期褐变机理与防褐变技术研究[J].食品工业科技,2003,24(1):87-89.
[4]Xing Y,Li XH,Xu QL,et al.Effects of chitosan-based coating and modified atmosphere packaging(MAP)on browning and shelf life of fresh-cut lotus root(Nelumbo nucifera Gaerth)[J].Innovative Food Science & Emerging Technologies,2010,11(4):684-689.
[5]Marri C,Frazzoli A,Hochkoeppler A,et al.Purification of a polyphenol oxidase isoform from potato(Solanum tuberosum)tubers[J].Phytochemistry,2003,63(7):745-752.
[6]Guo L,Ma Y,Shi J,et al.The purification and characterisation of polyphenol oxidase from green bean(Phaseolus vulgaris L.)[J].Food Chemistry,2009,117(1):143-151.
[7]Mishra BB,Gautam S,Sharma A.Purification and characterisation of polyphenol oxidase(PPO)from eggplant(Solanum melongena)[J].Food Chemistry,2012,134(4):1855-1861.
[8]刘芳.苹果膜结合态多酚氧化酶分离纯化及性质研究[D].北京:中国农业大学,2015.
[9]Conde-Petit B.Food texture and viscosity—concept and measurement[J].LWT-Food Science and Technology,2003,36(2):281.
[10]毕云枫,姜仁凤,刘薇薇,等.一种多酚氧化酶提取新方法与几种常规方法的比较研究[J].安徽农业科学,2013,41(22):9418-9420.
[11]Sun XH,Zhu KX,Zhou HM.Optimization of a novel backward extraction of defatted wheat germ protein from reverse micelles[J].Innovative Food Science & Emerging Technologies,2009,10(3):328-333.
[12]张国庆,董明,李娜,等.宣木瓜多酚氧化酶酶学特性与抑制剂研究[J].食品科学,2011,32(10):288-291.
[13]Gao ZJ,Han XH,Xiao XG.Purification and characterisation of polyphenol oxidase from red Swiss chard(Beta vulgaris subspecies cicla)leaves[J].Food Chemistry,2009,117(2):342-348.
[14]贺寅,王强,钟葵.响应面优化酶法提取龙眼多糖工艺[J].食品科学,2011,32(2):79-83.
[15]吴海霞,曹雨舟.丝瓜多酚氧化酶的分离纯化及酶学性质[J].食品科学,2014,35(7):187-191.
[16]周燕燕.金银花多酚氧化酶提取纯化、酶学性质及抑制效应研究[D].洛阳:河南科技大学,2014.
[17]Liu F,Zhao JH,Wen X,et al.Purification and structural analysis of membrane-bound polyphenol oxidase from Fuji apple[J].Food Chemistry,2015,183:72-77.
[18]潘永贵,陈维信.鲜切莲藕组织中多酚氧化酶的分离纯化[J].食品与生物技术学报,2008,27(2):55-60.
Purification and isolation of polyphenol oxidase from lotus seed
HE Yu-shan,LIU Xiao-ru*,DENG Ze-yuan,HUAN Yi-ning,YANG Xiao-yuan,HU Jiang-ning
(State Key Laboratory of Food Science and Technology,College of Food Sciences,Nanchang University,Nanchang 330047,China)
The enzyme browning induced by polyphenol oxidase(PPO)affects nutrition,flavor and economic value of lotus seed. Insight into the mechanism of the enzyme browning is based on the structure and characteristic of PPO.Therefore,to obtain a fairly pure PPO is the purpose of this study.The comparation between four methods of extracting lotus seed PPO was made,homogenization post-acetone extraction method was better in PPO specific activity and maintaining the total activity.The results of optimizing homogenization post-acetone extraction were as follows:the ratio of solid-to-solvent 1∶5,extract time 2 h,phosphate buffer containing 0.8% TritonX-100 and 2% PVPP at pH7,and the specific activity was 294.40 U/mg. The rude extraction was purified by DEAE Sepharose Fast Flow ion exchange column chromatography and Sephadex G-75 gel filtration chromatography.The specific activity of purified PPO was 7926.68 U/mg,a purification factor of 26.92,yield was 38.48%.The molecular weight of this enzyme was about 58 ku.
lotus seed;polyphenol oxidase;isolation and purification
2015-10-16
贺玉珊(1991-),女,硕士研究生,研究方向:莲子天然物质研究,E-mail:H231991@163.com。
刘小如(1986-),女,博士,助理研究员,研究方向:天然产物的开发研究,E-mail:xiaoruliu@outlook.com。
国家自然科学基金(31301578);江西省自然科学基金(20132BAB214002);江西省教育厅青年科学基金(GJJ13024);江西省自然青年科学基金(20142BAB214003)。
TS255.1
A
1002-0306(2016)09-0064-05
10.13386/j.issn1002-0306.2016.09.004
