血管紧张素Ⅱ诱导乳鼠心肌细胞凋亡的内质网应激途径
2016-09-11孙颖颖张彤王冀李莉严宇鹏李鸥胡罗文魏庆庆
孙颖颖 张彤 王冀 李莉 严宇鹏 李鸥 胡罗文 魏庆庆
基础研究
血管紧张素Ⅱ诱导乳鼠心肌细胞凋亡的内质网应激途径
孙颖颖 张彤 王冀 李莉 严宇鹏 李鸥 胡罗文 魏庆庆
作者单位:100028 北京市,煤炭总医院ICU(孙颖颖、王冀、李莉、严宇鹏、李鸥、胡罗文、魏庆庆);西苑医院肿瘤科(张彤)
目的 探讨血管紧张素Ⅱ(AngⅡ)对心肌细胞凋亡的影响以及与内质网应激的关系。方法培养的心肌细胞分别加入不同浓度的AngⅡ并给予不同时间段的刺激后,采用流式细胞仪检测细胞凋亡率,并甄选出最佳AngⅡ刺激浓度及刺激时间。将培养的心肌细胞给予最佳浓度及时间的AngⅡ刺激后收集,分别用免疫组化法及免疫印迹检测GRP78、caspase-12蛋白的表达水平。结果 AngⅡ诱导心肌细胞GRP78、Caspase-12表达升高。结论 AngⅡ通过ERS相关的Caspase-12通路介导心肌细胞凋亡。
血管紧张素Ⅱ;细胞凋亡;内质网应激;心肌
血管紧张素Ⅱ(AngⅡ)作为肾素-血管紧张素系统(RAS)的主要效应激素,在左室重构及心肌细胞凋亡的发生发展中起着重要作用。越来越多的实验证实,AngⅡ是促使多种细胞凋亡的重要诱因之一,其机制均与内质网应激(ERS)相关。因此我们拟在本研究中进行体外心肌细胞培养,以观察AngⅡ对心肌细胞凋亡的影响及与ERS的关系。
1 材料与方法
1.1 实验动物 1~3日龄Wistar大鼠,由西苑医院实验动物中心提供。
1.2 试剂及药物
1.2.1 细胞培养及鉴定所需试剂 ①AngⅡ,美国Sigma公司;②DMEM,美国GIBCO公司;③胎牛血清(fatal calf serum,FCS),杭州四季青生物公司;④胰蛋白酶,美国Sigma公司;⑤小鼠抗大鼠肌动蛋白单克隆抗体,武汉博士德生物公司。
1.2.2 流式细胞仪检测不同刺激培养心肌细胞凋亡率所需试剂 Annexin V-FITC/PI双标试剂盒,晶美生物公司产品。
1.2.3 免疫印迹所需试剂 ①抗羊GRP78多克隆抗体(SC-1611),美国Santa Cruz公司产品;②抗大鼠Caspase-12单克隆抗体(SC-21747),美国Santa Cruz公司产品;③抗兔Actin多克隆抗体(SC-72100,美国Santa Cruz公司产品;④抗小鼠JNK单克隆抗体(SC-81468),美国Santa Cruz公司产品;⑤抗小鼠p-JNK单克隆抗体(SC-6254),美国Santa Cruz公司产品;⑥辣根过氧化物酶标记山羊抗小鼠二抗,北京中杉金桥生物技术公司产品;⑦辣根过氧化物酶标记山羊抗大鼠二抗,北京中杉金桥生物技术公司产品;⑧预染蛋白marker(相对分子质量20~120 KD),标定分子量范围为20 KD、26 KD、36 KD、47 KD、85 KD、118 KD,美国 Fermentas公司产品;⑨增强的化学发光试剂盒(ECL试剂盒),Amersham Phamacia Biotech公司产品。
1.3 实验方法
1.3.1 心肌细胞的培养与鉴定
1.3.1.1 心肌细胞的培养 乳鼠心肌细胞较成年鼠心肌细胞易在体外存活,对刺激因素反应敏感,而且乳鼠心肌细胞蛋白合成和分泌旺盛,更适于进行研究。取1~3日龄内Wistar大鼠,在其心脏跳动时将心脏取下,小心剪取心室组织,用冰PBS液清洗干净后,将组织反复剪成0.5~1.0 mm3的小块,加2~3滴细胞培养液,用含EDTA的胰酶消化,用吸管轻轻吹打后分次吸取组织块悬液,将其均匀排在90 mm的有盖培养皿内,加入含150 ml/L胎牛血清的DMEM 3 ml培养液,做好标记置于37℃恒温培养箱30~40 min后,再缓慢、轻轻地将培养皿翻转,利用差速贴壁去除成纤维细胞后小心移入培养瓶,继续静止培养。每天小心取出培养瓶置于相差显微镜下进行观察,2 h后可见组织块周边有细胞伸出,1 d后周围爬满细胞,3~4 d后多数连接成片,可进行传代。用吸管轻吹组织块使其脱落移出,加入0.1%胰蛋白酶1 ml,放置在倒置显微镜下观察,3~5 min后部分细胞呈圆形,在瓶上做好标记,弃去胰蛋白酶液加入培养液5~10 ml在标记处反复吹打,计数板计数细胞5×105/ml,根据需要传至十二孔培养板中培养,多数3~4 d后长成致密单层可用于实验。在进行刺激之前,细胞应用不含血清的DMEM培养18~24 h。
1.3.1.2 培养心肌细胞的鉴定
1.3.1.2.1 心肌细胞形态观察 常规倒置显微镜观察细胞形态变化、心肌细胞搏动情况。镜下可见心肌细胞贴壁生长,逐渐呈梭型、多角型,细胞大小均匀,单个细胞自行蠕动,生长成片后可呈岛屿状搏动,搏动频率130~150次/min。
1.3.1.2.2 细胞成活率的测定 用体积分数0.4%的锥虫蓝等渗盐溶液与心肌细胞悬液以1∶9的比例混合,于混合后的1 min内在普通显微镜下观察,计算出未着色细胞数(即活细胞数)所占细胞总数的百分率,即为心肌细胞的成活率。
1.4 实验设计
1.4.1 AngⅡ的诱导刺激 在高血压的病理状态下,神经体液因子的激活比压力负荷的升高更为重要。业已证实,全身的RAS尤其是血管和心肌组织的RAS在高血压的发生、发展中起着重要作用。而RAS的中心环节是AngⅡ识别其特异性AngⅡ受体(AT受体),通过一定的信号途径而发挥作用。因此拟在体外培养的心肌细胞中,加入不同浓度的AngⅡ,给予不同时间长短的刺激,研究心肌细胞诱导刺激后的变化。将心肌细胞与不同终浓度(1、10、100 nmol/L)的AngⅡ进行培养,时间依次为6 h、12 h、24 h和48 h,后收集细胞,采用流式细胞仪检测心肌细胞凋亡率,以确定AngⅡ对心肌细胞凋亡的影响及实验的最适合浓度。
1.4.2 心肌细胞凋亡和ERS激活的检测 收集细胞,以未加AngⅡ刺激的心肌细胞为对照组,分别应用免疫印记法Western-blot对GRP78、Caspase-12的表达水平进行检测,以确定ERS及其凋亡途径在AngⅡ诱导的心肌细胞凋亡中所发挥的作用。
1.4.3 试验分组 ①空白对照组:无刺激因素孵育细胞;②AngⅡ刺激组:心肌细胞利用预试验筛选出的AngⅡ的浓度和时间进行刺激。
1.5 流式细胞仪检测不同刺激培养心肌细胞的凋亡率 应用Annexin V-FITC/PI凋亡检测试剂盒检测凋亡,按说明书操作。
1.6 免疫印迹检测 GPR78、Caspase-12蛋白表达 取-80℃保存的已收集细胞,提取总蛋白,经过SDS-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离、转膜、蛋白印记、ECL显色等步骤,检测GRP78、Caspase-12的蛋白表达。
1.7 统计学方法 由SPSS 17.0统计软件包完成数据分析。实验结果以±s表示,两组均数间比较采用小样本t检验,多组间均数间比较采用One-Way ANOVA方差分析。以P<0.05为差异具有统计学意义。
2 结果
2.1 心肌细胞培养结果
2.1.1 心肌细胞形态 倒置显微镜下可见传代细胞未贴壁呈圆形,贴壁后生长逐渐呈梭形、多角形,细胞大小均匀,生长迅速,单个细胞自行蠕动,当生长成片后可见呈岛屿状搏动,搏动频率为130~150次/min,见图 1。
2.1.2 心肌细胞成活率测定 计数500个细胞,16个染色阳性,成活率97.8%。
2.2 流式细胞仪检测心肌细胞的凋亡水平 以不同浓度 AngⅡ(1、10、100 nmol/L)分别刺激心肌细胞 6 h、12 h、24 h、48 h 后,采用流式细胞仪检测细胞凋亡率,结果显示,终浓度为1 nmol/L AngⅡ进行24 h刺激后,心肌细胞的凋亡率增加了1.1倍[(1.96±0.82%比(1.79±0.63)%],在48 h后达到最大效应2.0倍;终浓度为10 nmol/L AngⅡ刺激同样呈现出时间依赖性,给予24 h的刺激后,心肌细胞的凋亡率增加了 2.4倍[(4.61±0.94)%比(1.79±0.63)%],进行48 h的刺激后心肌细胞的凋亡率最高增加了3.9倍;终浓度为100 nmol/L AngⅡ在刺激6 h后就开始出现细胞凋亡增加,直到24 h达到最大效应,4.1倍于正常细胞的凋亡率[(7.34±1.58)%比(1.79±0.63)%],随后出现下降。实验结果表明,升高AngⅡ浓度能够诱导心肌细胞凋亡,且具有时间-浓度依赖性。给予心肌细胞100 nmol/L时AngⅡ刺激24 h为其最佳AngⅡ刺激浓度及刺激时间。见图2。
2.3 AngⅡ诱导心肌细胞GRP78/Caspase-12表达升高 为进一步验证AngⅡ是否通过ERS途径诱导心肌细胞凋亡,我们通过Western blot对GRP78/Caspase-12表达进行了检测。结果表明,AngⅡ升高GRP78/Caspase-12的作用是明显的(P<0.05),提示AngⅡ通过ERS途径的Caspase-12通路参与了心肌细胞凋亡。见图3。
3 讨论
细胞凋亡是多细胞有机体为调控机体发育、维护内环境的稳定由基因控制的细胞主动死亡过程,又称程序性细胞死亡。AngⅡ是RAS的最终效应产物。循环和心肌局部AngⅡ是引起心肌肥大最重要的生长因子之一。越来越多的研究发现,AngⅡ能够导致多种细胞凋亡增加。Fiordaliso等[1]的研究显示,链脲佐菌素诱导的糖尿病大鼠心肌细胞中肾素、血管紧张素原和AngⅡ水平升高;同时,心肌细胞凋亡增加,且在时间和空间分布上,AngⅡ水平和心肌细胞凋亡数量一致,抑制AngⅡ合成,也降低了细胞凋亡的发生。研究发现,细胞凋亡被两种不断进化的但中央区域相对保守的死亡途径介导:利用细胞表面死亡受体的外源性途径和与线粒体、内质网相关的内源性途径[2]。目前我们认为参与凋亡的三条通路是死亡受体通路、线粒体通路和内质网通路。在我们的研究中发现,AngⅡ组大鼠的心肌细胞中可见明显增加的凋亡细胞,同时GRP78、Caspase-12表达水平升高,而GRP78表达的上调是目前公认的ERS激活的标志[3,4],提示ERS介导了AngⅡ诱导的心肌细胞凋亡。ERS引起的细胞凋亡不同于线粒体细胞凋亡,它有一套自身的信号传递通路,即ERAD途径。ERAD途径包含ERS诱导CHOP/GADD153 表达[5]、JNK 活化[6]和Caspase-12蛋白水解酶的活化[7]。Caspase-12定位于ER外膜,是介导ERS凋亡的关键分子,在死亡受体或线粒体凋亡途径中不被活化[8]。研究表明,Caspase-12与ERS介导凋亡的机制有关,而与非ERS介导的凋亡无关。
AngⅡ能激活心肌细胞核内Ca2+依赖的DNA酶活性,导致DNA裂解、细胞凋亡[9]。AngⅡ在SHRs中更容易诱发心肌细胞凋亡,而且凋亡程度与Bax的表达和Caspase-3的活性相关。因此,AngⅡ水平升高极可能会导致内质网内调控细胞凋亡的靶点活化从而激活ERS。
总之,三条ERS相关凋亡通路在细胞凋亡发生过程中并非同时激活,每条通路激活与ERS的诱发因素、细胞类型和细胞状态等都有关系。我们的实验结果显示,在AngⅡ诱导的心肌细胞凋亡的过程中,Caspase-12的表达升高,提示ERS特异性的Caspase-12途径被激活。但其是否起到关键作用,尚需进一步探讨。
图1 乳鼠心肌细胞原代培养镜下观察
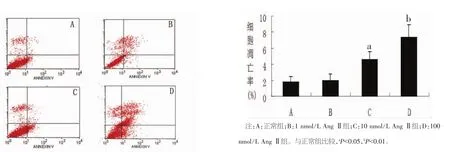
图2 不用浓度AngⅡ诱导心肌细胞的凋亡(浓度依赖)
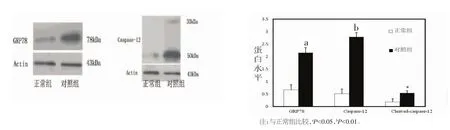
图3 AngⅡ诱导心肌细胞GPR78/Caspase12的蛋白表达变化
[1]Fiordaliso F,Cuccovillo I,Bianchi R,et al.,Cardiovascular oxidative stress is reduced by an ACE inhibitor in a rat model of streptozotocin-induced diabetes.Life Sci,2006,79:121-129.
[2]Danial NN,Korsmeyer SJ.Cell death:critical control points.Cell,2004,116:205-219.
[3]Cunard R,Sharma K.The Endoplasmic Reticulum Stress Response and Diabetic Kidney Disease.Am J Physiol Renal Physiol,2011,23:F1054-1061.
[4]Duan X,Zhou Y,Teng X,et al.ERS-mediated apoptosis is activated in vascular calcification.BBRC,2009,387:694-699.
[5]Justo P,Lorz C,Sanz A,et al.Intracellular mechanisms of cyclosporin A-induced tubular cell apoptosis.J Am Soc Nephrol,2003,14:3072-3080.
[6]Morishima N,Nakanishi K,Takenouchi H,et al.An endoplasmic reticulum stress-specific caspase cascade in apoptosis.cytochrome c-independent activation of caspase-9 by caspase-12.J Biol Chem,2002,277:34287-34294.
[7]Ermak G,Davies KJ.Calcium and oxidative stress:from cell signaling to cell death.Mol Immunol,2002,8:713-721.
[8]Ermak G,Davies KJ.Calcium and oxidative stress:from cell signaling to cell death.Mol Immunol,2002,8:713-721.
[9]Palomeque J,Delbridge L,Petroff MV.Angiotensin Ⅱ:a regulatorofcardiomyocyte function and survival.FrontBiosci,2009,14:5118-5133.
AngⅡinduces cardiomyocyte apoptosis through activation of endoplasmic reticulum stress
SUN Ying-ying*,ZHANG Tong,WANG Ji,et al.*Department of ICU,China MeiTan General Hospital,Beijing 100028,China
Objective To investigate whether AngⅡ induces cardiomyocyte apoptosis through activation of ERS.Methods The cardiomyocytes were incubated with AngⅡ for 6 to 48 h,the harvested cells were used by flow cytometer to detect the apoptosis cells.The time and dose point for maximal effect of AngⅡwas used in subsequent experiments.To demonstrate the relation between ER stress and cardiomyocyte apoptosis,after incubated with AngⅡ,the expression of GRP78,Caspase-12 was measured.Results We found that the protein level of glucose regulated protein78 were upregulated,and the caspase-12,dependent pathways were activated.Conclusion These results suggest that ER stress can contribute to myocardial apoptosis during this progression.
AngⅡ;Cell apoptosis;Endoplasmic reticulum stress;Myocardium
10.3969/j.issn.1672-5301.2016.03.026
Q95-33;R542
A
1672-5301(2016)03-0282-03
2015-09-13)
