MiR-30a在血管紧张素Ⅱ诱导的心肌肥厚中的作用
2016-09-11潘伟赵娟罗韶金杨泽福黄景文
潘伟 赵娟 罗韶金 杨泽福 黄景文
基础研究
MiR-30a在血管紧张素Ⅱ诱导的心肌肥厚中的作用
潘伟 赵娟 罗韶金 杨泽福 黄景文
目的 探讨miR-30a是否介导了血管紧张素Ⅱ(AngⅡ)诱导的心肌肥厚。方法 将心肌细胞分为对照组和AngⅡ诱导组,用Real-time PCR观察AngⅡ刺激后心肌细胞miR-30a的变化和肥厚基因的表达。将心肌细胞分为对照组和AngⅡ诱导组,用激光共聚焦观察AngⅡ刺激后心肌细胞大小的变化。将心肌细胞分为对照组(AngⅡ+NC)、miR-30a诱导组(AngⅡ+miR-30a mimics)和 miR-30a抑制组(AngⅡ+miR-30a inhibitors),通过对miR-30a过表达或者抑制miR-30a活性后,观察心肌细胞肥厚基因表达和心肌细胞大小的变化。结果 AngⅡ刺激心肌细胞后,心肌细胞miR-30a表达量下调至刺激前的32.9%。AngⅡ+miR-30a mimics组心肌细胞肥厚基因ANP和β-MHC表达分别是negative control组的51.7%和53.5%,AngⅡ+miR-30a inhibitors组心肌细胞肥厚基因ANP和β-MHC表达分别是AngⅡ+negative control组的1.88倍和1.64倍。激光共聚焦检测形态学的改变,AngⅡ刺激心肌细胞使心肌细胞面积增加至刺激前的2.95倍。与negative control组比较,AngⅡ+miR-30a mimics组心肌细胞面积减少至57.8%,AngⅡ+miR-30a inhibitors组心肌细胞面积增加至1.50倍。结论 miR-30a下调可介导AngⅡ诱导的心肌肥厚。
MiR-30a; 血管紧张素Ⅱ; 心肌肥厚
肾素-血管紧张素系统(renin-angiotensin-system,RAS)在心脏重构(cardiac remodeling)发生中起重要作用。血管紧张素Ⅱ(angiotensinⅡ,AngⅡ)是RAS中最主要的生物活性物质。我们的前期研究[1]表明,心脏肥厚(cardiac hypertrophy)大鼠心脏组织miR-30a下调。那么,AngⅡ是否是通过下调miR-30a引起心肌肥厚呢?即我们试图证明是否存在如下的心脏重构机制:AngⅡ↑→miR-30a↓→心肌肥厚。
1 材料与方法
1.1 大鼠原代心肌细胞培养及干预 出生1~3 d的新生SD大鼠,剪取心尖部,剪碎,胰蛋白酶消化,收集上清。过滤,离心,收集细胞悬液,差速分离培养心肌细胞。第5天予以含miR-30a mimics或inhibitors的慢病毒感染[4×105个心肌细胞予以20μl病毒(109 TU/ml)和 polybrene(终浓度 5 mg/ml)],第6天予以10-6mol/L AngⅡ刺激。第9天收集样本检测肥厚基因ANP和β-MHC、miR-30a及细胞形态。根据实验目的不同分组,将心肌细胞分为对照组和AngⅡ诱导组,观察AngⅡ刺激后心肌细胞miR-30a的变化、肥厚基因的表达和心肌细胞大小的变化;将心肌细胞分为对照组(AngⅡ+NC)、miR-30a诱导组(AngⅡ+miR-30a mimics)和miR-30a抑制组(AngⅡ+miR-30a inhibitors),观察心肌细胞肥厚基因表达和心肌细胞大小的变化。
1.2 细胞样本肥厚基因和miR-30a的Real-time RT-PCR Trizol提取总RNA。肥厚基因按逆转录试剂盒说明书方法先逆转录合成cDNA。25 μl PCR反应体系:2×UDG mix 12.5 μl,ROX(1∶10)0.5 μl,Primer (F+R)1.0 μl,cDNA 2.0 μl,DEPC-treated water 9.0 μl。反应条件:50 ℃ 2 min→95 ℃ 2 min→95℃ 15 s→62℃ 30 s。每个样品做3个复孔,并重复荧光定量PCR的检测,结果取平均值。经荧光信号理论方程推导出基因表达量计算公式,采用18 s作为内参对照,计算肥厚基因相对表达量=2-ΔΔCT。Trizol提取总 RNA后按如下体系 RT:40 U/μl RNaseOUT 0.125 μl,10×RT Buffer 2.000 μl,10 mM dNTPmix 0.750 μl,1 μM miR RT primer 1.200 μl,200 U/μl MMLV 反转录酶 0.100 μl,80 ng/μl总RNA 2.000 μl,DEPC 处理水 13.825 μl。PCR 反应体系:反应获得的模板 2.00 μl,2×Real-time PCR Master Mix 10.00 μl、5 μM miRNA specific primer set 0.36 μl,5 U/μl rTaq DNA polymerase 0.20 μl,25 μmol/L ROX 0.80 μl,DEPC 处 理 水 6.64 μl。MiR-30a的表达采用U6作为内参对照。计算2-ΔΔCT为 miRNA 相对表达量。引物序列:18 s:FP:5′-ACCGCAGCTAGGAATAATGGA-3′,RP:5′-GC -CTCAGTTCCGAAAACCA-3′。ANP:FP:5′-GGGGGTAGGATTGACAGGAT-3′,RP:5′-CTCCAGGAGGGTATTCACCA-3′。β-MHC:FP:5′-CCTCGCAATATCAAGGGAAA-3′,RP:5′-TACAGGTGCATCAGCTCCAG-3′。U6-F:GCTTCGGCAGCACATATACTAAAAT,U6-R:CGCTTCACGAATTTGCGTGTCAT。
1.3 激光共聚焦 心肌细胞直接种植于培养孔中,用鬼笔环肽(fluorescent phallotoxins)Alexa FluorR555 Phalloidin与DAPI染色,LSM 710激光共聚焦显微镜摄片观察,结果用image pro软件分析。
1.4 统计学方法 使用PASW Statistics 18.0统计软件分析。数据用±s表示,是否正态分布用Shapiro-Wilk检验。使用Levene′检验判断是否方差齐性。两组计量资料组间比较,若正态分布资料使用Student′s t检验。多样本正态、方差齐性计量资料比较使用ANOVA。P<0.05为差异有统计学意义。
2 结果
2.1 AngⅡ引起的心肌细胞miR-30a表达变化 与对照组(con组)比较,心肌细胞miR-30a表达量下调至刺激前的32.9%(P<0.05)。见图1。
2.2 心肌细胞miR-30a的变化对AngⅡ引起的心肌细胞肥厚基因表达的影响 在AngⅡ刺激心肌细胞肥大的基础上使心肌细胞过表达miR-30a mimics,miR-30a mimics组心肌细胞 ANP和 β-MHC表达分别是对照组的51.7%和53.5%(P<0.05)。在AngⅡ刺激心肌细胞肥大的基础上使心肌细胞过表达 negative control或者 miR-30a inhibitors,miR-30a inhibitors组 ANP和 β-MHC 表达分别是negative control组的1.88倍和1.64倍(P<0.05)。见图 2。

图1 AngⅡ引起的心肌细胞miR-30a表达变化
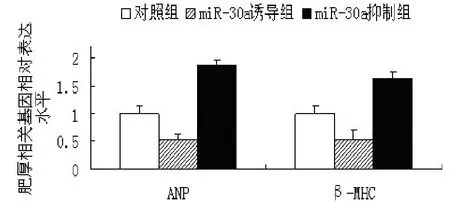
图2 miR-30a对心肌细胞肥厚相关基因表达的影响
2.3 激光共聚焦分析心肌细胞miR-30a的变化对AngⅡ引起的心肌细胞大小的影响 激光共聚焦检测形态学的改变,结果显示,AngⅡ刺激心肌细胞使心肌细胞面积增加至刺激前的2.95倍(P<0.05)。在AngⅡ刺激心肌细胞肥大的基础上使心肌细胞过表达 negative control,或者 miR-30a mimics,或者miR-30a inhibitors,与 negative control组比较,miR-30a mimics组心肌细胞面积减少至57.8%(P<0.05),miR-30a inhibitors组心肌细胞面积增加1.50 倍。见图 3、4。
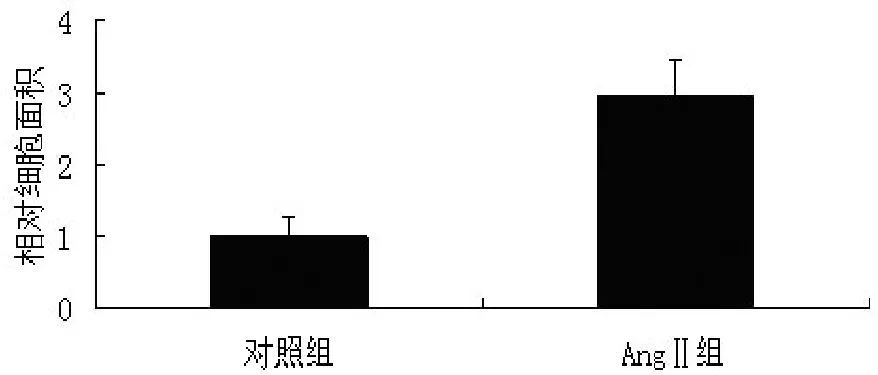
图3 AngⅡ引起的心肌细胞大小变化
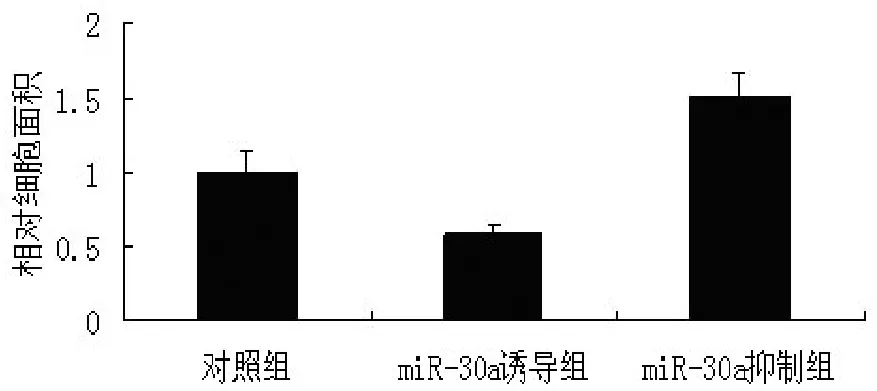
图4 MiR-30a对心肌细胞大小的影响
3 讨论
MicroRNA(miRNA)是一类在生物进化过程中高度保守的非编码微小RNA,是内源性(≈22核苷酸)非编码RNA分子,通过与靶基因mRNA的 3′UTR互补结合,降解目的mRNA或抑制其翻译,在转录后水平调节目的基因表达,导致降解或抑制翻译,进而影响细胞或生物个体的生理病理状态。MiRNA调控生物健康、疾病,包括心血管疾病。目前报道的microRNAs有1.8万多个。
在发达国家,1%~2%的成人患心力衰竭,而在70岁以上人群,该比例高达10%以上[2]。20世纪90年代前,60%~70%的心力衰竭患者在诊断心力衰竭5年内死亡。因心力衰竭住院的患者耗费了大量的医疗资源,患者生活质量严重下降。近年来,经过包括利尿剂、血管紧张素转换酶抑制剂(ACEI)、β受体阻滞剂、醛固酮受体阻滞剂等药物优化治疗和心脏再同步化治疗(cardiac resynchronization therapy,CRT)等器械治疗的综合治疗后,心衰患者预后较前改善,住院率减少,但仍不容乐观。人类对心力衰竭发病机制的认识不断深入,从20世纪40~60年代的心肾学说到70~80年代血流动力学说,再到90年代以来的心脏重构学说。目前认为,心脏重构是心力衰竭发生发展的基本机制,因而对心脏重构学说的研究不断深入。在各种病理刺激下,心脏出现实质和间质的结构改变,如心肌细胞肥大、心脏间质纤维化等,称为心脏重构[3]。心脏肥厚是心脏重构的重要环节,对心脏肥厚机制的进一步深入探讨可能为我们提供心力衰竭新的防治靶点。心肌细胞损伤和丢失在心脏肥厚和心脏重构中起重要作用。目前,人们把眼光逐步放在细胞水平,通过修复细胞损伤的途径来改善心脏重构。关于miRNA调控心脏重构的研究近年来有报道,miR-199b在心脏肥厚小鼠心肌组织中表达上调,抑制miR-199b的表达能逆转小鼠的心肌细胞肥大和纤维化[4]。
正如其他miRNA一样,近年来对miR-30的研究涉及广泛。目前报道的人类和褐家鼠miR-30家族有 miR-30a、miR-30b、miR-30c-1、miR-30c-2、miR-30d和miR-30e六个亚型。每个亚型均能生成5p和3p两个片段,其中miR-30c-1与miR-30c-2的5p片段相同。文献中未明确注明的默认为5p片段,3p片段有时也可以标注“*”,如“hsa-miR-30a-3p”可写作“hsa-miR-30a*”。MiR-30家族与肿瘤,以及神经系统、生殖系统、循环系统、消化系统、呼吸系统疾病和脂肪生成、细胞衰老、药物代谢、细胞分化有关[5-14]。MiR-30与循环系统疾病的研究亦有报道。一项研究[15]对6例胸主动脉夹层患者和6例年龄匹配的无主动脉疾病患者行主动脉组织microRNAs芯片检测发现,18种microRNAs上调2倍以上,56种microRNAs下调。选择其中7种microRNAs进一步研究发现,miR-30家族可能通过调控MAPK信号通路在胸主动脉夹层发生中起重要作用。
关于miR-30与心脏重构的关系,偶有报道。Duisters等[16]发现,miR-30家族在小鼠肥厚心脏和左室肥厚(LVH)患者的心脏活检组织中显著下调。MiR-30c调控结缔组织生长因子(CTGF),在心肌基质重构中起作用,参与心脏重构。一项研究[17]对miR-30在心脏重构中的作用进行了探讨,研究者不是采用传统的压力负荷所致心脏肥厚模型,而是酒精摄入。该研究显示慢性酒精摄入导致小鼠心肌肥厚、收缩功能受损、自噬增强。酒精代谢物乙醛引起miR-30a下调,导致自噬过度是其中的机制之一。另一项研究也显示,慢性酒精摄入导致小鼠肥厚心脏组织中miR-30a显著下调[18]。慢性房颤除了电重构之外,心房结构重构也是导致房颤发生的基础。Li等[19]快速起搏犬左上肺静脉制造慢性房颤犬模型,其心房组织miR-30下调。MiR-30在慢性房颤结构改变中起重要的作用。
Duisters等[16]发现,miR-30家族在小鼠肥厚心脏和左心室肥厚患者的心脏活检组织中显著下调。我们通过体外培养大鼠原代心肌细胞,予以AngⅡ诱导心肌细胞肥大的同时,心肌细胞miR-30a水平下调。我们使心肌细胞过表达miR-30a mimics后,能缓解心肌细胞肥厚基因的表达;抑制心肌细胞miR-30a的活性能增加心肌细胞肥厚基因的表达。接下来,我们进一步行形态学实验验证。
鬼笔环肽携带有荧光基团,能使心肌细胞骨架蛋白F-actinin染色,在激光共聚焦显微镜下可以显示心肌细胞的轮廓,进而计算细胞的表面积大小[20]。我们使心肌细胞过表达miR-30a mimics后,能减轻AngⅡ诱导的心肌自噬和心肌细胞形态学上的肥厚;抑制心肌细胞miR-30a的活性能加重AngⅡ诱导的心肌自噬和心肌细胞形态学上的肥厚。
综上所述,miR-30a水平下调介导了AngⅡ引起的心肌肥厚。故我们提出的一条可能参与心肌肥厚的新通路:AngⅡ↑→miR-30a↓→心肌肥厚。
在心脏重构的整个病理生理过程的不同阶段,并不是总以心肌肥厚为主要特征表现,所以该通路不能盲目扩大到适合所有心脏重构的过程。
本研究采用的心肌细胞部分为原代培养的乳鼠心肌细胞,而与乳鼠心肌细胞相比,成年鼠心肌细胞更接近疾病发生的内环境,所以,如果能在成年鼠心肌细胞上作研究,实验设计将会更加严谨。另外,本研究仅仅在细胞层面论证了miR-30a下调介导了AngⅡ引起的心肌肥厚,有待进一步在动物体内论证这一机制。
[1]Pan W,Zhong Y,Cheng CF,et al.MiR-30-regulated autophagy mediates angiotensinⅡ-induced myocardial hypertrophy.PLoS One,2013,8:e53950.
[2]Mosterd A,Hoes AW.Clinical epidemiology of heart failure.Heart,2007,93:1137-1146.
[3]Madanieh R,Mathew S,Shah P,et al.Cardiac Magnetic Resonance Imaging Might Complement Two-Dimensional Echocardiography in the Detection of a Reversible Nonischemic Cardiomyopathy.Clin Med Insights Case Rep,2015,8:109-114.
[4]da Costa Martins PA,Salic K,Gladka MM,et al.MicroRNA-199b targets the nuclear kinase Dyrk1a in an auto-amplification loop promoting calcineurin/NFAT signaling.NatCellBiol,2010,12:1220-1227.
[5]Mellios N,Galdzicka M,Ginns E,et al.Gender-Specific Reduction of Estrogen-Sensitive Small RNA,miR-30b,in Subjects With Schizophrenia.Schizophr Bull,2012,38:433-443.
[6]Yu Y,Yang L,Zhao M,et al.Targeting microRNA-30a-mediated autophagy enhances imatinib activity against human chronic myeloid leukemia cells.Leukemia,2012,26:1752-1760.
[7]Zhang J,Zhang H,Liu J,et al.miR-30 inhibits TGF-β1-induced epithelial-to-mesenchymal transition in hepatocyte by targeting Snail1.Biochem Biophys Res Commun,2012,417:1100-1105.
[8]Cheng CW,Wang HW,Chang CW,et al.MicroRNA-30a inhibits cell migration and invasion by downregulating vimentin expression and is a potential prognostic marker in breast cancer.Breast Cancer Res Treat,2012,134:1081-1093.
[9]Kumarswamy R,Mudduluru G,Ceppi P,et al.MicroRNA-30a inhibits epithelial-to-mesenchymal transition by targeting Snai1 and is downregulated in non-small cell lung cancer.Int J Cancer,2012,130:2044-2053.
[10]Zhou H,Xu X,Xun Q,et al.microRNA-30c negatively regulates endometrial cancer cells by targeting metastasisassociated gene-1.Oncol Rep,2012,27:807-812.
[11]Baraniskin A,Birkenkamp-Demtroder K,Maghnouj A,et al.MiR-30a-5p suppresses tumor growth in colon carcinoma by targeting DTL.Carcinogenesis,2012,33:732-739.
[12]Chartoumpekis DV,Zaravinos A,Ziros PG,et al.Differential Expression of MicroRNAs in Adipose Tissue after Long-Term High-Fat Diet-Induced Obesity in Mice.PLoS One,2012,7:e34872.
[13]Shizu R,Numazawa S,Yoshida T.Involvement of microRNA in the induction of drug-metabolizing enzymes.Yakugaku Zasshi,2012,132:311-318.
[14]Wu T,Zhou H,Hong Y,et al.miR-30 family members negatively regulate osteoblastdifferentiation.JBiolChem,2012,287:7503-7511.
[15]Liao M,Zou S,Weng J,et al.A microRNA profile comparison between thoracic aortic dissection and normal thoracic aorta indicates the potential role of microRNAs in contributing to thoracic aortic dissection pathogenesis.J Vasc Surg,2011,53:1341-1349.
[16]Duisters RF,Tijsen AJ,Schroen B,et al.miR-133 and miR-30 regulate connective tissue growth factor:implications for a role of microRNAs in myocardial matrix remodeling.Circ Res,2009,104:170-178.
[17] Guo R,Hu N, Kandadi MR,et al.Facilitated ethanol metabolism promotes cardiomyocyte contractile dysfunction through autophagy in murine hearts.Autophagy,2012,8:593-608.
[18]Mizushima N,Yoshimori T,Levine B.Methods in mammalian autophagy research.Cell,2010,140:313-326.
[19]Li H,Li S,Yu B,et al.Expression of miR-133 and miR-30 in chronic atrial fibrillation in canines.Mol Med Report,2012,5:1457-1460.
[20]Adamo A,Arione A,Sharei A,et al.Flow-through comb electroporation devicefordeliveryofmacromolecules.Anal Chem,2013,85:1637-1641.
Role of miR-30a on AngⅡ-induced myocardial hypertrophy
PAN Wei*,ZHAO Juan,LUO Shao-jin,et al.*Cardiovascular Department,Nanhai Hospital Affiliated to Southern Medical University,Foshan 528200,China
Objective To investigate whether miR-30a could mediate angiotensin Ⅱ(AngⅡ)-induced myocardial hypertrophy or not.Methods The neonatal cardiomyocytes were divided into control group and AngⅡ-induced group and relative expression of miR-30a and hypertrophy-related genes were analyzed in AngⅡ-stimulated cardiomyocytes by real-time PCR.The neonatal cardiomyocytes were divided into control group and AngⅡ-induced group and influence of AngⅡon relative cell area in cardiomyocytes was evaluated by confocal microscopy.The neonatal cardiomyocytes were divided into control group(AngⅡ+NC),miR-30a-induced group(AngⅡ+miR-30a mimics)and miR-30a-inhibited group (AngⅡ+miR-30a mimics).Influence of miR-30a on mRNA level of ANP and β-MHC was evaluated in hypertrophic cardiomyocytes.Results The expression of miR-30a in AngⅡ-stimulated cardiomyocytes was only 32.9%of that in unstimulated cells.The expression of ANP and β-MHC was measured in AngⅡ induced hypertrophic cardiomyocytes,treatment with an miR-30a mimic decreased the expression of ANP and β-MHC by 48.3%and 46.5%,respectively,relative to the negative control.Conversely,in hypertrophic cardiomyocytes,treatment with an miR-30a inhibitor increased the expression of ANP and β-MHC by 1.88-and 1.64-fold,respectively,relative to the negative control.The morphological observations indicated that the surface area of hypertrophic cardiomyocytes was 2.95-fold that of untreated cells.Compared with hypertrophic cardiomyocytes treated with AngⅡ+negative control,the cell surface area decreased by 42.2%in cardiomyocytes treated with AngⅡ+miR-30a mimic,and increased 1.50-fold in cardiomyocytes treated with AngⅡ+miR-30a inhibitor.Conclusion Down-regulation of miR-30a mediates AngⅡ-induced myocardial hypertrophy.
MicroRNA-30a; AngiotensinⅡ; Myocardial hypertrophy
2014年广东省医学科研基金立项(项目编号:A2014712)
528200 广东省佛山市,南方医科大学附属南海医院心内科(潘伟、罗韶金、杨泽福、黄景文),超声科(赵娟)
10.3969/j.issn.1672-5301.2016.06.023
Q95-33;R542
A
1672-5301(2016)06-0567-05
2015-12-24)
